Изобретение относится к области носителей кислорода, более конкретно к сложному манганиту со структурой перовскита, который может быть использован, в частности, при риформинге метана для получения синтез-газа, водорода, полного сжигания метана до углекислого газа и воды.
Известен материал, используемый в качестве носителя кислорода, имеющий слоистую структуру, поверхностный слой которой представляет собой перовскит состава LaFe0,3Mn0,7O3+δ, при этом массовое соотношение перовскита состава LaFe0,3Mn0,7O3+δ составляет 10-15 мас.%, а внутренний слой представляет собой подложку из пенокерамики состава CeO2-Fe2O3-Al2O3 при массовом соотношении CeO2 к Fe2O3 и Al2O3 равным (2-9): (4-18): 1( заявка CN 113429198; МПК B01J19/24, B01J19/32, C01B3/34, C04B35/40, C04B38/08, C04B38/10, C04B41/87; 2021 год).
Недостатком известного материала является использование подложки, что чаще всего обусловлено механическими недостатками, такими как фазовые превращения, которые приводят к неизбежному разрушению или агломерации аккумулирующего кислород материала, следовательно, такой материал подвержен высокой истираемости и не пригоден для использования в реакторах с подвижным слоем. Действительно, на предоставленных рентгенограммах LaFe0,3Mn0,7O3+δ видны пики примесных фаз, как после циклирования, так и в восстановительных условиях (в процессе циклирования). При этом использование подложек сильно уменьшает кислородную ёмкость за счет использования инертных или слабо обменивающихся кислородом с окружающей средой компонентов, таких как Al2O3.
Известен материал, аккумулирующий кислород, со структурой перовскита, используемый в способе выработки энергии, где кислород накапливают в материале твердого носителя кислорода в первом реакторе с псевдоожиженным слоем, а углеродсодержащее топливо сжигают в другом реакторе с псевдоожиженным слоем при использовании кислорода, высвобожденного из материала носителя кислорода. Известный материал имеет структурную формулу A1-xMxBO3-δ, где А представляет собой ион металла из групп 3А и 3В Периодической таблицы элементов или их смеси, М представляет собой ион металла из групп 1А и 2А Периодической таблицы или их смеси, В представляет собой ион переходного металла из d-элементов Периодической таблицы или их смеси, х варьируется в диапазоне от 0 до 1, а δ представляет собой отклонение от стехиометрического состава, получающегося в результате замещения ионов металлов А ионами металлов М, в частности известный материал имеет состав La1-xBaxMnO3-δ (патент RU 2433341; МПК F23C 10/18, F23C 10/01, F23C 5/30; 2011 год).
Однако, недостатком известного материала является значительное количество в его составе бария, что обусловливает выпадение примесной фазы BaMnO3 или BaCO3, и как следствие, уменьшение кислородной емкости.
Известен сложный манганит состава Ca1-xAxMnO3- δ, где A=Sr или Ba, со структурой перовскита, используемый в качестве носителя кислорода в процессах химического циклирования с использованием адсорбции/десорбции кислорода (CLOU процессы). Исследования показали, что нелегированный CaMnO3, обладающий высокой кислородной ёмкостью до 3 мас.%, но претерпевает необратимый фазовый переход на фазы CaMn2O4 и Ca2MnO4 во время циклирования. Однако по результатам данного исследования допирование Ba2+ в А-подрешетку CaMnO3 не приводит к кристаллизации однофазного перовскита. Другими словами, на рентгенограммах Ca1−xBaxMnO3 даже при небольшом уровне (x = 0,05) легирующей примеси можно наблюдать пики примесной фазы BaMnO3. При этом Ca1−xSrxMnO3 при 0 ≤ х ≤ 0,25 являются однофазными. Носитель кислорода состава Ca0,75Sr0,25MnO3 обладает достаточно большой кислородной ёмкостью, достигающей 3 мас.% при длительном восстановлении при 950°С. При умеренных температурах 600 - 700°С кислородная ёмкость составляет до 0,4 мас.%. Учитывая, что при 1000 °С начинается необратимый фазовый переход с кристаллизацией примесных фаз, нельзя выбирать высокие рабочие температуры, и следовательно рабочая кислородная ёмкость будет невысокой (Galinsky N., Amit Mishra, Jia Zhang , Fanxing Li “Ca1−xAxMnO3 (A= Sr and Ba) perovskite based oxygen carriers for chemical looping with oxygen uncoupling (CLOU)” //Applied energy. - 2015. - Т. 157. - С. 358-367).
Таким образом, недостатками известного материала являются, во-первых, невозможность работы при высоких температурах, поскольку в этом случае наблюдается необратимая кристаллизация примесных фаз, во-вторых, низкая кислородная емкость при умеренных рабочих температурах. Кроме того, известный носитель кислорода обладает медленной кинетикой адсорбции/десорбции кислорода.
Наиболее близким техническим решением к заявляемому является известный двойной перовскитоподобный манганит состава PrBaMn2O6-δ, полученный путем глицин-нитратного синтеза. Материал обладает фазовой стабильностью при нагревании на воздухе до 970 °C. Обратимость кислородного обмена обнаружена в циклических испытаниях путем переключения газовой фазы между воздухом и смесью 5% H2/Ar при температуре 950°C. Максимальная кислородная емкость составляет около 3,7 мас.% и снижается в процессе циклирования до 3,4 мас.% (Kudyakova V. S., B.V. Politov a , A.V. Chukin, A.A. Markov , A.Yu. Suntsov, V.L. Kozhevnikov “ Phase stability and oxygen storage capacity of PrBaMn2O6-δ” //Materials Letters. - 2020. - Т. 269. - С. 127650)(прототип).
Недостатком известного материала является постепенное уменьшение кислородной емкости во время окислительно-восстановительных циклов (в течение 10 циклов Δδ уменьшилась с 1,03 до 0,94, что в перерасчете составляет потери в 0,3 мас.%), что обусловлено кристаллизацией примесной фазы BaMnO3 при температуре 950 °С в воздушной атмосфере. Кроме того, из-за высокой концентрации ионов Ba2+ возможно образование карбонатов бария во время окисления носителя кислорода.
Таким образом, перед авторами стояла задача разработать состав аккумулирующего кислород материала, обеспечивающий отсутствие деградации кислородной емкости в течение окислительно-восстановительных циклов наряду с высокими ее значениями.
Поставленная задача решена в предлагаемом аккумулирующим кислород материале на основе сложного манганита редкоземельного элемента и бария, который в качестве редкоземельного элемента содержит неодим, дополнительно допирован ионами Ca+2 и имеет состав NdBa0,8Ca0,2Mn2O6-δ.
В настоящее время из патентной и научно-технической литературы не известен сложный манганит редкоземельного элемента и бария состава NdBa0,8Ca0,2Mn2O6-δ, используемый в качестве аккумулирующего кислород материала.
Техническим результатом предлагаемого изобретения является сложный оксид типа перовскита NdBa0,8Ca0,2Mn2O6-δ в качестве аккумулирующего кислород материала. Известно, что двойные упорядоченные манганиты могут обратимо высвобождать и захватывать кислород в ходе редокс реакции:LnBaMn2O6 ↔ LnBaMn2O5 + 1/2 O2 (где Ln - редкоземельный элемент). Исследования, проведенные авторами, позволили обосновать выбор неодима в качестве редкоземельного элемента с учетом возможности образования стабильной фазы манганита. Были проведены предварительные исследования для сравнения функциональных свойств и стабильности LnBaMn2O6-δ, содержащими лантаноиды разного ионного радиуса. В ходе исследований было установлено, что NdBaMn2O6-δ является наиболее стабильным соединением данного семейства в условиях окисления. Данный манганит характеризуется бóльшими температурами, необходимыми для разупорядочения А-подрешетки (что приводит к снижению анизотропии ионной проводимости, и, как следствие, уменьшению диффузии кислорода в решетке), а также для кристаллизации примесной фазы BaMnO3. При исследовании термодинамики кислородного обмена двойных манганитов было установлено, что энтальпия реакции восстановления катиона B-подрешетки зависит от радиуса лантаноида: более крупные катионы в А-подрешетке требуют большей энергии для высвобождения иона кислорода из решетки. Кроме того, уменьшение радиуса редкоземельного элемента приводит к увеличению границ стабильности (температура и парциальное давление кислорода), что подтверждает правильность выбора неодима в качестве редкоземельного элемента в составе предлагаемого материала. Авторы предлагаемого технического решения в своих исследованиях учитывали, что высокая концентрация ионов Ba2+ приводит к сегрегации BaMnO3 и BaCO3 на поверхности носителей кислорода при повышенных температурах в атмосфере воздуха (условия окисления). Модификация катионного состава манганита путем избирательного допирования ионами Ca2+ способствует уменьшению концентрации катионов бария. Кроме того, замещение Ba2+ катионами щелочноземельных металлов меньшего размера сопровождается увеличением кислородной емкости оксида, облегчению обмена кислорода с окружающей средой, а также повышению стабильности функциональных материалов. Действительно 20% замещение ионами Ca2+ в подрешетку бария провело к увеличению кислородной ёмкости оксида с 3,65 до 3,75 мас.%, а также отсутствию деградации во время циклирования за счет снижения кристаллизации примесных фаз.
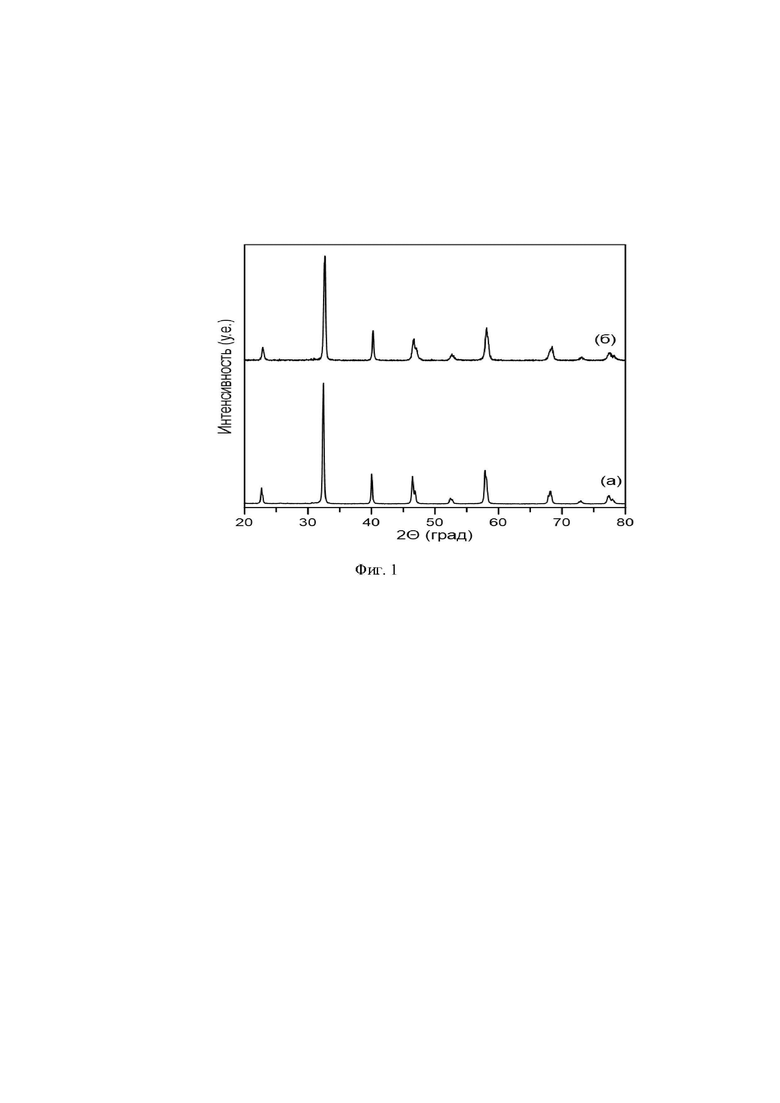
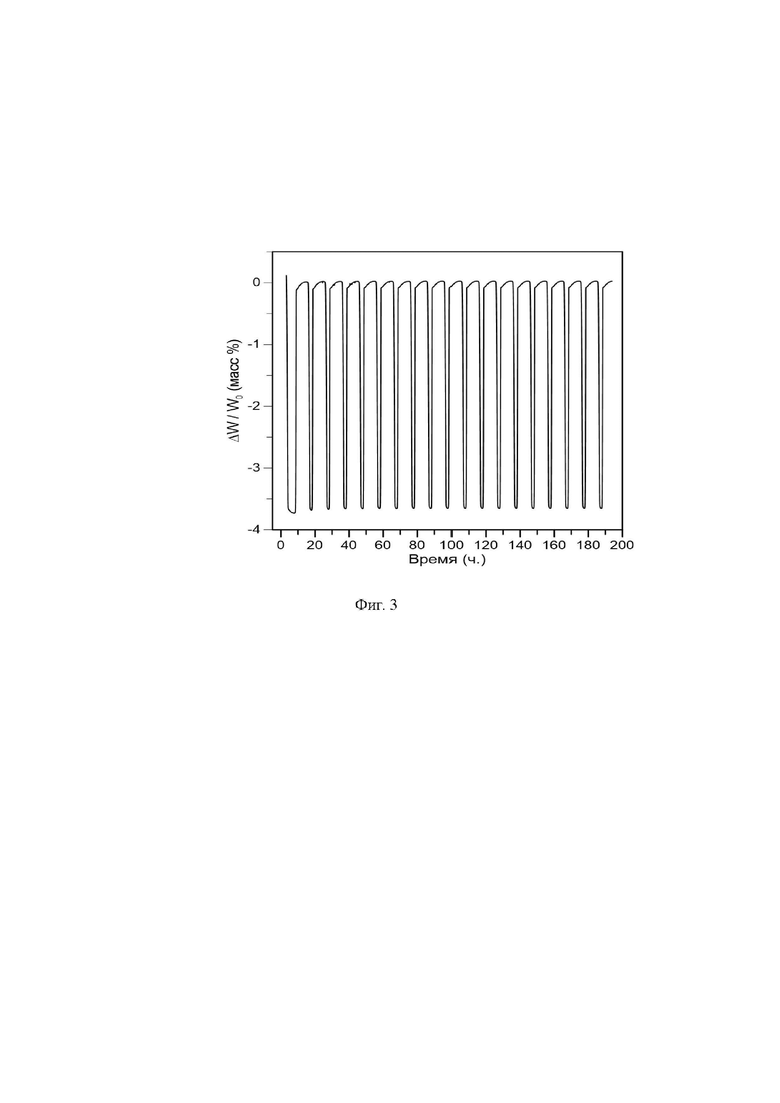
Предлагаемый аккумулирующий кислород материал может быть получен следующим образом. В качестве исходных реагентов квалификации “о.ч.” берут Nd2O3, BaCO3, CaCO3 и Mn2O3, подвергают их высушиванию в течение 10-11 часов при 150-160°C. Затем реагенты, взятые в стехиометрическом соотношении, растворяют в 65 %-ной азотной кислоте, взятой в количестве 8 мл/г исходной смеси и после полного растворения добавляют глицерин в эквимолярном соотношении к ионам металлов. Раствор выдерживают при нагревании при температуре 150-160°С для испарения воды и излишек азотной кислоты до образования геля, который при нагревании при температуре 200 - 400оС и выдержке в течение 15 - 45 минут образует мелкодисперсный порошок. Полученный порошок растирают в агатовой ступке с добавлением этилового спирта, а затем проводят одноосное прессование при давлении 5 бар для получения таблеток .Затем осуществляют отжиг в воздушной атмосфере при температуре 1100 -1300 °C в муфельной печи с точностью поддержания температуры ±1 °C. Время выдержки составляет 10-12 часов. После чего проводят отжиг в потоке смеси 5% H2/Ar при температуре 950 - 1000 °C в течение 8 - 10 часов, после чего выдерживают при 400 - 450 °C в течение 3 - 5 часов в воздушной атмосфере. В результате получают двойной манганит NdBa0,8Ca0,2Mn2O6-δ, который кристаллизуется в тетрагональной кристаллической решетке (пр. гр. P4/mmm) с параметрами a = 3,899 и c = 7,723 (фиг.1(а)). Фазовый состав образцов контролировался методом порошковой рентгеновской дифракции с использованием дифрактометра Shimadzu XRD-7000 с Cu-Kα излучением в интервале брегговских углов (2θ) от 20 до 80° с шагом сканирования 0.03°. Экспозиция составляла 3 секунды на точку при комнатной температуре. Полнопрофильный анализ кристаллической структуры проводили методом Ритвельда с использованием программного пакета FullProf Suite. Морфология исследуемых материалов была изучена с помощью сканирующего электронного микроскопа JEOL JSM 6390 (СЭМ). В результате синтеза образуются агломераты с размером зерен 1 - 5 мкм и большим количеством пор (фиг. 2). Абсолютное содержание кислорода оценивали методом йодометрического титрования. Навеску оксидного материала (±0,01 г) взвешивали на электронных весах с точностью ±10-4 г и помещали в ячейку для титрования. Далее последовательно добавляли 10 мл дистиллированной H2O, 3 мл 10% раствора KI и во время медленного перемешивания полученной смеси на магнитной мешалке по каплям добавляли 5 мл разбавленного раствора HCl. Ячейку держали в темноте при перемешивании в течение 15 мин. В процессе реакции выделился I2 в соответствии со средней степенью окисления марганца. Полученный йод титровали раствором 5-водного серноватистокислого натрия с помощью бюретки до перехода окраски раствора в желтую, затем добавляли 2 мл раствора крахмала и продолжали титрование при тщательном перемешивании до перехода синей окраски раствора в светло-зеленую. Полученный носитель кислорода полностью комплектен по кислороду (NdBa0,8Ca0,2Mn2O6,00). Термогравиметрические измерения проводились с использованием термоанализатора TG-DTA-92 (Setaram). Типичная начальная масса порошка составляла 100 мг. Процесс интеркаляции/деинтеркаляции кислорода оценивали по изменению массы. В изотермическом режиме при 700°С газовый состав внутри ячейки периодически изменялся H2/Ar ↔ воздух. В результате носитель кислорода сбрасывал и аккумулировал кислород в соответствии с реакцией NdBa0,8Ca0,2Mn2O6,00 ↔ NdBa0,8Ca0,2Mn2O5,00 + 1/2 O2. Таким образом кислородная ёмкость достигает 3,65 ± 3,75 % и сохраняется стабильной на протяжении 20 циклов (фиг.3). В результате обратимого обмена кислорода с газовой фазой кислород-аккумулирующий материал не претерпевает фазовых или структурных преобразований, выпадение примесей не зарегистрировано (фиг.1(б))
На фиг. 1 представлены ифрактограммы предлагаемого носителя кислорода свежесинтезированного (а) и после 20 окислительно-восстановительных циклов (б).
На фиг. 2 представлена морфология предлагаемогом носителя кислорода.
На фиг. 3 представлены изменения массы NdBa0,8Ca0,2Mn2O6-δ при интеркаляции/деинтеркаляции кислорода при 950°С в течение 20 окислительно-восстановительных циклов.
Получение предлагаемого аккумулирующего кислород материала на основе сложного манганита неодима и бария, допированного кальцием иллюстрируется следующими примерами.
Пример 1. Берут 17,9748 г Nd2O3, 16,8666 г BaCO3, 2,1387 г CaCO3 и 16,8672 г Mn2O3, что соответствует стехиометрии, и сушат в течение 10 часов при 150°C. Затем растворяют в 430 мл 65 %-ной азотной кислоте, что соответствует 8 мл/г исходной смеси, и после полного растворения добавляют 215 мл глицерина, что соответствует эквимолярному соотношению к ионам металлов. Раствор выдерживают на плитке при температуре 150°С для испарения воды и излишек азотной кислоты до образования геля, который при нагревании при температуре 200°С и выдержке в течение 45 минут образует мелкодисперсный порошок. Полученный порошок растирают в агатовой ступке с добавлением этилового спирта, а затем проводят одноосное прессование при давлении 5 бар для получения таблеток. Затем осуществляют отжиг в воздушной атмосфере при температуре 1100°C в муфельной печи с точностью поддержания температуры ±1°C. Время выдержки составляет 12 часов. После чего проводят отжиг в потоке смеси 5% H2/Ar при температуре 950°C в течение 10 часов, после чего выдерживают при 400 °C в течение 5 часов в воздушной атмосфере. Получают двойной манганит NdBa0,8Ca0,2Mn2O6-δ, который кристаллизуется в тетрагональной кристаллической решетке (пр. гр. P4/mmm) с параметрами a = 3,899 и c = 7,723 (см. фиг.1(а)) с образованием агломератов с размером зерен 1 - 5 мкм и большим количеством пор (см. фиг. 2). Полученный носитель кислорода полностью комплектен по кислороду (NdBa0,8Ca0,2Mn2O6,00). Кислородная ёмкость достигает 3,75% и сохраняется стабильной на протяжении 20 циклов (см. фиг. 3). В результате обратимого обмена кислорода с газовой фазой кислород-аккумулирующий материал не претерпевает фазовых или структурных преобразований, выпадение примесей не зарегистрировано (см. фиг.1(б)).
Пример 2. Берут 7,1899 г Nd2O3, 6,7467 г BaCO3, 0,8555 г CaCO3 и 6,7469 г Mn2O3, что соответствует стехиометрии, и сушат в течение 10 часов при 160°C. Затем растворяют в 172 мл 65 %-ной азотной кислоте, что соответствует 8 мл/г исходной смеси, и после полного растворения добавляют 86 мл глицерина, что соответствует эквимолярному соотношению к ионам металлов. Раствор выдерживают на плитке при температуре 160°С для испарения воды и излишек азотной кислоты до образования геля, который при нагревании при температуре 400°С и выдержке в течение 15 минут образует мелкодисперсный порошок. Полученный порошок растирают в агатовой ступке с добавлением этилового спирта, а затем проводят одноосное прессование при давлении 5 бар для получения таблеток. Затем осуществляют отжиг в воздушной атмосфере при температуре 1300°C в муфельной печи с точностью поддержания температуры ±1°C. Время выдержки составляет 10 часов. После чего проводят отжиг в потоке смеси 5% H2/Ar при температуре 1000°C в течение 8 часов, после чего выдерживают при 450°C в течение 4 часов в воздушной атмосфере. Получают двойной манганит NdBa0,8Ca0,2Mn2O6-δ, который кристаллизуется в тетрагональной кристаллической решетке (пр. гр. P4/mmm) с параметрами a = 3,899 и c = 7,723 с образованием агломератов с размером зерен 1 - 5 мкм и большим количеством пор. Полученный носитель кислорода полностью комплектен по кислороду (NdBa0,8Ca0,2Mn2O6,00). Кислородная ёмкость достигает 3,65 % и сохраняется стабильной на протяжении 20 циклов (см. фиг. 3). В результате обратимого обмена кислорода с газовой фазой кислород-аккумулирующий материал не претерпевает фазовых или структурных преобразований, выпадение примесей не зарегистрировано.
Таким образом, авторами предлагается аккумулирующий кислород материал на основе сложного манганита неодима и бария, допированный кальцием, обеспечивающий отсутствие деградации кислородной емкости в течение окислительно-восстановительных циклов, при этом величина кислородной емкости достигает 3,65-3,75 мас. %.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения сложного оксида манганита BaLnMnO | 2019 |
|
RU2718697C1 |
| Тройной манганит празеодима, бария и стронция | 2024 |
|
RU2838991C1 |
| Твердооксидный электродный материал на основе феррита празеодима-бария | 2024 |
|
RU2825434C1 |
| Способ жидкофазного синтеза нанокерамических материалов в системе LaO-MnO-NiO для создания катодных электродов твердооксидного топливного элемента | 2020 |
|
RU2743341C1 |
| МАТЕРИАЛ ДЛЯ КИСЛОРОДНОГО ЭЛЕКТРОДА ЭЛЕКТРОХИМИЧЕСКИХ УСТРОЙСТВ | 1997 |
|
RU2146360C1 |
| Способ получения электролитного материала на основе (La,Sr)(Ga,Mg)O | 2024 |
|
RU2834390C1 |
| ТВЕРДЫЙ ОКИСНЫЙ ЭЛЕМЕНТ И СОДЕРЖАЩАЯ ЕГО БАТАРЕЯ | 2009 |
|
RU2521874C2 |
| МАТЕРИАЛ ДЛЯ КИСЛОРОДНОГО ЭЛЕКТРОДА ЭЛЕКТРОХИМИЧЕСКИХ УСТРОЙСТВ | 2011 |
|
RU2460178C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАНГАНИТА ЛАНТАНА, ЛЕГИРОВАННОГО КАЛЬЦИЕМ | 2012 |
|
RU2505485C1 |
| МЕМБРАНА И ЕЕ ИСПОЛЬЗОВАНИЕ | 1998 |
|
RU2197320C2 |

Изобретение относится к материалу со структурой перовскита, который может быть использован при риформинге метана для получения синтез-газа, водорода, полного сжигания метана до углекислого газа и воды. Аккумулирующий кислород материал на основе сложного манганита редкоземельного элемента и бария содержит в качестве редкоземельного элемента неодим, дополнительно допирован ионами Ca+2 и имеет состав NdBa0,8Ca0,2Mn2O6-δ. Изобретение позволяет получить аккумулирующий кислород материал, обеспечивающий отсутствие деградации кислородной емкости в течение окислительно-восстановительных циклов, при этом величина кислородной емкости достигает 3,65-3,75 мас.%. 3 ил., 2 пр.
Аккумулирующий кислород материал на основе сложного манганита редкоземельного элемента и бария, отличающийся тем, что он содержит в качестве редкоземельного элемента неодим, дополнительно допирован ионами Ca+2 и имеет состав NdBa0,8Ca0,2Mn2O6-δ.
| KUDYAKOVA V.S | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Нож для надрезывания подошвы рантовой обуви | 1917 |
|
SU269A1 |
| RU 2006132422 A, 20.03.2008 | |||
| АККУМУЛИРУЮЩИЙ КИСЛОРОД МАТЕРИАЛ С ВЫСОКОЙ ТЕРМОСТОЙКОСТЬЮ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1998 |
|
RU2214861C2 |
| 0 |
|
SU195987A1 | |
| CN 113429198 A, 24.09.2021 | |||
| ШАЛАМОВА А.М | |||
| и др | |||
| Образование дефектов и термодинамика кислородного обмена в слоистых перовскитоподобных | |||
Авторы
Даты
2025-02-14—Публикация
2024-06-17—Подача