Настоящее изобретение относится к классу новых пептидных соединений, к их солям, содержащим их фармацевтическим композициям и к их применению для терапии человека. В частности, изобретение направлено на класс соединений, которые являются агонистами рецепторов глюкагоноподобного пептида (GLP). Более конкретно, изобретение направлено на соединения, которые являются агонистами рецепторов глюкагоноподобного пептида-1 (GLP-1) и глюкагоноподобного пептида-2 (GLP-2). Более конкретно, изобретение направлено на соединения, которые являются селективными агонистами рецептора глюкагоноподобного пептида-2 (GLP-2). Изобретение также относится к производству и применению этих соединений и композиций для профилактики или лечения таких заболеваний, в которые вовлечены рецепторы GLP.
Уровень техники
Глюкагоноподобный пептид-1 (GLP-1) и глюкагоноподобный пептид-2 (GLP-2) представляют собой высококонсервативные аминокислотные пептиды, происходящие из одного белка-предшественника. Эти биологически активные пептиды кодируются геном проглюкагона, который подвергается тканеспецифичному посттрансляционному процессингу в поджелудочной железе (альфа-клетках), кишечнике (L-клетках) и центральной нервной системе (ЦНС). В желудочно-кишечном тракте прогормонконвертаза 1/3 отвечает за расщепление проглюкагона с образованием ряда биологически активных пептидов, включая GLP-1, GLP-2, IP2, оксинтомодулин и глицентин. Как GLP-1, так и GLP-2 секретируются в ответ на прием питательных веществ кишечными L-клетками, локализованными в дистальном отделе подвздошной кишки и толстой кишки, и сообщается, что у человека уровни этих кишечных пептидов в плазме повышаются после приема пищи.
Действие GLP-1 и GLP-2 опосредуется активацией связанных с G-белком рецепторов класса B, GLP-1R и GLP-2R, которые связаны с Gs-белком и стимулируют продукцию цАМФ посредством активации аденилатциклазы. GLP-1R экспрессируется в головном мозге, островковых клетках поджелудочной железы, сердце, почках и нейронах межмышечного сплетения в желудочно-кишечном тракте. С другой стороны, экспрессия GLP-2R более ограничена, а рецептор в значительной степени локализован в ЦНС и желудочно-кишечном тракте. Сообщалось, что ряд типов клеток экспрессируют GLP-2R в кишечнике, включая кишечные нейроны, субэпителиальные миофибробласты и энтероэндокринные клетки, однако точное клеточное распределение еще предстоит определить.
Сообщалось, что GLP-2 участвует в широком спектре физиологических функций, включая барьерную функцию кишечника, мезентериальное кровообращение, кишечную моторику и секрецию кислоты. Экзогенное введение GLP-2 стимулирует пролиферацию клеток крипт, увеличивает длину кишечных ворсинок и способствует росту и восстановлению слизистой оболочки тонкой кишки. Мощная кишечнотропная активность GLP-2 была зарегистрирована у разных видов, включая крыс, свиней и человека. Кроме того, GLP-2 повышает абсорбционную способность кишечника за счет регуляции ферментов щеточной каймы кишечника и переносчиков растворенных веществ, что подчеркивает потенциальную роль этого гормона кишечника в контроле энергетического гомеостаза. На основании способности стимулировать сильные кишечнотропные эффекты в кишечнике, тедуглутид, аналог GLP-2, был одобрен в качестве фармакологической терапии для зависимых от парентерального питания пациентов с синдромом короткой кишки, и было показано, что он снижает потребность в парентеральном питании, а также способствует энтеральной автономии.
GLP-1 представляет собой пептид из 31 аминокислот, который высвобождается совместно с GLP-2 в ответ на питательные вещества (углеводы, жиры, белки) в просвете кишечника и служит инкретиновым гормоном кишечника, который действует совместно с глюкозозависимым инсулинотропным полипептидом (GIP). GLP-1 играет ключевую физиологическую роль в функции островковых β-клеток поджелудочной железы, регулируя пролиферацию β-клеток, а также постпрандиальный синтез/высвобождение инсулина. Кроме того, исследования показали, что GLP-1 контролирует высвобождение других кишечных пептидов, таких как соматостатин и глюкагон. После своего высвобождения соматостатин подавляет секрецию GLP-1 и GIP, тем самым создавая систему обратной связи в энтероэндокринных клетках. GLP-1 является ключевым анорексигенным пептидом, участвующим в регуляции чувства сытости и контроля аппетита, а также влияет на функцию желудочно-кишечного тракта посредством воздействия на опорожнение желудка и перистальтику кишечника. Несколько агентов GLP-1 в настоящее время продаются для лечения сахарного диабета 2-го типа и успешно улучшают гликемический контроль у пациентов с диабетом.
Кишечная недостаточность (КН) относится к серьезному и инвалидизирующему состоянию, при котором кишечник не может поглощать воду, электролиты, макро- и микроэлементы, необходимые для выживания. Причины КН разнообразны и могут быть результатом обструкции, нарушения моторики, хирургической резекции, врожденного дефекта или связанной с болезнью потери всасывания.
Синдром короткой кишки (СКК) представляет собой наиболее распространенную причину кишечной недостаточности и возникает в результате физической или функциональной потери участка кишечника, что часто приводит к недоеданию, потере веса, обезвоживанию, диарее, стеаторее, утомляемости и болям в животе. Лечение СКК требует мультидисциплинарной помощи и поддержки в виде парентерального питания (ПП) для компенсации значительной потери жидкости и восстановления баланса питательных веществ и электролитов. Хотя это имеет решающее значение для выживания, длительная зависимость от парентерального питания может негативно сказаться на качестве жизни пациента и, кроме того, увеличить риск опасных для жизни осложнений, таких как сепсис, связанный с катетером, венозный тромбоз и повреждение печени (например, стеатоз, холестаз).
Симптомы и тяжесть СКК могут варьировать в зависимости от локализации и длины остатка кишечника. Известно, что на моторику кишечника влияют несколько гормонов кишечника, включая GLP-1, GLP-2 и PYY, которые обычно продуцируются L-клетками в подвздошной кишке и проксимальном отделе толстой кишки. Гормоны, такие как GLP-1, обеспечивают важные механизмы обратной связи для контроля скорости транзита через ЖКТ для эффективного переваривания и всасывания питательных веществ. Пациенты с еюностомой, у которых утерян подвздошный тормоз, имеют более низкие концентрации GLP-1 и GLP-2 в плазме натощак и обычно страдают быстрым опорожнением желудка и желудочно-кишечным транзитом с высоким выходом через стому. Небольшие пилотные исследования показали, что эксенатид или лираглутид (агонисты GLP-1) улучшают симптомы диареи у пациентов с СКК и, кроме того, снижают потребность в ПП.
В дополнение к сложной клинической картине также существуют данные о нарушении регуляции энтероинсулярной оси у пациентов с резекцией кишечника, что приводит к нарушению инсулинового ответа в ответ на пероральное введение глюкозы. Кроме того, гипергликемия является частым осложнением парентерального питания у госпитализированных больных и может повышать риск летального исхода и инфекционных осложнений. По оценкам, распространенность гипергликемии у пациентов, получающих специализированную нутритивную поддержку, составляет до 30% у пациентов, получающих энтеральное питание, и 50% у пациентов, получающих парентеральное питание. Признано, что постоянный плохой контроль гипергликемии может привести к снижению функции бета-клеток поджелудочной железы и может способствовать усугублению осложнений, таких как микрососудистые заболевания, сердечно-сосудистые события и гипертония. Пациенты с гипергликемией на полном ПП имеют больший риск госпитализации в ОИТ, более длительное пребывание в стационаре и более высокий уровень смертности по сравнению с пациентами без гипергликемии.
Основываясь на известной инсулинотропной активности агонистов GLP-1, активация этого механизма потенциально может принести дополнительную пользу тем, у кого после операции развилась сниженная чувствительность к инсулину, и у пациентов, получающих парентеральное питание. Таким образом, эти результаты подчеркивают потенциал комбинированного фармакологического подхода GLP-2/GLP-1 в лечении состояний кишечной недостаточности, включая СКК.
Другие состояния кишечной недостаточности, при которых агонисты GLP-2/GLP-1 могут принести пользу, включают редкие врожденные диарейные заболевания, такие как тафтинг-энтеропатия, которая проявляется ранним началом тяжелой трудноизлечимой диареи, которая сохраняется во время голодания. Интенсивное лечение младенцев с помощью парентерального питания, восполнения жидкости и электролитов крайне необходимо для предотвращения обезвоживания, дисбаланса электролитов и нарушения роста в результате сильной недостаточности питания.
Ген, кодирующий молекулу адгезии эпителиальных клеток, EpCAM, демонстрирует связь с тафтинг-энтеропатией, и на сегодняшний день в литературе описано более 25 мутаций EpCAM. Мутации в гене EpCAM приводят к потере экспрессии на клеточной поверхности, вызывая характерные гистологические признаки в кишечном эпителии, такие как очаговое скопление энтероцитов и образование «пучков». Мыши, несущие делецию 4-го экзона гена EpCAM, демонстрируют сходные морфологические дефекты с пациентами с тафтинг-энтеропатией, сопровождаемые значительной заболеваемостью и смертностью. EpCAM напрямую связывается с клаудином 7, молекулой плотных контактов, и нарушения в этом гене приводят к плохой адгезии энтероцитов и нарушению барьерной функции кишечника, возможно, за счет подавления молекул плотных контактов.
Младенцы с тафтинг-энтеропатией имеют низкий уровень IGF-1 и зависят от парентерального питания для компенсации снижения способности усваивать питательные вещества. В настоящее время не существует фармакологического лечения этого изнурительного состояния, и существует острая потребность в средствах, которые могут улучшить функцию кишечника, чтобы способствовать независимости от парентерального питания. Недавний анализ отдаленных результатов лечения пациентов с тафтинг-энтеропатией показал, что энтеральная автономия может быть успешно достигнута у большинства пациентов, если они эффективно лечатся в специализированных учреждениях. Ожидается, что терапия, способствующая раннему отлучению от парентерального питания, приведет к лучшим долгосрочным результатам у этих пациентов и улучшит качество жизни. Агенты, действующие на рецепторы GLP-2 и GLP-1, могут быть многообещающими в восстановлении барьерной функции и содействии восстановлению функции кишечника при этом врожденном диарейном заболевании.
Сущность изобретения
Настоящее изобретение относится к новым соединениям с агонистической активностью в отношении рецепторов GLP-2 и GLP-1, содержащим их фармацевтическим композициям и к применению соединений для изготовления лекарственных средств для лечения заболеваний.
Соответственно, в одном варианте осуществления изобретение относится к соединению формулы (1):

(1)
где:
Q представляет собой фенил или моноциклическое гетероарильное кольцо, каждое из которых необязательно может быть замещено одной или несколькими группами Rq;
Rq выбирают из галогена, гидроксила, аминогруппы или C1-6-алкила, имеющего алкильную цепь, необязательно содержащую один или несколько гетероатомов, выбранных из O, N или S;
n представляет собой 1-3;
R1 и R2 независимо выбирают из водорода или C1-6-алкильной группы, или вместе с углеродом, к которому они присоединены, соединяются с образованием C3-8-циклоалкильной или гетероциклической группы;
W представляет собой последовательность -Gly-Ser-, -Ala-Ser- или -DAla-Ser-;
Y представляет собой последовательность -Leu-Asp-;
Z представляет собой последовательность -Asp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-;
AA1 представляет собой -NHCHR3CO-; где R3 выбирают из -(CH2)yCONH2, -(CH2)yCOOH или -(CH2)yтетразолила; где у представляет собой 1 или 2;
АА2 представляет собой -NHCR4aR4bCO-; где R4a представляет собой водород или C1-3 алкильную группу; и R4b представляет собой бензильную группу, необязательно замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами;
AA3 представляет собой -Aib- или -Ile-;
АА4 представляет собой -NHCR5aR5bCO-; где R5a представляет собой водород или C1-3-алкильную группу; и R5b представляет собой необязательно замещенную C1-6-алкильную группу или -(CH2)xCONH2; где х представляет собой 1 или 2;
АА5 представляет собой -Ala- или -Aib-;
АА6 представляет собой -Lys-, -Aib- или группу -LysR-;
АА7 представляет собой -Lys- или -Arg-;
AA8 представляет собой -NHCR6aR6bCO-; где R6a представляет собой водород или C1-3-алкильную группу; и R6b представляет собой необязательно замещенную C1-6-алкильную группу;
АА9 представляет собой -NHCR7aR7bCO-; где R7a представляет собой водород или C1-3 алкильную группу; и R7b представляет собой -(CH2)zCOOH или бензильную группу, необязательно замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами; где z представляет собой 1 или 2;
LysR представляет собой N-замещенный остаток лизина;
где С-конец AA9 представляет собой карбоксильную группу или карбоксамидную группу, или примыкает к любой природной или неприродной аминокислотной последовательности или любому другому фрагменту, функциональной группе или группам;
или к его таутомерной или стереохимически изомерной форме, или его пролекарству, соли или цвиттериону.
Производные GLP-2/GLP-1 по настоящему изобретению можно использовать для лечения различных заболеваний, как описано ниже.
В одном аспекте настоящее изобретение относится к способу стимуляции роста ткани тонкой кишки у пациента, нуждающегося в этом, включающему в себя стадию доставки пациенту кишечнотропного количества аналога GLP-2/GLP-1 по настоящему изобретению.
В дополнительном аспекте настоящее изобретение относится к способу изготовления лекарственного средства для лечения желудочно-кишечных заболеваний, которые включают кишечную недостаточность или другие состояния, ведущие к нарушению всасывания питательных веществ и кишечной недостаточности. Примеры таких заболеваний могут включать синдром короткой кишки, диарейные заболевания, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, поухит, радиационно-индуцированное поражение кишечника, глютеновую болезнь (глютен-чувствительную энтеропатию), НПВП-индуцированное поражение ЖКТ, индуцированное противораковым лечением повреждение тканей, например, энтерит, вызванный химиотерапией), болезнь Паркинсона, атрофию слизистой оболочки, вызванную парентеральным питанием, кишечную недостаточность у недоношенных детей, некротизирующий энтероколит, непереносимость питания новорожденных, врожденные диарейные заболевания, врожденные или приобретенные нарушения пищеварения и всасывания, повреждение тканей, вызванное сосудистой обструкцией, травмой или ишемией.
Дополнительным аспектом изобретения является способ лечения симптомов или лечения редких врожденных диарейных заболеваний у пациента, нуждающегося в этом, путем доставки аналога GLP-2/GLP-1 по настоящему изобретению в терапевтически эффективном количестве. Постоянная неконтролируемая диарея может вызвать серьезное обезвоживание, дисбаланс электролитов, недоедание и задержку развития, которые при отсутствии лечения могут привести к опасному для жизни состоянию, включая смерть.
В еще одном аспекте настоящее изобретение относится к применению соединения, описанного выше, для изготовления лекарственного средства для лечения тафтинг-энтеропатии, редкого врожденного диарейного заболевания, характеризующегося ранним началом тяжелой и трудноизлечимой диареи, которая часто приводит к кишечной недостаточности.
Еще одним аспектом изобретения является способ лечения метаболических заболеваний и синдромов у пациента, нуждающегося в этом, путем доставки аналога GLP-2/GLP-1 по настоящему изобретению в терапевтически эффективном количестве. В одном варианте метаболические заболевания и синдромы включают ожирение, диабет 2-го типа, неалкогольную жировую болезнь печени (НАЖБП), неалкогольный стеатогепатит (НАСГ), резистентность к инсулину, гипергликемию, резистентность к инсулину, непереносимость глюкозы. Предполагается, что лечение аналогом GLP-2/GLP-1 может восстановить гликемический контроль и чувствительность к инсулину. Это может быть полезно для лечения гипергликемии во время терапии энтеральным и парентеральным питанием у пациентов с кишечной недостаточностью или мальабсорбцией.
Подробное описание изобретения
Настоящее изобретение относится к новым соединениям. Изобретение также относится к применению новых соединений в качестве агонистов рецепторов GLP. Изобретение также относится к применению новых соединений в производстве лекарственных средств для применения в качестве агонистов рецептора GLP или для лечения желудочно-кишечных и метаболических нарушений. Изобретение дополнительно относится к соединениям, композициям и лекарственным средствам, которые являются селективными агонистами рецептора GLP-2.
Соответственно, в одном варианте осуществления изобретение относится к соединению формулы (1):

(1)
где:
Q представляет собой фенил или моноциклическое гетероарильное кольцо, каждое из которых необязательно может быть замещено одной или несколькими группами Rq;
Rq выбирают из галогена, гидроксила, аминогруппы или C1-6-алкила, имеющего алкильную цепь, необязательно содержащую один или несколько гетероатомов, выбранных из O, N или S;
n представляет собой 1-3;
R1 и R2 независимо выбирают из водорода или C1-6-алкильной группы, или вместе с углеродом, к которому они присоединены, соединяются с образованием C3-8-циклоалкильной или гетероциклической группы;
W представляет собой последовательность -Gly-Ser-, -Ala-Ser- или -DAla-Ser-;
Y представляет собой последовательность -Leu-Asp-;
Z представляет собой последовательность -Asp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-;
AA1 представляет собой -NHCHR3CO-; где R3 выбирают из -(CH2)yCONH2, -(CH2)yCOOH или -(CH2)yтетразолила; где у представляет собой 1 или 2;
АА2 представляет собой -NHCR4aR4bCO-; где R4a представляет собой водород или C1-3 алкильную группу; и R4b представляет собой бензильную группу, необязательно замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами;
AA3 представляет собой -Aib- или -Ile-;
АА4 представляет собой -NHCR5aR5bCO-; где R5a представляет собой водород или C1-3-алкильную группу; и R5b представляет собой необязательно замещенную C1-6-алкильную группу или -(CH2)xCONH2; где х представляет собой 1 или 2;
АА5 представляет собой -Ala- или -Aib-;
АА6 представляет собой -Lys-, -Aib- или группу -LysR-;
АА7 представляет собой -Lys- или -Arg-;
AA8 представляет собой -NHCR6aR6bCO-, где R6a представляет собой водород или C1-3-алкильную группу; и R6b представляет собой необязательно замещенную C1-6-алкильную группу;
АА9 представляет собой -NHCR7aR7bCO-; где R7a представляет собой водород или C1-3 алкильную группу; и R7b представляет собой -(CH2)zCOOH или бензильную группу, необязательно замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами; где z представляет собой 1 или 2;
LysR представляет собой N-замещенный остаток лизина;
где С-конец AA9 представляет собой карбоксильную группу или карбоксамидную группу, или примыкает к любой природной или неприродной аминокислотной последовательности или любому другому фрагменту, функциональной группе или группам;
или к его таутомерной или стереохимически изомерной форме, или его пролекарству, соли или цвиттериону.
Q может представлять собой имидазольное кольцо. Q может представлять собой:  .
.
n может представлять собой 1. n может представлять собой 2. n может представлять собой 3.
R1 и R2 могут быть независимо выбраны из водорода или C1-6-алкильной группы. R1 может представлять собой водород или C1-6-алкильную группу. R2 может представлять собой водород или C1-6-алкильную группу. R1 и R2 оба могут представлять собой метил. R1 может представлять собой метил. R2 может представлять собой метил.
W может представлять собой -Gly-Ser-. W может представлять собой -Ala-Ser-. W может представлять собой -DAla-Ser-.
X может представлять собой -Ser-Asp-Glu-Nle-DPhe-Thr-. X может представлять собой -Ser-Asp-Glu-Nle-Asn-Thr-.
AA1 может представлять собой -NHCHR3CO-; где R3 представляет собой -(CH2)yтетразолил, где y представляет собой 1.
AA1 может представлять собой -NHCHR3CO-; где R3 представляет собой -(CH2)yтетразолил, где y представляет собой 2.
R3 может представлять собой -CH2тетразолил.
AA1 может представлять собой -NHCHR3CO-; где R3 представляет собой -(CH2)yCOOH, где y представляет собой 1.
AA1 может представлять собой -NHCHR3CO-; где R3 представляет собой -(CH2)yCOOH, где y представляет собой 2.
R3 может представлять собой -CH2COOH.
AA1 может представлять собой
 .
.
AA1 может представлять собой -Asp-. AA1 может представлять собой остаток аспарагиновой кислоты. AA1 может представлять собой
 .
.
AA2 может представлять собой -NHCR4aR4bCO-; где R4a представляет собой водород, а R4b представляет собой бензил. AA2 может представлять собой -NHCR4aR4bCO-; где R4a представляет собой метил, а R4b представляет собой бензил. AA2 может представлять собой -NHCR4aR4bCO-; где R4a представляет собой метил, а R4b представляет собой бензил, необязательно замещенный фтором. AA2 может представлять собой -NHCR4aR4bCO-; где R4a представляет собой метил, а R4b представляет собой 2-фторбензил.
R4a может представлять собой водород или метил. R4a может представлять собой водород. R4a может представлять собой метил. R4b может представлять собой бензил. R4b может представлять собой бензил, необязательно замещенный фтором. R4b может представлять собой 2-фторбензил.
AA2 может представлять собой -Phe-. AA2 может представлять собой остаток фенилаланина. AA2 может представлять собой
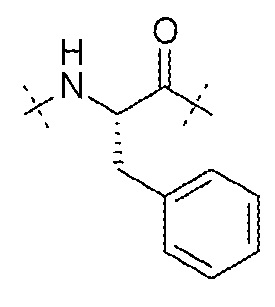 .
.
AA2 может представлять собой остаток α-метилфенилаланина. AA2 может представлять собой
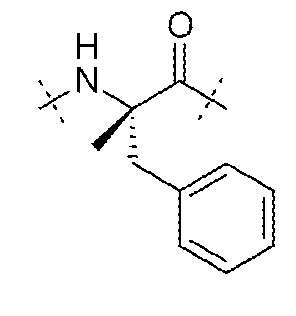 .
.
AA2 может представлять собой остаток α-метил-2-фторфенилаланина. AA2 может представлять собой
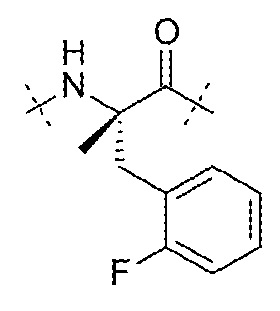 .
.
AA3 может представлять собой -Aib-. AA3 может представлять собой -Ile-.
AA4 может представлять собой -NHCR5aR5bCO-; где R5a представляет собой водород и R5b представляет собой изобутил. AA4 может представлять собой -NHCR5aR5bCO-; где R5a представляет собой метил, а R5b представляет собой изобутил. AA4 может представлять собой -NHCR5aR5bCO-; где R5a представляет собой водород, и R5b представляет собой -CH2CONH2.
R5a может представлять собой водород или метил. R5a может представлять собой водород. R5a может представлять собой метил. R5b может представлять собой изобутил или -CH2CONH2. R5b может представлять собой изобутил. R5b может представлять собой -CH2CONH2.
AA4 может быть -Leu-. AA4 может представлять собой остаток лейцина. AA4 может представлять собой
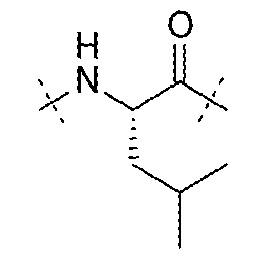 .
.
AA4 может представлять собой остаток α-метиллейцина. AA4 может представлять собой
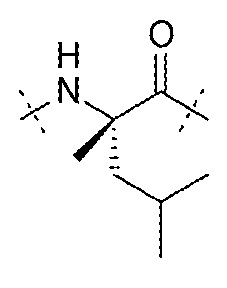 .
.
AA4 может представлять собой -Asn-. AA4 может представлять собой остаток аспарагина. AA4 может представлять собой
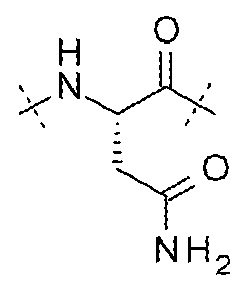 .
.
АА5 может представлять собой -Ala-. АА5 может представлять собой -Aib-.
AA6 может представлять собой -Lys-. AA6 может представлять собой -Aib-. AA6 может представлять собой группу -LysR-.
AA7 может представлять собой -Lys-. AA7 может представлять собой -Arg-.
AA8 может представлять собой -NHCR6aR6bCO-, где R6a представляет собой водород, а R6b представляет собой втор-бутил.
AA8 может представлять собой -NHCR6aR6bCO-, где R6a представляет собой метил, а R6b представляет собой изобутил.
R6a может представлять собой водород или метил. R6a может представлять собой водород. R6a может представлять собой метил.
R6b может представлять собой изобутил или втор-бутил. R6b может представлять собой изобутил. R6b может представлять собой изобутил.
AA8 может представлять собой -Ile-. AA8 может представлять собой остаток изолейцина. AA8 может представлять собой
 .
.
AA8 может представлять собой остаток α-метиллейцина. AA8 может представлять собой
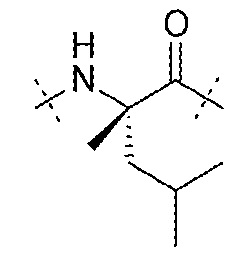 .
.
AA9 может представлять собой -NHCR7aR7bCO-; где R7a представляет собой водород, а R7b представляет собой -CH2COOH. AA9 может представлять собой -NHCR7aR7bCO-; где R7a представляет собой водород и R7b представляет собой бензил. AA9 может представлять собой -NHCR7aR7bCO-; где R7a представляет собой метил, а R7b представляет собой -CH2COOH.
R7a может представлять собой водород или метил. R7a может представлять собой водород. R7a может представлять собой метил.
R7b может представлять собой бензил или -CH2COOH. R7b может представлять собой бензил. R7b может представлять собой -CH2COOH.
AA9 может представлять собой -Asp-. AA9 может представлять собой остаток аспарагиновой кислоты. AA9 может представлять собой
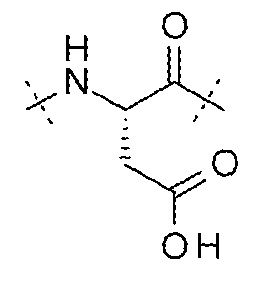 .
.
AA9 может представлять собой -Phe-. AA9 может представлять собой остаток фенилаланина. AA9 может представлять собой
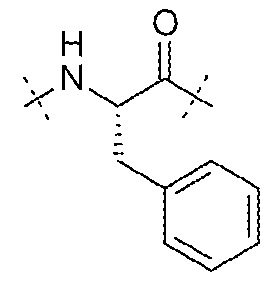 .
.
AA9 может представлять собой остаток α-метиласпарагиновой кислоты. AA9 может представлять собой
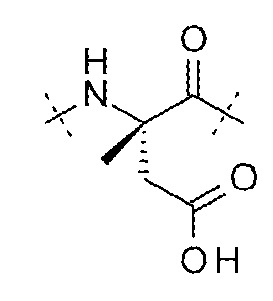 .
.
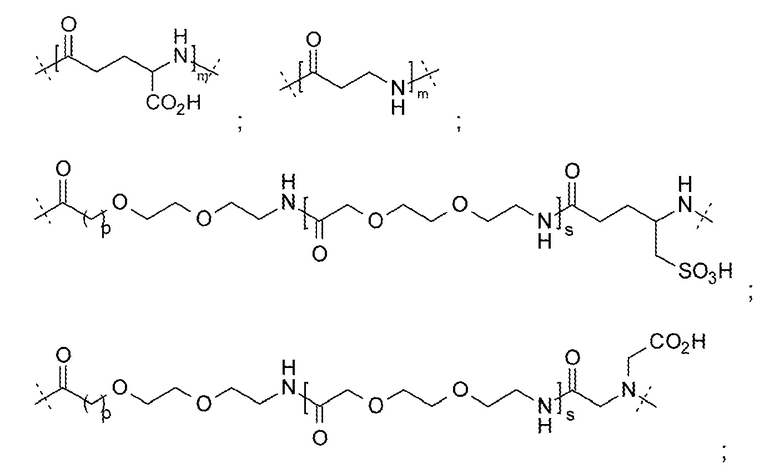
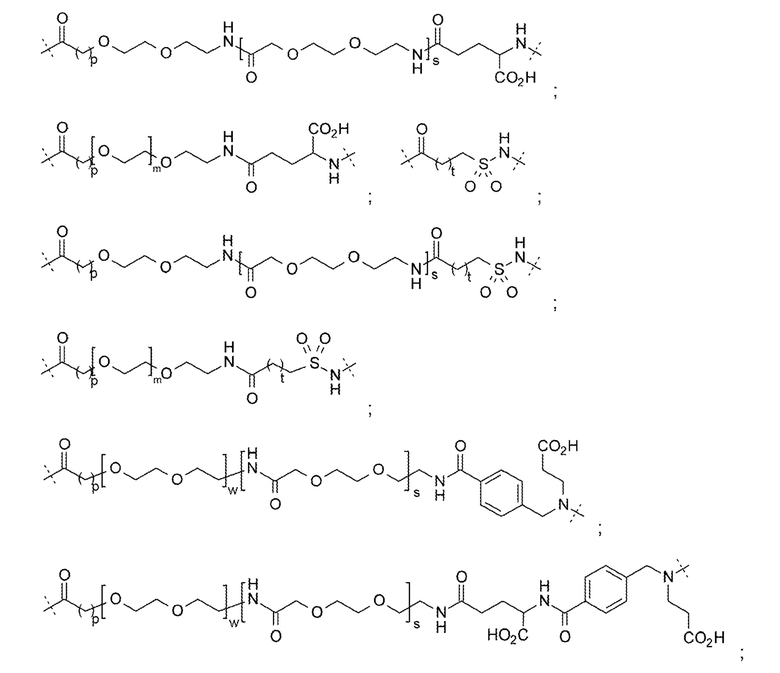
LysR может представлять собой N-замещенный остаток лизина, где N-заместитель выбирают из: -CO(CH2)qCH3; -CO(CH2)qCO2H; -CO(CH2)qCHCH2; -COO(CH2)qCH3; -COO(CH2)qCO2H и -COO(CH2)qCHCH2; где q представляет собой от 1 до 22.
LysR может представлять собой N-замещенный остаток лизина, где N-заместитель представляет собой -COO(CH2)qCHCH2; где q представляет собой от 1 до 22. LysR может представлять собой N-замещенный остаток лизина, где N-заместитель представляет собой -COO(CH2)qCHCH2; где q представляет собой 1. LysR может представлять собой N-замещенный остаток лизина, где N-заместитель представляет собой -COOCH2CHCH2.
LysR может представлять собой

LysR может представлять собой N-замещенный остаток лизина, где N-заместитель представляет собой группу -L-G;
где L выбирают из группы, состоящей из:
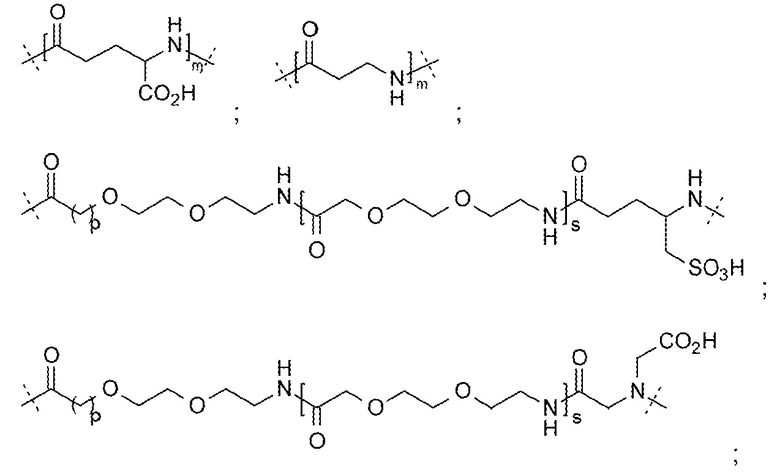

; и 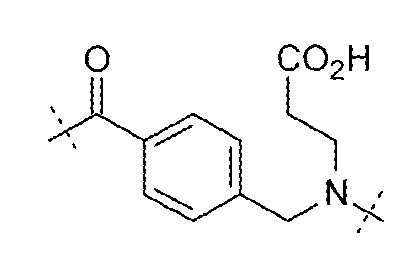 ;
;
и G выбирают из группы, состоящей из:
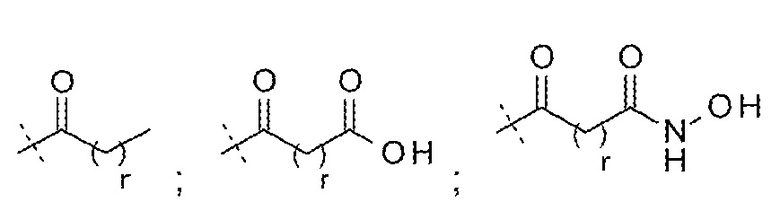 и
и 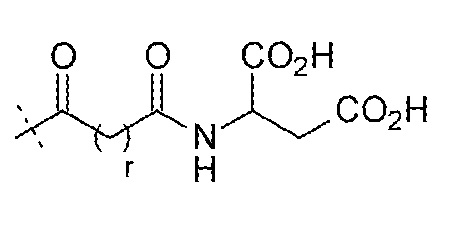 ;
;
где m представляет собой 1-23;
р представляет собой 1-3;
r представляет собой 1-20;
s представляет собой 0-3;
t представляет собой 0-4;
и w представляет собой 0-4
LysR может представлять собой
 .
.
LysR может представлять собой
 .
.
С-конец AA9 может представлять собой карбоксильную группу. С-конец AA9 может представлять собой карбоксамидную группу. С-конец AA9 может быть присоединен к любой природной или неприродной аминокислотной последовательности или любому другому фрагменту, функциональной группе или группам.
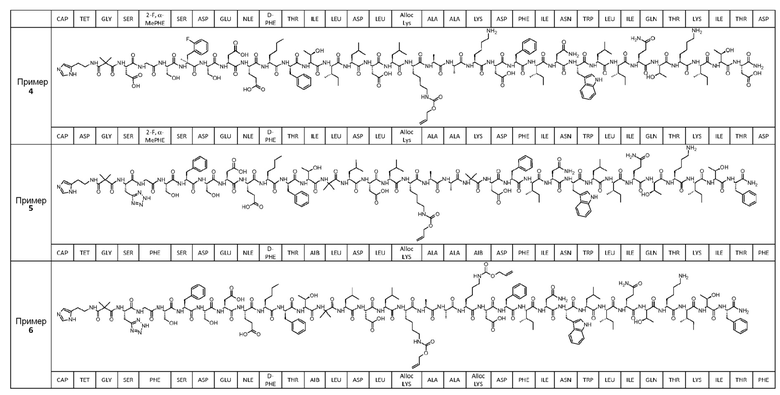
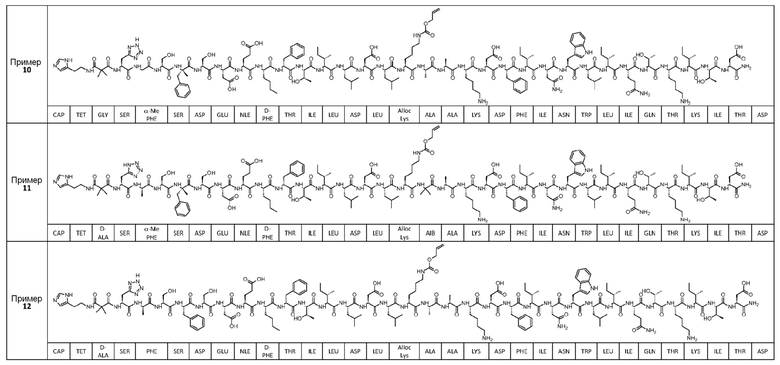
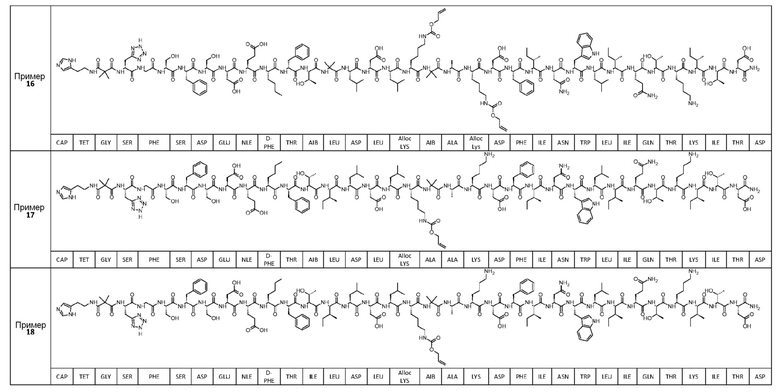
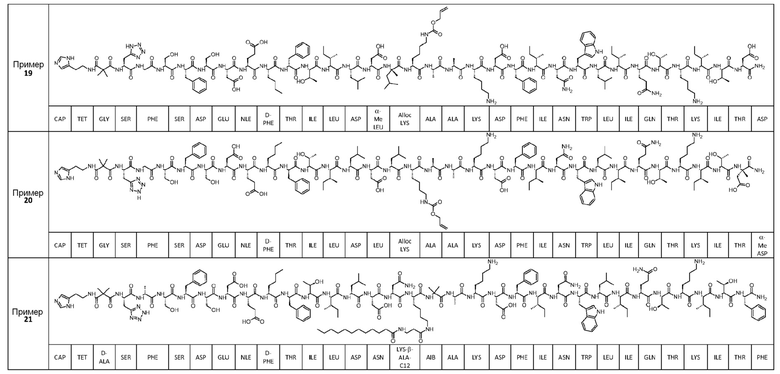
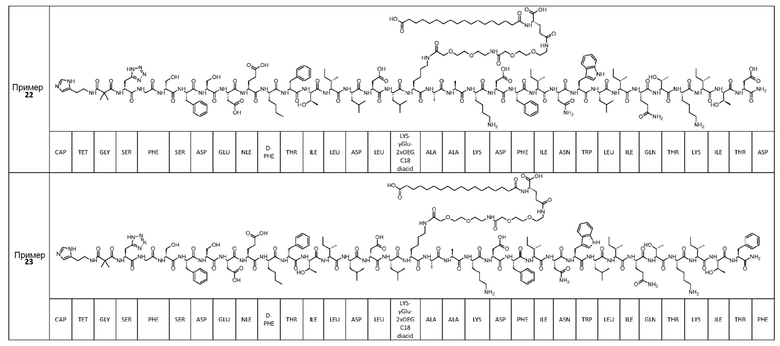
Соединение может быть выбрано из любого из примеров 1-23, приведенных в таблице 1.
Конкретные примеры соединений включают соединения, обладающие активностью агониста рецептора GLP.
Конкретные примеры соединений включают соединения, обладающие активностью агониста рецепторов GLP-1 и/или GLP-2.
Конкретные примеры соединений включают соединения, которые обладают более высокой активностью агониста рецептора GLP-2 по сравнению с активностью агониста рецептора GLP-1.
Соединения по изобретению можно использовать в фармацевтической композиции, содержащей соединение по изобретению и фармацевтически приемлемое вспомогательное вещество.
Соединения изобретения могут быть использованы в медицине.
Настоящее изобретение относится к применению соединения-аналога GLP-2/GLP-1 для изготовления лекарственного средства для лечения желудочно-кишечных и метаболических заболеваний. Аналоги GLP-2/GLP-1 по настоящему изобретению могут быть полезны для стимуляции восстановления кишечника и нутритивного статуса у пациентов с нарушениями всасывания, кишечной недостаточностью, кишечной недостаточностью, диарейными заболеваниями и хроническими воспалительными заболеваниями кишечника. Кроме того, терапевтическое лечение аналогами GLP-2/GLP-1 может улучшить барьерную функцию слизистой оболочки, уменьшить воспаление кишечника и уменьшить проницаемость кишечника, что может улучшить симптомы у пациентов с воспалительными заболеваниями, глютеновой болезнью, врожденными и приобретенными синдромами пищеварения и мальабсорбции, хроническими диарейными заболеваниями, состояниями, вызванные повреждением слизистой оболочки (например, при лечении рака). Ожидается, что аналог GLP-2/GLP-1 по настоящему изобретению восстанавливает гликемический контроль и чувствительность к инсулину. Это может быть полезно для лечения гипергликемии во время терапии энтеральным и парентеральным питанием у пациентов с кишечной недостаточностью или мальабсорбцией.
В дополнительном аспекте настоящее изобретение относится к способам лечения одной из групп, состоящих из повреждения ЖКТ, диарейных заболеваний, кишечной недостаточности, кишечной недостаточности, кислотного повреждения кишечника, дефицита аргинина, ожирения, глютеновой болезни, энтерита, вызванного химиотерапией, сахарного диабета, ожирения, мальабсорбции жиров, стеатореи, аутоиммунных заболеваний, пищевой аллергии, язвы желудка, нарушений желудочно-кишечного барьера, болезни Паркинсона, сепсиса, бактериального перитонита, воспалительного заболевания кишечника, повреждения тканей, связанного с химиотерапией, травмы кишечника, ишемии кишечника, ишемии брыжейки, синдрома короткой кишки, недостаточности питания, некротизирующего энтероколита, некротизирующего панкреатита, непереносимости питания у новорожденных, НПВП-индуцированного поражения ЖКТ, недостаточности питания, поражения ЖКТ при полном парентеральном питании, недостаточности питания у новорожденных, лучевого энтерита, лучевого поражения кишечника, мукозита, поухита, ишемии, ожирения, сахарного диабета 2-го типа, неалкогольной жировой болезни печени (НАЖБП), неалкогольного стеатогепатита (НАСГ), инсулинорезистентности, гипергликемии, инсулинорезистентности, непереносимости глюкозы.
В частности, предполагается, что состояние при врожденных диарейных заболеваниях, которое характеризуется тяжелой диареей, потерей жидкости и электролитов, нарушением всасывания и нарушением транспорта питательных веществ, может быть улучшено путем лечения аналогами GLP-2/и GLP-1 по настоящему изобретению. В частности, тафтинг-энтеропатия представляет собой состояние, связанное с нарушением морфологической архитектуры ворсинок, что приводит к нарушению всасывания питательных веществ и повышению проницаемости кишечника. Агенты, которые могут улучшать всасывание жидкости и питательных веществ, а также корректировать нарушение кишечного барьера, могут быть полезными для содействия раннему отлучению от парентерального питания.
Другие примеры врожденных диарейных заболеваний, которые можно лечить пептидом по изобретению, включают недостаточность ферментов щеточной каемки (врожденную недостаточность лактазы, врожденную недостаточность сахаразы-изомальтазы, врожденную недостаточность мальтазы-глюкоамилазы), дефекты мембранных носителей (глюкозо-галактозо-мальабсорбцию, мальабсорбцию фруктозы, энтеропатический акродерматит, врожденную хлоридно-натриевую диарею, первичную билиарную мальабсорбцию, муковисцидоз), дефекты метаболизма липидов/липопротеинов (болезнь ретенции хиломикронов, абеталипопротеинемию), дефекты дифференцировки энтероцитов или клеточной поляризации (атрофию микроворсинок, тафтинг-энтеропатию, трихогепатоэнтеральный синдром), и дефекты энтероэндокринных клеток (врожденную мальабсорбционную диарею, анэндокриноз, дефицит протеинконвертазы 1/3).
Соединения по изобретению можно использовать для лечения тафтинг-энтеропатии.
Определения
В настоящей заявке используются следующие определения, если не указано иное.
Термины «алкил», «арил», «галоген», «алкокси», «циклоалкил», «гетероциклил» и «гетероарил» используются в их обычном смысле (например, как определено в IUPAC Gold Book), если не указано иное.
Термин «лечение» в отношении применения любого из описанных в настоящем документе соединений, включая соединения формулы (1), используется для описания любой формы вмешательства, когда соединение вводят субъекту, страдающему от или подверженному риску заболевания или потенциально подверженному риску заболевания или расстройства, о которых идет речь. Таким образом, термин «лечение» охватывает как превентивное (профилактическое) лечение, так и лечение, при котором проявляются измеримые или обнаруживаемые симптомы заболевания или расстройства.
Термин «эффективное терапевтическое количество», используемый в данном документе (например, в отношении способов лечения расстройства, заболевания или состояния), относится к количеству соединения, которое является эффективным для получения желаемого терапевтического эффекта. Например, если состояние представляет собой боль, то эффективное терапевтическое количество представляет собой количество, достаточное для обеспечения желаемого уровня облегчения боли. Желаемым уровнем облегчения боли может представлять собой, например, полное устранение боли или снижение интенсивности боли.
В случае если любое из описанных соединений имеет хиральные центры, настоящее изобретение распространяется на все оптические изомеры таких соединений, как в форме рацематов, так и разделенных энантиомеров. Изобретение, описанное в настоящем документе, относится ко всем кристаллическим формам, сольватам и гидратам любого из раскрытых соединений, независимо от того, как они получены. В случае если любое из раскрытых в настоящем документе соединений имеет кислотные или основные центры, такие как карбоксильные группы или аминогруппы, тогда в изобретение включены все солевые формы указанных соединений. В случае применения в фармацевтике соль следует рассматривать как фармацевтически приемлемую соль.
Соли или фармацевтически приемлемые соли, которые могут быть упомянуты, включают соли присоединения кислот и соли присоединения оснований. Такие соли могут быть образованы обычными способами, например реакцией соединения в форме свободной кислоты или свободного основания с одним или несколькими эквивалентами соответствующей кислоты или основания, необязательно в растворителе или в среде, в которой соль является нерастворимой, с последующим удалением указанного растворителя или указанной среды с использованием стандартных методов (например, в вакууме, лиофилизацией или фильтрацией). Соли также могут быть получены путем замены противоиона соединения в форме соли на другой противоион, например, с использованием подходящей ионообменной смолы.
Примеры фармацевтически приемлемых солей включают соли присоединения кислот, полученные из минеральных кислот и органических кислот, и соли, полученные из металлов, таких как натрий, магний, калий и кальций.
Примеры солей присоединения кислот включают соли присоединения кислот, образованные уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, арилсульфоновой кислотами (например, бензолсульфоновой, нафталин-2-сульфоновой, нафталин-1,5-дисульфоновой и п-толуолсульфоновой), аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензойной, 4-ацетамидобензойной, бутановой, (+)камфорной, камфор-сульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновой, каприловой, коричной, лимонной, цикламовой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактаровой, гентизиновой, глюкогептоновой, глюконовой (например, D-глюконовой), глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой, бромистоводородной, соляной, йодистоводородной, изетионовой, молочной (например, (+)-L-молочной и (±)-DL-молочной), лактобионовой, малеиновой, яблочной (например, (-)-L-яблочной), малоновой, (±)-DL-миндальной, метафосфорной, метансульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памовой, фосфорной, пропионовой, L- пироглутаминовой, салициловой, 4-аминосалициловой, себациновой, стеариновой, янтарной, серной, дубильной, винной (например, (+)-L-винной), тиоциановой, ундециленовой и валериановой кислотами.
Также охватываются любые сольваты соединений и их солей. Предпочтительными сольватами являются сольваты, образованные путем включения в твердую структуру (например, кристаллическую структуру) соединений по изобретению молекул нетоксичного фармацевтически приемлемого растворителя (называемого ниже сольватирующим растворителем). Примеры таких растворителей включают воду, спирты (такие как этанол, изопропанол и бутанол) и диметилсульфоксид. Сольваты могут быть получены путем перекристаллизации соединений по изобретению с растворителем или смесью растворителей, содержащей сольватирующий растворитель. Образовался или нет сольват в любом конкретном случае, можно определить, подвергая кристаллы соединения анализу с использованием хорошо известных и стандартных методов, таких как термогравиметрический анализ (ТГА), дифференциальная сканирующая калориметрия (ДСК) и рентгеновская кристаллография.
Сольваты могут быть стехиометрическими или нестехиометрическими сольватами. Конкретные сольваты могут быть гидратами, и примеры гидратов включают полугидраты, моногидраты и дигидраты. Для более подробного обсуждения сольватов и способов, используемых для их получения и описания, см. Bryn et al, Solid-State Chemistry of Drugs, Second Edition, published by SSCI, Inc of West Lafayette, IN, USA, 1999, ISBN 0-967-06710-3.
Термин «фармацевтическая композиция» в контексте данного изобретения означает композицию, включающую действующий агент и дополнительно включающую один или несколько фармацевтически приемлемых носителей. Композиция может дополнительно содержать ингредиенты, выбранные из, например, разбавителей, адъювантов, вспомогательных веществ, носителей, консервантов, наполнителей, дезинтегрирующих агентов, смачивающих агентов, эмульгаторов, суспендирующих агентов, подсластителей, ароматизаторов, отдушек, антибактериальных агентов, противогрибковых агентов, смазывающих агентов и диспергирующих агентов в зависимости от характера способа введения и лекарственных форм. Композиции могут иметь форму, например, таблеток, драже, порошков, эликсиров, сиропов, жидких препаратов, включая суспензии, спреи, ингаляционные препараты, таблетки, леденцы, эмульсии, растворы, облатки, гранулы, капсулы и суппозитории, а также жидкие препараты для инъекций, в том числе липосомальные препараты.
Соединения по изобретению могут содержать один или несколько изотопных заместителей, и ссылка на конкретный элемент включает в себя все изотопы этого элемента. Например, ссылка на водород включает в себя 1H, 2H (D) и 3H (T). Точно так же ссылки на углерод и кислород включают в себя соответственно 12C, 13C и 14C, и 16O и 18O. Аналогичным образом ссылка на конкретную функциональную группу также включает в себя изотопные варианты, если в контексте не указано иное. Например, ссылка на алкильную группу, такую как этильная группа, или алкоксигруппу, такую как метоксигруппа, также охватывает варианты, в которых один или несколько атомов водорода в группе находятся в форме изотопа дейтерия или трития, например, в этильной группе, в которой все пять атомов водорода находятся в изотопной форме дейтерия (пердейтероэтильная группа), или в метоксигруппе, в которой все три атома водорода находятся в изотопной форме дейтерия (тридейтерометоксигруппа). Изотопы могут быть радиоактивными или нерадиоактивными.
Терапевтические дозы могут варьировать в зависимости от потребностей пациента, тяжести состояния, подлежащего лечению, и используемого соединения. Определение надлежащей дозировки для конкретной ситуации находится в пределах компетенции специалистов в данной области. Как правило, лечение начинают с меньших доз, которые меньше оптимальной дозы соединения. После этого дозу увеличивают понемногу до тех пор, пока не будет достигнут оптимальный эффект в данных обстоятельствах. Для удобства общая суточная доза может быть разделена и при желании может вводиться частями в течение дня.
Величина эффективной дозы соединения будет, конечно, варьировать в зависимости от характера тяжести состояния, подлежащего лечению, а также от конкретного соединения и пути его введения. Выбор подходящих дозировок находится в пределах компетенции специалиста в данной области и не представляет для него трудности. В целом диапазон суточных дозировок может составлять от примерно 10 мкг до примерно 30 мг на кг массы тела человека и животного, предпочтительно, от примерно 50 мкг до примерно 30 мг на кг массы тела человека и животного, например, от примерно 50 мкг до примерно 10 мг на кг массы тела человека и животного, например, от примерно 100 мкг до примерно 30 мг на кг массы тела человека и животного, например, от примерно 100 мкг до примерно 10 мг на кг массы тела человека и животного, и, наиболее предпочтительно, от примерно 100 мкг до примерно 1 мг на кг массы тела человека и животного.
Фармацевтические составы
Хотя действующее соединение можно вводить отдельно, предпочтительно предоставлять его в виде фармацевтической композиции (например, состава).
Соответственно, в другом варианте осуществления изобретения предложена фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (1), определенной выше, вместе по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом.
Композиция может представлять собой композицию, подходящую для инъекций. Инъекция может быть внутривенной (IV) или подкожной. Композиция может поставляться в стерильном буферном растворе или в виде твердого вещества, которое может быть суспендировано или растворено в стерильном буфере для инъекций.
Фармацевтически приемлемое вспомогательное вещество (вещества) можно выбрать, например, из носителей (например, твердого, жидкого или полутвердого носителя), адъювантов, разбавителей (например, твердых разбавителей, таких как наполнители или объемообразующие агенты, и жидких разбавителей, таких как растворители и сорастворители), гранулирующих агентов, связующих веществ, средств для улучшения текучести, средств для покрытия, веществ, контролирующих высвобождение (например, полимеров или восков, замедляющих или откладывающих высвобождение), связующих агентов, разрыхлителей, буферных агентов, смазывающих агентов, консервантов, противогрибковых и антибактериальных агентов, антиоксидантов, буферных агентов, регулирующих тоничность агентов, загустителей, ароматизаторов, подсластителей, пигментов, пластификаторов, маскирующих вкус агентов, стабилизаторов или любых других вспомогательных веществ, обычно используемых в фармацевтических композициях.
Термин «фармацевтически приемлемый» в контексте настоящего документа означает соединения, материалы, композиции и/или лекарственные формы, которые, в рамках здравого медицинского суждения, подходят для применения в контакте с тканями субъекта (например, субъекта-человека) без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соответствующих разумному соотношению польза/риск. Каждое вспомогательное вещество также должно быть «приемлемым» в смысле совместимости с другими ингредиентами состава.
Фармацевтические композиции, содержащие соединения формулы (1), могут быть составлены в соответствии с известными методиками, см., например, Remington’s Pharmaceutical Sciences, Mack Publishing Company, Easton, PA, USA.
Подходящие составы как правило содержат 0-20% (масс./масс.) буферов, 0-50% (масс./масс.) сорастворителей и/или 0-99% (масс./масс.) воды для инъекций (WFI) (в зависимости от дозы и использования лиофилизации). Составы для внутримышечных депо могут также содержать 0-99% (масс./масс.) масел.
Соединения формулы (1) в общем будут предложены в виде стандартной лекарственной формы и, как таковые, обычно содержат достаточное количество соединения для обеспечения желаемого уровня биологической активности. Например, состав может содержать от 1 нанограмма до 2 граммов действующего ингредиента, т.е. от 1 нанограмма до 2 миллиграммов действующего ингредиента. В пределах этих диапазонов конкретные поддиапазоны для соединения составляют от 0,1 миллиграммов до 2 граммов действующего ингредиента (чаще от 10 миллиграммов до 1 грамма, например, от 50 миллиграммов до 500 миллиграммов) или от 1 микрограмма до 20 миллиграммов (например, от 1 микрограмма до 10 миллиграммов, например, от 0,1 до 2 миллиграммов действующего ингредиента).
Действующее соединение будет вводиться нуждающемуся в этом пациенту (например, пациенту-человеку или животному) в количестве, достаточном для достижения желаемого терапевтического эффекта (эффективное количество). Точное количество вводимого соединения может быть определено лечащим врачом в соответствии со стандартными процедурами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
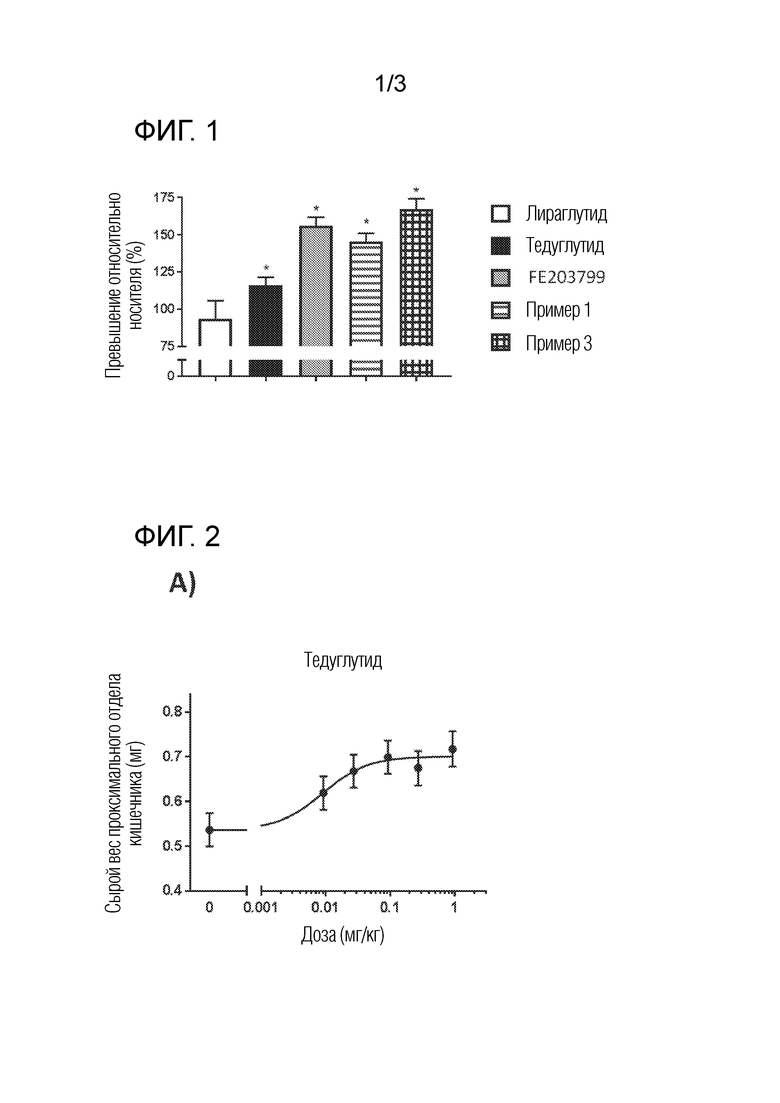
На фигуре 1 представлен график, демонстрирующий активность соединений в отношении роста кишечника in vivo. Мышам один раз в день подкожно вводили либо носитель (0,1% Tween80 в PBS), либо тедуглутид, либо соединения (270 нмоль/кг). Лираглутид вводили ежедневно в виде внутривенных инъекций (200 мкг/кг). Мышей умерщвляли на 3-й день и количественно определяли сырую массу тонкой кишки. Пептиды с активностью GLP-2 демонстрируют значительное увеличение веса тонкой кишки. С другой стороны, соединение с активностью GLP-1, лираглутид, не показало признаков активности в модели. Примеры 1 и 3 демонстрируют превосходное увеличение массы кишечника по сравнению с тедуглутидом в тех же дозах. N=6 животных на группу. *p <0,05 по сравнению с носителем.
На фигуре 2 представлен график, демонстрирующий дозозависимое действие соединений на рост массы кишечника после 7-дневного введения соединений мышам. Увеличение сырой массы тонкой кишки (по сравнению с носителем) представлено как функция от дозы пептида. A) тедуглутид; B) пример 1; C) пример 3. В целом, примеры 1 и 3 демонстрируют большее максимальное увеличение сырой массы тонкой кишки по сравнению с тедуглутидом. N=6 животных на группу.
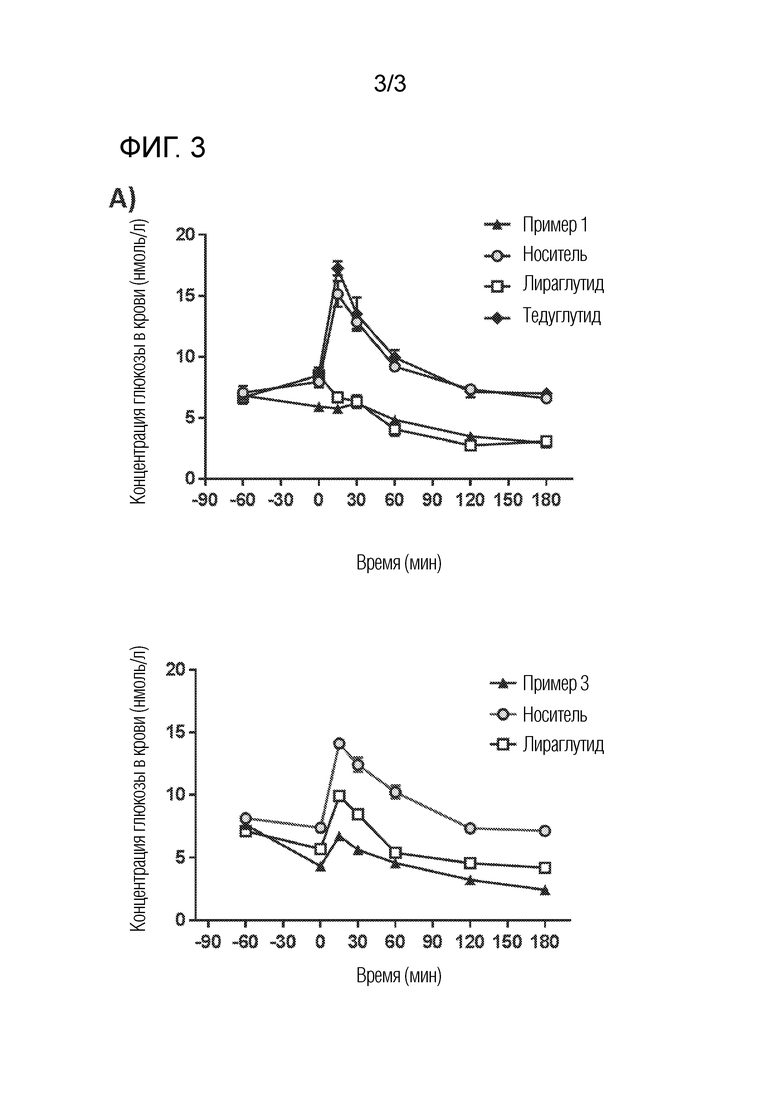
На фигуре 3 показано влияние соединений или введения носителя на пероральный тест на толерантность к глюкозе (OGTT). За час до введения глюкозы в виде однократной подкожной инъекции вводили соединение из примера 1 или 3 (270 нмоль/кг) или носитель (0,1% Tween80 в PBS). Лираглутид вводили внутривенно болюсно (200 мкг/кг) за 30 минут до перорального приема глюкозы. Серийные измерения уровня глюкозы в крови проводились на исходном уровне и в моменты времени после перорального введения глюкозы. (A) Динамика уровня глюкозы в крови. N=6 животных на группу. Среднее +/-SEM.
Биологическая активность
В таблицах 3 и 4 проиллюстрировала активность пептидов in vitro в отношении GLP-2R и GLP-1R в анализе с использованием рекомбинантных клеток. Функциональную активность пептидов оценивали с помощью анализа HTRF cAMP. Приведены значения pEC50. Результаты анализа GLP-2 in vitro для соединений, приведенных в таблице 1, находились в диапазоне от примерно 0,001 нМ до примерно 1 нМ. Аналоги GLP-2 по изобретению проявляют активность как в отношении рецепторов как GLP-2, так и GLP-1, при этом более высокая активность проявляется в отношении рецептора GLP-2.
ПРИМЕРЫ
Изобретение теперь будет проиллюстрировано, но не ограничено, ссылкой на конкретные варианты осуществления, описанные в следующих примерах.
ПРИМЕРЫ 1-23
Были получены соединения примеров 1-23, приведенные в таблице 1 ниже. Их свойства согласно ЖХ-МС и способы, используемые для их получения, изложены в таблице 2. Исходные вещества для каждого из примеров являются коммерческими, если не указано иное.
Таблица 1
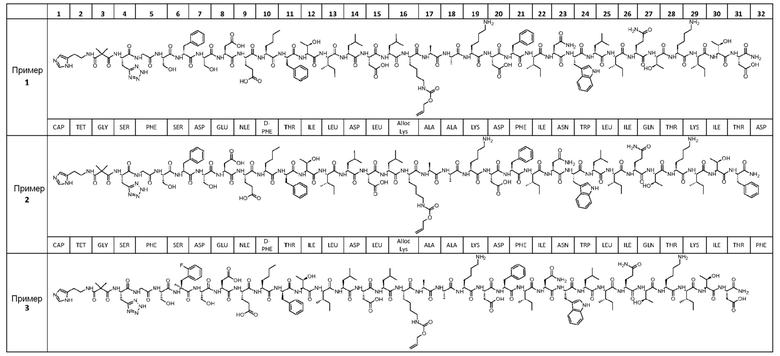


Общие методики
Если в описание не включены пути синтеза, то соответствующий промежуточный продукт имеется в продаже. Коммерческие реагенты использовали без дополнительной очистки. Комнатная температура (rt) относится примерно к 20-27°C. Спектры 1Н ЯМР регистрировали при частоте 400 МГц на приборе Bruker. Химический сдвиг выражается в частях на миллион (млн), т.е. в величине δ. Следующие сокращения используются для различных сигналов ЯМР: с=синглет, шир.=широкий, д=дублет, т=триплет, к=квартет, кв=квинтет, тд=триплет дублетов, тт=триплет триплетов, кд=квартет дублетов, ддд=дублет дублетов дублетов, ддт=дублет дублетов триплетов, м=мультиплет. Константы связи указаны как значения J, измеренные в Гц. Результаты ЯМР и масс-спектроскопии были скорректированы с учетом фоновых пиков. Хроматография относится к колоночной хроматографии, проводимой с использованием силикагеля 60-120 меш под давлением азота (флеш-хроматография).
Аналитические методы
ЖХ-МС анализ соединений проводили с использованием электроспрея.
ЖХ-МС метод А
Инструменты: Waters Acquity UPLC, Waters 3100 PDA Detector, SQD; Колонка: Acquity HSS-T3, 1,8 мкм, 2,1×100 мм; Градиент [время (мин)/растворитель B в A (%)]: 0,00/10, 1,00/10, 2,00/15, 4,50/55, 6,00/90, 8,00/90, 9,00/10, 10,00/10; Растворители: растворитель А=0,1% трифторуксусной кислоты (TFA) в воде; растворитель В=ацетонитрил; объем впрыска 1 мкл; длина волны обнаружения 214 нм; температура колонки 30°С; скорость потока 0,3 мл в мин.
Аналитический метод В
МС-ион идентифицировали с помощью метода ЖХ-МС, описанного ниже, с использованием электроспрея, время удерживания в ВЭЖХ (RT) определяли с помощью описанного ниже метода ВЭЖХ, чистота составляла > 95% по данным ВЭЖХ, если не указано иное.
ЖХ-МС: Agilent 1200 HPLC&6410B Triple Quad, колонка: Xbridge C18 3,5 мкм 2,1×30 мм. Градиент [время (мин)/растворитель B (%)]: 0,0/10, 0,9/80, 1,5/90, 8,5/5, 1,51/10. (Растворитель A=1 мл TFA в 1000 мл воды; растворитель B=1 мл TFA в 1000 мл MeCN); объем впрыска 5 мкл (может варьироваться); УФ-обнаружение 220 нм, 254 нм, 210 нм; температура колонки 25°С; 1,0 мл/мин.
ВЭЖХ: Agilent Technologies 1200, колонка: Gemini-NX C18 5 мкм 110A 150×4,6 мм. Градиент [время (мин)/растворитель B (%)]: 0,0/30, 20/60, 20,1/90, 23/90. (Растворитель A=1 мл TFA в 1000 мл воды; растворитель B=1 мл TFA в 1000 мл MeCN); объем впрыска 5 мкл (может варьироваться); УФ-обнаружение 220 нм, 254 нм; температура колонки 25°С; 1,0 мл/мин.
Аналитический метод С
Инструмент: Thermo Scientific Orbitrap Fusion; Колонка: Phenomenex Kinetex Biphenyl C18 100 Å, 2,6 мкм, 2,1×50 мм; Градиент [время (мин)/растворитель B в A (%)]: 0,00/10, 0,30/10, 0,40/60, 1,10/90, 1,70/90, 1,75/10, 1,99/10, 2,00/10; растворители: растворитель А=0,1% муравьиной кислоты в воде; растворитель B=0,1% муравьиной кислоты в ацетонитриле; объем впрыска 5 мкл; температура колонки 25°С; скорость потока 0,8 мл/мин.
Синтез промежуточных продуктов и соединений
Следующие примеры представлены для иллюстрации предпочтительных аспектов изобретения и не предназначены для ограничения объема изобретения.
Синтез промежуточных продуктов
Все Fmoc-аминокислоты являются доступными в продаже, за исключением промежуточных соединений 1 и 2.
Синтез 2,2-диметил-3-оксо-3-((2-(1-тритил-1H-имидазол-4-ил)этил)амино)пропановой кислоты (промежуточное соединение 1)
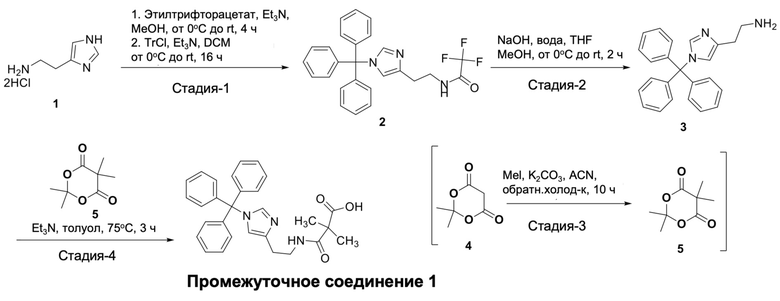
Стадия 1: синтез 2,2,2-трифтор-N-(2-(1-тритил-1H-имидазол-4-ил)этил)ацетамида (2): к раствору 2-(1H-имидазол- дигидрохлорид-4-ил)этан-1-амина (соединение 1, 25,0 г, 136,6 ммоль) в MeOH (100 мл), добавляли при комнатной температуре Et3N (67 мл, 464,4 ммоль), и реакционную смесь охлаждали до 0°C. К реакционной смеси добавляли раствор этилтрифторацетата (20 мл, 164,0 ммоль) в MeOH (50 мл) в течение 30 минут при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Эту реакционную смесь разбавляли безводным DCM (200 мл) и Et3N (60 мл, 409,8 ммоль), и реакционную смесь охлаждали до 0°С. Порциями добавляли Tr-Cl (76 г, 273,2 ммоль), и полученную реакционную смесь перемешивали при rt в течение 16 часов. После завершения реакционную смесь гасили водой (300 мл), и водный слой экстрагировали хлороформом (3×150 мл). Органические слои объединяли, сушили (над Na2SO4) и концентрировали в вакууме. Неочищенный остаток растирали с н-гексаном, получая 2,2,2-трифтор-N-(2-(1-тритил-1H-имидазол-4-ил)этил)ацетамид (соединение 2, 50,10 г, 81%) в виде белого твердого вещества.
МС (ESI+ve): 450
1H-ЯМР (400 МГц; CDCl3): δ 2,75 (т, J=5,9 Гц, 2H), 3,60-3,65 (м, 2H), 6,61 (с, 1H), 7,08-7,15 (м, 6H), 7,31-7,38 (м, 9Н), 7,40 (с, 1Н), 8,41 (шир.с, 1Н).
Стадия 2: синтез 2-(1-тритил-1H-имидазол-4-ил)этан-1-амина (3): к раствору 2,2,2-трифтор-N-(2-(1-тритил-1Н-имидазол-4-ил)этил)ацетамида (соединение 2, 50,0 г, 111,3 ммоль) в THF (150 мл) и МеОН (180 мл) медленно добавляли NaOH (22,0 г, 556,7 ммоль) в воде (100 мл) при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакционную смесь гасили водой (300 мл), и водный слой экстрагировали хлороформом (3×150 мл). Органические слои объединяли, сушили (над Na2SO4) и концентрировали в вакууме, получая 2-(1-тритил-1H-имидазол-4-ил)этан-1-амин (соединение 3, 34,0 г, 86%) в виде желтоватого липкого твердого вещества. Неочищенное вещество использовали на следующей стадии без дополнительной очистки.
МС (ESI+ve): 354
1H-ЯМР (400 МГц; CDCl3): δ 1,53 (шир.с, 2H), 2,65 (т, J=6,5 Гц, 2H), 2,95 (т, J=6,5 Гц, 2H), 6,58 (с, 1H), 7,11-7,16 (м, 6Н), 7,28-7,38 (м, 10Н).
Стадия 3: синтез 2,2,5,5-тетраметил-1,3-диоксан-4,6-диона (5): к раствору 2,2-диметил-1,3-диоксан-4,6-диона (соединение 4, 20,0 г, 138,8 ммоль) в ACN (200 мл), добавляли при комнатной температуре K2CO3 (96 г, 694,0 ммоль) и MeI (26 мл, 416,6 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 10 часов. После завершения реакционную смесь охлаждали до комнатной температуры, фильтровали через слой целита, промывали EtOAc (3×50 мл). Органический слой промывали 10% водным раствором Na2S2O3 (100 мл), сушили (над Na2SO4) и концентрировали в вакууме, получая 2,2,5,5-тетраметил-1,3-диоксан-4,6-дион (соединение 5, 21 г, 88%) в виде твердого вещества желтого цвета. Неочищенный остаток использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (400 МГц; CDCl3): δ 1,63 (с, 6H), 1,73 (с, 6H).
Стадия 4: синтез 2,2-диметил-3-оксо-3-((2-(1-тритил-1H-имидазол-4-ил)этил)амино)пропановой кислоты (промежуточное соединение 1): раствор 2-(1-тритил-1H-имидазол-4-ил)этан-1-амина (3, 8,0 г, 22,6 ммоль) и Et3N (16,0 мл, 113,0 ммоль) в толуоле (100 мл) по каплям добавляли к в течение 60 мин к раствору 2,2,5,5-тетраметил-1,3-диоксан-4,6-диона (соединение 5, 5,8 г, 29,76 ммоль) в толуоле (50 мл) при 75°С. Реакционную смесь дополнительно перемешивали при той же температуре 3 ч. После завершения реакционную смесь концентрировали в вакууме. Остаток растворяли в хлороформе (100 мл) и промывали 10%-ным водным раствором лимонной кислоты (pH ~ 6-6,5). Органический слой сушили (над Na2SO4) и концентрировали в вакууме. Полученный неочищенный остаток растирали с горячим хлороформом (150 мл) и н-гексаном (75 мл), и суспензию перемешивали при комнатной температуре в течение 16 часов. Твердое вещество отфильтровывали, промывали смесью хлороформ:н-гексан (1:1, 2×50 мл) и сушили в вакууме, получая 2,2-диметил-3-оксо-3-((2-(1-тритил-1H-имидазол-4-ил)этил)амино)пропановую кислоту (промежуточное соединение 1, 6,8 г, 64%) в виде белого твердого вещества.
ЖХ-МС (метод A): m/z 468 [M+H]+ (ES+), при 5,38 мин, 99,31%
1H-ЯМР (400 МГц; ДМСО-d6): δ 1,21 (с, 6H), 2,57 (т, J=6,8 Гц, 2H), 3,22-3,27 (м, 2H), 6,66 (с, 1H), 7,06-7,11 (м, 6Н), 7,28 (с, 1Н), 7,35-7,42 (м, 8Н), 7,64 (т, J=5,4 Гц, 1Н), 8,31 (с, 1Н), 12,44 (шир.с, 1Н).
Синтез (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2-тритил-2H-тетразол-5-ил)пропановой кислоты (промежуточное соединение 2)
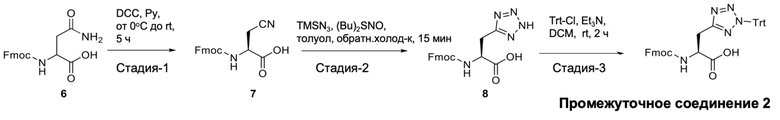
Стадия-1: синтез (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-цианопропановой кислоты (7): к суспензии (((9H-флуорен-9-ил)метокси)карбонил)-L-аспарагина (соединение 7, 50,0 г, 423,7 ммоль) в пиридине (200 мл) добавляли DCC (34,0 г, 466,1 ммоль) при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь осторожно гасили 2N водным раствором HCl до тех пор, пока pH не становился кислым, и экстрагировали диэтиловым эфиром (3×500 мл). Органические слои объединяли и промывали насыщ. водн. раствором NaCl, сушили (над Na2SO4) и концентрировали в вакууме. Остаток растирали с пентаном, получая (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-цианопропановую кислоту (соединение 7,96 г, 68%) в виде белого твердого вещества.
МС (ESI-ve): 335.
1H-ЯМР (400 МГц; ДМСО-d6): δ 2,85-3,05 (м, 2H), 4,22-4,39 (м, 4H), 7,33 (т, J=7,6 Гц, 2H), 7,42 (т, J=7,6 Гц, 2H), 7,72 (д, J=7,2 Гц, 2H), 7,90 (д, J=7,6 Гц, 2H), 8,09 (д, J=8,4 Гц, 1H).
Стадия-2: синтез (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2H-тетразол-5-ил)пропановой кислоты (8): к суспензии (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-цианопропановой кислоты (соединение 7, 48,0 г, 142,8 ммоль) в толуоле (50 мл) добавляли оксид дибутилолова (21,0 г, 85,6 ммоль), и реакционную смесь перемешивали в течение 15 мин. К этой реакционной смеси добавляли триметилсилилазид (61 мл, 422,8 ммоль), и реакционную смесь кипятили с обратным холодильником при 120°С в течение 15 мин. После охлаждения реакционной смеси до комнатной температуры образовавшееся твердое вещество отфильтровывали и промывали диэтиловым эфиром. Твердый остаток растирали со смесью 5% MeOH/DCM (500 мл), получая (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2H-тетразол-5)-ил)пропановую кислоту (соединение 8, 32,5 г, 60%) в виде грязно белого твердого вещества.
МС (ESI+ve): 380
1H-ЯМР (400 МГц; ДМСО-d6): δ 3,22-3,41 (м, 2H), 4,18-4,28 (м, 3H), 4,41-4,48 (м, 1H), 7,31 (т, J=7,2 Гц, 2H), 7,41 (т, J=7,2 Гц, 2H), 7,65 (т, J=7,6 Гц, 2H), 7,77 (д, J=7,6 Гц, 1H), 7,88 (д, J=7,6 Гц, 2H).
Стадия 3: синтез (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2-тритил-2H-тетразол-5-ил)пропановой кислоты (промежуточное соединение 2): к раствору (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2H-тетразол-5-ил)пропановой кислоты (соединение 8, 12×5 г, 12×13,0 ммоль) в DCM (12×45 мл), добавляли Et3N (12×5,6 мл, 12×39,0 ммоль) при 0°C. После перемешивания в течение 5 минут добавляли тритилхлорид (12×4,0 г, 12×14,0 ммоль), и реакционную смесь перемешивали при той же температуре в течение 2 часов. Реакционную смесь гасили водой (50 мл) и экстрагировали DCM (2×100 мл) (12 раз). Органические слои объединяли и промывали насыщ. водн. раствором NaCl, сушили (над Na2SO4) и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией [нормальная фаза, силикагель (100-200 меш), градиент от 1% до 5% метанола в DCM], получая (S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(2-тритил-2H-тетразол-5-ил)пропановую кислоту (промежуточное соединение 2, 41 г, 41%) в виде белого твердого вещества.
ЖХ-МС (метод A): m/z 620 [M-H]+ (ES-), при 5,99 мин, 86,85%
1H-ЯМР (400 МГц; CDCl3): δ 3,44-3,62 (м, 2H), 4,12-4,20 (м, 1H), 4,25-4,32 (м, 1H), 4,36-4,44 (м, 1H), 4,82-4,88 (м, 1H), 7,02-7,12 (м, 6H), 7,24-7,32 (м, 11H), 7,34-7,42 (м, 2H), 7,44-7,48 (м, 1H), 7,49-7,58 (м, 2H)), 7,74 (д, J=6,6 Гц, 2Н).
Используется в твердофазном синтезе пептидов без дополнительной очистки.
Синтез примеров 1-23
Стандартный твердофазный Fmoc-синтез пептидов (SPPS) использовали для синтеза линейных пептидов, которые затем отщепляли от смолы и очищали.
Общий метод синтеза пептидов:
Пептид был синтезирован с использованием стандартной Fmoc-химии.
1) Добавляли DCM в сосуд, содержащий смолу Rink Amide MBHA (замещение: 0,35 ммоль/г, 0,2 ммоль, 0,57 г) и оставляли набухать в течение 2 часов.
2) Сливали воду, а затем промывали DMF (5 раз, сливали растворитель между каждой промывкой).
3) Добавляли раствор 20% пиперидина в DMF при перемешивании барботированием N2 в течение 30 мин.
4) Сливали воду и промывали DMF (5 раз, сливали растворитель между каждой промывкой).
5) Добавляли раствор Fmoc-аминокислоты (3,0 эквивалента в DMF) и перемешивали в течение 30 секунд, затем добавляли активационный буфер (HBTU (2,85 эквивалента) и DIEA (6 эквивалентов) в DMF), перемешивали при барботировании N2 в течение 1 часа.
6) Реакцию связывания контролировали с помощью нингидринового теста.
7) При необходимости повторяли стадии с 4-й по 6-ю для связывания той же аминокислоты при неэффективном присоединении.
8) Повторяли стадии с 2-й по 6-ю для присоединения следующей аминокислоты.
Примечание: для кислот в таблице ниже использовались разные эквиваленты и/или конденсирующие агенты.
Отщепление от смолы и очистка пептидов:
1) Добавляли буфер для отщепления от смолы (92,5%TFA/2,5%EDT/2,5%TIS/2,5%H2O) в колбу, содержащую пептид с защищенными боковыми цепями при комнатной температуре, и перемешивали в течение 3 часов.
2) Пептид осаждали холодным трет-бутилметиловым эфиром и центрифугировали (3 мин при 3000 об/мин).
3) Остаток промывали трет-бутилметиловым эфиром (2 раза).
4) Неочищенный пептид сушили в вакууме в течение 2 часов.
5) Неочищенный пептид очищали с помощью препаративной ВЭЖХ. Условия препаративной ВЭЖХ: Прибор: Gilson 281. Растворитель: A - 0,1% TFA в H2O, B - ацетонитрил, Колонка: Luna C18 (200×25 мм; 10 мкм) и Gemini C18 (150×30 мм; 5 мкм) в серии. Градиент [время (мин)/растворитель B (%)]: 0,0/20, 60,0/50, 60,1/90, 70/90, 70,1/10, при 20 мл/мин с УФ-обнаружением (длина волны=215 нм). Осадок повторно очищали препаративной ВЭЖХ. Условия препаративной ВЭЖХ: Прибор: Gilson 281. Растворитель: A - 0,08% NH4HCO3 в H2O, B - ацетонитрил, Колонка: Luna C18 (200×25 мм; 10 мкм) и Gemini C18 (150×30 мм; 5 мкм) последовательно. Градиент [время (мин)/растворитель B (%)]: 0,0/20, 60,0/55, 60,1/90, 70/90, 70,1/10, при 20 мл/мин с УФ-обнаружением (длина волны=215/254 нм), а затем лиофилизировали, получая Пример 3 (25,8 мг, выход 3,1%).
Таблица 2 - МС-ВР и ЖХ-МС свойства очищенных пептидов, представленных примерами 1-23
(Аналитический метод С)
(Аналитический метод B)
ND - не определено
Биологическая активность
Следующие примеры представлены для иллюстрации предпочтительных аспектов изобретения и не предназначены для ограничения объема изобретения.
Пример A. Фармакологическая характеристика пептидов in vitro - функциональный агонизм рецепторов GLP2 или GLP1 человека, анализ накопления цАМФ
Продукцию цАМФ при стимуляции агонистом рецептора GLP2 или GLP1 человека оценивали с использованием набора HiRange cAMP (Cisbio). Кратко, клетки НЕК инфицировали вирусами системы BacMam для экспрессии рецептора GLP2 или GLP1 человека в течение 24 часов и замораживали для последующего использования в анализе. В день анализа различные концентрации соединений распределяли с помощью ECHO-555 (LabCyte) до общего объема 100 нл в 384-луночные планшеты Proxi малого объема (Perkin Elmer) с последующим добавлением 10 мкл клеточной суспензии, внося по 800 тыс. клеток на лунку. Клетки подготавливали в буфере для анализа (HBSS (Lonza) с добавлением 0,5 мМ IBMX (Tocris)). После 45-минутной инкубации при 37°C реакцию останавливали добавлением реагентов для обнаружения HTRF в буфере для лизиса, входящем в комплект. После 1-часовой инкубации при комнатной температуре планшеты считывали на Pherastar FS (BMG Labtech, Inc.). Программное обеспечение Dotmatics Studies использовали для расчета значений pEC50 путем аппроксимации данных на четырехпараметрической кривой доза-эффект.
Эксендин-4 и лираглутид использовали в качестве эталонных соединений для активации рецептора GLP-1, тогда как тедуглутид и FE-203799 использовали в качестве эталонных соединений для активации рецептора GLP-2.
Таблица 3
GLP-1R человека по накоплению цАМФ
GLP-2R человека по накоплению цАМФ
Пример B. Фармакологическая характеристика пептидов in vitro - функциональный агонизм мышиных рецепторов GLP2 или GLP1, анализ накопления цАМФ
Продукцию цАМФ при агонистической стимуляции рецепторов GLP2 или GLP1 мыши оценивали с использованием набора HiRange cAMP (Cisbio). Кратко, клетки НЕК транзиентно трансфицировали кДНК в течение 24 часов с использованием реагента для трансфекции GeneJuice (EMD Millipore) и замораживали при -80°C для последующего использования в анализе. В день анализа различные концентрации соединений распределяли с помощью ECHO-555 (LabCyte) до общего объема 100 нл в 384-луночный планшет Proxi малого объема (Perkin Elmer) с последующим добавлением 10 мкл клеточной суспензии, внося по 8000 клеток на лунку. Клетки подготавливали в буфере для анализа (HBSS (Lonza) с добавлением 0,5 мМ IBMX (Tocris)). После 45-минутной инкубации при 37°C реакцию останавливали добавлением реагентов для обнаружения HTRF в буфере для лизиса, входящем в комплект. После 1-часовой инкубации при комнатной температуре планшеты считывали на Pherastar FS (BMG Labtech, Inc.). Программное обеспечение Dotmatics Studies использовали для расчета значений pEC50 путем аппроксимации данных на четырехпараметрической кривой доза-эффект.
Лираглутид использовали в качестве эталонного соединения для активации рецептора GLP-1, тогда как тедуглутид и FE-203799 использовали в качестве эталонного соединения для активации рецептора GLP-2.
Таблица 4
GLP-1R мыши по накоплению цАМФ
GLP-2R мыши по накоплению цАМФ
ND - не определено
Пример C: влияние на сырую массу кишечника у нормальных мышей
Самцов мышей C57BL/6J (Charles River, Италия, ~8 недель) случайным образом распределяют по группам воздействия на основе исходной массы тела. Животным предоставляется свободный доступ к пище и воде в течение всего периода исследования. Мышам ежедневно вводили тестируемые соединения посредством подкожной инъекции. На 4-й день животных забивают и надежно помещают на подушку из пенополистирола. Брюшную полость открывают, и осторожно вырезают кишечник, чтобы избежать перфорации. Собирают ткань из верхнего отдела тонкой кишки (сегмент длиной 15 см от пилоруса). Кишечник очищают путем промывания ледяным PBS для удаления любых фекалий.
Значительное увеличение сырой массы кишечника было продемонстрировано у животных, получавших лечение активными пептидами GLP-2 (тедуглутид, примеры 1 и 3), в то время как пептид GLP-1, лираглутид, не увеличивал массу кишечника (фиг. 1).
Пример D: дозозависимое влияние соединений на массу кишечника у нормальных мышей
Самцов мышей C57BL/6J (Charles River, Италия, ~8 недель) случайным образом распределяют по группам воздействия на основе исходной массы тела. Животным предоставляется свободный доступ к пище и воде в течение всего периода исследования. Мышам ежедневно вводят носитель или тестируемые пептиды с помощью подкожной инъекции. На 7-й день животных забивают, и сегменты верхней части тонкой кишки (сегмент длиной 15 см от пилоруса) собирают и взвешивают (см. пример В).
У животных, получавших лечение тедуглутидом или соединениями из примеров 1 и 3, наблюдалось дозозависимое увеличение сырой массы тонкой кишки (фиг. 2).
Пример E: влияние на толерантность к глюкозе у нормальных мышей
Самцов мышей C57BL/6J (Charles River, Италия, ~8 нед) не кормят в течение 6 часов в день тестирования со свободным доступом к питьевой воде. Перед введением препарата проводят измерения содержания глюкозы в крови с помощью глюкометра (ACCU-CHEK Performa, Roche Diagnostic GmbH). Животным вводят либо носитель (0,1% Tween80 в PBS), либо соединение (270 нмоль/кг) с помощью подкожной инъекции. Лираглутид (200 мкг/кг) вводили внутривенно. Через 1 час после введения мышам через зонд дают 2 г/кг глюкозы, и в определенные моменты времени отбирают пробы крови для анализа содержания глюкозы в крови. Моменты отбора проб: t=0 (до введения дозы глюкозы), 15 минут, 30 минут, 60 минут, 120 минут и 180 минут.
У мышей, получавших носитель, наблюдалось быстрое повышение уровня глюкозы в крови, которое достигало пика в первые 15 минут, а затем возвращалось к исходному уровню через 3 часа. У животных, получавших лираглутид, примеры 1 и 3, пиковая концентрация глюкозы в крови была значительно снижена (фиг. 3).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕРОРАЛЬНЫЕ АГОНИСТЫ РЕЦЕПТОРОВ GLP | 2021 |
|
RU2836443C1 |
| ПРОИЗВОДНЫЕ 2-((4-(4-(БЕНЗИЛОКСИ)ПИРИМИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛА В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2024 |
|
RU2838323C1 |
| ОКСИСТЕРОЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2754130C2 |
| АЗОЛЬНЫЕ И ТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2436779C2 |
| ПРОИЗВОДНЫЕ ГЕКСАГИДРОДИАЗЕПИНОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, И ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ИНСУЛИННЕЗАВИСИМОГО ДИАБЕТА | 2003 |
|
RU2301803C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ Е3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2666530C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ E3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2781452C2 |
| ЗАМЕЩЕННЫЕ 3-АЗАБИЦИКЛО[3.1.0]ГЕКСАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КЕТОГЕКСОКИНАЗЫ | 2016 |
|
RU2696269C1 |
| ЦИКЛИЧЕСКИЕ АЗАИНДОЛ-3-КАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2487874C2 |
| АГЕНТЫ, СВЯЗЫВАЮЩИЕСЯ С АМИЛОИДАМИ | 2010 |
|
RU2517174C2 |

Изобретение относится к области биотехнологии, в частности к новым двойным агонистам рецепторов GLP-1 и GLP-2, а также может быть применимо в медицине. Раскрываются соединения общей формулы (1):
 (1), где Q, W, X, Y, Z, AA1, AA2, AA3, AA4, AA5, AA6, AA7, AA8, AA9, LysR, R1, R2 и n определены в настоящем документе. Изобретение может быть применимо при лечении, предотвращении, облегчении, контроле или снижении риска нарушений, связанных с рецепторами глюкагоноподобного пептида (GLP). 3 н. и 21 з.п. ф-лы, 3 ил., 4 табл., 5 пр.
(1), где Q, W, X, Y, Z, AA1, AA2, AA3, AA4, AA5, AA6, AA7, AA8, AA9, LysR, R1, R2 и n определены в настоящем документе. Изобретение может быть применимо при лечении, предотвращении, облегчении, контроле или снижении риска нарушений, связанных с рецепторами глюкагоноподобного пептида (GLP). 3 н. и 21 з.п. ф-лы, 3 ил., 4 табл., 5 пр.
1. Соединение, обладающее активностью агониста рецептора GLP-1 и GLP-2, содержащее последовательность формулы (1):
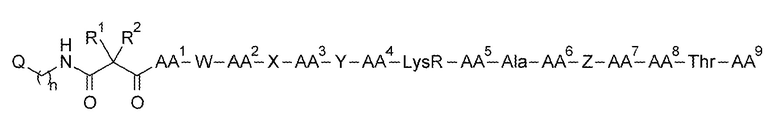
(1)
где:
Q представляет собой фенил или моноциклическое гетероарильное кольцо, каждое из которых незамещено или замещено одной или несколькими группами Rq;
Rq выбирают из галогена, гидроксила, аминогруппы или C1-6-алкила, имеющего алкильную цепь, содержащую или не содержащую один или несколько гетероатомов, выбранных из O, N или S;
n представляет собой 1-3;
R1 и R2 независимо выбирают из водорода или C1-6-алкильной группы, или вместе с углеродом, к которому они присоединены, соединяются с образованием C3-8-циклоалкильной или гетероциклической группы;
W представляет собой последовательность -Gly-Ser-, -Ala-Ser- или -DAla-Ser-;
Y представляет собой последовательность -Leu-Asp-;
Z представляет собой последовательность -Asp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-;
AA1 представляет собой -NHCHR3CO-; где R3 выбирают из -(CH2)yCONH2, -(CH2)yCOOH или -(CH2)yтетразолила; где у представляет собой 1 или 2;
АА2 представляет собой -NHCR4aR4bCO-; где R4a представляет собой водород или C1-3 алкильную группу; и R4b представляет собой бензильную группу, незамещенную или замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами;
AA3 представляет собой -Aib- или -Ile-;
АА4 представляет собой -NHCR5aR5bCO-; где R5a представляет собой водород или C1-3-алкильную группу; и R5b представляет собой незамещенную или замещенную C1-6-алкильную группу или -(CH2)xCONH2; где х представляет собой 1 или 2;
АА5 представляет собой -Ala- или -Aib-;
АА6 представляет собой -Lys-, -Aib- или группу -LysR-;
АА7 представляет собой -Lys- или -Arg-;
AA8 представляет собой -NHCR6aR6bCO-; где R6a представляет собой водород или C1-3-алкильную группу; и R6b представляет собой незамещенную или замещенную C1-6-алкильную группу;
АА9 представляет собой -NHCR7aR7bCO-; где R7a представляет собой водород или C1-3 алкильную группу; и R7b представляет собой -(CH2)zCOOH или бензильную группу, незамещенную или замещенную одной или несколькими галогеновыми группами, C1-3-алкильными группами или C1-3-алкоксигруппами; где z представляет собой 1 или 2;
LysR представляет собой N-замещенный остаток лизина;
где С-конец AA9 представляет собой карбоксильную группу или карбоксамидную группу, или примыкает к любой природной или неприродной аминокислотной последовательности или любому другому фрагменту, функциональной группе или группам;
или его таутомерная или стереохимически изомерная форма, или его пролекарство, соль или цвиттерион.
2. Соединение по п.1 формулы (1), где Q представляет собой:
 .
.
3. Соединение по п. 1 или 2, где n представляет собой 1 или 2.
4. Соединение по любому из пп. 1-3, где R1 и R2 независимо выбирают из водорода или C1-6-алкильной группы.
5. Соединение по п. 4, где R1 и R2 оба представляют собой метил.
6. Соединение по любому из пп. 1-5, где R3 представляет собой -CH2тетразолил.
7. Соединение по любому из пп.1-6, где R4a представляет собой водород или метил.
8. Соединение по п.7, где R4b представляет собой бензил, незамещенный или замещенный фтором.
9. Соединение по любому из пп. 1-8, где R5a представляет собой водород или метил.
10. Соединение по п. 9, где R5b представляет собой изобутил или -CH2CONH2.
11. Соединение по любому из пп. 1-10, где R6a представляет собой водород или метил.
12. Соединение по п. 11, где R6b представляет собой изобутил или втор-бутил.
13. Соединение по любому из пп. 1-12, где R7a представляет собой водород или метил.
14. Соединение по п.13, где R7b представляет собой бензил или -CH2COOH.
15. Соединение по любому из пп. 1-14, где LysR представляет собой N-замещенный остаток лизина, где N-заместитель выбирают из: -CO(CH2)qCH3; -CO(CH2)qCO2H; -CO(CH2)qCHCH2; -COO(CH2)qCH3; -COO(CH2)qCO2H и -COO(CH2)qCHCH2; где q представляет собой от 1 до 22.
16. Соединение по любому из пп. 1-14, где LysR представляет собой N-замещенный остаток лизина, где N-заместитель представляет собой группу -L-G;
где L выбирают из группы, состоящей из:
и 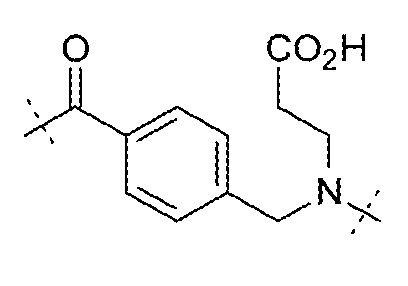 ;
;
и G выбирают из группы, состоящей из:
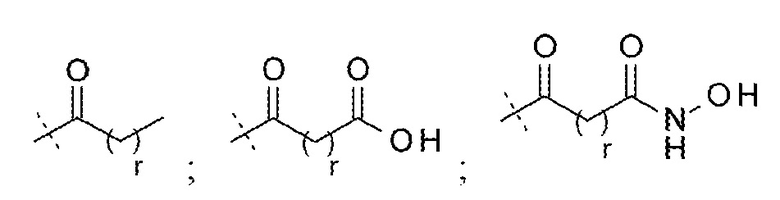 и
и 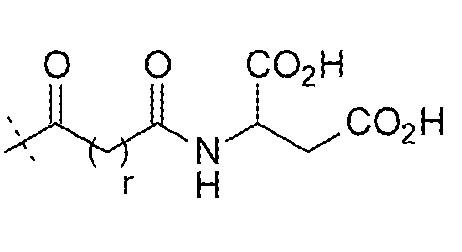 ;
;
где m представляет собой 1-23;
р представляет собой 1-3;
r представляет собой 1-20;
s представляет собой 0-3;
t представляет собой 0-4;
и w представляет собой 0-4.
17. Соединение по п. 15, где LysR выбирают из:
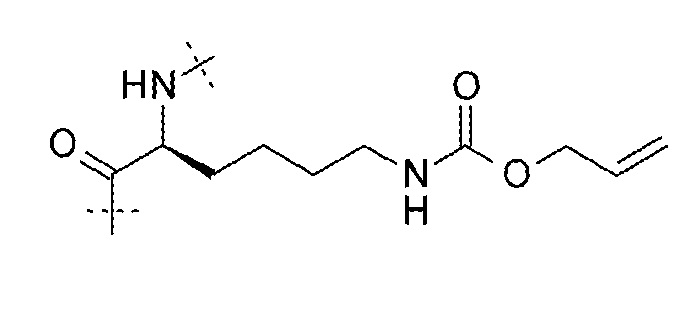 ;
;
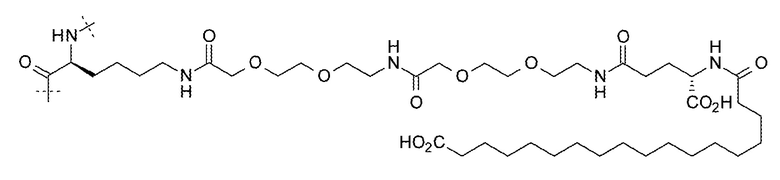 ;
;
или 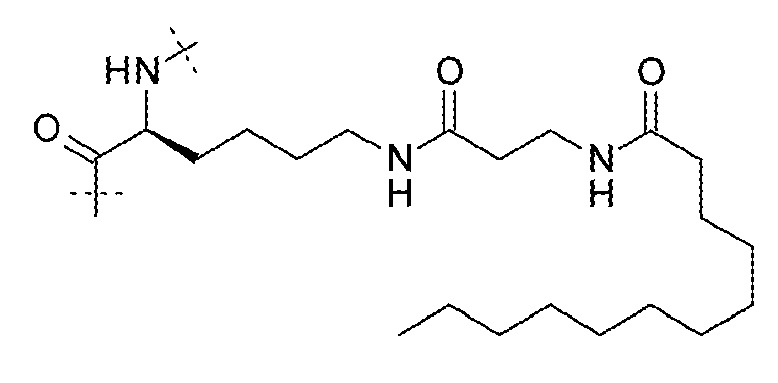 .
.
18. Соединение по любому из пп. 1-17, где C-конец AA9 представляет собой карбоксамидную группу.
19. Соединение по п. 1, которое выбирают из любого одного из примеров 1-23, показанных в таблице:



20. Соединение по п. 1, которое выбирают из:
примера 1:
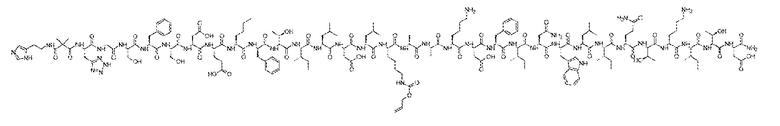
или примера 3:
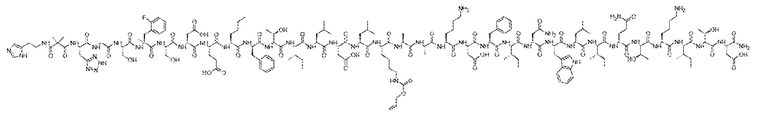
или его таутомер, соль или цвиттерион.
21. Фармацевтическая композиция, обладающая активностью агониста рецептора GLP-1 и GLP-2, содержащая терапевтически эффективное количество соединения по любому из пп. 1-20 и фармацевтически приемлемое вспомогательное вещество.
22. Применение соединения по любому из пп. 1-20 или фармацевтической композиции по п. 21 для лечения заболеваний, в которые вовлечены рецепторы GLP, где заболевания выбраны из желудочно-кишечных и метаболических заболеваний, для усиления восстановления кишечника и нутритивного статуса пациентов с нарушением всасывания, кишечной недостаточностью, кишечной недостаточностью, диарейными заболеваниями, хроническими воспалительными заболеваниями кишечника, для улучшения барьерной функции слизистой оболочки, для облегчения воспаления кишечника, глютеновой болезни, врожденных и приобретенных пищеварительных и мальабсорбционных синдромов, хронических диарейных заболеваний, состояний, вызванных повреждением слизистой оболочки, гипергликемии во время терапии энтеральным и парентеральным питанием у пациентов с кишечной недостаточностью, или мальабсорбцией, желудочно-кишечных травм, диарейных заболеваний, кишечной недостаточности, кишечной недостаточности, кислото-индуцированного повреждения кишечника, дефицита аргинина, глютеновой болезни, энтерита, вызванного химиотерапией, диабета, ожирения, мальабсорбции жиров, стеатореи, нарушений желудочно-кишечного барьера, воспалительного заболевания кишечника, травмы кишечника, ишемии кишечника, мезентериальной ишемии, синдрома короткой кишки, гипотрофии, некротизирующего энтероколита, некротизирующего панкреатита, поражения ЖКТ, вызванного НПВП, недостаточности питания, поражения ЖКТ при полном парентеральном питании, недостаточности питания у новорожденных, радиационно-индуцированного поражения кишечника, мукозита, поухита, ишемии, ожирения, диабета 2-го типа, неалкогольной жировой болезни печени, неалкогольного стеатогепатита, инсулинорезистентности, гипергликемии, непереносимости глюкозы, дефектов мембранных переносчиков, дефектов метаболизма липидов/липопротеинов, дефектов дифференцировки или клеточной поляризации энтероцитов, дефектов энтероэндокринных клеток или врожденных диарейных заболеваний.
23. Применение по п. 22, где заболевания выбраны из состояний, вызванных повреждением слизистой оболочки при лечении рака, врожденного дефицита лактазы, врожденного дефицита сахаразы-изомальтазы, врожденного дефицита мальтазы-глюкоамилазы, глюкозо-галактозной мальабсорбции, мальабсорбции фруктозы, синдрома Фанкони-Биккеля, энтеропатического акродерматита, врожденной хлоридно-натриевой диареи, непереносимости лизинурического белка, первичной билиарной мальабсорбции, наследственного панкреатита, врожденного дефицита липазы поджелудочной железы, болезни ретенции хиломикронов, гипобеталипопротеинемии, абеталипопротеинемии, микроворсинчатой атрофии, тафтинг-энтеропатии, трихогепатоэнтерального синдрома, наследственного гемофагоцитарного лимфогистиоцитоза 5-го типа, врожденной мальабсорбционной диареи, анэндокриноза и дефицита конвертазы 1/3.
24. Применение по п. 22, где расстройство представляет собой тафтинг-энтеропатию.
| WO 2016066818 A1, 06.05.2016 | |||
| WO 2018104558 A1, 14.06.2018 | |||
| Нагревательное приспособление к пастеризатору для молока | 1929 |
|
SU18000A1 |
| Способ изготовления пластин для контактных медно-окисных выпрямителей | 1930 |
|
SU22816A1 |
| Устройство для электрической телескопии | 1925 |
|
SU28929A1 |
Авторы
Даты
2025-04-14—Публикация
2021-03-16—Подача