Ot)
со
00
со
Изобретение относится к медицине и может быть использовано для получения антигенного эритроцитарного туберкулезного диагностикума.
Известен способ получения туберкулбзного диагностикума, включающий культивирование микобактерий туберкулеза, выделение и очистку фосфатидного антигена из микробной массы ацетоном и метанолом с последукщей сенсибилизацией им каолина СП.
Однако известный способ не позволяет получить диагностикум с высокой активностью и, кроме того, сложен в исполнении.
Цель изобретения - повышение активности диагностикума.
Указанная цель достигается тем, что согласно способу получениятуберкулезного диагностикума, включающему культивирование микобактерий туберкулеза, выделение и очистку фосфатидного антигена из ладкробной массы ацетоном и метанолом с последуквдей сенсибилизацией им сорбента, культивируют микобактерий Dt/St и Valu, после метаноловой очистки фосфатидный антиген выпаривают до появления осадка, обрабатывают хлороформом и сенсибилизируют эритроциты из расчета 0,4-1,0 мг антигена на 1 мл 10%-ной взвеси эритроцитов. ,.
Способ осуществляют следующим образом.
Г кобактерии туберкулеза- Dt/St и Valu выращивают в отдельных матрицах, заполненных средой Линниковой и Могилевского (,состав среды: вода дистиллированная 200 л, гликокол 1,7 кг, аммоний лимоннокислый однозамещенный 1,0 кг; натрий углекислый безводный 0,6 кг, натрий хлористый 0,4 кг, магний сернокислый 0,2 кг, железо лимоннокислое окисное 0,01 кг; глицерин 14 кг, ортофосфорная кислота 60-90 мл; калий фосфорнокислый двузамещенный 0,6 кг), в течение 6-8 недель при 38°С. После этого проводят стерилизацию йикробных культур автоклавированием текучим паром в течение 1ч. Затем микробные культуры смешивают в равных объемах,после чего для полчения микробнь1Х тел культуральную жидкость удаляют путем фильтрации через асбестовые пластины.
Полученные микробные клетки высушвают обработкой ацетоном.
Высушенные ацетоном микробные клетки заливают ацетоном из расчета два объема ацетона на один объем микробной массы и помещают в термостат при 38°С на 3 ч,, после чего . ацетон сливают. Эту операцию выполняют дважды.
Обработанные ацетоном клетки заливают метанолом из .расчета 0,5 л метанола на 50 г клеток и встряхивают в течение 5 ч при 37°С, после чего микробные клетки отделяют центрифугированием. Эту операцию также проводят два раза.
Кетаноловые экстракты первого и второго извлечения (по указанной операции) объединяют и помещают в вакуум-сушильный шкаф, в котором проводят выпаривание метанолового экстракта до появления осадка фосфатидного антигена. Выпаривание целесообразно проводить при разрежении 0,8-0,6 кгс/см и температуре 48-52 с. Окончание операции выпаривания устанавливают либо визуально по выпадению осадка (для чего вакуумсушильный шкаф должен иметь прозрачное окно для наблюдения), либо по времени, предварительно установленного в зависимости от используемой аппаратуры и конкретного режима выпаривания из расчета выпаривания до 1/3 объема. Выпаривание до 1/3 исходного объема метанолового экстракта достаточно для выпадания осадка фосфатидного антигена без соосаждения примесей.
Образовавшийся осадок фосфатидного антигена отделяют центрифугированием и растворяют в хлороформе. К этому раствору добавляют два объема ацетона для осаждения фосфатидного антигена. Осажденный антиген промывают ацетоном и высушивают в вакуум-эксикаторе.
Полученный полуфабрикат (фосфатидный антиген) до проведения операции сенсибилизации эритроцитов хранят в ампулах, запаянных под азотом, i Навеску фосфатидного антигена расворяют в метаноле. Этот раствор добаляют по каплям в физраствор, после чего производят выпаривание метанола при 50°С на магнитной мешалке до первоначального объема физраствора. Таким путем получают рабочий раствор фосфатидного антигена для сенсибилизации им эритроцитов, поскольку непосредственно в физрастворе фосфатидный антиген не растворяется. Объем физраствора при приготовлении фосфатидной эмульсии зависит от требуемой концентрации фосфатидного антигена, обеспечивающей высокий титр противофосфатидных антител в соответствующих иммунных сыворотках и экономное расходование фосфатидного антигена. Целесообразно брать такое количество физраствора, чтобы весовая концентрация фосфатидного антигена в нем составила 0,4 1,0 мЕ/мл. При этом для сенсибилизации используют 10%-ную взвесь формалинизированных эритроцитов в объеме равном объему использованного для
приготовления фосфатидной эмульсии физраствора. самым обеспечивается сенсибилизация эритроцитов, при соотношении ингредиентов: 0,41,0 мг фосфатидного антигена на 1 мл 10%-ной взвеси эритроцитов.
Операцию сенсибилизации проводят соединением равных объемов фосфатидной эмульсии и 10%-ныз4 формалинизированных эритроцитов с последующцм вьщерживанием данной смеси в течение 14 ч при 31°С припостоянном перемешивании. Затем производят центрифугирование и отмывание осадка физраствором. Из осадка отмытых
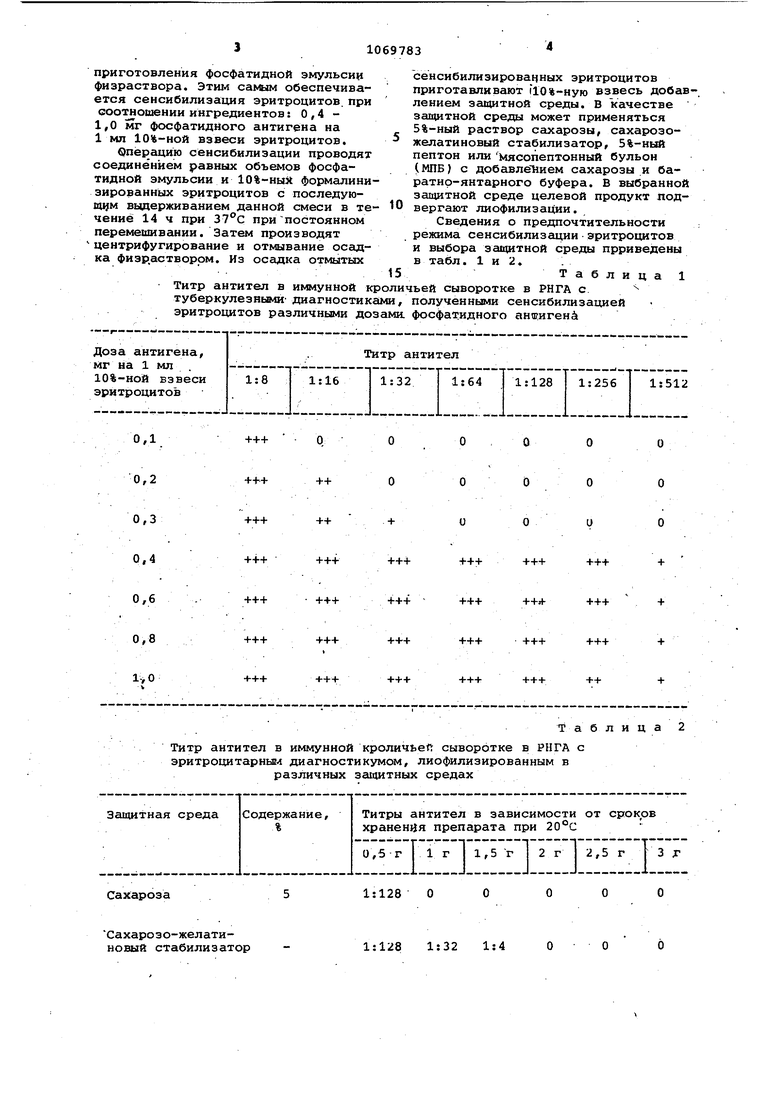
Титр антител в иммунной кроличьей сыворотке в РИГА с туберкулезными- диагностиками, полученными сенсибилизацией эритроцитов различными дозами. фосфа1:идного аншигенй
сенсибилизированных эритроцитов приготавливают |10%-ную взвесь добавлением защитной среды. В качестве защитной среды может применяться 5%-ный раствор сахарозы, сахарозожелатиновый стабилизатор, 5%-ный пептон илимясопептонный бульон (МПБ) с добавлеТ1ием сахарозы и баратнр-янтарного буфера. В выбранной защитной среде целевой продукт подвергают лиофилизации.
Сведения о предпочтительности режима сенсибилизации эритроцитов и выбора защитной среды прриведены в табл. 1 и 2
Таблица 1



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ R-БРУЦЕЛЛЕЗНОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) | 2008 |
|
RU2411041C2 |
| Способ диагностики туберкулеза | 1987 |
|
SU1527593A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА ДЛЯ МАССОВОЙ ДИАГНОСТИКИ И ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА | 2013 |
|
RU2538624C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО АНТИГЕННОГО САПНОГО | 2001 |
|
RU2188036C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО АНТИГЕНА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ ПРИ БРУЦЕЛЛЕЗЕ | 2005 |
|
RU2283498C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) ПРИ МИКОПЛАЗМОЗЕ КРУПНОГО РОГАТОГО СКОТА | 2007 |
|
RU2342155C1 |
| Способ определения дозы сенситина,необходимой для получения эритропитарного диагностикума | 1983 |
|
SU1124229A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО АНТИГЕНА ДЛЯ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА | 2008 |
|
RU2415434C2 |
| СПОСОБ ПОЛУЧЕНИЯ БРУЦЕЛЛЕЗНОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) | 2016 |
|
RU2667121C2 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА ЖИВОТНЫХ | 2007 |
|
RU2366454C2 |
СПОСОБ ЦОЛУЧЕЙИЯ. ТУБЕРКУЛЕЗНОГО даАГНОСТИКУMA, включающий культивирование микобактерий туберкулеза, вьвделение и очистку фосфатидного антигена из микробной массы ацетоном и метанолом с последующей сенсибилизацией им сорбента, о т л и ч а ю щ и и с я тем, что, с целью повышения активности целевого продукта, культивируют микобактерий Dt/St и Valu, после мйтаноловой очистки фосфатидный антиген- выпаривают до появления осадка, обрабатывают хлороформом и сенсибилизируют эритроциты из расчета 0,4 1,0 мг антигена на 1 мл 10%-ной взвеси эритроцитов.
0,1
О
+++
0,2
++
+++
0,3
+++
++
0.4
+++
+++
0,6
+++
+++
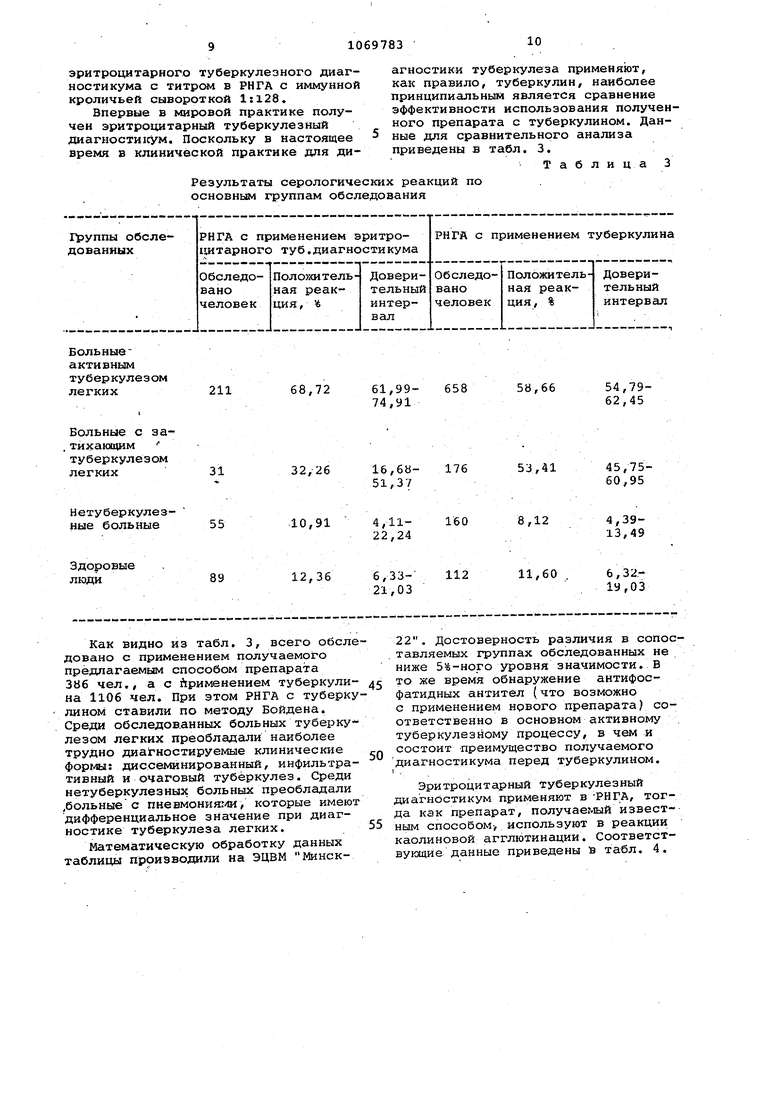
Титр антител в иммунной кроличьей сыворотке в РИГА с эритроцитарныг- диагностикумом, лиофилизированным в различных защитных средах
Сахароза
Сахарозо-желатиновый стабилизатор
+++
+++
+++
+++
++rf+++
+++ +++
Таблица 2
1:128 О
1:128 1:32 1:4
1:641:32 1:8
Пептон
25
МПБ.
Сахароза ОстальБаратно-янтарныйное 1:128 буфер
Данные табл. 1 иллюстрируют проведение операции сенсибилизации эритроцитов барана различными дозами фосфатидного антигена. Как видно из табл. 1 оптимальной сенсибилизирующей лозой является 0,4-0,6 мг/мл, так как меньшая доза не обеспечивает достаточного выявления антител, а-большие дозы приводят в неэкономному расходованию антигена.
Как видно из табл. 2, наиболее предпочтительной для лиофилизации и хранения препарата является защитная среда следующего соста;ва:
Мясопептонный бульон,
об.%25
Сахароза, вес.% 5
Боратно-янтарный.
буферОстальное
Лиофилизированный в этой среде препарат может храниться 3 года, тогда как при использовании других защит, ных сред срок хранения не более 6 мес.
Используемые в предлагаемом способе штаммы являются новыми только по отношению к выбранному прототипу. Они используются в указанной технологии получения туберкулина При этом штамм Dt/St является штаммом человеческого типа. Он получен из США (Г.Вашингтон, комиссия земледелия) и хранится в коллекции гаск им. Л.А.Тарасебича. Штамм Valu является штаммом бычьего типа. Он получен из ЦНИИ туберкулеза и хранится в коллекции ГИСК им. Л.А.Тарасевича. Ксерокопии паспортов штаммов прилагаются.
Замена штаммов произведена в сВязи с тем, что использовавшиеся в способе-прототипе штаммы, особенно ВСУ,приводили к выявлению антител, характеризующих, главным образом, поствакцинальный иммунитет, что снижает специфичность этого серологиПродолжение табл. 2
ческого теста. Кроме того, достигнутое использование одних и тех же штаммов как для приготовления туберкулина, так и предлагаемого туберкулезного диагностикума, дает возможность осуществить безотходное производство одновременно обоих (препаратов: при -этом в технологической схеме их получения общей стадией будет культивирование продуцентов после чего из культуральной жидкости извлекают туберкулин, а из микробной массы (которая ранее являлась отходом производства/ выделяют фосфатидный антиген для предлагаемого получения туберкулезного диагностикума .
Использование только одного из этих штаммов в предлагаемом способе так же, как и при получении туберкулина, недостаточно для полного выявления соответствующих антител у больных туберкулезом.
Обработка фосфатидного антигена хлороформом введена для растворения целевого продукта, что позволяет освободить его от нерастворимых в хлороформе балластных веществ, продуцируемых используемыми штаммами микобактерий туберкулеза. При этом всшным является выпа)ивание метанолового экстракта не полностью, а только до появления осадка (в котором содержится фосфатидный антиген) . Экспериментально установлено, что в противном случае (т.е. при полном выпаривании метанолового экстракта до получения сухого осадка) осадок приобретает темную окраску, что свидетельствует о соосаждении балластных пигментированных веществ, и не поддается растворению в хлороформе. Возможно, что это требование обусловлено использованием названных штаммов. , 1:128 1:12в 1:128 1:64 1:64 Ирпользование в качестве сорбента эритроцитов позволяет получить препарат в виде эритроцитарного туберкулезного диагностикума, так -как его применяют не в РКА, а в реакции непрямой гемагглютинации (PHTAJ Кроме того, эритроцитарный диагностикум подлежит лиофилизации, что ув личивает срок его годности. Пример. Матрацы, предварите но простерилизованныё температурной обработкой, емкостью 1,5 л стерильн заполняют синтетической питательной средой Линниковой и Могилевского из расчета по 600 мл на 1 матрац, рН среды равен 6,У-7,1. Одну поло вину матрацев засевают штаммом Dt/s а другую - штаммом Valu. Выращивани микобактерий туберкулеза в этих мат рацах производят при 38°С в течение 6-е недель. В течение этого срока ежедневно посевы просматривают для выявления матрацев с росте посторонней флоры, которые отбраковывают и обеззараживают. Матрацы с 6-8-недельными хорошо выросшими туберкулезными ; культурами помещают в оцинкованные ящики, в которых обеззараживают эти культуры автоклавированием текучим паром в течение 1 ч при 120°С. Обеззара женные культуры смешиваю поштаммно путем сливания их в 20литровые бутыли в равных объемах для каждого штамг а) . Для приготовле ния фосфатидного антигена берут 1012 л смешанной культуры обоих штамMOB. Смешанную культуру фильтруют через асбестовые пластины для получения микробных клеток, которые затем промывают 7 л дистиллированной воды и 3 л ацетона. После этого производит экстрагир вание ацетонорастворимых компонентов путем обработки одного объема микробной массы двумя объемами ацетона при в течение 3 ч, по истечении которых ацетон сливают. Данную операцию проводят дважды. Обработанные ацетоном клетки заливают, метанолом из расчета 0,5 л метанола на 50 г клеток и помещают на шуттель-аппарат в термостат при 37°G, осуществляя встряхивание реак ционной смеси в течение Ъ ч. Осадок отделяют центрифугированием при фак торе разделения F 1500 в течение 20 мин, после чего производят повторное экстрагирование метанолом при тех же условиях. Метаноловые экстракты первого и второго извлечений объединяют и выпаривают в вакуум-сушильном шкафу при 0,7 кгс/см и 50°С в тече- . ние 5 ч. За это время происходит упаривание раствора до 1/3 от перво начального объема, что достаточно для выпадения осадка фосфатидного антигена без соосаждения примесей. Осадок фосфатидного антигена отделяют центрифугированием при указанном режиме, затем промывают ацетоном при , вновь центрифугируют и растворяют в хлороформе из расчета на один объем использованного метанола 0,1 объема хлороформа. К хлороформенному раствору фосфатидного антигена добавляют двойной объем предварительно охлажденного до ацетона. Выпавший оса- . док фосфатидного антигена отделяют центрифугированием при том же режиме, промывают 3 раза ацетоном и высушивают в вакуум-эксикаторе при комнатной температуре в течение 48 ч. Выход сухого .фосфатидного антигена составляет 2-2,5 г из 50 г микробных клеток.Фосфатидный антиген расфасосывают в ампулы по 10 мг и запаивают последние под азотом. Установлено, что в таком виде фосфатидный антиген может храниться 5 лет. Для сенсибилизации формалинизированных эритроцитов барана взятую из ампулы навеску фосфатидного антигена Ь,О мг растворяют в 3,О мл метанола. Этот раствор добавляют по каплям к 12 мл 0,85%-ного изотонического раствора хлористого натрия, после чего производят выпаривание метанола на магнитной мешалке при 50°С до первоначального объема физраствора (т.е. до 12 МП . Полученные 12 мл фосфатидной , эмульсии соединяют с 12 мл 10%-ных формалинизированных эритроцитов при постоянном перемешивании. При этом концентрация фосфатидного антигена составляет 0,5 мг на 1 мл 10%-ных формалинизированных эритроцитов (барана). Приготовленную смесь выдерживают 1ч в водяной бане при 37°С и при постоянном перемешивании, Затем производят центрифугирование взвеси при факторе разделения F 2000, после чего осадок дважды отмывают от избытка антигена физраствором рН 7,0-7,2. Из осадка отмытых сенсибилизированных эритроцитов приготавливают 10%-ную взвесь добавлением 12 мл защитной средал следующего состава: Мясопептонный бульон, : об.%is Сахароза, вес, 5 Боратно-янтарный буферОстальное Полученный жидкий препарат эритроцитарного туберкулезного диагностикума разливают по 1,0 мл в ампулы и замораживгиот до -70 С, после чего препарат лиофилизируют.. При указанном соотношении ингредиентов получают 12 ампул сухого эритроцитарного туберкулезного диагностикума с титрсял в РИГА с иммунной кроличьей сывороткой 1:128. Впервые в мировой практике получен эритроцитарный туберкулезный диагности1сум. Поскольку в настоящее время в клинической практике для диРезультаты серологичес основным группам обсле
211
68,72
Больные с за,тикающим туберкулезом Как видно из табл. 3, всего обсле довано с применением получаемого предлагаемым способом препарата 386 чел., а с йрименением туберкулина 1106 чел. При этом РИГА с туберку лином ставили по методу Бойдена. Среди обследов.анных больных туберкулезом легких преобладали наиболее трудно диагностируеьдале клинические фор1/ы: диссеминированный, инфильтративный и очаговый туберкулез. Среди нетуберкулезных больных преобладали .больные с пнеамонняг и, которые имеют дифференциальное значение при диагностике туберкулеза легких. Математическую обработку данных таблицы производили на ЭЦВМ Минск658
54,795Ь,66 62,45 агностики туберкулеза применяют, как правило, туберкулин, наиболее принциписшьным является сравнение эффективности использования полученного препарата с туберкулином. Данные для сравнительного анализа приведены в табл. 3. Таблица 3 реакций по ания 22. Достоверность различия в сопоставляемых группах обследованных не ниже 5%-ного уровня значимости. В то же время обнаружение антифосфатидных антител (что возможно с применением нового препарата) соответственно в основном активному . туберкулезному процессу, в чем и Состоит преимущество получаемого диагностикума перед туберкулином. Эритроцитарный туберкулезный диагностикум применяют вРИГА, тогда как препарат, получаемый известным способом-, используют в реакции каолиновой агглютинации. Соответствуквдие данные приведены ь табл. 4.
Диагностика туберкулеза постановкой РИГА с эритроцитарным, диагностикумом и РКА по методу Такахаши
Больные aKTHBHfcJM туберкулезом легких
БольныеС затихающим
Как видно из табл. 4, при близкой вероятности диагностирования туберкулезнойинфекции полученный препарат более чем в 2 раза реже дает положительную реакцию при обследовании больных с нетуберкулезными заболеваниями.
В табл. 5 представлены сведения об активности получаемого предлагаемым способом промежуточного продук
Содержание антигена,.%
Таблица 4
68,7
70,2
та - фосфатидного антигена. Об активности -фосфатидного антигена можно судить по содержанию фосфора в препарате выделенного антигена. Содержание фосфора в полученном антигене определяли по методу Чена.
. В табл; 5 приведено содержание фосфора в препаратах фосфатидного антигена, полученного известным и предлагаемым способами.
ТаблицаБ
| liTakahashi Y | |||
| and Katsuo О | |||
| Study on the Passive Hemagglutination Reaction Ъу the Phosphatide of Mt Tuberculoses | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - Amer | |||
| Rev | |||
| Resp | |||
| Dis | |||
| , 1961, № 8.3, p | |||
| Счетная бухгалтерская линейка | 1922 |
|
SU386A1 |
Авторы
Даты
1984-01-30—Публикация
1982-03-22—Подача