Изобретение относится к новым хи мическим биологически активным соед нениям, а именно к ацетилированным глюкозидам 2,5- и 2,8-дигидрокси-1,4-нафтохинонЬв общей формулы I СН20АС О В2 где а) R, Н, R ОН (I), б) R ОН, R,j Н (II) , обладающим антигрибковой активность В настоящее время для лечения грибковых заболеваний применяются х мические вещества как природного, так и синтетического происхождения. В качестве возможных антигрибковых (Средств изучаются гидроксинафтохино ны различного строения, 5-гидрокси-1,4-нафтохинон (юглон) формулы II показал хорошую эффективность при лечении глубокой трихофитии у человекаНаиболее близким по строению к соединениям формулы 1 являются ацетилированные гликозиды 2-окси-1,4-нафтрхинона общей формулы III СН20АС о АО IT Т RIM I/ X. -хх. k-l--LJОАС о где а) R Н, R ОАс, 0) R ОАс, R Н, сведений об антигрибковой активност этих соединений в литературе нет. Целью изобретения являются новые биологически активные вещества, рас ширяющие арсенал средств воздействи на живой организм и обладающие анти грибковой активностью. Поставленная цель достигается ац тшшрованными гликозидами 2,5- и 2,8-дигидрокси-1,4-нафтохинонов фор мулы 1, обладающими антигрибковой активностью. Способ получения данных соединен основан на известной реакции и заключается в конденсации эквимолярных 6 количеств 2,5-дигидрокси-1,4-нафтохинона формулы III и 2,8-дигидрокси-1,4-нафтохинона формулы IV с 2,4,6-три-0-ацетил-1,2,-р-(1-трет-бутоксиэтилиден) -oL-Д-глюкопиранозой формулы V при кипячении в абсолютном хлорбензоле по следующей схеме: СН20АС О 1 ОАС 5 R,. (III, R/ Н, R, ОН), (IV, R, ОН, R Н) Via) R, Н, R ОН, б) R, ОН, R Н Строение синтезированных глюкози- . дов (1а, 16) подтверждается данными элементного анатгаза и физико-хиьянческих методов исследования. Положение глюкозидного остатка следует из наличия в спектрах Н сигналов пери ОН-групп. На р -конфигурацию гликозидной связи указывает величина химического сдвига сигнала атома C-l (97,8 м.д.) в спектрах ЯМР С. Пример 1. 2-(Тетра-0-ацетил- -D-глюкопиранозилокси)-5-гидрокси-1,4-нафтохинон (1а). Смесь 404 мк (1 ммоль) 3,4,6-три-О-ацетил-1,2-0-(1-третбутоксизтй- лвден)-л-В-гглюкопиранозы и 190 мг (1 ммоль) 2,5-дигидрокси-1,4-нафтохинона в 15 мл абсолютного хлорбензола кипятят 1 ч в колбе, снабженной обратным холодильником с хлоркальциевой трубкой. Хлорбензол упаривают в вакууме, остаток растворяют в 50 мл хлороформа и экстрагируют непрореагировавший 2,5-дигиДрокси-1,4-нафтЬхинон 20 мл 1 М водного раствора поташа. Хлороформенный слой промывают 2x20 мл водой, сушат безводным сульфатом натрия, упаривают, растворяют остаток в 5 мл ацетона и высаживают целевой гликозид медленным добавлением-гексана. Получают, 3 . 418 мг (80%) 2-(тетра-0-ацетил)-о(-В-глюкопиранозилокси)-5-гидрокси-1,4-нафтохинона с т.пл. ITO-nrc, - Cct - - 46,0 (С 1, хлороформ). Найдено, %: С 54,07, 54,33, Н 4,53, 4,46. С,,Н,,0„ 0,5Н,0. Вычислено %: С 54,44, ,Н 4,76., ИК-спектр (хлороформ, -V), 1752 (), 1682 и 1636 (). ЯМР Н-спектр (дейтерохлороформ, ТМе, 90МГц, 6 ), М.Д.: 2,05-2,11 (м, 12Н, 4 X ОАс), 3,89-4,15 (м, 1Н, н), 4,20-4,25 (м, 2Н, 2Н). 5,14-5,36 (м, 4Н, н,, Hj, н;, нр, 6,33 (с, 1Н, 1Н, 7,20-7,31 Ы, 1Н, Hg), 7,56-7,63 (м, 2Н, Н .J и Н J 12,02 (с, 1Н, пери-ОН). ЯМР С-спектр (дейтерохлороформ, ТМС, 22,63 МГц, ), М.Д.: С-1 (178,1), С-2 (157,8), С-3 (114, С-4 (190,6), С-5 (161,0), С-6 (125,0), С-7 (135,8). С-8 (119,5), С-9 (130,9), С-10 (114,1), С-1 (97,8), С-2 (70,5), С-З (72,2), С-4 .(68,0), С-5 (73,0) , С-б (61,8), (170), CHjCOO (20,5) Пример 2. 2-(Тетра-0-ацег тш1-|5-В-глюкопиранозилокси)-8-гидррк си-1,4-нафтохинон (16). Смес.ь 404 мг (1 мноль) 3,4,6-три-0-ацетил-1,2-0-(1-трет-бутоксиэтялиден)-то(.-П-глюкопиранозы и 190 мг (1 ммоль) 3,5-дигидокси-1,4-нафтохи,нона в 15 МП абсолютного хлорбензола кипятят 1 ч в колбе, снабженной обратным холодильником с хлоркальцие вой трубкой. Хлорбензол упаривают в вакууме, остаток растворяют в 50 хлороформа и экстрагируют непррреаги ровавший 3,5-дигидрокси-1;,4-нафтохи нон 20 мл 1М водного раствора поташа &1ороформенный слой промывают 2 х X 20 мл водой, сушат безводным сульфатом натрия, упаривают и кристалли зуют остаток из 5 мл смеси бензол гексан. Вьтавшие кристаллы промывают холодным гексан(5й и получают 425 мг (82%) 2-(тетра-р-ацетил-р-В-глюкопиранозилокси)-8-гидрокси-1,4-н фтохинон с т. пл. 158-160 С, oLl (С1, хлороформ).
Найдено, %: С 55,31, 55,45, Н 4,41, 4,55.
7 2
Вычислено, %: С 55,38, Н 4,65. ИК-спектр (хлороформ, О, : 1755 (СНзСОО), 1652 и 1648 ().
Действие вещества на культуру грибов оценивают визуально по отсутствию в инкубационной среде- колоний
грибов.
Антигрибковую активность оценивают по минимальной ингибирующей концентрации химического соединения, вьфаженной в мкг/мл.
Токсичность исследуемых соединений изучают на белых беспородных мьшах массой 24-26 г при однократном введении (острая токсичность). Препараты вводят внутрибрюшинно. 64 ЯМР Й-спектр (дейтерохлороформ, ТМС, 90 МГц, S ), м.д,: 2,05-2,12 .(м, 12Н, 4хОАС), 3,92-4,02 (м, 1Н, Нр, 4,21-4,26 (м,2Н,2Н.), 5,045,41 (м, 4Н, Н, , Hj, Н, Нр, 6,36 (с, 1Н, HJ, 7,18-7,28 (м, 1Н, Н), 7,53-7,65Чм, 2Н, Н и Н),. 11,65 (с, 1Н, пери-ОН). ЯМР С-спектр (дейтерохлороформ, ТМС, 22,63 МГц, S), м.д. С-1 (183,9), С-2 (115,3), С-3 (157,0), С-4 (183,9),С-5 (161,8), С-6 (124,1), С-7(137,0), С-8 (118,9), С-9 (131,7),С-10 .(114,2), С-1 (97,8), С-2(70,4), С-З - (72,2), С-4 (68,1), С-5 (72,9) , С-6 (61,8), CHgCO (170), CHgCO (20,5). Приведены данные испытаний антигрибковой активности в отношении культуры грибов Trichophyton mentagraphytes. Навеску исследуемого вещества. (1 мг) растворяют в этиловом спирте (0,1 мл), добавляют горячую жидкую питательную среду Сабуро до объема 10 МП и получают раствор с исходной концентра.хдаей 100 мкг/мл. Из этого раствора на среде Сабуро методом двукратных последовательных разведе ний готовят серию разведений с концентрацией исследуемых веществ, мкг/мп: 50,0, 25,0, 12,5, 6,25 и 3,12.. Испытания проводят на 7-дневной культуре грибов Trichophyton mentagraphytes, выращенной на жидкой питательной среде Сабуро. Мицелий 7дневной культуры грибов растирают в ступке и смешивают с питательной средой до получения взвеси. Смешивают 0,5 мл взвеси клеток и 0,5 мп каждого разведения в пробирке, закрывают ее ватно-марлевым тампоном и культувируют в термостате 7 дней при . Навеску исследуемого вещества (4 мг) растворяют в 0,02 мл диметилсульфоксида, добавляют 1 мл 5%-ного водного раствора Твин-80 и гомогенируют до полного растворения. Указанная форма растворителя в объемах, используемых при введении веществ, не оказьюает токсического действия на животных. Антигрибковая активност и их ацетилированны 108
9 1 466 Наблюдение за экспериментальными зкивотными проводят в течение 7 дней. Гибель животных отмечалась в первые сутки с момента введения препарата. Значение ЬД определяют по формуле Кёрбера. Результаты испытаний приведены в таблице. и токсичность хинонов глюкозидов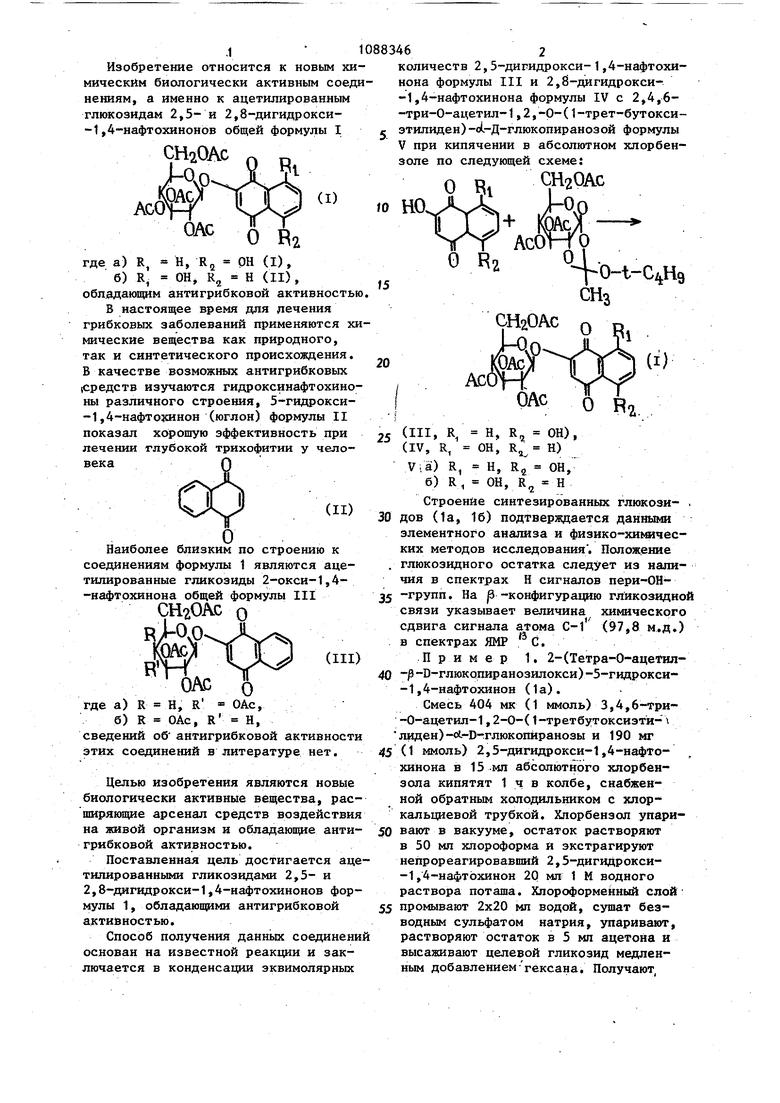


| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ АПОПТОЗ КЛЕТОК ЛЕЙКЕМИИ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2007 |
|
RU2372919C2 |
| Способ получения ацетилированных гликозидов 2-окси-1,4-нафтохинона общей формулы | 1980 |
|
SU892899A1 |
| Способ получения 2,3,5,6,8-пентагидрокси-1,4-нафтохинона (спинохрома D) и промежуточные соединения, используемые в этом способе | 2016 |
|
RU2632668C2 |
| ТЕТРАВАЛЕНТНЫЕ НЕОГЛИКОКОНЪЮГАТЫ С УГЛЕВОДНЫМ РАЗВЕТВЛЯЮЩИМ ЯДРОМ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2575925C1 |
| ГЛЮКОПИРАНОЗИЛОКСИПИРАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ ПРОИЗВОДНЫЕ, И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2232767C2 |
| Средство, обладающее противовоспалительным и анальгезирующим действием | 2017 |
|
RU2657803C1 |
| НОВЫЕ ОПТИЧЕСКИ АКТИВНЫЕ 4-ГИДРОКСИ-2-АЗА-9,10-АНТРАХИНОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2436775C1 |
| Способ получения производных 3(2Н)пиридазинона или их фармацевтически приемлемых солей | 1986 |
|
SU1468415A3 |
| Способ получения производных 3-пропенил-7- @ 2-(2-аминотиазолил-4)-2-гидроксииминоацетамидо @ -3-цефем-4-карбоновой кислоты или ее сложных эфиров в виде Z- или Е-изомеров или их смесей | 1986 |
|
SU1428204A3 |
| ПРОИЗВОДНЫЕ ГЛЮКОПИРАНОЗИЛОКСИПИРАЗОЛА И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 2001 |
|
RU2317302C2 |
1. Ацетилированные гликозиды 2,5- и 2,8-дигидрокси-1,4-нафтохино нов общей формулы: СЛс о Вг где R, Н, R,. ОН, R, ОН, RJ Н, (П обладающие антигрибковой активностью. 00 00 со U О)
| Hershon L | |||
| Shanks | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| naphtoquinones to Candida Albicans and Trichophyton mentagraphytes, Canad | |||
| Q | |||
| Microbiol., 2J | |||
Авторы
Даты
1986-12-30—Публикация
1982-09-28—Подача