эо | :л
Изобретение относится к новым химическим соединениям, конкретно к синтезу гидрохлоридов производных 7-(2-окси-3-амидиног1ропил)-теофиллина общей формулы I:
CH2-(f:H-CH2-N-CR CH3--NV4 }R RHC1
СНз
где R - водород;
R - водород или метильная груп2 i
R - метильная группа, или R и R - вместе метиленовая группа ()„,где 3-5; R и группа или
(-СНг )5 ,
проявляющим противогистаминную активность и бронхорасширяющее действие.
Указанные, свойства позволяют предполагать возможность применения их в медицине.
Аналогами заявленн1Ых соединений общей формулы I по структуре и фармакологическому действию являются лекарственные препараты теофиллин, дипрофиллин, эуфиллин и другие, которые применяются в качестве спазмолитических, бронхорасширяющих и сосудорасширяющих средств, В эксперименте эти препараты расслабляют гладкую мускулатуру различных органов (бронхов, сосудов), уменьшают спазмогенное действие хлорида бария, гистамина, серотонина, ацетилхолина. Их фармакологическое (спазмолитическое) действие реализуется путем ингибиробания фермента фосфодиэстеразы, что приводит к накоплению в клетках органов циклического 3,5-аденозинмонофосфата.
CHjCHCHzNHj
ён (Ф &с, осш, о i ..
, т-
где X - диметиламино-, морфолинонли пиперидино-группа.
Теофиллин, дипрофиллин, зуфшшин широко применяются при лечении бронхиальной астмы, относящейся к аллергическим заболеваниям. Для этой цели используют также противогистаминные препараты димедрол, пипольфен, супрастин и другие. Эти препараты часто недостаточно эффективны,
В связи с индивидуальной чувствительностью больных аллергическими заболеваниями и возможностью снижения терапевтического эффекта известных противогистаминных препаратов при их длительном применении необходим поиск новых противогистаминных препаратов среды соединений различных химических классов.
Современная замена одного противогистаминного лекарственного препарата другим, относящимся к новому для этих средств химическому классу, позволяет поддерживать терапевтический эффект на необходимом уровне.
Цель изобретения - расширение арсенала средств, обладающих одновременно противогистаминной активностью к бронхорасширяющим действием в ряду пуринов.
Цель достигается новыми производными 7-(2-окси-З-амидинопропил)теофиллина общей формулы I.
Соединение общей формулы I представляет собой кристаллическое вещество белого цвета, температура плавления 195-285°С, растворимое в воде, устойчивое при хранении.
Предлагаемо соединение общей формулы Т получают известными методами путем вз аимодействия гидрохлорида 7-(2-окси-3-аминопропил)теофШ1лина (II) с избытком лактимного эфира (III) или ацеталя лактама (IV) или амида (V) в среде кипящего абсолютного спирта согласно следующей схе5 ,ме:
jblCHzN-Ctl
Исходные соединения, необходимые для синтеза предлагаемых соединений доступны.
1идрохлорид 7-(2-окси-3-аминопропил)-теофиллина представляет собой белое кристаллическое вещество, растворимое в воде, т. пл. 277-279 С
Пример 1. Подучение гидрохлорида 7-(2-окси-З-(гексагидроазепинйлиден-2)-имино -пропил -теофиллина.
Смесь 14,5 г (0,05 моль) гидрохлорида 7-(2-окси-3-аминопрош1л)теофиллина и 8 г (0,053 моль) 0-метилкапролактима кипятят в 100 мл абсолютного этилового спирта в течение 2 ч. Реакционную массу охлаждают и фильтруют. Осадок кристаллизуют из ДМФА.
Получают 13,1 г (67,6%) гидрохлорида 7- 2-окси-З- (гексагидроазепипилиден-2)-имино -пропил теофиллина (соединение 1), т.пл. 281-283 С.
Найдено, %: С 49,94; Н 6,42; се 9,26; N 22, 12.
Вычислено, %: С 49,93; Н 6,50; Ct 9,23; N 21,85.
Cj Hj N O-HCl.
Получение гидрохлорида 7-(2-окси-З-аминопропил)теофиллина.
Смесь 27,2 г (0,1 моль) 7-(2-окси-3-хлорпропил)теофиллина и 100 мл 25% водного раствора.амиака перемешивают при 50-60с в течение 2 ч. Смесь охлаждают, фильтруют, фильтрат упаривают досуха. Остаток кристаллизуют из изопропилового спирта.
Получают 16,4 (56,94%) гкдрохлорида 7-(2-окси-3-аминопропил)ттеофиллина, т. пл. 277-279 с.
Найдено, %: С 41,53; Н 5,68 Ct 12,23; N 24,06.
Вычислено, %: С 41,45; Н 5,53, Ct 12,26; N 24,18.
,,N,0,-HCl..
ИК-спектр, см-: 1714, 1668 (СО
УФ-спектр, К тон (1б) Н 275 (3,99).
Получение 7-(2-окси-3-фталимидопропил)теофиллина„
Смесь 44 г (0,244 моль) теофиллина, 2-окси-З-хлорпропулфтальимида 68,5 г (0,286 моль) и 34,3 г (0,244 моль) поташа перемешивают в 500 мл диметилформамида 1,5ч при 125-130 С. Смесь охлаждают, выпавший осадок отфильтровывают.
Получают 74,92 г (80%) 7-(2-окси-3-фтальимидопропил)теофиллина, т. пл. 338-339-5°С (из ДМФА).
Найдено, %: С 56,21; Н 4,60 N 18,26.
100875
Вычислено, %: С 56,25; Н 4,43; N 18,23.
(
Получение гидрохлорида 7-(2-ок-
5 си-3-аминопропил)-теофиллина.
Смесь 74,92 г (0,196 моль) 7-(2-окси-3-фтальимидопропил)-теофиллина и 20 г (0,4 моль) гидразингидрата в 600 мл бутанола кипятят 2 ч, to охлаждают и фильтруют. Осадок на фильтре промьшают метанолом, затем его размешивают с 300 мл воды, подкисленной до рН 2, и отфильтровывают гидразид фталевой кислоты, фильт15 рат упаривают досуха, остаток кристаллизуют из 90%-ного ДМФА.
Получают 44,6 г (78,75%) гидрохлорида 7-(2-окси-3-аминопропш1)теофиллина, т. пл. 277-279с. 20 Проба смешения ;Ве1цеств, полученных двумя способами, плавится при той же температуре 277-279°С.
Пример 2. Получение гидрохлорида 7-{2-окси-3-(1-метилпирро5 лидилиден-2)-имино -пропил -теофиллина.
Смесь гидрохлорида 7-(2-окси-3-аминрпропил)-теофиллина 2,5 г (о,01 моль) и 2,1 г (0,012 моль) ди0 этилового ацеталя N-метилбутиролактама в 10 МП абсолютного спирта кипятят 1,5 ч. Реакционнзпо массу охлаждают до 5-10°С, подкисляют спиртовой НС до рН 4 и вьщерживают в те5 чение 12-13 ч при . Выпавший
осадок отфильтровьшают и кристаллизуют из спирта.
Получают 2,43 г, (65,6%) гидрохлорида 7- 2-окси-З-(1-метилпирролкди0 лиден-2)-имино -пропил -теофиллина (соединение 2), т, пл. 227-228°С.
Найдено, %: С 48,56j Н 6,50 Cf 9,77; N 22,60.
J Вычислено, %: С 48,58- Н 6,20 С 9,58; N 22,68.
C,,,.HCl.
ИК-спектр, 1,690,1650 (СО).
УФ-спектр X „х (Ig ) нм: 275 (3,96).
В условиях примера 2 из гадрохлорида 7-(2-окси-3-аминопропил) -теофиллина и диэтштового ацеталя N-метилвалеролактама получают (70,3%) гндрохлорид 7- 2-окси-З- (1-метилпиперидилиден-2)-имино -пропил -теофиллина (соединение 3), т. пл. 225-227°С (из ДМФА). Найдено, %: С 49,78; Н 6,46; Ct 9,41, N 21,13, Вычислено, %: С 49,93; Н 6,50; С€ 9,23; N 21,85. с,бН,4МбО,-НС1. ИК-спектр, см-: 1717,1680 (СО УФ-спектр, Л р,о, (IgE) м: 275 (3,93). . В условиях примера 2 из гидрохло рида 7-(2-окси-3-аминопропил)-теофиллина и диэтилового ацеталя N-метилкапролактама получают (52,7%) гидрохлорид 7-Г2-ОКСИ-3-(1-метилге сагидроаэепинилиден-2)-имино -пропил -теофиллинов (соединение 4), т. пл. 199-201°С. Найдено, %: С 51,16 Н 6,82; Ct 8,85J N 21,13. Вычислено, %: С 51,19; Н 6,77 Cf 8,90; N 21,07, ,,N,0,.HC1 ИК-спектр, см : 1700,1655 (СО УФ-спектр,- д,( (lg) нм: 275 (3,94). Пример 3. Получение гидрохлорида 7- 2-окси-3(К-морфолиномети лен)-аминопропил -теофиллина. Смесь 5,8 г (0,02 моль)гидрохлорида 7-(2-окси-З-аминопропил)-теофи лина и 5,7 г (0,03 моль) диэтилово- зо го ацеталя морфолина кипятят 1 ч
в 30 мл абсолютного этилового спирта Смесь охлаждают до 5-10 С, прибавляют насыщенный спиртовый раствор HCf до рН 4 и вь держивают 12-13 ч при 5-7°С. Вьшавший осадок отфильтровывают и кристаллизуют из метилового спирта с добавлением изопропилового спирта. Получают 4,5 г (58,2%) гидрохлорида 7- 2-окси-З-(N-морфолинометилен)-аминопропил -теофиллина (соединение 5), т. пл, 207-208 С. Найдено, %: С 46,28; Н б, 11, Сг 9,23; N 21,77. Вычислено, %: С 46,57; Н 5,95; сг 9,18; N 21 ,73. ИК-спектр, см : 1695, 1654 (С УФ-спектр, та, (Ig В ) нм: 27.5 (3,91). В условиях примера 2 из гидрохло рида 7-(2 окси-3-аминопропил)-теофи лина и диэтилового ацеталя пиперидина получают (51,6%) гидрохлорид 7- 2-окси-З-(N-пиперидинометилен)-аминопропил | -теофиллина (соединени 6),. т. пл. 208-210°С.
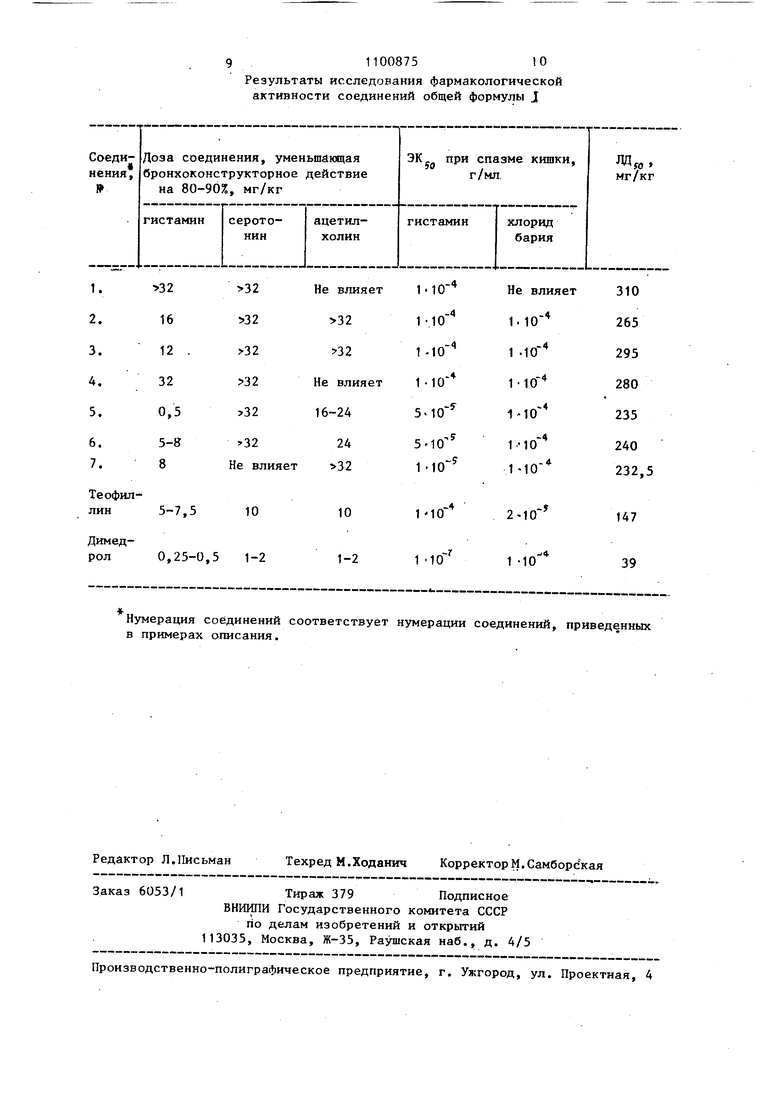
Исследование противогистаминной активности и бронхорасширяющего действия соединений общей формулы 1 проводилось на наркотизированных и ненаркотизированных морских свинках массой 350-550 г, крысах 100-150 г, мьшах 16-18 г и-на изолированных, органах-отрезке подвздошной кишки 756 Найдено, %: С 49,90; Н 6,38; Ct 9,19; N 21,82„ Вычислено, /i: С 49,93; Н 6,50 Ct 9,23; N 21,85. ,,. НС1. ИК-спектр, : 1698, 1658 (СО) УФ-спектр, гпох R 275 (3,94). В условиях примера 3 из гидрохло-. рида 7-(2-окси-З-аминопропил)-теофиллина и диэтилового ацеталя диметилформамида получают (62,4%) гидрохлорид Н- 2-окси-3-(теофиллинил-7) - пропил -N ,N -диметилформамидина (соединение 7), т. пл. 195-196°С. Найдено, %: С 45,42; Н 6,00; Cf 10,17; N 24,50. Вычислено, %: С.45,28; Н 6,09; Ct 10,30; N 24,38. . ИК-спектр, т см : 1696, 1661 (СО) УФ-спектр, 5 jflo, (Ig6) им: 275 (3,92). Исследование биологической активности заявляемых соединений общей формулы i проведенр в лаборатории фармакологии ВНИХФИ. Все соединения общей формулы 1 обладают избирательной противогистаминной активностью и бронхорасширяющим действием. морской свинки.Соединения общей формулы I сравнивались по активности с лекарственными препаратами теофиллином и димедролом. В результате исследования установлйно, что соединения общей формулы ,1 в отличие от теофиллина обладают преимущественной противогистаминной активностью, они обладают также бронхорасширяющим действием и прак-« тически не влияют на холинореактивные и серотонинореактивные системы организма. В опытах на наркотизированных морских свинках модифицированным методом Концетта-Росслера изучено влияние соединений формулы I на тонус бронхиальной мускулатуры и бронхеконстрикторное действие гистамина, серотонина, ацетилхо.пина, которые вводили внутривенно в дозах 5,5-7
и 10 мкг/кг соответственно. Установлено, что теофиллин в дозах 5 - 10 мг/кг (внутривенно) уменьшает действие гистамина на 80-90%, действие теофиллина в указанных дозах продолжается 1-2 ч.
Заявленные соединения общей формулы 1 по этому показателю превосходят действие теофиллина, уменьшают гистаминовый брбнхоспазм на 80-90% в меньших дозах и на более длительное время - до 4 ч (см. таблицу).
Димедрол в этих опытах предотвращает действие гистамина при дозе 0,25-0,5 мг/кг, но его действие при этой дозе менее продолжительно и не превьш1ает 1-1,5 ч,
В опытах на ненаркотизированных морских свинках при ингаляции животным аэрозоли 1%-ного раствора гис-тамина предлагаемые соединения общей формулы 1 при внутрибрюшинном введении в дозе 50 мг/кг более чем в два раза по сравнению с контролем увеличивают латентный период интоксикации, которая проявляется клонико-тоническими судорогами и остановкой дыхания. При этом соединения 1. защищают всех подопытных животных от летальной гистамиповой интоксикации (при 100% летальности в контрольной группе).
t
Теофиллин в тех же условиях опыта и при дозе 50 мг/кг лишь на 30 40% увеличивает латентный период интоксикации и защищает от летальных исходов только 40% животных.
Димедрол предупреждает токсические эффекты аэрозоли гистамина и защищает животных от летальных исходов при внутрибрюшинном введении в дозах 15-25 мг/кг.
. В опьггах на изолированных органах (отрезок подвздошной кишки морской свинки) определяли спазмолитическую активность соединений общей формулы 5 1 в сравнении в теофиллином при спазмах, вызванных гкстамином (в концентрации г/мл) и хлоридом бария (в концентрации 110 г/мл). Установлено, что величина ЭК (эффектив10 ная концентрация вещества, снижающая действие гистамина на 50%) для заявляемых соединений составляет 5 «10 - г/мл, для теофиллинаIlO г/мл« Димедрол предотвращает
5 действие гистамина (ЭК j-o х10 г/мл)% но оказывает лишь слабое спазмолитическое действие при сокращении кишки, вызванным хлоридом бария.
0 Важным преимуществом соединений общей формулы I является их низкая токсичность. теофиллина при внутривенном введении мышам составляет 147 мг/кг, димедрола - 39 мг/кг,
5 у соединений общей формулы I эта величина находится в пределах 230 310 мг/кг. Таким образом, у соединеНИИ общей формулы I разница меаду эффективными противогистаминными до0 зами и токсическими дозами больше ч.ем у димедрола или теофиллина. Результаты фармакологических испытаний представлены в таблице.
Наиболее активным соединениям является гидрохлорид 7- 2-окси-3-(М-морфолинометш1ен)-аминопропил |-теофиллина (соединение 5), который близок по действию к димедролу, но превосходит его по длительности действия.
Важное значение имеет тот факт, что впервые в ряду пурина найденысоединения, обладакнцие одновременно противогистаминной активностью и бронхорасширяющим действием.
Результаты исследования фармакологической активности соединений общей формулы J



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных теофиллина | 1982 |
|
SU1114337A3 |
| Способ получения производных теофиллина | 1974 |
|
SU526291A3 |
| Производные 1-амино-3-(1,2,3,4-тетрагидро-или 1,2,3,4,4 @ ,9 @ -гексагидродибензофуранил-8-окси)-пропанолов-2,обладающие @ -адреноблокирующим,гипотензивным,спазмолитическим,нейротропно-депримирующим и бронхолитическим свойствами | 1980 |
|
SU869278A1 |
| Способ получения производных ксантина или их солей | 1977 |
|
SU668604A3 |
| Способ получения производных теофиллина | 1973 |
|
SU504490A3 |
| Способ получения производных бензодиазепина или их солей | 1973 |
|
SU625607A3 |
| Способ получения хлор- и/или бромсодержащих соединений бензимидазолона | 1974 |
|
SU520915A3 |
| Способ получения производных ксантина или их кислотно-аддитивных солей | 1980 |
|
SU1079176A3 |
| Способ получения тетрациклических соединений или их солей | 1975 |
|
SU682122A3 |
| ИЗОНИКОТИНОИЛГИДРАЗОН 2-ГИДРОКСИ-3-МЕТОКСИБЕНЗАЛЬДЕГИДА, ПРОЯВЛЯЮЩИЙ АНТИАСТМАТИЧЕСКУЮ, ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНТИАЛЛЕРГИЧЕСКУЮ АКТИВНОСТЬ | 1997 |
|
RU2139711C1 |
Гидрохлориды производных 7-
Нумерация соединений соответствует нумерации в примерах описания. соединений, приведенных
| Машковский М.Д | |||
| Лекарственные средства | |||
| М., Медицина, 1977, с | |||
| Ситценабивная машина | 1922 |
|
SU391A1 |
| R.Stolle, M.Herke, F.Hanusch, iiber feine neue Methode zur Darstellung von Imidazple dihidrigen, j | |||
| prakt | |||
| Приспособление к рогульчатым ватерам для торможения катушки | 1924 |
|
SU1934A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| J.Bueko-oszczapowych, I.Cieslak, Penicyling polsyntetyczne | |||
| X | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| pharm., 30,43,1973. | |||
Авторы
Даты
1986-11-07—Публикация
1980-12-31—Подача