Изобретение относится к новым производным тетрагидроизохинолина, а именно к гидрохлоридам 2-метил-или 1,2-диметил-6,7-диметокси-1,2,3,4-тетрагидроизохино-лин-4-спиро- 4'-циклогексанолов общей формулы: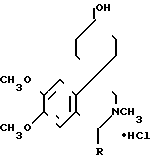 где 1) R-H;
где 1) R-H;
2) R-CH3, обладающим центральным М-холинолитическим действием.
Известны гидрохлориды 2-аралкил-4-спироциклогексан-6,7-диметокси -1,2,3,4-тетрагидроизохинолина.
В литературе отсутствуют данные о холинолитическом действии этих соединений.
Известен хлоргидрат диметиламиноэтилового эфира ортометилбензгидрола (мебедрол), который применяется как антипаркинсоническое средство.
Цель изобретения новые соединения, обладающие центральным М-холинолитическим действием, в ряду тетрагидроизохинолилспироциклогексанолов.
Предлагаются гидрохлориды 2-метил- или 1,2-диметил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-4-спиро-4' -циклогексанолов общей формулы I, обладающие центральным М-холинолитическим действием.
Новые соединения получают метилированием по азоту 4-(3,4-диметокси) фенил-4-аминометилциклогексанола и 1-метил- 6,7-диметокси-1,2,3,4-тетрагидроизохинолин-4-спиро -4'-циклогексанола смесью муравьиной кислоты и формалина.
Структура полученных соединений подтверждена элементным анализом, ИК-, ПМР-спектроскопией и масс-спектрометрически.
П р и м е р 1. N,О-Диацетил-4-(3,4-диметокси)фенил-4- аминометилциклогексанол. К смеси 5,3 г (0,02 моль) 4-(3,4-диметокси)фенил-4-аминометилциклогексанола и 3,2 г (0,04 моль) пиридина в 40 мл абсолютного бензола прибавляют по каплям 3,2 г (0,04 моль) хлористого ацетила. Смесь кипятят в течение 5 ч, отфильтровывают образовавшийся осадок, фильтрат промывают 5%-ной соляной кислотой до кислой реакции, 10%-ным раствором бикарбоната натрия до щелочной реакции и водой. Сушат над сернокислым натрием, отгоняют растворитель. Остаток кристаллизуют в эфире. Выход 5,1 г (72,5%), т.пл. 150-151оС (бензол-эфир), Rf 0,42 (силуфол, бензол-ацетон, 1:1).
Найдено, C 65,08; H 7,60; N 4,33.
C19H27NO5
Вычислено, C 65,34; H 7,73; N 4,01.
ИК-спектр: ν, см-1: 1725 (O-C=0); 1680 (N-C=O).
Мол.вес 349 (масс-спектрометрически).
П р и м е р 2. 1-Метил-6,7-диметокси-3,4-дигидроизохинолин-4- спиро-4'-циклогексанол. Смесь 7 г (0,02 моль) N, O-диацетил-4-(3,4-диметокси)фенил-4- аминометилциклогексанола и 24 г пятиокиси фосфора в 100 мл толуола кипятят в течение 6 ч. Декантируют толуол, остаток растворяют в 30 мл воды и подщелачивают гидроокисью калия. Образовавшиеся кристаллы отфильтровывают. Выход 4,5 г (79,3%); т.пл. 221-223оС (спирт-бензол, 1:1).
Найдено, C 70,14; H 7,65; N 4,42.
C 17H23NO3
Вычислено, C 70,58; H 7,97; N 4,84.
ИК-спектр, ν, см-1: 3200 (OH); 1650 (C=N).
Мол.вес 289 (масс-спектрометрически).
ТСХ на силуфоле (бутанол-уксусная кислота вода, 5:3:3), Rf 0,44.
П р и м е р 3. 1-Метил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-4-спиро- 4'-циклогексанол. К раствору 0,76 г (0,02 моль) алюмогидрида лития в 30 мл абсолютного эфира прибавляют по каплям 2,9 г (0,01 моль) 1-метил-6,7-диметокси-3,4-дигидро-изохинолин-4-спиро- 4'-циклогексанола в 30 мл тетрагидрофурана. Смесь кипятят в течение 18-20 ч. Разлагают водой, отфильтровывают осадок и отгоняют растворитель.
Выход 2,1 г (72,4%); т.пл. 155-157оС (бензол).
Найдено, C 70,48; H 8,50; N 4,55.
C17H25NO3
Вычислено, C 70,10; H 8,59; N 4,81.
ИК-спектр, ν см-1: 3280 (ОН); 3200-3080 (NH).
Мол. вес 291 (масс-спектрометрически).
ТСХ на силуфоле (бутанол-уксусная кислота вода, 5:3:3), Rf 0,51.
П р и м е р 4. Гидрохлорид 2-метил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-4-спиро -4'-циклогексанола (I).
Смесь 4 г (0,015 моль) 4-(3,4-диметокси)фенил-4-аминометилциклогексанола, 6,8 г 85%-ной муравьиной кислоты и 6,6 г 40%-ного формалина нагревают 3 ч на масляной бане при 140оС. Отгоняют растворитель, остаток растворяют в 30 мл воды и подщелачивают гидроокисью калия. Экстрагируют бензолом (3 ˙ 30 мл), промывают 15 мл воды, сушат над сернокислым натрием и отгоняют растворитель.
Выход гидрохлорида 2-метил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-4-спи- ро- 4'-циклогексанола 3,8 г (86,3%); т.пл. 159-161оС (бензол эфир, 3: 1).
Найдено, C 70,13; H 8,79; N 4,95.
C17H25NO3.
Вычислено, C 70,08; H 8,65; N 4,81.
ИК-спектр, ν, см-1: 3360 (ОН).
ПМР-спектр, δ, м. д. 6,68 и 6,38 (2Н ароматические протоны), c; 3,71 и 3,70 (6H 2СН3О), д; 3,6-3,5 (Н СНОН), м; 3,38 (2Н NCH2Ar) с; 2,50 (2HCNCH2), c; 2,40 (3H N-CH3); 2,0-1,4 (8Н циклогексана), м,
Мол.вес 291 (масс-спектрометрически).
ТСХ на силуфоле (бутан-уксусная кислота вода, 5:3:3), Rf 0,39.
На раствор 3,8 г полученного основания в этиловом спирте действуют эфирным раствором хлористого водорода. Выход соединения I 3,8 г (90,5%); т.пл. 233оС.
Найдено, Cl 10,67.
C17H26NO3Cl
Вычислено, Cl 10,80.
П р и м е р 5. Гидрохлорид 1,2-диметил-6,7-диметокси-1,2,3,4- тетрагидроизохинолин-4-спиро-4'-циклогексанола (II). Смесь 2,9 г (0,01 моль) 1-метил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин- 4-спиро-4'-циклогексанола, 6 мл 85%-ной муравьиной кислоты и 6 мл 40%-ного формалина нагревают на масляной бане при 140оС в течение 5 ч. Добавляют 10 мл концентрированной соляной кислоты и отгоняют растворитель. Выход 2,3 г (67,3%); т.пл. 227-229оС (спирт-эфир, 1:2).
Найдено, N 3,82; Cl 10,00.
C18H28NO3Cl.
Вычислено, N 4,09; N 10,37.
ИК-спектр, ν, см-1: 3400 (ОН).
ПМР-спектр, δ, м.д. 6,90 и 6,70 (2Н ароматические протоны), с; 4,5-4,4 (1H N-CHAr), м; 3,78 (6Н 2СН3О), д; 3,7 (1Н СН-ОН); 3,5 (2H NCH2), c; 2,0-1,65 (8Н циклогексана), м; 1,58 и 1,48 (3НС-СН3),д.
Мол.вес 305 (масс-спектрометрически).
Центральные холинолитические свойства предлагаемых соединений изучали на белых мышах по действию на судороги, вызванные ареколином (М-холинолитическое действие). Соединения вводили внутрибрюшинно за 20 мин до введения ареколина.
В результате проведенных экспериментов обнаружено, что исследуемые соединения предупреждают развитие ареколинового тремора.
Статистическую обработку результатов проводили с вычислением 50%-ных эффективных доз ЕД50 по методу Литчфильда-Уилкоксона.
Средние эффективные дозы (ЕД50) составляли 41 мг/кг (I), 17,5 мг/кг (II) и 26 мг/кг (мебедрол) (таблица).
Острую суточную токсичность определяли на белых мышах.
Наблюдения вели в течение 24 ч. Статистическую обработку проводили по методу Литчфильда-Уилкоксона. Средние смертельные дозы ЛД50 при внутрибрюшинном введении приведены в таблице.
Используя полученные величины ЛД50 и ЕД50, вычисляют защитные индексы РJ, указывающие на диапазон между средними эффективными и токсическими дозами. У обоих соединений значение РJ по ареколиновому тремору превышает эту величину у мебедрола.
Таким образом, соединения I и II обладают центральным М-холинолитическим действием, причем соединение II наиболее активно.
Обнаруженные впервые центральные М-холинолитические свойства в ряду спироциклоалкантетрагидроизохинолинов раскрывают широкие возможности в изыскании новых биологически активных веществ с указанной активностью в этом классе химических соединений.

Гидрохлориды 2-метил- или 1,2-диметил-6,7 -диметокси-1,2,3,4 -тетрагидроизохинолин-4- спиро- 4′ -циклогексанолов общей формулы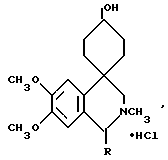
где 1) R H,
2) R CH3,
обладающие центральным M-холинолитическим действием.
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1978, т.1, с.148. |
Авторы
Даты
1995-10-20—Публикация
1983-01-12—Подача