Изобретение относится к новому химическому соединению, а именно к гищ охлориду этилового э4мра 8-6ромаденозин-5 карбоновой кислоты формулыf - NHjC
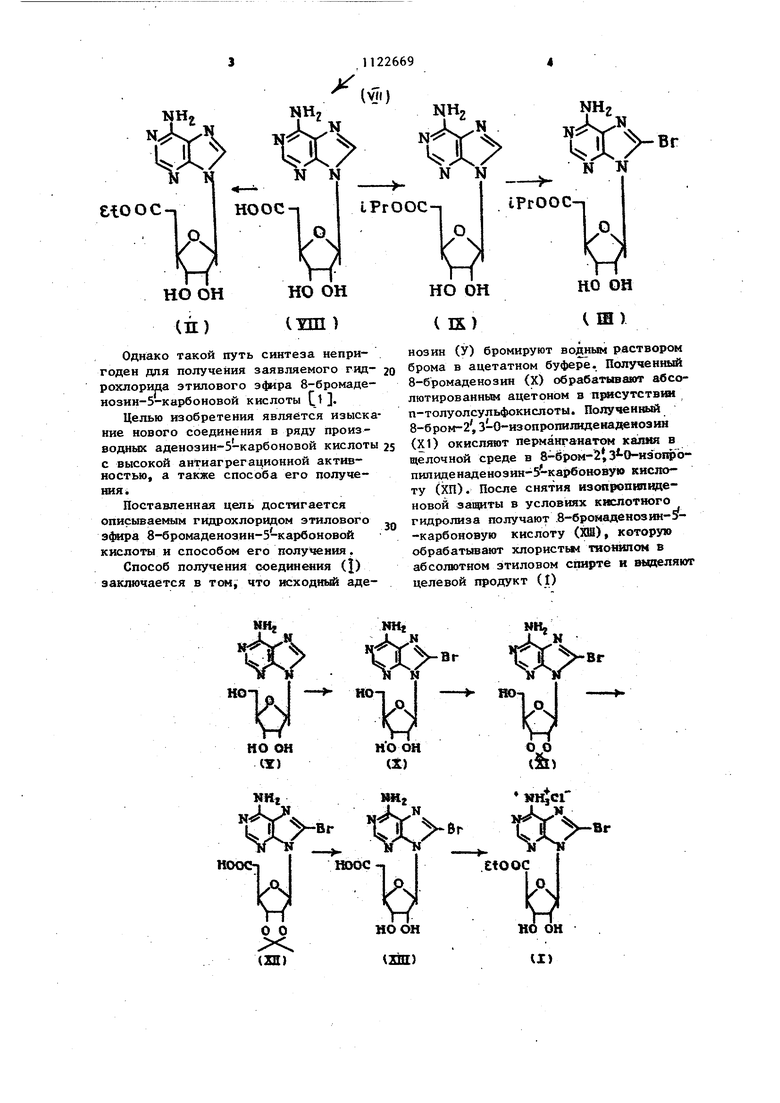
М N НО ОС но он проявлякяцему антйагрегационную тивность, и способу его получен Известны структурные аналоги динения (I) - этиловый эфир аде зин-5-карбоновой кислоты (П) С изспропиловый эфир 8-бромаденоз -З -карбоноврй кислоты (Щ) {.2}, еюос iPrOOC I;) но он но он
Соединение (П) проявляет кардиотоническую и сосудорасширяющую активность СЗ 3, Данных о биологической активности соединения (Ш) в .литературе не имеется.
Известна ацетилсалициловая кисло- . ;та (1У), применяемая в медицинской практике как средство, ингибирующее тромбоцитарное звено гемокоагуляции 43
10 ОСОСН, Известен;, способ получения соединений (П) и (Ш),состоящий в следующем :аденозин (У) переводят в его изопроиипеденовое производное (У1), которое затем окисляют перманганатом калия в щелочной среде до соответствующей кислоты (УП), после чего удаляют изопропипнценовую защиту в условиях кислотного гидролиза и получают соединение (УШ), которое этери ицируют абсолютированным этиловым или изопропиловым спиртом в присутствии хлористого тионила (SOCl) и получают соответственно эфиры аденозин-5-карбоновой кислоты (П) и (IX) С5. Однако 8-бромпроизводное (Ы) было получено только для изопропилового фира аденозин-5-карбоновой кислоты (1Х) посредством бромирования его свободным бромом в смеси диоксана и натрийфосфатного буфераС23.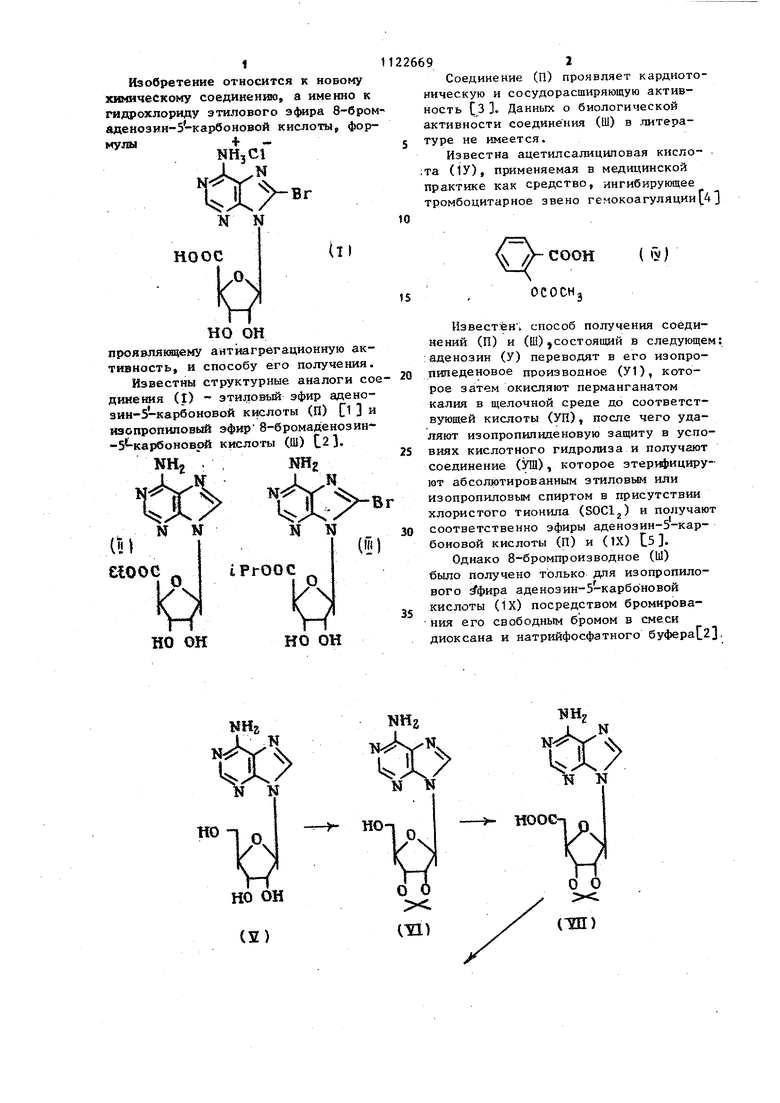




| название | год | авторы | номер документа |
|---|---|---|---|
| 8-Бромаденозин-5-карбоновая кислота или ее изопропилиденовое производное в качестве полупродуктов в синтезе гидрохлорида этилового эфира 8-бромаденозин-5-карбоновой кислоты | 1983 |
|
SU1122670A1 |
| Производные 1-(3,5-ди-трет-бутил-4-гидроксибензил)изатина, обладающие антиагрегационной активностью | 2023 |
|
RU2822271C1 |
| 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-2)- И 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-3)-6Н-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2445310C2 |
| 2-ЦИКЛОАЛКИЛАМИНО-5-ТИЕНИЛ-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2379306C1 |
| 5-(4'-ГИДРОКСИФЕНИЛ)- И 5-(2',5'-ДИГИДРОКСИФЕНИЛ)-6Н-1,3,4-ТИАДИАЗИН-2-АМИНЫ, ГИДРОГАЛАГЕНИДЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ ПРИ ВНУТРИВЕННОМ ВВЕДЕНИИ | 2009 |
|
RU2458060C2 |
| Способ получения антиагрегационного и антиоксидантного средства | 2023 |
|
RU2819387C1 |
| 2-(1S,2R,5S)-6,6-ДИМЕТИЛБИЦИКЛО[3.1.1]ГЕПТ-2ИЛ]МЕТИЛ}СУЛЬФИНИЛ)ЭТАНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ АНТИАГРЕГАЦИОННЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2522198C2 |
| СПОСОБ УСИЛЕНИЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТИ | 2010 |
|
RU2440370C2 |
| ГИДРОГАЛОГЕНИДЫ 11-ФЕНОКСИЭТИЛ- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2582618C1 |
| Антиагрегационное и антиоксидантное средство | 2023 |
|
RU2808474C1 |
1. Гидрохлорид этилового 8-бромаденоэин-5 -карбоиовой кислоты формулы NHsCT ноос но ш п1роявляющий антиагрегацноннз активность. 2. Способ получения гадрохлорида 8-бромаденозни-5 -карбоновой кислоты, отличающийся тем, что аденозин бронируют водным раствором брома в ацетатном буфере, в получен ный 8-брсн4аденозин вводят защитную ;изопропипиденовуюгруппу, завдивбенное производное 8-бромаденозина окисляют перманганатом калиа в щелочной среде, полученную 8-бром-2,З,-0-изопропилиденаденозин-5-карбоновую кислоту подвергают кислотному гвдролизу, полученную В-бромадеяозин-5-карбоновую кислоту обрабатывают хлористым тионилом в абсолютном этиловом спирте и выделяют целевой продукт.
ННг
X
(Ю)
(т) etooc-n HO ОС HO OH 1Ш
Однако такой путь синтеза непригоден для получения заявляемого гидрохлорида этилового эфира 8-бромаденозин-5-карбоновой кислоты СОЦелью изобретения является изыскание нового соединения в ряду производных аденозин-5-карбоновой кислоты с высокой антиагрегационной активностью, а также способа его получения
Поставленная цель дос-шгается oпиcывae fым гидрохлоридом этилового 8-бромаденозин-5-карбоновой кислоты и способом его получения.
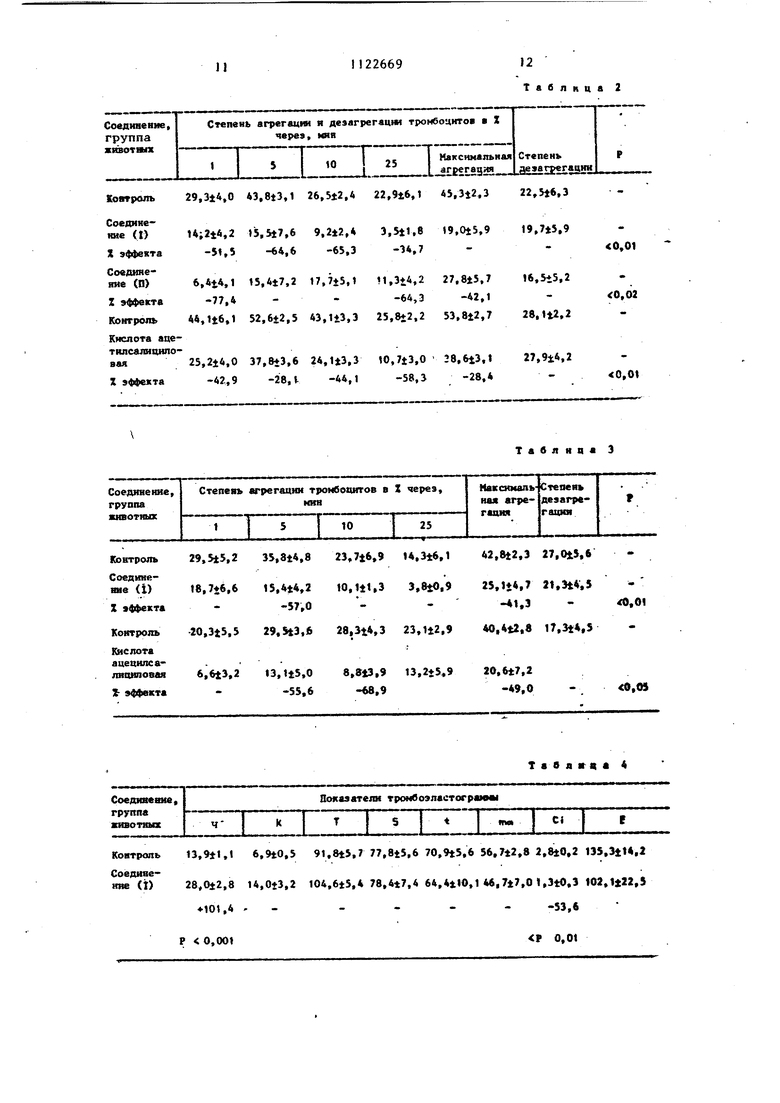
Способ получения соединения (|) заключается в том, что 1к:ходнь аденозин (У) бромируют водным раствором брома в ацетатном буфере. Полученный 8-бромаденозин (X) обрабатывают абсолютированным ацетоном в П1 сутствш п-толуолсульфокислоты. Полученшдй 8-6 ром-2, 3-0-изопропилиденаденозин {XI) окисляют перманганатом кал в щелочной среде в 8-6ром-12 3 -0-изо1фопилиденаденозин-5-кар6оновую кислоту (ХП). После снятия изопропинзденовой защиты в условиях кислотного гидролиза получают .8-бромаденозин-5-карбоновую кислоту (ХШ), которую обрабатьюают хлористым тнонилом в абсолютном этиловом спирте и выделяю целевой продукт (I) txv tPrOOCn HO OH O OH Ш) ( IX)
mtt
ноос
ею ОС
но он
vzni) Таким образом, способом, которым получают структурный аналЪг(Ш), соединение (Г) получить невозможно, поскольку непосредственное бромирование этилового эфира аденозин-5-карбоновой кислоты (П) приводит к гидролизу эфирной группировки и пол чаемая при этом смесь продуктов не содержит целевого соединения. Было установлено также, что невозможно пробромировать и аденозин-5-карбоновую кислоту (yiH) известными способами . Невозможность получения этиловог эфира 8-бромаденозин-5-карбоновой кислоты бромиров&нием этилового эфи аденозин-5 карбоновой кислоты объяс няется свойствами конечного продукта - его крайней нестабильностью в водной среде. В связи с этим бьш получен предпагаем ям способом не этиповьй эфир 8-бромаденозин-5-карб новой кислоты, а его гидрохлорид. Если гиирохлорид этилового 8-бромаденозин-5-карбоновой кислоты обработать водным раствором, содержащим бикарбонат натрия в количестве, необходимом для нейтрализации НС С, то вместо образования ожидаемого продукта - этилового эфира. 8-бромаденозин-5-карбоновой кислоты происходит его полное разложение. П данным тех образуется 8-бромаденозин-5-карбоновая кислота, В присутствии даже следов Bnarji гидроклорид этилового эфира 8-бромаденозин-5-карбоновой кислоты постепенно разлагается. Все методы введения брома основываются на бромировании в водных средах. Поэтому даже, если и происходит бромирование, то образовавшийся этиловый эфир 8-бромаденозин 5-карбоновой кислоты сразу разлагается . Таким образом, практически невоз можно получить гидрсйшорид этипового эфира 8-бромаденрзин-5 -карбоново кислоты. В связи с этим разработан синтез предлагаемого соединения (i) исходя из 8-бромпроизводных аденозина (X) и(Х1) с получением промежу точных новых соединений (ХП) и (ХШ) Пример 1. Получение гидрохлорида этилового эфира В-бромаденрзин-5-карбоновой кислоты. 10 г аденозина (37,4 ммоль) раст ряют при нагревании и перемешивании в 200 МП 0,5 М ацетатного буфера, Ра створу дают остьггь до комнатной температуры, после чего при тщательном перемешивании прибавляют к по каплям раствор 3 мл брома (58 ммоль) в 300 мл воды. Через 3 ч избыток брома разлагают добавлением сульфита натрия до исчезновения красной окраски и раствор нейтрализуют 5 н. NaOH до рН 7. Колбу помещают на ночь в колодилышк. Выпавпме кристаллы отфильтровывают, промывают водой, спиртом и э4мром, сушат и получают ,9,7 г (28 ммоль 8-бромаденозина. Т.пл. 163°С (разл.), выход 75%. К суспензии 8-бромаденозина (5,0 г 14,45 ммоль высушен над PjOj в вакуумном эксикаторе)в 800 мл абсо лютированного ацетона прибавляют п-толуолсульфокислоту (27,3 г, 144,5 ммоль). Реакционную смесь перемешивают 2 ч и выпивают затем в 400 мл воды со льдом, содержащей 28 г бикарбоната натрия. Для удаления ацетона раствор упаривают при пониженном давлении на ротационном испарителе. По мере удаления ацетона начинается выделение кристаллического продукта, плохо растворимого в воде. Его отфильтровывают, сушат и получают 4,7 г (12,2 ммоль) 8-бром-2,3-0-изопропш1иденаденозина, Т.пл. 221-222°С, выход 84%. К суспензии 8-бром-2, 3-0-изопропилиденаденозина (2,0 г, 5,15 ммопь в 540 мл воды) добав-ляют 0,86 г КОН н порциями в течении часа BMnO (3,32 г, 21 ммоЛь). Реакционную смесь перемешивают трое суток. Непрореаги ровавший перманганат калия разрушают 3.0%-ной перекисью водорода, двуокись марганца отфильтровывают, промывают горячей водой, объединенные фильтра-, ты концентрируют до 200 мл и подкисляют 10%-ной соляной кислотой до , . Выделившиеся кристаллы отфипьтровьшают, сушат и получают 1,52 г (з,8 ммоль) 8-бром-2,3 -0-изопропш1иденаденозин-5-карбоноБОй кислоты, Т.пл. 245-247 С (разл), выход 73,( молекулярный вес 400. Найдено, %: С 39,09; Н 3,66; В 19,92. %H 40sNffBr Вычислено, %: С 39,00; Н 3,30; в 20,00. А(Н{6,12 с; Н 5.70g; Н, 5,60gg; ,72g) 1,,, 6,ОГц. 154 2,ОГц;Лд, ммкс 0,1 н.NaOH 266 нм ( 1 i72 10 ммоль -см-). 2,5 г (6,25 ммоль) 8-бром-2,3-0 ИЗопропилиденаденозин-5 -карбоновойкислоты прибавляют в один прием в 250 мл 1 н. НС и перемешивают при в течение 25 мин. Затем раство быстро охлаждают.и нейтрализуют до рН 4-5 H.NaOH. Раствор концентрирую до 120 МП,при этом образуется хлопь видный осадок. Его от льтровывают, промывают водной, сушат и получают 1,73 г (4,81 ммоль) 8-6ромаденозин-5-карбоновой кислоты. Т.пл. (разл), выход 77%, молекулярныйвес 378. Найдено, %: С 31,60; Н 3,36; Ег 21,53. C.H gOgNyBr С 31,75; Н 3,17; Вычислено, Вг 21,16. с/(Н; 5,94g; Н, 5,04 gg; н 4,53 gg; н; 4,38 g)- 6,0 Гц; j:2,}i 5,0 Гц: 1э,4 3,5 Гц,Д 2,69 нм ( е 1,8010 ммольсм- : К 0,8 г (2,22 ммоль) 8-бромаденозЦн-5-карбоновой кислоты добавляют 50 мл абсолютированного этиловог спирта и затем при перемешивании и охлаждении льдом -0,5 мл хлористого тионила. Смесь перемешивают 1 при Ос и 30 ч при комнатной температуре. Раствор концентрируют в вакууме до 15 мл, рхлазкдают и прибавляют к нему 300 мл холодного эфира Образовавшийся осадок отфильтровывают и сушат в вакуумном эксикаторе получают 0,85 г (1,81 ммоль) гидрохлорида этилового эфира 8-бромадено зин-5-карбоновой кислоты. Т. пл. .108-1 , выход 82%, молекулярный вес 460,5. Найдено, %: С 35,31; Н 4,61; CtBr 24,41. C.jH.jOjNjCtBr. Вычислено %: С 35,70; Н 4,46; CfBr 24,54. сЛ(н; 6,0g; HJ 5,19яй). 1,а, ,5,25Гц; 1,.з 5:05Гц „1МеО|1 262 нм (Е 2,03 Ю ммоль оГ). Выход на исходный аденозин 29,3% Предлагаемый способ является единственным способом получения гидрохлорица этилового эфира 8-бром аденозин-5-карбоновой кислоты. Способ основан на доступном отечественном исходном аденрзине. Соединение (1) в конечной концентрации 10 М снижает свертываемость крови,изменяя статистическидо 98 товерно все показатели тромбоэластограммы, что косвенно подтверждает влияние его на функциональную активность тромбоцитов. Подобного эффекта на установлено для структурного аналога (соединение П). Соединение (I) обладает высокой антиагрегационной активностью и в условиях ; применения прямых тест-систем, Соединение (J) в концентрации ЮМ на 50-85% снижает степень АДФ - индуцированной агрегации тромбоцитов. Антиагрегационный эффект наблюдается в течение 25 мин регистрации динамической функции тромбоцитов и свидетельствует о прямом продолжительном действии соединения (1). Весьма существенно, что соединение (1) не влияет на спонтанную дезагрегацию тромбоцитов,, не прюпятствует распаду тромбоцитарных агрегатов по сравнению с контролем. В условиях целостного организма соединение (I) в дозе 10 ie/кг (t% от максимально переносимой дозы внутривенном введеню) снижает степень агрегации тромбоцитов на 57% продолжительностью 5-6 мий. По величине эффективной дозы соединение О) в 5 раз превосходит активность фармакодогического стандарта, вызывая при этом более выраженный антиагрегационный эффект. Соединение (1) обладает вьфаженной антикоагуляционной активностью, абсолютно нетоксично, практически не влияет на важнейшие физиологические функции организма, хорошо растворимо в воде. Следовательно, оно имеет существеяные преимущества по сравненшо с кислотой ацетипсалициловой не только по эффективности, но и но безопасности, Соединение (I) щдагодно для разработки быстродействуюв1 с лекарственных форм для внутривенного введения при неотложной антиагрегационной терапии в экстремальных условиях. Структурный аналог (П) в условиях прямой тест-системы в конечной концентрации проявляет двухфазное действие на агрегацию тромбоцитов, вызываемую АДФ. Соединение (П) оказывает прямое антиагрегационное деист- вие, снижая на 77% степень агрегации тромбоцитов в течение первой минуты после добавления агреганта. Затем статистически .достоверный антиагрегационньй эффект отмечается на 25 миHjn e опыта,которьй вероятно обусловлен продуктом распада соединения (П) Структурный: аналог, уступая по глубине и продолжительности действия изучаемому соединению (1), вась)ю сильное влияние на важнейоие физиологические функц1Ш организма. Следовательно, соединение (П) абсолютно непригодно в качестве потенциального антикоагулянта, так как способно вызывать целую гамму побочнмс эффектов, весьма опасных для жизнедеятельности организма в УСЛОВИЯХ диссемияированного внутрйсосудистого свертывания крови.
Стандартное фармакологические средство - кислота ацетилсалициловая в концентрации проявляет tfeHee выраженное антиагрегационное действ1ю уступая активности изучаемого соединения более, чем в tO раз. В условиях целостного « гажзма кислота ацетилсалициловая в дозе 55 мг/кг (5% от СДд,) проявшет сопоставимую по величине антиаг гационную активность. Следовательно, только индексы вшЕроты терапевтического действия соединения (t) (94) и фармакологического стандарта (1У) (20) могут служить несомненным доказательством щ еимущества изучаемого вещества. При этом следует учитывать ш фок1й спектр фармакологической активности кислоты ацетипсаладиловой, только оральный способ применения, медленное развитие loNTpoOb l,2tt,2 СОАДШМ юп (t) fS,HO,7 tO,,3 nS,6j,4 KowfWb ео«даа« ШЮ (XI) t7,2tO,9 8,6±1,9 113,8tt,7
антиагрегационного эффекта, непригодность препарата в качестве средства в неотложной терации.
В табл. 1 приведено влияние производных йданозин-З -карбоновой кислоты (соединение 1и Jl, )на свертывающую систему крови белых крыс инвитро по данным тромбозластограммы, в табл 2 - влияние производ1влс (соедйнение I и П) аденозин-5-карбоновой кислоты (l() и ацетилсалициловой К1я;лоты () наАДФ - индуцщ ованную агрегацию тромбоцитов белых в опытах инвитро.В табл.3 дано соединения Т (10 мг/кг нутР1й5рю1шйно) и ацетилсалицшювой кислоты (55 мг/кг внутрибрюшинно) на степень агрегации тромбоцитов (агрег ч уювр1й агент -. АДФ) в .отитах на белых крысах (вещества вводил за 20-30 мин до начала исследоваш 1я). В табл. 4 и 5 дано влшяшЕе сое|ШшеНИН (.1) на свертывающею сист@ кроМ белых крыс пук введевдда в дозе 10 мг/кг вйутшбрюшйнно за 20 Ш1в до заборе крови.
Таким образом, гцдрсвслорид этинд во го 3 ф|фа 8 рома;в5енозйн -5-карбоновой кислоты /обладает прею уществами в антяагрега Ц1бяном э4|фекте перед известНьвш структурными соединениями, и пpeдпaIae adй способ позволяет получить новое соединение (1).
.Т в б лица I 8,,0 n7,5t2,« tOO,3t2.l 9V,,5 48,,6 .4 103,7+21,8 20, Г6,5±2,В t23,2t2,0 ieo, 84,2tb9 3«,3i3,5 1, 60.3t9,5 0,05ff.,05 0,05 99,611,589,,2 4t,4t4,8 1,7tQ,3 76,6t18,5 96,6+0,8 88,04,8 43,2+3,0,1,8tO,3 78,1t24,9
1 Контроль t3,9tt,t 6.9tO.S Соединение (t)28,0t2,e 1A,Ot3.2
10,4 P 0,00t
1122669
12 Таблица 2
Твбянца Э
4
-53,6 P O.Ot 91.8t5.7 77,8t5,6 70,9tS,6 56.7t2,8 2,8tO,2 13S,3tt4.2 104.6tS.4 78.4t7,4 64,4tl0.14«,7t7,OI,3tO,a t02H±22,5
Контрою95,
Соеввтнт U)
X вМмта«25,7
,05
Тввлнца 5
55,8t4,2
7,2iO,4
iO,,5 48,3t4,0
43,t
0,001
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Патент США № 3855205, Kjj | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Ber., 106, 1256-1261, | |||
Авторы
Даты
1984-11-07—Публикация
1983-06-17—Подача