ю
00 Од I Изобретение относится к биооргани ческой химии, в частности к синтезу биологически активных соединений, обладающих сродством к материалу тромба и проявляющих тромболитическу активность. Предлагаемые соединения представляют собой продукт связывания урокиназы с фибриногеном,. Фермент уроки-.наза используется в медицине для лечёййя ГрЬмаозмболий кровеноснь сосудов. Фибриноген представляет соб белок крови и после превращения в фибрин под действием тромбина является строительным материалом тромбов Известны производные урокиназы, которые получают присоединением фермента к различным носителям. Так получают водонерастворимые производные урокиназы, например путем связывания ее с эритроцитарной массой lj Однако для терапевтических целей пригодными являются водорастворимые производные урокиназы, например электростатический комплекс фермента с гепарином 2 . К недостаткам подоб ных производных относится их нестабильность. Наиболее близким к известным производным является препарат, представляющий собой урокиназу, ковалент но связанную с декстраном з . Однако подобная модификация фермента не имеет сродства к материалу тромба и поэтому повышение общей фибринолитической активности крови при использовании таких производных не гарантирует эффективного осуществ ления процесса тромболизиса. Цель изобретения - получение ново го препарата - иммобилизованной урокиназы, обладающей пролонгированной тромболитической активностью и сродством к материалу тромба. Цель изобретения достигается свойствами иммобилизованной урокиназы общей формулы P-C-NH-(CH2)rpNH-(i-E Оо где Р - фибриноген, Е - урокиназа, п - О, 4, 7, 10, 12, -М1гЫ с М-К2 01 характеризующейся мол.мае. соответственно 360000; 385000; 400000; 420000; 440000 и содержанием белка соответственно 30, 15, 14, 12, 10 мас.%, получаемой присоединением молекул фермента к фибриногену через алифатические диамины различной длины с предварительной активацией карбоксильных групп белков карбодиимидом. Способ осуществляют в три стадии. 1. Активация карбоксильных групп фибриногена с помощью карбодиимида и присоединение к нему алифатического амина. Этот процесс проводят по общепринятой методике д. К раствору фибриногена в дистиллированной воде (рН 3,8) добавляют 100-кратный молярный избыток 1-этил-3(диметиламинопропил) карбомиида и инкубируют смесь 10 мин при комнатной температуре, после чего к ней при рН 4,5 и температуре 4 добавляют 100-кратньй молярный избыток алифатического амина в фосфатном буфере рН 8,3 и инкубацию продолжают в течение 5 ч. Полученный продукт (I) диализуют против дистиллированной воды при 4 , а затем против фосфатного буфера рН 8j3. 2.Активация карбоксильных групп урокиназы с помощью карбодиимида. К раствору урокиназы, предварительно отдиализованной против дистих лированной воды и фосфатного буфера рН 8,3, добавляют 1-; зтил-3(диметил7 аминопропил)карбодиимид молярном г отношении 1:100 и инкубируют при 4 в течение 20 мин (продуктП). 3.Полученные урокиназы, иммобилизованной на фибриногене. Реакцию связывания урокиназы с фибриногеном осуществляют сливанием продуктов Г и И с последующей инкубацией смеси в течение 18 ч при 4°. Затем пролученный препарат урокиназы, ковалентно связанной с фибриногеном,вьщеляют с помощью гельхроматографии или ультрафильтрации на приборе Amikon с фильтром ХМ-100. Процесс получения производных урок назы иллюстрируется следующей О HNRi |-С-0 -1-НгК-(СНг)„- 1Н2О
ра -C-NH-(CH2)n-NH2+Ri-N-C-N-R2
где Р - белок (фибриноген). 2) Е|-С( ОН
де Е - фермент урокинаэа
О
VJJJ JCX
,3) р|-с-кн-(сн2)п-кн24 е-о-е-|Б
I о о
P -t-NH-CciHzlrrNH-Cl- E
Пояученно е производное урокиназы (Ш) представляет собой урокиназу, ковалентно связанную с фибриногеном, являющимся строительным материалом тромба, и обладакицую вследствие этого повьшенным сродством к тромбу,
Включение подобного конъюгата в тромб за счет средства носителя (после взаимодействия с тромбином) с материалом тромба обеспечивает повышенную локальную концентрацию уроккназы на.поверхности тромба. По-видимому, это происходит на всех участках тромбообразования, что обус ловливает возможность превращения подобных производных в сродство системного тромбилизиса.
Включение в структуру производных фибриногена и урокиназы не позволяет с очевидностью предположить, что получаемые производные будут характеризоваться тромболитической активностью с повышенным сродством к мате риалу тромба. Неожиданность достигаемого эффекта обеспечивается тем что как урокиназа, так и фибриноген, относятся к элементам противоборству ющих систем в организме. Урокиназа активатор плазминогена - элемент системы фибринолиза, в то время как фибриноген - элемент системы свертывания крови. Соединение этих элементов в одном производном предполагает возможное разрушение матрицы
н н
HNRx
NRf
О
11
носителя (фибриногена) под каталитическим действием урокиназы, поскольку фибриноген является субстратом для системы фибринолиза. Только структура агломератов - подшивка фермента к фибриногену через ножку диамина - позволяет урокиназе, с одной стороны, обладать определенной подвижностью, необходимой для эффективного тромболиза, а с другой стороны, препятствует разрушению носителя вследствие стерических затруднений, обусловленных модификацией фиброногена диамином.
Подобное связывание урокиназы с фибриногеном придает получаемым производным неочевидные, новые свойства: наряду с тромболитической активностью повышенное сродство к материалу тромба. Влияние структуры получаемых агломератов на достигаеемый эффект проявляется в том, что матрица носителя (фибриноген) в результате известных превращений способствует встраиванию препарата в формируялцийся тромб, основу которого составляет фибрин. Это обеспечивает достаточную эффективность действия таких препаратовj тромболитическая активность возрастает.
Полученное производное урокиназы, ковалентно связанной с фибриногеном (НО сохраняет около 50% первоначальной эстеразной активности, опре,HNR E3-Ci-0-C S NR2
1
деляемой по гидролизу метилового эфира ацетилглицшшизина (AGLMe) . По кинетическим параметрам гидролиза этого субстрата полученное производное близко к нативному ферменту, а по термостабильности превосходит его рН-оптимум каталитической активности модифицированной урокиназы по гидролизу . AGLMe сдвигается в кислую сторону по сравнению с нативным ферментом переходя вобласть физиологических рН. Преимущество производных заключается в повышении сродства их к тромбу, что в результате обеспечивает большую эффективность тромболизиса.
Кроме того, связывание фермента с высокополимерной матрицей, обычно повьшает стабильность фермента в физиологических условиях, что означает удлинение сроков его действия и повьшение эффективности ферментной терапии.
При исследовании свойств предлагаемых соединений сравнение проводили с нативным ферментом, так как известное производное урокиназы проявляет свойства, идентичные свойствам нативного фермента.
Пример 1. 7,83мг фибриногена растворяют в 6 мл дистиллированной воды (3, М) при комнатной температуре, раствор подкисляют с помощью НС1 до рН 3,8 и затем добавляют карбодиимида. Через 10 мин когда рН раствора достигнет максимального значения (рН 4,5), отбирают 2 мл раствора активированного фибриногена, который добавляют на холоду (4°С) к 2 мл раствора додекаметилендиамина (3, М) в 0,1 М фосфатном буфере рН 8,3 и инку бируют смесь в течение 5ч. После этого инкубационную смесь диализуют в течение 2 ч на холоду сначала против дистиллированной воды, а затем в тех же условиях против 0,02 М фосфатного буфера рН 8,3 (, продукт I ) .
Препарат урокиназы (24.000 I U) растворяют в 2 мл дистиллированной воды и диализуют на холоду 2 ч против дистиллированной воды, затем еще 2 ч против 0,05 М фосфатного буфера рН 8,3. К отдиализованному раствору урокиназы добавляют 4 мг карбодиимида и инкубируют смесь
016
при перемешивании на холоду в течение 20 мин (продукт К ).
После этого к раствору активированной урокиназы (И) приливают 2 мл раствора фибриноген-додекаметилендиамина (I). Смесь инкубируют в течение 18 ч: при , затем полученный препарат вьщеляют из реакционной смеси с помощью ультрафильтрации на Amicon с фильтром ХМ-100. b результате эксперимента с фибриногеном связывается 80% урокиназы, причем препарат сохраняет 50% эстеразной активности от первоначальной.
Мол.мае, полученного продукта 440000, содержание белка -10мас.%.
Пример 2. Процесс осуществляется -так же, как и в примере 1, за исключением того, что в качестве
сшивающего реагента используется 1,10-декаметилендиамин.
С фибриногеном связывается 90% уро кйназы, сохраняемая препаратом остаточная эстеразная активность составляет 45% от первоначальной. Мол.мае. продукта - 420000, содержание белка - 12 мас.%.
Пример .3. Процесс осуществляется Так же, как и в примере 1,
за исключением того, что в качестве сшивающего агента используется 1,7-гептаметилендиамин.
С носителем связывается 85% уроки назы, остаточная эстеразная активность производных урокиназа - фибриноген 30%, Мол.мае. 400000, содержание белка 14 мас.%.
Пример 4. Процесс осуществляется так же, как и в примере 1, за исключением того, что в качестве сшивающего агента используется 1,4-тетраметш1ендиамин.
К фибриногену присоединяется до 90% урокиназы. Препарат имеет остаточную эстеразную активность 40%. Мол.мае. 385000, содержание белка 15 мас.%.
Пример 5. Урокиназу присоединяют к фибриногену непосредственно, без удлиняющего мостика алифатического диамина.
2 мл урокиназы (12,000 I U/ml) диализуют 2 ч при против дистиллированной воды, а затем против 0,02 М фосфатного буфера рН 8,3. К раствору урокиназы добавляют 2 мл активированного карбодиимидом фибриногена (3,8-10 М) и 1 мл 0,1 М
фосфатного буфера рН 8,3. Смесь инкубируют 18 ч при . Полученное производное выделяют ультрафильтрацией.
С фибриногеном связывается 90% урокиназы, препарат сохраняет до 32% первоначальной эстеразной активности Мол.мас, 560000, содержание белка 30 мас.%.
Таким образом, присоединение урокиназы к фибриногену с помощью раз личных алифатических диаминов с предварительной карбодиимидной активацией исходных белков позволяет получать производные урокиназы, присоединенные к матрице носителя как через ножки различной длины, так и без них.
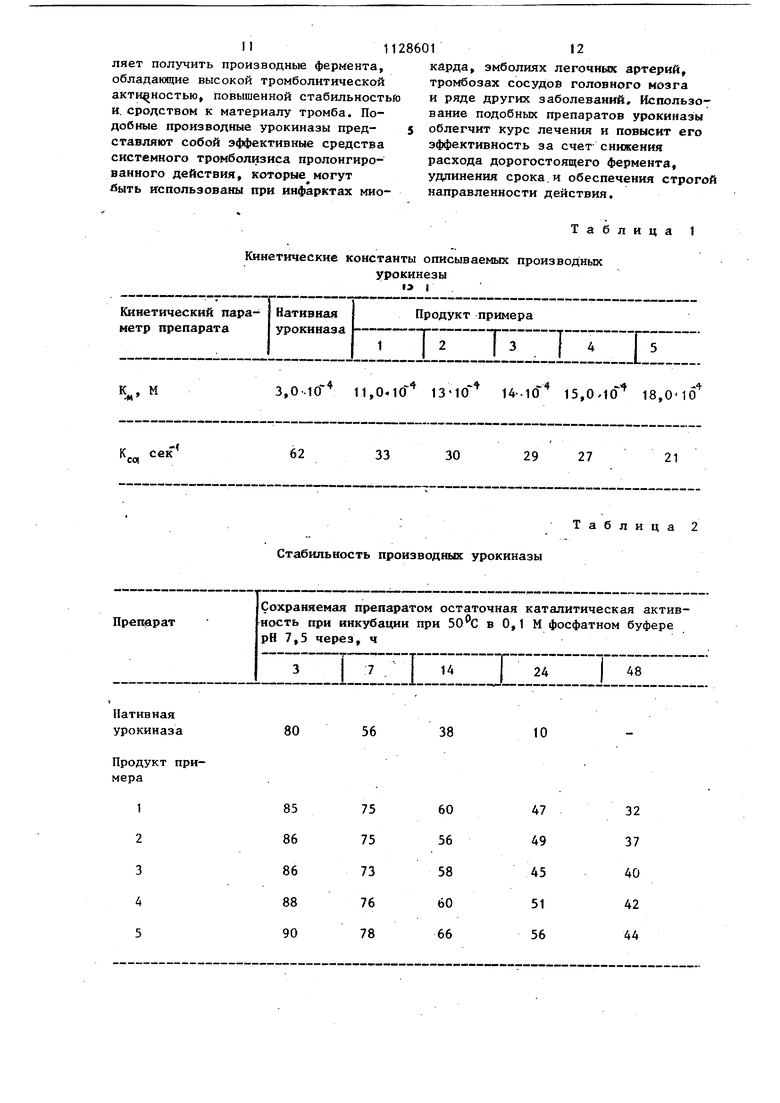
Кинетические параметры каталитического гидролиза такими препаратами низкомолекулярного субстрата AGLMe (рН 7,5| 0,1 М НС1, комнатная температура) незначительно отличаются от соответствующих констант нативной урокиназы. Об этом свидетельствуют данные табл. 1. В качестве объекта сравнения использована нативная урокинвза, так как последняя в условиях эксперимента сопоставима с известным препаратом з.
Концентрация AGLMe 10 -10 М, концентрация фермента в ячейке 100 lU/ml.
Как видно из данных табл. 1, лучшие кинетические параметры среди модифицированных препаратов урокиназы имеет продукт примера 1 - урокиназа, присоединенная к фибриногену с помощью 1,12-додекаметилендиамина. Использование самой длинной из имеющегося набора ножек позволяет получать препараты, наиболее близкие по свойствам к нативному ферменту.
По-видимому, длинная ножка в значительной степени устраняет неблагоприятное слияние на глобулу фермента со стороны матрицы, которое мсотсет проявляться в изменении конформационного состояния молекулы-связанного фермента, в стерическЕсх затруднениях возникаюсцих при взаимодействии с субстратом и т.д. Это подтверждается сравнением кинетических характеристик нативной урокиназы и продуктов ее модификации. Так, по мере укорочения ножки для производных урокиназы возрастают величины К и уменьшаются величины Kjj( . Для продукта примера 5 (урокиназа, связанная с фибриногеном без помощи диамина) характерны максимальное значение К, и минимальное значение , что означает резкое снижение активности этого производного по сравнению с нативной урокиназой.
Присоединение урокиназы к фибриногену сдвигает рН-оптимум каталитической активности фермента по гидролизу AGLMe в кислую сторону. Так, рН-оптимум нативной урокиназы 8,3, рН-оптимум продукта модификации урокиназы из примера 1 - 7,5. Это объясняется элиминированием отрицательного заряда карбоксильных групп в глобуле урокиназы при их активации карбодиимидом. Изменение остаточной каталитической активности урокиназы при ее модификации происходит следующим образом: активность фермента до модификации - 100% после стадии карбодиимидной активации - 88%, после связывания с фибриногеном, модифицированным 1,12,додекаметилендиамином, - 57%, после выделения полученного пронзводного методом ультрафильтрации на Araicon - 52%. Связывс:;ше фермента с полимерной матрицей фибриногена наряду с тем, что позволяет глобуле фермента сохранять определенную подвижность (изменения К/ц, ) придает получаемому препарату биокатализатора повышенную стабильность, о чем говорят данные табл. 2.
Определение остаточной каталитической активности проводили на рН-стате по гидролизу 10 И раствора AGLMe в 0,1 М КС1 при рН 7,5 и комнатной температуре.
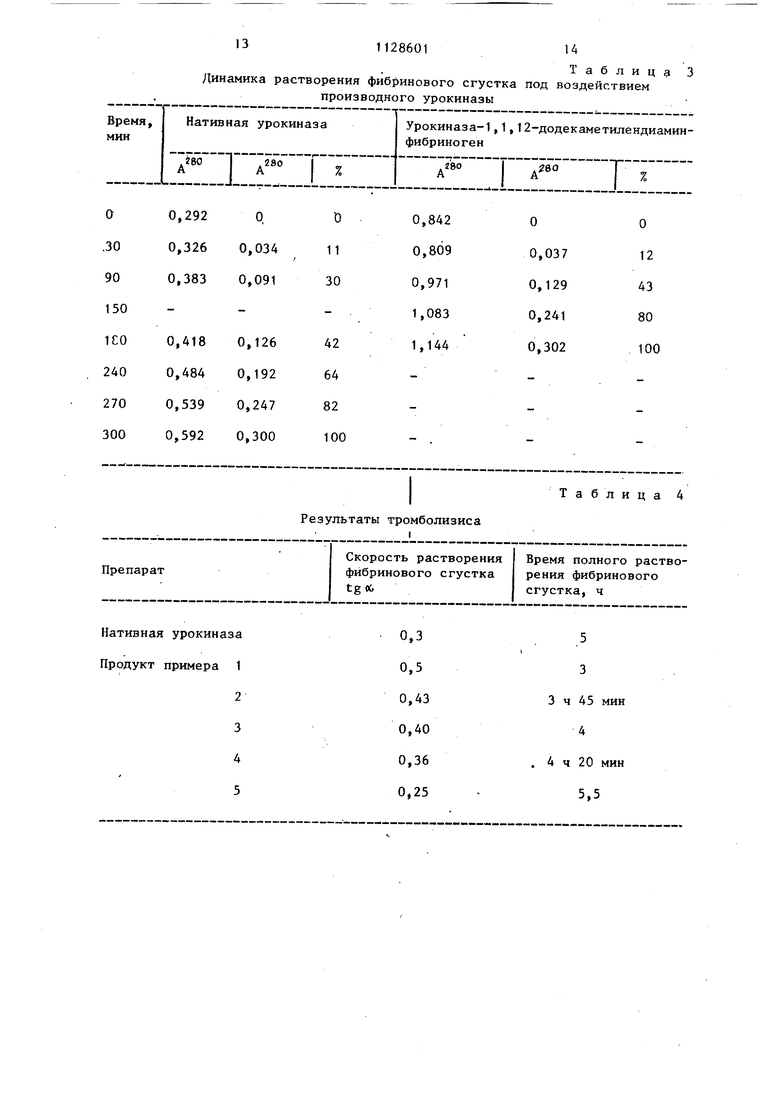
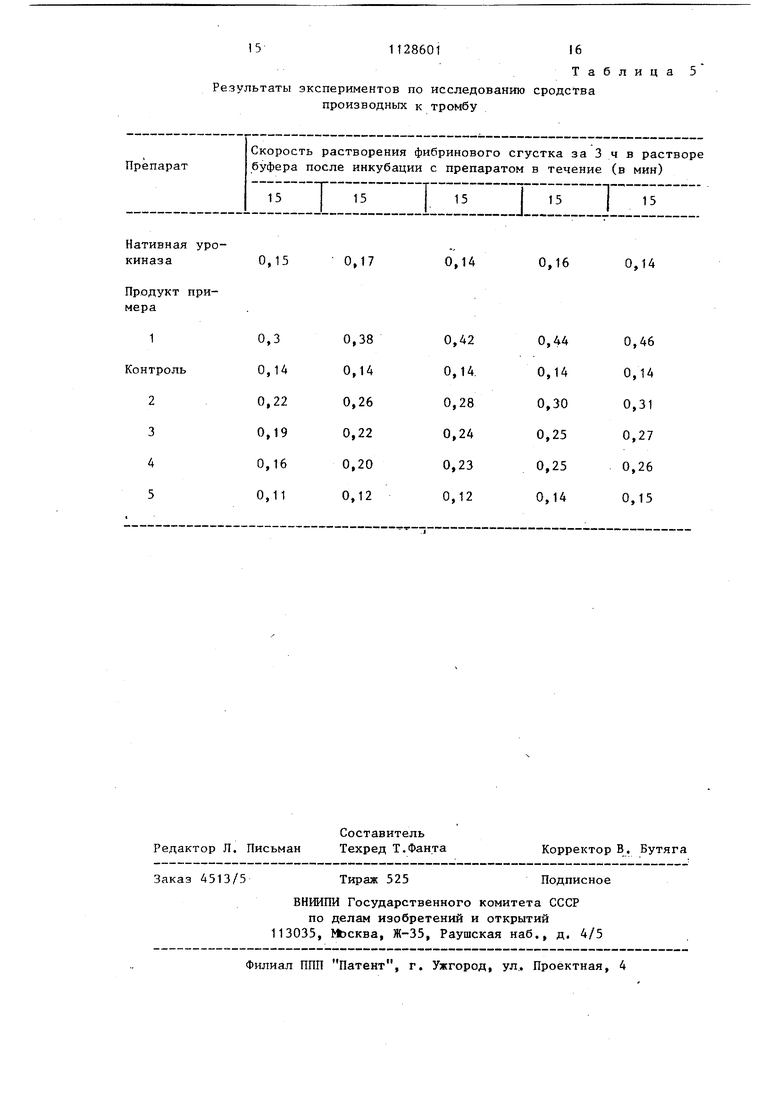
Экспериментальное определение ; тромболитической активности препаратов нативной и модифицированной урокиназы было выполнено согласно известной методике 5, с добавлением в омывакяций раствор 0,33 мг/мл плазминогена человека. К 0,5 мл раствора (10 мг/мл) фибриногена приливают 0,2 мл раствора (4 мг/мл) тромбина и вьщерживают эту смесь 1 ч при комнатной температуре, за это время формируется фибриновый остов тромба. Его помещают на проницаемую пленку в закрепленную пластмассовую трубочку диаметром 1,0-1,5 см, дно которой омьгоается 15 мл раствора 0,1 М фосфатного буфера рН 7,4. В этом растворе астворяют плазмимо9ген (0,33 мг/мл контроль), а также препвраты нативной и модифицированно урокиназы, которые берут в соотношени обеспечивающем их одинаковую эстеразную (AGLMe) каталитическую активност За растворением фибринового сгустка следят по увеличению оптической плотности при Ъ 280 нм омывающего раствор по времени. Результаты эксперимента приведены в табл. 3. . Отношение приростаоптической плотности раствора (в результате деструкции при тромболизисе нерастворимого фибринового сгустка и перехода его фрагментов в раствор) к величине промежутка времени, за кото1м 1й оно произошло, характеризуе скорость процесса тромболизиса (tgti в такой системе. В контрольном эксперименте значительного лизиса фибринового сгустка не наблюдается. Для препаратов же нативной и модифицированной урокиназы (продукт примера 1) значения tg об составляют соответственно 0,3 и 0,5, что свидетельствует о большой тромболитической эффективности модифицированного производного и подтверждается также значениями времени полного растворения тромба, составляющими 5 и 3 ч соответственно. Окончательные результаты экспериментов по тромболизису представлены в табл. 4i Приведенные в табл. 4 данные показывают, что с ростом длины ножки использованного диамина растет эффек тивность тромболитического действия препарата модифицированной урокиназы Можно предполагать, что причина этог заключается в наиболее благоприятном соотношении у таких производных подвижности фермента, удаленности его от матрицы носителя и ее способности быть встроенной в материал тромба, Дальнейшее увеличение длины ножки нецелесообразно, так как утрачивается стабилизирующее влияние носителя и затрудняется его модификация такими бифункциональными реагентами, возрастающая гидрофобность которых сокращает их реальную длину (скручивание метиленовой цепи), Как показывают дачные, 12 метиленовых групп в цепи реагента - это близкая к оптимальной длина межмолекулярной сшивки. 1 Экспериментальное подтверждение возросшей тропности препарата модифицированной урокиназы к тромбу было предемонстрировано следующим образом: сформировавшиеся сгустки фибрина омывались определенное время (15 мин) растворами препаратов нативной и модифицированной урокиназы. Затем сгустки переносили в растворы того же буфера без фермента и инкубации в течение 3 ч. В этих растворах определяли прирост оптической плотности, т.е. скорость растворения фибринового сгустка, причем контролем служил буфер, содержащий плазминоген и омывающий фибриновый сгусток в течение всего времени эксперимента. Показано, что происходит быстрое встраивание и фибриновый сгусток фибриногена из омьгоающего раствора. Это включение обнаруживается визуально уже через 5-15 мин (см. . 5 ) . Из данных табл. 5 следует, что действие нативного препарата урокиназы (tgWO,15) по эффективности тромболизиса близко к данным контрольного эксперимента (tgoi. 0,14). Фибринолиз в контроле объясняется, вероятно, наличием в препарате плазминогена примесей плазмина , Значительно большую тромЬолитическую активность обнаруживает продукт модификации урокиназы из примера 1 (tge60,3). Это означает, что именно это производное урокиназы обладает сродством к фибриновому сгустку, поскольку влючается в него при первой 15-минутной инкубации и переносится вместе со сгустком в буферный раствор, где в течение 3 ч продолжается фибринолитическое действие препарата. Более того, при повторении этого эксперимента с теми же фибриновьми сгустками несколько раз (до 5, см. табл. 5) обнаруживается, что производные урокиназы обладают способностью дополнительно встраиваться в уже лизирующийся тромб, о чем свидетельствуют возрастающие значения (от 0,3 до 0,46) tg«i характерного показателя эффективности тромболизиса. Как видно из табл. 5, подобная способность не свойственна нативной урокиназы. Синтез препаратов урокиназы, ковалентно связанных через алифатический диамин с фибриногеном, позволяет получить производные фермента, обладающие высокой тромболитическр й активностью, повышенной стабильностьй и. сродством к материалу тромба. Подобные производные урокиназы представляют собой эффективные средства системного тромболизиса пролонгированного действия, которые могут Лыть использованы при инфарктах миоКиКинетический параметр препарата К, М К сек Прецарат
80
85 86 86 88 90
карда, эмболиях легочных артерий, тромбозах сосудов головного мозга и ряде других заболеваний. Использование подобных препаратов урокиназы облегчит курс лечения и повысит его эффективность за счет снижения расхода дорогостоящего фермента, удлинения срока.и обеспечения строгой направленности действия.
10
за
47 49 45 51 56
60 56 58 60 66
32 37 40 42
44 етические константы описываемых производных Нативная Продукт примера урокиназа«г-т1 3,0-.10 11,0. 14-. 15,0.10 18,01б 62 33 30 29 27 21 Стабильность производных урокиназы Сохраняемая препаратом остаточная каталитическая активность при инкубации при 50 С в 0,1 М фосфатном буфере рН 7,5 через, ч 3 7 I Т I Таблица 1 урокинезы |л г 1 2Li- L i... -Т а б л и ц а 2 131128601 Динамика растворения фибринового сгустка под производного урокиназы 14 Таблица 3 воздействием 




| название | год | авторы | номер документа |
|---|---|---|---|
| Урокиназа,иммобилизованная на гепарине | 1982 |
|
SU1137760A1 |
| Способ получения модифицированной урокиназы | 1981 |
|
SU1037683A1 |
| Стабилизированная урокиназа,обладающая тромболитической активностью,и способ ее получения | 1979 |
|
SU1022988A1 |
| ПРИМЕНЕНИЕ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-10 (ММР-10) ДЛЯ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ | 2008 |
|
RU2489163C2 |
| ПРОЛОНГИРОВАННОЕ ТРОМБОЛИТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2121362C1 |
| ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS ТВ-06 В КАЧЕСТВЕ ПРОДУЦЕНТА ГЛУТАМИЛЭНДОПЕПТИДАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2611378C2 |
| СПОСОБ ОЦЕНКИ ТРОМБОЛИТИЧЕСКОГО ПОТЕНЦИАЛА МИКРОМИЦЕТОВ | 2020 |
|
RU2788697C2 |
| ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS EO-11 ВКПМ В-11978 В КАЧЕСТВЕ ПРОДУЦЕНТА СУБТИЛИЗИНОПОДОБНОЙ ПРОТЕИНАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2622006C2 |
| РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД СО СВОЙСТВАМИ ПЛАЗМИНОГЕНА ЧЕЛОВЕКА ПРЕВРАЩАТЬСЯ ПРИ АКТИВАЦИИ В ПЛАЗМИН, КОТОРЫЙ КАТАЛИЗИРУЕТ РАСЩЕПЛЕНИЕ ФИБРИНА, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ПОЛИПЕПТИД, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДА И ТРАНСФОРМИРОВАННАЯ КЛЕТКА Escherichia coli - ПРОДУЦЕНТ ПОЛИПЕПТИДА | 2009 |
|
RU2432396C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВАТОРА ПЛАЗМИНОГЕНА | 2007 |
|
RU2346983C1 |
Урокиназа, иммобилизированная на фибриногене, общей формулы P-C-NH-(CH2)n-NH-C-E J f, О где Р - фибриноген, Е - урокиназа, п - О, 4, 7, 10, 12, обладающая пролонгированной тромболитической активностью и сродством к материалу тромба, характеризующаяся мол.мае. соответственно 36000, 385000 400000, 420000, 440000, содержанием белка соответственно 30, 15, 14, 12, (Л 10 мае.%,
Результаты тромболизиса
Таблица 4 I 151128601 Результаты экспериментов по исследованию производных к тромбу 16 ТаблицаЗ сродства
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| T.Kitao, K.Hattori | |||
| Thrombos Haemostas, 1980, 43, 70 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Регулятор давления для автоматических тормозов с сжатым воздухом | 1921 |
|
SU195A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Biophis | |||
| Acta, 1979, 568, 1 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1985-07-15—Публикация
1983-05-10—Подача