Изобретение относится к биохимии, конкретно к усовершенствованному способу получения радиоактивномеченого кортикостерона и кортизрла и может найти применение для синтеза радиоактивномеченых стероидных гормонов глюкокортикоидного и минералокортикоидного ряда, необходимых при создании медицинских радиодиагностических наборов.
Цель изобретения - повышение выхода целевого продукта.
Поставленная цель достигается тем, что в способе получения Н- и С-меченых 11 / -оксистероидов прегненового ряда, включающем трансформацию соответствующего радиоактивного 11 -дезоксистероида с помощью системы, содержащей иммобилизованные на сефарозе адренодоксин, 11 )3-гидроксилирующий цитохром Р-450, адренодоксин редуктазу и НАДФ-Н-регенерирую. щую систему, содержащую НАДФ-Н, глюкозо6-фосфат и глюкозо-6-фосфатдегидрогеназу,
Сл отличительной особенностью является то, что
ю ел проводят реконструкцию мультиферментной системы при соотношении белковых компонентов 88-118 нмоль адренодоксинредуктазы:220 нмоль адренодоксина:22-35 нмоль цитохрома Р-450, осуществляемую путем сорбции цитохрома Р-450 и адренодоксинредуктазы в объеме адренодоксинсефарозы.
(Способ осуществляют следующим образом.
Заявляемый способ включает ковалентную иммобилизацию адренодоксина и получение адренодоксин-сефарозы с емкостью около 280 нмоль иммобилизованного белка на 1 мл уплотненного сорбента. Насыщение
сорбента цитохромом Р-450 проводили с помощью бэтч-варианта сорбции, что включает в себя инкубацию всего объема сорбента с цитохромом Р-450. Данный способ сорбции белка в отличие от метода фронтальной хроматографии, использованного в прототипе, обеспечивает равномерное распределение молекул во всем объеме а(финного сорбента. Бэтч-адсорбцию цитохрома Р-450 повторяли 4-5 раз, что позволяет сорбировать до 40 нмоль цитохрома Р-450 на 1 мл адренодоксин-сефарозы. Бзтч-адсорбцию адренодоксинредуктазы проводили путем однократной инкубации раствора флавопротеида с адренодоксин-сефарозой. содержащей цитохром Р-450, что позволяет достигать величин 120-160 нмоль сорбированной адренодоксинредуктазы на 1 мл аффинного сорбента (70-80% от максимальной емкости сорбента в отношение адренодоксинредуктазы.
Реконструированную таким образом мультиферментную систему использовали для ферментативной трансформации 11 -дезоксистероидов прегненового ряда. Для этого адренодоксин-сефарозу с сорбированными на ней белками набивали в колонку и через полученный колоночной реактор пропускали буферный раствор, содержащий компоненты НАДФ-Н-генерирующей системы (НАДФ-Н, глюкозо-6-фосфат и глюкозо-6-фосфатдегидрогеназу), а также раствор 11-дезоксистероида с добавкой Нлибо С-меченого соответствующего стероида.
Количественное определение продуктов реакции показало, что использованный в заявляемом способе метод бэтч-адсорбции и измененное количественное соотношение белков позволяет значительно увеличить каталитическую эффективность системы, что выражается в увеличении процента трансформации стероидов, увеличении валового выхода продукта и особенно в увеличении выхода продукта в расчете на 1 нмоль активного компонента мультиферментной системы - цитохрома Р-450. Данный эффект обусловлен тем, что в заявляемом способе условия реконструкции и количественные соотношения белковых компонентов мультиферментной системы обеспечивают условия для равномерного распределения реакционных центров 11 /3-гидроксилирования во всем объеме сорбента и пространственного сближения центров электронного переноса от адренодоксинредуктазы к адренодоксину и от адренодоксина к цитохрому Р-450. В отличие от этого в способе реконструкции мультиферментной системы, описанном в прототипе, в результате использования несбалансированных количеств адренодоксинредуктазы и цитохрома Р-450 создаются условия для пространственного разделения зон сорбции адренодоксинредуктазы и цитохрома Р-450, что снижает концентрацию активных центров 11 /3-гидроксилирования.
Пример 1. Для ковалентно-сорбционной реконструкции мультиферментной 11
гидроксилазной системы используют гомогенные белковые компоненты этой системы - адренодоксинредуктазу, адренодоксин и цитохром Р-450, выделенные из митохондрий надпочечных желез крупного рогатого скота.
Ковалентной иммобилизацией адренодоксина на CNBV-активированной сефарозе получают аффинный сорбент адренодоксин-сефарозу, содержащую 220330 нмоль иммобилизованного адренодоксина на 1 мл уплотненного геля.
Сорбцию цитохрома проводили следующим образом. Раствор с концентрацией цитохрома Р-450 20-30 мкМ в 0,05 М натрий-фосфатном буфере (рН 7,4), содержащем 0,3% холата натрия, 2 М KCI, 0,05% твина 20 и 20 мкМ 11-дезоксикортикостерона, разводили в 25-30 раз 0,01 М натрийфосфатным буфером, содержащим 10 мкМ 11-дезоксикортикостерона и инкубировали
40 мин при 0°С адренодоксин-сефарозой из расчета 15 мл раствора цитохрома Р-450 (10-15 нмоль гемопротеида) на 1 мл адренодоксин-сефарозы.Затем сорбент осаждали центрифугированием при 2000дх2 мин,супернатант удаляли и процедуру сорбции цитохрома повторяли еще 3-5 раз с новыми порциями раствора белка.
Для сорбции адренодоксинредуктазы раствор с концентрацией флавопротеида 34 мкМ в 0,01 М натрий-фосфатном буфере (рН 7,4), содержащем 10 мкМ 11-дезоксикортикостерона, инкубировали 20 мин при 0°С с адренодоксин-сефарозой из расчета 10 мл раствора флавопротеида (30-40 нмоль
белка) на 1 мл адренодоксин-сефарозы. Суспензию сорбента центрифугировали при 2000дх2 мин и супернатант с несорбированным белком удаляли.
Количества сорбированных белков определйли как по убыли белков в супернатанте, так и после экстракции сорбированных
белков с аликвоты адренодоксин-сефарозы.
Уплотненную адренодоксин-сефарозу с
сорбированными на ней флавопротеидами
и цитохромом Р-450 суспендируют в 0,01 М натрий-фосфатном буфере Н 7,4), содержащем 10 мкМ 11 -дезоксикортикостерон и набивают в колонку диаметром 8 мм. Для проведения 11 гидроксилазной реакции
через реконструированную таким образом мультиф.ерментную систему пропускают фосфатный буфер, содержащий 11-дезоксикортикостерон с добавкой 11-дезокси 1а 2а (п)-Н -кортикостерона и компоненты НАДФ-Н-регенерирующей системы: НАДФ-Н, глюкозо-6-фосфат-дегидрогеназу. Скорость тока раствора - 1.5 мл/ч, температура - . Элюат собирают порциями по 0,75 мл с помощью коллектора фракций и во фракциях количественно определяют соотношение субстрата и продуктов реакции. Для зтого стероиды экстрагируют 6 мл этилацетата, упаривают при температуре не выше 45°С и разделяют с помощью тонкослойной хроматографии на пластинках с за- крепленным слоем силикагеля, используя в качестве элюента систему бензол:ацетон (13:7). Процент трансформации субстрата определяли по формуле: 100хВ/(А+В+С), где Арадиоактивность в пятне субстрата реакции, В - радиоактивность в пятне основного продукта реакции,а С - радиоактивность в пятнах побочных продуктов реакции.
Колоночный реактор, использованный для трансформации н-меченого 11 -дезоксикортикостерона, содержал 0,8 мл уплотненной адренодоксин-сефарозы (220 нмоль иммобилизованного адренодоксина, 100 нмоль адренодоксинредуктазы и 32 нмоль цитохрома Р-450). Элюционный раствор содержал 0,01 М натрий-фосфатный буфер(рН 7,4), 100 мкМ 11-дезоксикортикостерона с добавкой соответствующего Н-меченого субстрата в концентрации 1,5 мкКи/мл, 3 мМ НАДФ-Н, 5 мМ глюкозо-6-фосфат и глюкозо-6-фосфат-дегидрогеназу в количестве 2,5 единицы на 1 мл раствора.
Образованный продукт ферментативной трансформации 11-дезоксикортикостерона - кортикостерон очищен с помощью тонкослойной хроматографии и идентифицирован на основании сравнения хроматографических подвижностей со стандартом кортикостерона в различных системах растворителей. Радиохимическая чистота полученного кортикостерона составляла 96%.
Пример 2. Иллюстрирует ферментативную трансформацию С-меченого 11-дезоксикортикостерона в С-кортикостерон. Реконструкцию мультиферментной системы 14 ферментативный цикл проводили, как описано в примере 1, заменяя Н-меченый 11-дезоксикортикостерон на 4- с -11-дезоксикортикостерон (0,1 мкКи/мл). Колоночный реактор в зтом случае содержал 0,8 мл уплотненной адренодоксинсефарозы (220 нмоль иммобилизованного адренодоксина), 88 нмоль адренодоксинредуктазы и 28 нмоль цитохрома Р-450.
Радиохимическая чистота продукта составила в этом случае 95%.
Пример 3, Ферментативная трансформация Н-меченого 11-дезоксикортизола в Н-меченый кортизол. Приготовление колоночного реактора и цикл ферментативной трансформации проводили согласно примеру 1. В качестве субстрата реакции использовали 11-дезоксикортизол с добавкой 11-дезокси- 1 ,2 , - Н1-кортизола (1,2 мкмКи/мл). Колоночный реактор содержал 0,8 мл адренодоксин-сефарозы (220 нмоль иммобилизованного адренодоксина), 96 нмоль адренодоксинредуктазы и 31 нмоль цитохрома Р-450,
Радиохимическая чистота продукта реакции, идентифицированного на основании сравнения его хроматографических подвижностей с подвижностями кортизола в нескольких системах растворителей, составила 97%,
Пример 4. Иллюстрирует ферментативную трансформацию С-меченого 11-дезоксикортикостерона в с-меченый кортизол.
Реконструкцию мультиферментной системы и ферментативный цикл проводили согласно примеру 1, используя в качестве субстрата 11-дезоксикортикол с добавкой 4- С -11-дезоксикортизола (0,1 мкКи/мл), Колоночный реактор содержал 0,8 мл адре. нодоксинсефарозы (220 нмоль иммобилизованного адренодоксина), 118 нмоль адренодоксинредуктазы и 35 нмоль цитохрома Р-450.
Радиохимическая чистота полученного
14, С-кортизола составляла 96%.
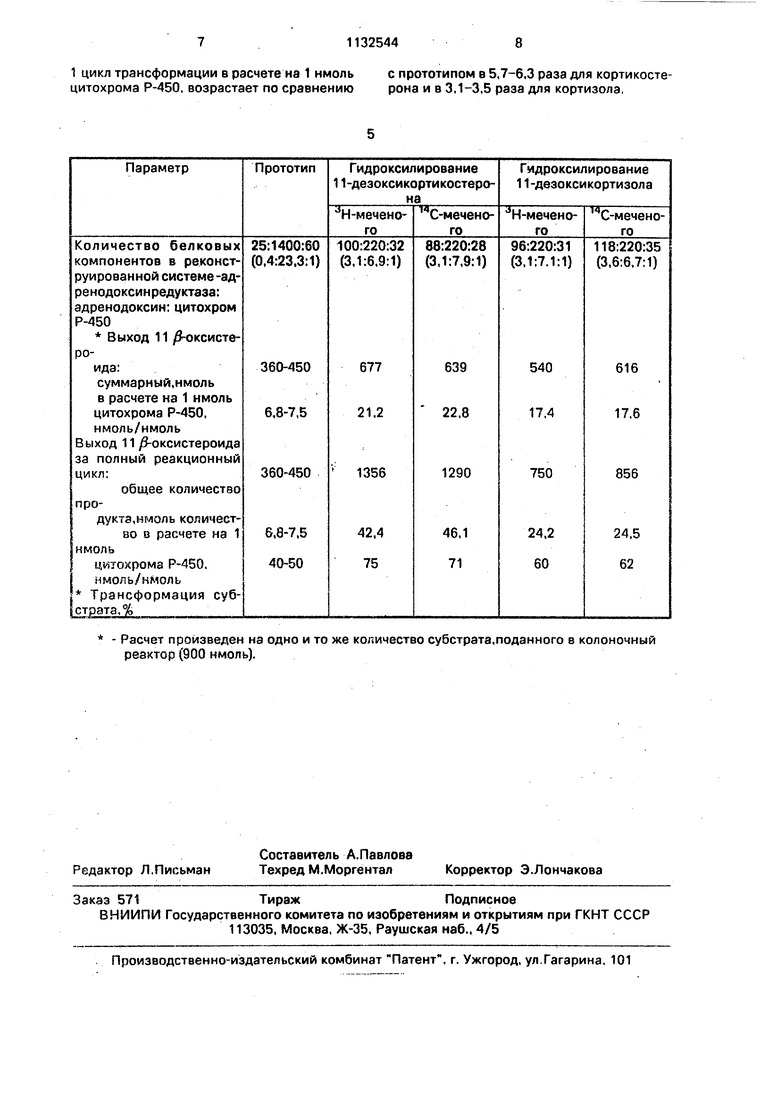
В таблице приведено сравнение каталитических зффективностей реконструированных мультиферментных систем в заявляемом способе ферментативной трансформации и в прототипе. Поскольку основным компонентом мультиферментной системы, содержащим каталитический центр 11 гидроксилирования, является цитохром Р-450, параметры каталитической эффективности системы нормированы к 1 нмолю цитохрома. Из данных таблицы следует, что заявляемый способ ферментативной трансформации в 2,8-3,1 раза более эффективен для 11/3-гидроксилирования 11дезоксикортикостерона и в 2,3-2,5 раза для трансформации 11-дезоксикортизола. При этом увеличивается про цент трансформаций субстрата - до 75% для 11-дезоксикортизола и до 62% - для 11-дезоксикортизола по сравнению с прототипом (40-50% в обоих случаях). Общее количество 11 оксистероид6в, полученное за
1 цикл трансформации в расчете на 1 нмоль цитохрома Р-450. возрастает по сравнению
с прототипом в 5,7-6.3 раза для кортикостерона и в 3,1-3,5 раза для кортизола.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения @ 4- @ или @ прегненолона | 1982 |
|
SU1090716A1 |
| СПОСОБ ДИАГНОСТИКИ СТЕРТОЙ ФОРМЫ ВРОЖДЕННОЙ ГИПЕРПЛАЗИИ КОРЫ НАДПОЧЕЧНИКОВ С ДЕФЕКТОМ 11БЕТА-ГИДРОКСИЛАЗЫ | 2004 |
|
RU2279090C1 |
| НОВЫЙ ПОЛИПЕПТИД СИСТЕМЫ ЦИТОХРОМА Р450 С ПОВЫШЕННОЙ ФЕРМЕНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2677997C2 |
| СПОСОБ ДИАГНОСТИКИ СТЕРТЫХ ФОРМ ВРОЖДЕННОЙ ГИПЕРПЛАЗИИ КОРЫ НАДПОЧЕЧНИКОВ | 2004 |
|
RU2261447C1 |
| ПРИМЕНЕНИЕ АГЕНТА, ОБЛАДАЮЩЕГО МОДИФИЦИРУЮЩИМИ СВОЙСТВАМИ В ОТНОШЕНИИ ГОРМОНОВ НАДПОЧЕЧНИКОВ | 2011 |
|
RU2598708C2 |
| Способ иммобилизации микросом печени | 1981 |
|
SU1057536A1 |
| Способ одновременной диагностики неклассических форм врожденной дисфункции коры надпочечников с недостаточностью 21-гидроксилазы и 11β-гидроксилазы | 2016 |
|
RU2649801C1 |
| ЦЕЛЬНОКЛЕТОЧНАЯ СИСТЕМА ДЛЯ БИОКАТАЛИЗА МОНООКСИГЕНАЗ ЦИТОХРОМА P450 | 2014 |
|
RU2684714C2 |
| Способ прогнозирования глюкокортикоидной недостаточности коры надпочечников у больных синдромом Кушинга в раннем послеоперационном периоде | 2024 |
|
RU2840883C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОСОМАЛЬНОЙ ФРАКЦИИ АЛКАНОКИСЛЯЮЩИХ ДРОЖЖЕЙ CANDIDA MALTOSA | 1991 |
|
RU2032735C1 |
СПОСОБ ПОЛУЧЕНИЯ Н- и С-МЕЧЕНЫХ 11 /J-ОКСИСТЕРОИДОВ ПРЕГНЕНОВОГОРЯДА,включающий трансформацию соответствующего радиоактивного 11 -дезоксистероида с помощью системы, содержащей иммобилизованные на сефарозе адренодоксин, 11 гидроксилирующий цитохром Р-450, адренодоксинредуктазу и НАДФ-Н - регенерирующую систему, содержащую НАДФ-Н, глюкозо-6фосфат и глюкозо-6-фосфатдегидрогеназу, отличающийся тем, что, с целью увеличения выхода целевого продукта, проводят реконструкцию мультиферментной системы при соотношении белковых компонентов 88-118 нмоль адренодоксинредуктазы:220 нмоль адренодоксина:28-35 нмоль цитохрома Р-450, осуществляемую путем сорбции цитохрома Р-450 и адренодоксинредуктазы в обьеме адренодоксин-сефаро- .-; зы.
Расчет произведен на одно и то же количество субстрата,поданного в колоночный реактор (900 нмоль).
| Ахрем А, А | |||
| и др | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Биоорганическая химия, 1979, т.5, Nfe 6, с.937-939. | |||
Авторы
Даты
1992-12-30—Публикация
1982-11-22—Подача