Изобретение относится к производному новой спирогетероциклической системы, содержащей диазаадамантановый и пирановый циклы, 2',2',5,7-тетраметил-6-оксоспиро-(1,3-диазаадамантан-2,4'-тетрагидро- пирану), которое может найти применение в медицине.
Известен 1,5-дифенил-9-оксоспиро-(3,7-диазаадамантан-10-циклогексан), полученный конденсацией 1,5-дифенил-3,7-диазабицикло[3.3.1] нонан-9-она с циклогексаном.
Целью изобретения является производное новой спирогетероциклической системы, содержащей диазаадамантановый и тетрагидропирановый циклы, на основе которой могут быть получены биологически активные вещества, в частности, коронарорасширяющие средства.
Поставленная цель достигается описываемым 2',2',5,7-тетраметил-6-оксоспиро-(1,3-диазаадамантан-2,4'-тетрагидропира-ном ) формулы I Соединение I получают конденсацией 2,2-диметилтетрагидропиран-4-она с 1,5-диметил-3,7-диазабицикло[3.3.1] нонан-9-оном (II), полученным гидролизом 3,7-диацетил-1,5-диметил-3,7-диазабицикло[3.3.1]нонан-9-она в солянокислой среде. Последний получают взаимодействием 5,7-диметил-1,3-диазаадамантан-6-она с уксусным ангидридом. Схема синтеза:
Соединение I получают конденсацией 2,2-диметилтетрагидропиран-4-она с 1,5-диметил-3,7-диазабицикло[3.3.1] нонан-9-оном (II), полученным гидролизом 3,7-диацетил-1,5-диметил-3,7-диазабицикло[3.3.1]нонан-9-она в солянокислой среде. Последний получают взаимодействием 5,7-диметил-1,3-диазаадамантан-6-она с уксусным ангидридом. Схема синтеза:
П р и м е р 1. 3,7-Диацетил-1,5-диметил-3,7-диазабицикло[3.3.1]нонан-9-он (III). К 5 г (0,028 моль) 5,7-диметил-1,3-диазаадамантан-6-она прибавляют 25 мл уксусного ангидрида, перемешивают реакционную смесь 30 мин при 70оС и 1 ч при комнатной температуре, затем добавляют 25 мл воды и перемешивают еще 30 мин. Растворитель отгоняют в вакууме, к остатку прибавляют 15 мл холодной воды, фильтруют, осадок промывают 25 мл холодной воды и перекристаллизовывают из воды. Выход 4,6 г (65%); т. пл. 265-266оС; Rf 0,30 (силуфол UV-254 бутанол-уксусная кислота-вода 3:1:1).
Найдено, C 62,03; H 8,00; N 11,25.
C13H20N2O3
Вычислено, C 61,90; H 7,93; N 11,11.
ИК-спектр, ν см-1: 1650 (C=0 амид); 1730 (С=О кетон).
ПМР-спектр (CDCl3) δ м.д. 0,9 с (6Н, 2СН3); 2,9 д (4Н ах, 4СН2N); 3,0 c (6H. 2CH3CO); 3,35 д. (4Н, eq, 4СН2N).
УФ-спектр (96% С2Н5ОН), λмакснм (ε): 204 (6330), 231 (3164).
П р и м е р 2. 1,5-Диметил-3,7-диазабицикло[3.3.1]нонан-9-он (II).
Раствор 5,2 г (0,02 моль) 3,7-диацетил-1,5-диметил-3,7-диазабицикло[3.3.1] нонан-9-она (III) в 50 мл 5 н.соляной кислоты кипятят в течение 5 ч. Затем отгоняют две трети объема растворителя в вакууме и остаток охлаждают, выпавшие кристаллы отфильтровывают и растворяют в 20 мл воды. К полученному раствору прибавляют по каплям 60%-ный водный раствор гидроокиси натрия до рН 10. После охлаждения осадок отфильтровывают и перекристаллизовывают из этилацетата. Выход 2 г (59%), т. пл. 66-68оС, Rf 0,47 (силикагель КСК-гипс, пропанол-вода 7:3).
Найдено, C 64.28; H 9,30; N 16,50.
C9H16N2O
Вычислено, С 64,29; H 9,52; N 16,66.
ИК-спектр, ν, см-1: 1705 (С=О кетон), 3170-3360 (NH).
ПМР-спектр (DMCO-d6), δ м.д. 0,7 с (6Н, 2СН3), 2,7 д.
(4Нах, 4СН2N), 3,2 н. (4Нeq, 4CH2N), 3,35 c. (2H, NH).
УФ-спектр (96% С2Н5ОН), λмакс нм ( ε): 205 (2000), 247 (833).
Мол.вес 168 (масс-спектрометрически).
П р и м е р 3. 2',2',5,7-Тетраметил-6-оксоспиро-(1,3-диазаадамантан-2,4'-тетра-гидропиран) (I). К раствору 0,84 г (0,005 моль) 1,5-диметил-3,7-диазабицикло (3.3.1) нонан-9-она (II) в 15 мл этанола прибавляют 0,8 г (0,007 моль) 2,2-диметилтетрагидропиран-4-она и кипятят в течение 4 ч. Растворитель отгоняют в вакууме, остаток перекристаллизовывают из гексана. Выход 1,1 г (79%), т. пл. 140-141оС Rf 0,62 (силуфол, пропанол вода 7: 3).
Найдено, C 69,36; H 9,20; N 10,12.
C16H26N2O2
Вычислено, C 69,06; H 9,35; N 10,07.
ИК-спектр, ν см-1: 1095 (C-0-C), 1700 (C-O кетон).
ПМР-спектр (CDCl3) δ м.д. 0,9 c (6H, 2CH3); 1,3 c, (6H, 2CH3); 2,1 м. (4Н, 2СН2); 2,8 д. (4Нах, 4СН2N); 3,65 д. (4Нeq, 4CH2N), 3,75 м. (2Н, СН2О).
УФ-спектр (96% С2Н5ОН); λмакс нм (ε ): 205 (291), 258 (2222).
Мол.вес 278 (масс-спектрометрически).
Фармакологические свойства 2', 2',5,7-тетраметил-6-оксоспиро (1,3-диазаадамантан-2,4'-тетрагидропиран) (соединение I) изучали на наркотизированных уретаном с хлоралозой кошках массой 2,5-3 кг.
В качестве аналога по действию избран коронарорасширяющий препарат карбокромен.
Регистрацию объемной скорости коронарного кровотока осуществляли по методу Моравитца и Цана в модификации Н. В. Кавериной.
Сущность метода заключается в измерении объемной скорости крови, проходящей через венечные сосуды сердца за единицу времени, до и после введения исследуемых соединений. Параллельно регистрируется системное артериальное давление в сонной артерии с помощью ртутного манометра.
Исследуемое соединение вводили в бедренную вену в виде водного раствора. Исследования показали, что соединение I обладает способностью улучшать кровоснабжение сердечной мышцы. При введении его в дозе 1 мг/кг наблюдали увеличение объемной скорости коронарного кровотока в течение 80-90 мин.
Указанный эффект начинается через 30-40 мин, затем постепенно нарастает и на 50-60 мин достигает максимальной величины -65±7,6% (Р < 0,05) по сравнению с исходным уровнем.
На этом уровне эффект сохраняется на протяжении 30 мин и более (средние данные 6 опытов).
В аналогичных условиях опыта параллельно изучают влияние карбокромена на объемную скорость коронарного кровотока. Установлено, что карбокромен в дозе 2 мг/кг при внутривенном введении увеличивает коронарный кровоток на 80±8,5% что соответствует литературным данным.
Соединение I в дозах 1 и 10 мг/кг не оказывает заметного влияния на системное артериальное давление.
Общее действие и острую токсичность изучают на белых мышах обоего пола весом 17-20 г. Соединение I вводили внутривенно в дозах 50, 55, 60, 65, 70 мг/кг, карбокромен в дозах 28, 30, 32, 34 и 36 мг/кг. Каждую дозу испытывают на 6-ти мышах. В течение 2-3 ч после введения соединений наблюдали за поведением животных, а через 24 ч производят подсчет погибших и выживших животных. Статистическую обработку результатов проводят по методу Литчфильда и Уилкоксона.
Установлено, что ЛД50 при внутривенном введении для соединения I равна 56,5 (51,9-61,4) мг/кг, а для карбокромена 33 (30-36) мг/кг, (Р 0,05), что соответствует литературным данным.
Сравнительная оценка коронарорасширяющей активности и острой токсичности соединения I и карбокромена дана в таблице.
Описываемое соединение относится к новой гетероциклической системе, обладает коронарорасширяющей активностью и может найти применение в медицине.

2′,2′,5,7 -ТЕТРАМЕТИЛ-6-ОКСОСПИРО-(1,3-ДИАЗААДАМАНТАН- 2,4′ -ТЕТРАГИДРОПИРАН) формулы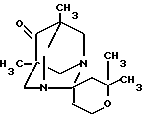
| R.L.Vittory et al | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| chim | |||
| Ital | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
1995-10-10—Публикация
1984-03-23—Подача