Предлагается новое биологически активное соединение, а именно оксалат 1-(2,2-диметилтетрагидропиранилиден-4-амино-окси)-3-(N-фенэтиламино)-2-пропа нола, обладающий коpонаpоpасшиpяющим действием.
Известен гидрохлорид 1-(1,2,3,4-тетрагидронафтилиден-1-аминоокси)-3-(N-3,4-диметоксифенэтиламино) -2-пропанола, который обладает β -адреноблокирующей активностью.
В качестве аналога по структуре и действию известен оксалат 2, 2-диметил-4-(3'-хлор-5'-диметиламино-3'-пентенилокси)тет- рагидропирана, обладающий коpонаpоpасши- pяющим действием. Однако это соединение имеет недостаточно высокую коpонаpо- pасширяющую активность.
Целью предлагаемого изобретения является повышение биологической активности и понижение токсичности.
Эта цель достигается новой химической структурой, описываемой формулой 1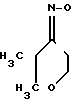 -CH2-
-CH2-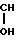 -C
-C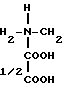 -CH2-
-CH2-
Соединение указанной формулы получают взаимодействием 1-[4-(2,2-диметилтетрагидропиран)оксимино] -2,3-эпоксипро- пана с фенэтиламином в этиловом спирте с последующим осаждением образовавшегося 1-(2,2-диметилтетрагидропиранилиден-4-аминоокси)-3-(N-фенэтиламино)-2-пропа- нола в эфире в виде оксалата 1-[4-(2,2-диметилтетрагидропиран)-оксимино] -2,3-эпоксипропан получают взаимодействием оксима 2,2-диметилтетрагидропиран-4-она с натриевой пылью в среде абсолютного толуола с последующим взаимодействием образовавшегося натриевого производного оксима 2,2-диметилтетрагидропиран-4-она с эпихлоргидpином в среде диметилформамида. По данным ГЖХ 1-[4-2,2-диметилтетрагидропиран)оксимино] -2,3-эпоксипро- пан получается в смеси с оксимом 2,2-диметилтетрагидропиран-4-она (60 и 40% соответственно). ГЖХ осуществлена на приборе "Хром-4" с пламенно-ионизационным дефектом, колонка 120x0,3 см, неподвижная фаза Silicon Elastomer Е-301 (6%) на хроматоне NАW 0,20-0,25 мк.
ГМДC: температура 180оС, газ-носительа -зот, скорость 0,9-1,2 л/ч.
Исходный оксим 2,2-диметилтетрагидропиран-4-она получают взаимодействием доступного 2,2-диметилтетрагидропиран-4-она с гидроксиламином.
Структура полученного соединения подтверждена данными элементного анализа, ИК- и ПМР-спектроскопии. Индивидуальность определена ТСХ на силуфоле "UV-254", проявитель пары йода.
ИК-спектры сняты на спектрофотометре VR-20 (ГДР). ПМР-спектры получены на приборе Т-60 (60 мГц) фирмы "Varian", растворитель-дейтерохлороформ, в качестве стандарта использовался ТМС.
П р и м е р 1. Оксим 2,2-диметилтетрагидропиран-4-она.
Смесь 12,8 г (0,1 моль) 2.2-диметилтетрагидропиран-4-она, 7,76 г (0,11 моль) солянокислого гидроксиламина, 5 мл этилового спирта и 5 мл воды нагревают при перемешивании при 35оС. Затем к этой смеси при перемешивании и комнатной температуре по каплям прибавляют раствор 12,7 г (0,12 моль) углекислого натрия в 25 мл воды. Смесь кипятят в течение 2 ч. По охлаждении выделившийся органический слой отделяют, водный слой экстрагируют эфиром, эфирный зкстракт соединяют с органическим слоем, промывают водой и сушат над безводным сернокислым магнием. После удаления растворителей остаток перегоняют в вакууме, выход 13 г (91%); т. кип. 105оС/5 мм рт. ст. nd20 1,4880; R 0,86 (подвижная фаза: бензол ацетон, 1:6).
Найдено, С 58,44; Н 9,01; N 9,82.
С7Н13О2N
Вычислено, С 58,74; Н 9,09; N 9,79.
П р и м е р 2. 1-[4-(2,2-Диметилтетрагидропиран)оксимино]-2.3-эпоксипропан.
К 2,3 г (0,1 г˙ ат) натриевой пыли в 200 мл абсолютного толуола прибавляют 14,3 г (0,1 моль) оксима 2,2-диметилтетрагидропиран-4-она, растворенного в 50 мл абсолютного толуола. Смесь кипятят до полного исчезновения натрия. После удаления основной части толуола остаток растворяют в 100 мл диметилформамида. К раствору добавляют 9,25 г (0,1 моль) эпихлоргидрина, растворенного в 30 мл диметилформамида. Смесь выдерживают при комнатной температуре в течение 24 ч, затем прибавляют 50 мл воды и экстрагируют хлороформом. Экстракт промывают водой, органический слой высушивают над безводным сернокислым магнием. Получают 14,1 г смеси оксима (5,6 г, 57,5%) и эпоксида (8,5 г 42,5%), т. кип. 89-91оС/1 мм рт. ст. ГЖХ: время удержания оксида 1,2 мин/180оС, исходного оксима 0,7 мин/180оС.
П р и м е р 3. 1-(2,2-Диметилтетрагидропиранилиден-4-аминоокси)-3-(N-фенэтила- мино)-2-пропанол.
Раствор смеси, состоящей из 6 г (0,03 моль) 1-[4-(2,2-диметилтетрагидропиран)оксимино]-2,3-эпоксипропана и 4 г (0,21 моль) оксима 2,2-диметилтетрагидропиран-4-она, 45,3 г (0,045 моль) фенэтиламина в 100 мл этилового спирта кипятят в течение 15 ч. После отгонки растворителя и избытка фенэтиламина конечный продукт перегоняют под низким давлением в токе азота, выход 11,2 г (70,0%); т. кип. 204-205оС/2 мм рт. ст. nd20 1,5290; R 0,85 (подвижная фаза: 25%-ный водный аммиак вода бутиловый спирт этилацетат 1,5: 1,5:9,7; проявитель пары йода).
Найдено, С 67,51; Н 8,63; N 8,94.
С18H28N2O3
Вычислено, С 67,68; Н 8,52; N 8,77.
ИК-спектр, ν, см-1: 1260 (С-О-С); 1590, 1610 (С=С аром.); 1655 (-С=N-); 3040, 3070 и 3090 (=СН аром.); 3300-3400 (-ОН).
ПМР-спектр, δ, м. д. 1,23 [6Н, с(СН3)2] 2,03-2,97 [10Н, м -(СН2-С=N-)2; (-СН2-N )2 и СН2-С6Н5); 3,37-4,17 [7Н, м (-О-СН2)2, СН-ОН и NH); 7,2 (5Н, с -С6Н5).
П р и м е р 4. Оксалат 1-(2,2-диметилтетрагидропиранилиден-4-аминоокси)-3-(N- фенэтиламино)-2-пропанола (1).
К 6,4 г (0,02 моль)-1-(2,2-диметилтетрагидропиранилиден-4-аминоокси)-3-(N-фе-нэтиламино)-2 -пропанола, растворенного в 100 мл абсолютного эфира, добавляют раствор 1 г (0,011 моль) щавелевой кислоты в 150 мл абсолютного эфира. Выпавшие кристаллы отфильтровывают, промывают 20 мл абсолютного эфира, сушат в эксикаторе, выход 6,8 г (91%); т. пл. 148-150оС (ацетон); R 0,35 (подвижная фаза: бутанол уксусная кислота вода 5:3,5:3,5; проявитель пары йода).
Найдено, С 62,61; Н 8,05; N 7,93.
С19Н29N2О5
Вычислено, С 62,44; H 8,00; N 7,67.
Фармакологические свойства оксалата 1-(2,2-диметилтетрагидропиранилиден-4-аминоокси)-3-(N-фенэтиламино)-2-пропан о- ла изучали на наркотизированных уретаном с хлоралозой кошках.
Регистрацию объемной скорости коронарного кровотока осуществляли по методу Моравитца и Цана в модификации Н. В. Кавериной. Сущность метода заключается в изменении объемной скорости крови, проходящей через венечные сосуды сердца за единицу времени до и после применения испытуемых соединений. Параллельно регистрируется системное артериальное давление в сонной артерии с помощью ртутного манометра.
Соединение I вводили в бедренную вену в виде водного раствора. Исследования показали, что это соединение обладает способностью увеличивать кровоснабжение сердечной мышцы. При введении его в дозе 0,1 мг/кг наблюдали увеличение объемной скорости коронарного кровотока в течение 130-140 мин.
Указанный эффект начинался через 35-40 мин, затем постепенно нарастал и на 60-ой минуте достигал максимальной величины 112,2 (11,9%) (Р < 0,01) по сравнению с исходным уровнем. На этом уровне эффект сохранялся на протяжении 70 мин и более (средние данные 6 опытов).
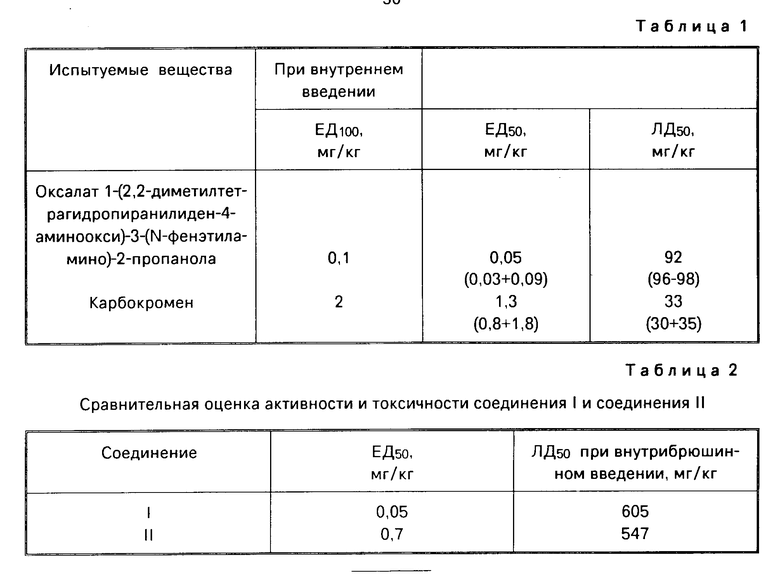
В аналогичных условиях опыта параллельно изучали влияние известного препарата карбокромена на объемную скорость коронарного кровотока. Опыты показали, что карбокромен в дозе 2 мг/кг увеличивает коронарный кровоток на 80±8,5%
Соединение I в дозах 0,1 и 2 мг/кг не оказывало заметного влияния на системное артериальное давление.
Далее влияние соединения 1 изучали на коронарном кровотоке в условиях экспериментального спазма венечных сосудов сердца, вызванного питуитрином (3,5 ед/кг). Спазм продолжался в течение 20-25 мин.
Опыты показали, что соединение 1, введенное в дозе 0,1 мг/кг, за 50-60 мин до введения питуитрина, предупреждает развитие спазма венечных сосудов сердца. Аналогичный эффект наблюдается при введении карбокромена в дозах 0,5-2 мг/кг.
Определяли также дозу испытуемого соединения, вызывающую коронарорасширяющий эффект у 50% подопытных животных (ЕД50). Испытуемое соединение вводили внутривенно. Исследования проводили на 17 кошках в дозах 0,025, 0,05, 0,075 и 0,1 мг/кг. Статистическую обработку результатов проводили по методу Литчфильда и Уилкоксона.
Установлено, что ЕД50 для соединения I равняется 0,05 (0,03-0,09) мг/кг. Параллельно вычисляли ЕД50 для карбокромена. Препарат вводили внутривенно в дозах 0,5; 1; 1,5 и 2 мг/кг. Каждую дозу испытывали на 6 кошках. Установлено, что ЕД50 карбокромена равняется 1,3 (0,8-1,8) кг/кг.
Общее действие и острую токсичность изучали на белых мышах обоего пола весом 17-25 г. Испытуемое соединение вводили внутривенно в дозах 80; 85; 90; 95; 100 и 105 мг/кг, а карбокромен в дозах 28; 30; 32; 34; 36 мг/кг. Каждую дозу испытывали на 6 мышах. В течение 2-3 ч после введения соединений наблюдали за поведением животных, а через 24 ч подсчитывали погибших и выживших животных. Статиcтическую обработку проводили по методу Литчфильда и Уилкоксона.
Установлено, что ЛД50 при внутривенном введении для соединения 1 равняется 92 (86-98) мг/кг (Р 0,05), а для карбокромена 33 (30+35) мг/кг (Р 0,05). Таким образом, соединение I обладает длительной коpонаpоpасшиpяющей активностью и менее токсично, чем карбокромен.
Сравнительная оценка коронарорасширяющей активности и острой токсичности оксалата 1-(2,2-диметилтетрагидропиранилиден-4-аминоокси)-3-(N-фенэтиламино)-2- пропанола с карбокроменом приведена в табл. 1.
При сопоставлении данных биологических испытаний соединения 1 и аналога по структуре и действию оксалата 2,2-диметил-4-(3'-хлор-5'-диметиламино-3'-пентени- локси)тетрагидропирана (II) видно, что соединение I увеличивает объемную скорость коронарного кровотока в дозе 0,1 мг/кг (ЕД50 0,05 мг/кг) на 112,2 ±11,9% в то время как известное соединение увеличивает коронарный кровоток на 100±13,2% лишь в дозе 1 мг/кг (ЕД50 0,7 мг/кг), что свидетельствует о большей эффективности соединения 1. При изучении влияния оксалата 1-(2,2-диметилтетрагидропиранилиден-4-аминоо кси)-3-(N-фенэтиламино)-2-пропанола на коронаpный кровоток при предварительной перевязке левой нисходящей артерии сердца у кошек оказалось, что соединение I подобно соединению II увеличивает коронарный кровоток, однако этот эффект соединения I наблюдается в дозе 0,1 мг/кг, а у соединения II в дозе 1 мг/кг, что также подтверждает эффективность соединения I.
Острая токсичность соединения I при внутривенном введении составляет 92 (86-98) мг/кг, однако для сопоставления с оксалатом 2,2-диметил-4-(3-хлор-5-ди- метиламино-3-пентенилокси)тетрагидропи- рана острую токсичность дополнительно определили при внутрибрюшинном введении. Оказалось, что ЛД50 со единения I при внутрибрюшинном введении равна 605 мг/кг, а соединения II равна 547 мг/кг, т. е. соединение I менее токсично.
Таким образом, соединение I намного активнее и менее токсично, чем оксалат 2,2-диметил-4-(3-хлор-5-диметиламино-3-пенте- нилокси)тетрагидропирана.
Данные сравнительных испытаний представлены в табл. 2.
Оксалат-1-(2,2-диметилтетрагидро пиранилиден-4-аминоокиси)-3-(N-фенэтиламино)-2-пропанола формулы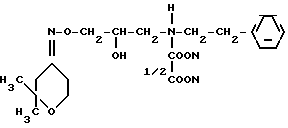
обладающий коронарорасширяющим действием.
| Витониль Р.О., Кименис А.А | |||
| Фармакологические исследования нового коронарорасширяющего препарата - карбокромена | |||
| Изв | |||
| АН Латвийской ССР, 1971, N 4, с.84-88. |
Авторы
Даты
1995-11-27—Публикация
1983-03-17—Подача