I
Изобретение относится к способам получения производных (,4p,5t)i, 6ао(.)гексагидро-5-окси-4-оксиме- тил-2Н-циклопента J3-фуран-27она общей формулы
и°
YO
ОХ
(1)
Z - водород, тетрагидропиранил, 2-метокси-2-пропил,метокси- этоксиметил или трет ,-бутил- диметилсилилгруппа,
У - водород или КСО-группа,где R - алкил, содержапщй 1-2
или С,Н С,Н- 6 5 6 4
атома углерода,
группа.
Указанные вещества общей формулы 1 являются ключевыми промежуточными продуктами при синтезе всех основных типов простагландинов, их производных и аналогов, модифицированных в альфа- и омега-цепи, Простагландины как тканевые гормоны показывают широкую и незаменимую
06276
биологическую активность. В последние годы они применяются в медицине в акушерстве и гинекологии, при лечении заболеваний обмена крови, 5 желудочных заболеваний и в других областях. В ветеринарной медицине они нашли широкое применение при управлении течкой сельскохозяйственных животных и родов у свинома10. ток. I
Известен способ, согласно которому 5-хлор-2-оксибицикло (2,2,1) г.еп- тан-7-карбоновую кислоту путем окиJ5 сления м-хлорнадбензойной кислотой переводят в соответствующий S-лак- тон, который под воздействием хлор- муравьиноэтилового эфира образует смешанный ангидрид. При восстанов20 лении этого ангидрида натрийборгид- ридом первоначальная карбоксильная группа восстанавливается в гидрок- сил, который защищается в форме ТГП-производного. Полученный 8-лак25 тон воздействует гидроокиси натрия и перекиси водорода переводится в Y-лактон, а из него - в спирт Кори. Схема синтеза включает следующие реакции:
Н02С
РВРСО 10
РВРСб И
3кипение с хлористоводородной кислотой, 1 ч,
4окисление 3-хлорнадбензойной кислотой,
5этилхлорформиат, триэтиламин в эфире,
6 натрийборгидрид в этаноле при -20 С,
7 дигидропиран в присутствии р-то- луолсульфоновой кислоты, 8 водный раствор гидроокиси натрия, перекись водорода.
9р-фенилбензоилхлорид в пиридине,
10смесь тетрагидрофуран-вода-уксус ная кислота.
Альтернативным синтезом по способу 2 переводят 5-бром-2-оксо- бицикло(2,2,1)гептан-7-карбоновую кислоту путем воздействия перук- сусной кислоты в 8-лактон, из которого посредством двух расщеплений - воздействием бромистоводород- ной кислоты в уксусной кислоте и
3 N
II РВРСО
206276
последующей реакцией с гидроокисью натрия получают у-лактонкислоту. Эту кислоту воздействием р-бром- фенацилспирта переводят в сложный г эфир, далее защищают второй гидрок- сип в форме р-фенилбензоилпроиз- водного, на следующей ступени выделяют воздействием цинка из уксусной кислоты опять кислоту и осуществля- восстановление дибораном. Схема синтеза:
10
1азеотропная бромистоводородная кислота и уксусная кислота,
2надуксусная кислота,
3бромистоводородная кислота и уксусная кислота,
4водный раствор гидроокиси натрия
5р-бромфенацилалкоголь,
6р-фенилбензоилхлорид в пиридине,
7цинк в уксусной кислоте,
8восстановление дибораном.
Однако оба известных метода обладают некоторыми недостатками для промьшшенного внедрения синтеза спирта Кори. В обоих случаях невыгодно восстановление карбоксильной группы. Синтез осуществляется с относительно дорогостоящими и врными для здоровья химикатами (хлормуравьиноэтиловый эфир, ди- боран, р-бромфенацилалкоголь. Кроме того, в ряде ступеней из реакционной среды трудно вьщелить требуемый продукт - часто при этом необходим хроматографический метод
К -СН2СОСбН Вп
Предлагаемый способ получения
соединения общей формулы 1 состоит
в том, что на алкилэфир 5-гапоген-2-кетобицикло (2,2,l) гептан-7-кар4Q боновой кислотц общей формулы
45
где R - О -С -алкил,
А - хлор или бром, действуют спиртом в присутствии кислоты и органического растворителя (например, бензола, толуола и хлорированных алканов), а возникшую при реакции воду отгоняют азеотропно или удаляют высушиванием Над неорганическим соединением, после окончания реакции кислоту удаляют из реакционной смеси праймущественно кислым углекислым натрием, потом отгоняют растворители и возникший каталь общей формулы
(III)
где R - С -С -алкил или К-+Кз вмес-те означает (CHj)-группу, где , переводят действием ком- плексного гидрида (молярное соотношение 1:0,5-2) при температуре 0+30 С в соответствующий спирт общей формулы
(IV)
где К„ и А имеют указанное значение а затем при кислом катализе удаляют защитную группу Rg. Эту операцию осуществляют или смесью вода+вода смешиваемого органического растворителя в присутствии неорганической кислоты, или транскатализацией низшим кетоном в кислой среде сильной органической кислоты например, бензолсульфоновой, толуол- сульфоновой, или с помощью ионита при повьш енной температуре.
Полученный данным методом кристаллический 5-галогён-7-окси-метил- бицикло(2,2,1)гептан-2-он общей формулы
1206276
(V)
где А имеет указанное значение, перед дальнейшими операциями защищают на гидроксильной группе заместителем 2, где 2 имеет указанное значение. Защищенное таким образом производное кетона окисляют с помощью органической надкислоты (например, надуксусной, м-хлорнадбензой- ной) в присутствии слабощелочных веществ( например, кислого углекислого натрия, уксуснокислого натрия), а изолированный из реакционной смеси кристаллический S-лактон общей рмулы
ZO
25
(VI)
0
где А и Z имеют указанное значение, действием смеси гидроокиси щелочного металла и перекиси водорода пере- водят в требуемый продукт общей формулы 1, где У - водород, а 2 имеет указанное значение. Из этого вещества реакцией с соответствующим ацил- хлоридом в присутствии третичного амина или замещенного фенилизо- цианата получают продукт общей формулы 1, где У имеет указанное значение.
Схема синтеза и краткое описание условий реакции предлагаемого способа следующие:
л
«Д
о. J
YOY6
8
oz «Д
о.
oz 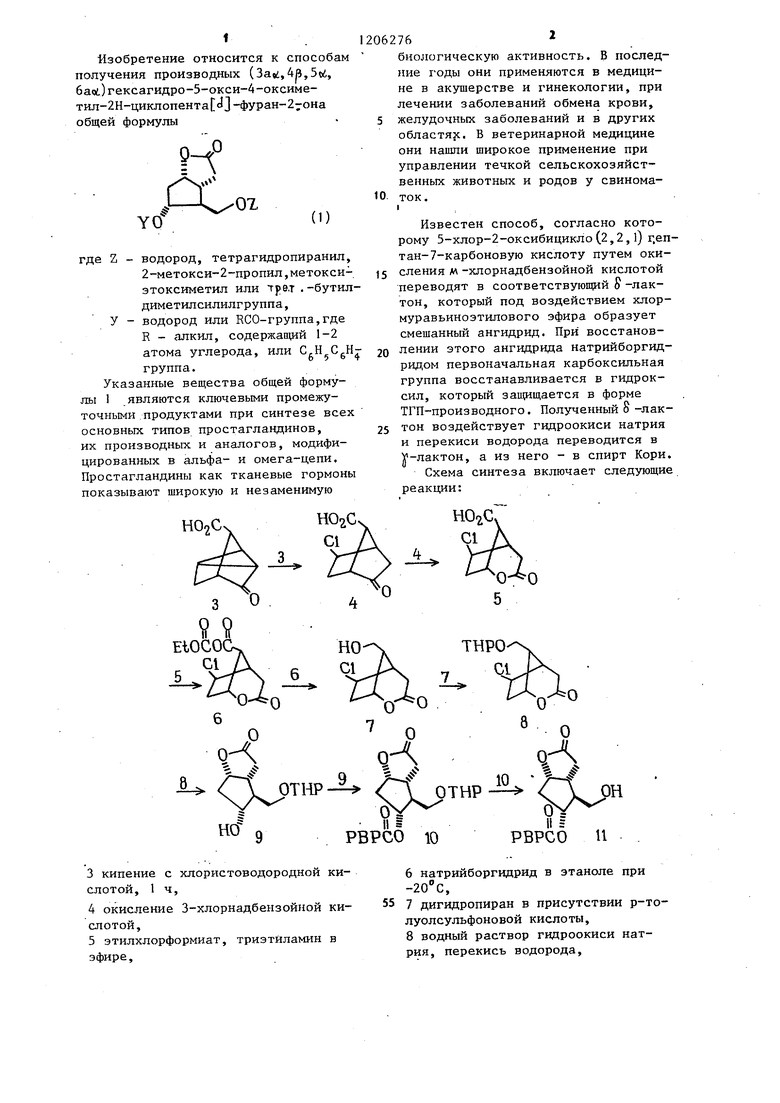





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения аналогов простагландинов @ | 1979 |
|
SU1104134A1 |
| Способ получения 5-галоген-7-оксиметил-бицикло(2,2,1)гептан-2-она | 1980 |
|
SU1142466A1 |
| Способ получения производных гексагидро-5-гидрокси-4-гидроксиметил-2Н-циклопента( @ )-фуран-2-она | 1982 |
|
SU1698253A1 |
| Эфиры 5-хлор-2-кетобицикло/2,2,1/-гептан-7-карбоновой кислоты и способ их получения | 1979 |
|
SU962281A1 |
| Способ получения производных 2-пенем-3-карбоновой кислоты в виде свободной кислоты или ее защищенных производных,или ее солей | 1979 |
|
SU925252A3 |
| Способ получения производных циклопентана | 1975 |
|
SU645564A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОКСАЗОЛОНА | 1990 |
|
RU2036913C1 |
| Способ получения 3-(4-аминоэтоксибензоил) бензо( @ )тиофенов или их солей | 1982 |
|
SU1155157A3 |
| 1S,3R-2,2-ДИМЕТИЛ-3-(2-МЕТИЛ-2-ОКСИПРОПИЛ)ЦИКЛОПРОПАНКАРБОНИТРИЛ В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ В СИНТЕЗЕ ПИРЕТРОИДНОГО ИНСЕКТИЦИДА-ДЕЛЬТАМЕТРИНА И СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 1989 |
|
RU1679761C |
| Способ получения имидов карбоновых кислот, их право-или левовращающих изомеров или их солей | 1975 |
|
SU665803A3 |

1алкоголь, р -толуолсульфоновая кислота,
2комплексный гидрид, литийалюмо- гидрид,
3ацетон, кислый катализ, вода,
4защитный реактив,
5надбензойная кислота -м-хлор, или надуксусная кислота,
6гидроокись лития или натрия, перекись водорода,
7р-фенилбензоилхлорид, щелочная среда,
8реактив относительно заместителя И , удаление защитной группы.
При синтезе по предлагаемому способу практически нет необходимости применять хроматографию для выделения и очистки отдельных промежуточных продуктов. Отдельные содинения очищаются простой кристаллзацией. Существенным преимуществом является относительно легкодоступное и дешевое сырье, а далее то, что синтез можно осуществлять в больших объемах на несложном оборудовании. Высокий выход продуктов на отдельных стадиях синтеза, экономия электроэнергии и снижение трудоемкости делают выгодным предлагаемый способ и с экономической точки зрения.
Пример 1. Диэтилкетапь изо- пропилэфира 5-бром-2-кетобицикло (2,2,1)гептан-7-карбоновой кислоты формулы III (Н2(СНз)2 СН-; :.- ).
К раствору бромкетоэфира формулы II (Н,(СНз)2СН-, )(44,5 г) и этилового эфира (40 мл) и 300 мл бензола добавляют 0,3 г р-толуолсуль фоновой кислоты и после 8-часово- го кипения с применением азеотроп- ной надставки отделяют рассчитанное количество реакционной воды. Потом
5
0
5
0
5
0
5
0
5
смесь охлаждают, кислоту нейтрализуют твердым кислым углекислым натрием, твердые части отсасывают на воронке, бензольный слой промывают насыщенньм раствором поваренной соли и сушат сульфатом магния. После отгонки растворителей получают 56,3 г кристаллического продукта с т.пл. 49-51°С, из которого после перекристаллизации из смеси изопропиловый спирт - вода получают чистое вещество формулы III/ В масс-спектре обнаружены характеристические виды ионов с величиной m/Z 348/350, 333/335, 289/291, 268 и 209, в ИК- спектре полоса при 1726 см подтверждает присутствие эфирной группы, а полосы 1365, 1385 см (деформационное колебание СН) подтверждает присутствие (СНз)2 СН-группировки.
П р и м е р 2. Этиленкеталь метилового эфира 5-хлор-2-кетобицикло (2,2,1)гептан-7-карбоновой кислоты формулы III ( R,+R,-(CH)g-; ).
Из смеси соответствующего хлор- кетоэфира формуоуы II (, R СНд) (88,5 г), этиленгликоля (27 мл, 700 мл бензола и 0,58 г р-толуол- сульфоновой кислоты на азеотропной надставке отгоняют реакционную воду (8 мл). После охлаждения реакционную смесь промывают раствором кислого углекислого натрия, насыщенным раствором поваренной соли, а органический слой сушат сульфатом магния.
После испарения растворителей остаток дистилляции закристаллизовы- вается. Перекрист аллизацией из смеси вода - метиловый спирт получают 98,6 г (91,5%) продукта с-т.пл. 64-66 С.
Вычислено, %: С 53,56, Н 6,13, С1. 14,37
(246,7)
..9
Найдено, %: С 53,42, И 6,31, С1 14,25
В ИК-спектре полоса при 1717 см подтверждает присутствие эфирной группы.
И р и м е р 3. Диэтилкеталь 5- -бром-7 оксометилбицикло(2,2,1)геп тан-2-она формулы IV (,А.Ъ
К эфирному раствору каталя бром кетоэфир. формулы III (Е( R CgHj-, ) (34,9 г) в 600 мл абсолютного эфира при температуре от -30 до -10°С добавляют 276 мл эфирного раствора литийалгамогид- рйда (0,36-молярньй раствор), соответствующий 6,24 г, в течение 20 мин. После 2-часового перемешивания при данной температуре реак- ционную смесь разлагают 20 мл этилового спирта и, наконец, 200 мл приблизительно 2н. бромистоводород ной кислоты. Эфирный слой отделяют сушат сульфатом магния, растворители отгоняют. Маслянистый остаток (28,6 г) содержит на основе газожикостной хроматографии 97,8% соот- ветствугощего продукта формулы IV.
Вычислено, %: Вг 27,26
,jBr03 (293,2)
Найдено, %: Вг 26,94
В НК-спектре полосы При 3610, 3440-3530 см подтверждают присутствие гидроксильной группы, а 1078 - эфирной группировки.
П р и м е р 4. Этиленкеталь 7- -оксиметил-5-хлорбицикло(2,2,1)геп тан-2-она формулы IV ((СЕ ).
К эфирному раствору хлоркеталь- эфира формулы III (80 г) в 1400 мл безводного эфира нрикапывают при температуре от -15 до 5 С 45,6 мл эфирного раствора литийалюмогидрид (раствор содержит в общем 0,34 мол литийал иомогидрида), соответствующего 12,92 г. После 3-5-часовой реакции к реакционной смеси добавляют 37 i-uj этилового спирта и, наконец, 2н. соляную кислоту.. При об |работке согласно примеру 3 получаю 70,8 г маслянистого продукта, который закристаллизовывается. С помщью газожидкостной хроматографии определяют, что чистота этого продукта 99,5%.
Вычислено, %: С1 16,12
С,,Н,5С10 (218,7) .Найдено, %: С1 16,31
10
В масс-спектре присутствие ионов с величиной Wz 218/220, 183/185, 174/176, 13$ и в ИК-спектре присутствие полос 3610, 3440-3540 см,
соответствуюпц х гидроксильной группе, находится в соответствии с предложенной структурой.
П р и м е р 5. 5-Бром-7-окси- метилбицикло(2,2,1)гептан-2-он
формулы V ().
Смесь бромкеталкоголя формулы IV ( R CgH5-) (2,93 г), 50 мл азеотропной бромистоводород- ной кислоты и 20 мл воды нагревают
4-6 ч при кипении. После отгонки бромистоводородной кислоты при пониженном давлении остаток дистилляции экстрагируют 2 30 мл хлороформа, хлороформовый раствор
промывают 3 мл 2%-ного водного раствора кислого углекислого натрия, 5 мл насыщенного раствора поваренной соли и сушат сульфатом магния. После испарения растворителей ,маслянистый остаток закристаллизовы- вается. Перекристаллизацией из смеси бензол-циклогексан получают 1,79 г кристаллического нродукта с т.пл. 87-89°С.
Вычислено, %: С 43,86, Н 5,06, Вг 36,, 48
CgH,,BrOg (219,1) Найдено, %: С 43,52, Н 5,18, Вг 36,16
Б ИК-спектре полоса 1735 см подтверждает присутствие СО-группы,
а полосы при 3605 и 3450-3540см соответствуют ОН-группе.
Пример 6. 7-Оксиметил-5- -хлорбицикло (.2,.2, 1) геп.тан-2-он формулы V ().
Смесь 1 г хлоркетоалкоголя формулы IV (, E,(), 16 мл ацетона и 30 мг р.-толуол- сульфоновой кислоты нагревают в те- чение 20 мин при кипении, а после охлаждения кислоту нейтрализуют кислым углекислым натрием. Твердые части отсасывают на воронке, промы- вают ацетоном и выпаривают растворители. При перекристаллизации остатка дистилляции из бензола получают 0,66 г продукта .пл. 81
82° С.
Вычислено, %: С 55,02, Н 6,35, CI 20,30
CgH,,C102 (174,6)
11
Найдено, %: С 55,13, Н 6,42, С1 20,05
В масс-спектре обнаружены виды ионов с величиной т/ 174/176, 138, 120, 114, 112, 101, 96, 95, 9.3, 92, 81, 79, 77, 65.
В ИК-спектре полосы, соответствующие ОН-группе при 3600 и 3440- 3540 , и кетоны при 1738 .
П р и м е р 7. (ot,2j,,5jb)S- -Лактон(3-окси-5-хлор-2)тетрагид- ро-пиран-2-илоксиметил(циклопент- -1-ил)уксусной кислоты формулы VI (, ).
К раствору 30 г хлоркетоалкого- ля формулы V () и 130 мг безводной р-толуолсульфоновой кислоты в 100 мл дихлорметана при перемешивании и внешнем охлалсдении льдом и,водой добавляют по каплям 31,4 м дигидропирана. Спустя 45 мин реакц прекращают добавлением насыщенного водного раствора кислого угле- кислого натрия, водный слой отделяют, а органический слой сушат сульфатом магния, растворители испаряют. Маслянистый продукт (48,2 г) растворяют в 680 мп .дихлорметана и при внейнем охлаждении льдом и водой постепенно добавляют 48 г .и-хлорнадбензойной кислоты и 36 г кислого углекислого натрия. Эту реакционную смесь спустя 12ч разлагают избытком кислого углекислого натрия, органический слой отделяют и промывают насыщенным водным расвором сульфата натрия (отрицательная реакция на йод-крахмальньй бумажный индикатор). Потом органический слой сушат сульфатом магния, растворители отгоняют, а остаток после перекристаллизации из смеси бензол-циклогексан составляет 39 г кристаллического продукта с т.пл. 46-50°С.
Вычислено, %: С1 12,91
С„Н„С104 (274,8)
Найдено, %: С1 13,07
Масс-спектр содержит ввды ионов при т/г 274/276, 219, 173/175, 137, 129, 109, 101, 93, 85, а в ИК-спектре полоса при 1745 см соответствует 8 -лактоновой группировке.
Пример 8. (lot, 1р,3«,5р) - 8-:Лактон 5-бром-З-окси)2-метокси- проп-2-ипоксиметш1 (циклопент-1- -ил)уксусной кислоты формулы V (. ; ).
206276
К раствору 2,19 г бромкетоалко- ГО.ЦЯ формулы V () и 10 мг р-толуолсульфоновой кислоты в 50 мл дихлорметана при перемешивании 5 и охлаждении добавляют 1,1 г изо- пропенилметилэфира в течение 5 мин. После обычной обработки смеси согласно примеру 7 получают 3,05 г маслянистой жидкости, которую раст- 10 воряют в 50 мл дихлорметана и при внешнем охлаждении водой к этому раствору постепенно добавляют 2,8 г м -хлорнадбензойной кислоты и 2,5 г кислого углекислого натрия, 15 и, наконец, перемешивают в течение 10 ч при комнатной температуре, После обработки согласно примеру 7 получают 1,95 г 97,5%-ного по. данным ГЖХ маслообразного продук- 20 та.
Вычислено, %: Вг 26,01 .rO. (307,2) Найдено, %: Вг 26,45 Молекулярный вид иона с m/Z 25 306/307 относительной интенсивности 1,2/1,2 %и присутствие полосы 1738 см в ИК-спектре подтверлсда- ет структуру вещества.
П р и м е р 9. (Зао,4й,5о;, баы) - 3Q -Гексагидро-5-окси-4-(тетрагидро- -2Н-пиран-2-илокснметил -2Н-цикло- пента Ь фуран-2-он формулы 1 ( ).
к раствору 150 мгS-лактона в 5 мл тетрагидрофурана добавляют 3,5 мл концентрированной перекиси водорода, а после 20-минутного перемешивания добавляют 2,2 мг гидроокиси лития в 3,5 мл воды. По истечению одного часа реакционная смесь выливается в 60 мл этилацетата, а избыточное количество перекиси полностью удаляют добавлением насыщенного раствора сульфита натрия (температура смеси ), органический слой отделяют и высушивают ;сульфатом магния. Затем на ротационном испарителе отгоняют растворители, а полученный маслянистый остаток (.120 мг) на основании данных газожидкостной хроматографии содержит 98,5% требуемого продукта. Присутствие полосы 1785 см в ИК- спектре и ионов с m/Z 240, 222, 139, 137, 121, 01 и 85 в масс-спектре 55 находится в соответствии с предложенной структурой.
Пример 10. (Зао, 4p,5oi,6ao(;)- -Гексагидро-5- (l,1-бифенил-4-кар35
40
45
13
бонилокси)-4-оксиметил-2Н-циклопен- ) фуран-2-он формулы 1 (У Се НдСбН СО-, ).
К раствору 8,1 г -лактона формулы 1 (, ), растворенного в 50 мл сухого пиридина, добавляют 6,85 г п-фенилбензоилхлорида. и после 2-6-часового перемешивания при комнатной температуре к реакционной (:меси добавляют 1 мл воды и перемешивают еще 30+10 мин. После отгонки пиридина на вакуумном ротационном испарителе к остатку дистилляции добавляют 100 мл хлороформа и отделяют водный слой, органический слой промывают насьпценным водным раствором кислого углекислого натрия, водой, сушат сульфатом натрия и отгоняют органические растворители. Маслянистый остаток дистилляции (13,5 г) растворяют в 160 мл ацетона и после добавления 10-15 мл 1 М соляной кислоты вьщер- живают при комнатной температуре еще 4-10 ч. Потом нейтрализуют кислоту перемешиванием с твердым углекислым натрием, твердые частицы отсасывают, промывают ацетоном и из соединенных ацетоновых растворов отгоняют ацетон на ротационно м вакуумном испарителе. Остаток дистилляции экстрагируют хлороформом (в общем 300 мл), экстракт промывают водой, сушат сульфатом магния и выпаривают досуха. Кристаллизацией из смеси дихлорметана и петролейного эфира (2:1) получают 6,79 г (61%) вещества формулы 1 с т.пл. 124- 25°С,
Вычислено, %: С 71,58, Н 5,72
СгЛо05(352,4)
Найдено, %: С 71,34, Н 5,82. -Масс-спектр содержит ионы c.tn/Z 352, 279, 256, 199, 198, 181, 167, 139, а полоса в ИК-спектре 1785 см соответствует валентному колебанию СО-группы в I-лактоне. 3595, 3420, 3535 и 1055 см соответствуют гид- роксильной группе и находятся в соответствии с предложенной структурой.
Пример П. (U,2p,3ot,5()8- -Лактон-3-гидрокси-5-хлор-2- меток сиэтоксиметилоксиметилциклопент-1- -ял)уксусной кислоты формулы VI |(, ::СН.,ОСН,,).
К раствору 1 ,75 г хлорке то алкоголя V () в 15 мл ацетонитрила
206276
добавляют раствор 2,26 г метокси- этоксиметилтриэтиламмонийхлорида в 15 мл того же растворителя при 20- 25 С (ход реакции наблюдают при по5 мощи тонкослойной хроматографии). По истечении 30 мин вьделенный триэтиламингидрохлорид отсасывают растворители отпаривают на ротационном вакуумном испарителе темпе10 ратура ванны 40-45°С при давлении 5-5,2 кПа) . К дистилляционному остатку добавляют 10 мл воды и производят экстрагирование 3 раза 10 мл 1,2-дихлорэтана. Соединенные экст15 ракты высушивают сульфатом магния и после отпаривания растворителя получают 2,13 г маслянистого продукта, который растворяют в 30 мл того же растворителя и при внешнем
20 охлаждении льдом и водой добавляют 2,4 г м-хлорнадбензойной кислоты и 1,8 г двууглекислого натрия. После 10-часового перемешивания при 20-25°С добавляют избыток двуугле25 кислого натрия, органический слой , отделяют и промывают 3 раза 3 мл насыщенного раствора сульфита натрия (до негативной реакции йодокрах- мального раствора)..
После высушивания органического раствора сульфатом натрия отпаривают растворители и кристаллизацией остатка из смеси гексан-бензол получают 1,82 г воскообразного продукта общей формулы VI (, Ъ СН осилен20СН2), который на основании данных газожидкостной хроматографии содержит 95,5% требуемого продукта.
Вычислено, %: С1 13,29 С,2Н,,С105(266,7) Найдено, %: С1 13,03 Виды ионов т/ 226/228 (молекулярный ион) и полоса 1735 съГ в ИК-спектре подтверждают предложенную структуру.
Пример 12. (1о,,2/3,3ог,5/)6- -Лактон-3-гидрокси-5-бром-2-(треТ.- бутилдиметилсилилоксиметилцикло- пент-1-ил)уксусной кислоты формулы
50 VI (, г(СНд)зС(СН ) Si).
к раствору 2,29 г бромкетоалко- голя формулы V () и 1,65 г Трете .-бутилдиметилсилил хлорида в течение 10 мин прикапывают 1,21 г
55 триэтиламина и 50 г 4-диметштами- нопиридина в 5 мл дихлорметана. После часового перемешивания в атмосфере азота реакционную смесь про30
40
45
15
268, 217/219, 203/205, 131, Ь полоса при 1741 см в ИК-спекмывают 3 мл воды, 5 мл насьщенно- го раствора хлористого аммония и высушивают сульфатом магния. После отпаривания растворителей на рота- ционном вакуумном испарителе получают 3,08 г маслянистого продукта, который после растворения в 40 мл дихлорметана окисляется м-хлорнад- бензойной кислотой при условиях,указанных в примере 7. После аналогичной обработки реакционной смеси получают 2,34 г маслянистого продукта которьй на основании данных газожидкостной хроматографии содержит 96,3% требуемого продукта.
Вычислено, %: Вг 22,87
(349,4)
Найдено, %: Вг 22,12
В масс-спектре ионы с т/ 348/35
145 и -спектре
соответствуют СО-группе в Jf -лакто- не и находятся в соответствии с преложенной структурой.
Пример 13. {3ac,4,5oi,6a(v;) Гексагидро-5-грщрокси-4-(метокси этоксиметилоксиметил)-2Н-циклопента Ь фуран-2-он формулы 1 ,, где , И СН ОСЫ2Х:Н20СНг.
К раствору 1,5 г 6 -лактона формулы VI (, г СНзОСН2СНгОСНг)в 50 мл I,2-дихлорэтана добавляют 35 мл концентрированной перекиси водорода и после 10-15-минутного перемешивания добавляют раствор 22 мг гидроокиси лития в 35 мл воды. После обработки реакционной смеси, как указано в примере 9, получают 1,05 г воскообразного продукта, который на основании данных газожидкостной хроматографии содержит 94,2% требуемого Продукта.В ИК-спектре полосы 1783 (колебание СО в -лактоновой группировке), 3596, 3450-3500.и 1106 (валентное и деформационное колебание гидроксильной группы), 1063 и 1085 см Чколебание С-О-С) находится в соответствии с предпоженной струк урой.
Пример 14. (Заа:,4,5ог,6аоб) Гексагидро-5-гидрокси-4-( тр&т/.-бу- тилдиметилсилоксиметил)-2Н-циклопен та Ь фуран-2-он формулы I, где , Z(CH),C(CH,)2.
к раствору 500 мг 8 -лактона формулы VI (, Z(CE)C(CE)Si}, растворенного в 15 мл тетрагидро06276
фурана, добавляют 10 мл 30%-ной перекиси водорода и после 15-минутио- го перемешивания добавляют 7,1 мг гидроокиси лития, растворенной в 5 10,5 мл воды. После обработки реакционной смеси, как указано в примере 9, получают 324 г маслообразного продукта, который на основании данных газожидкостной хроматографии
О содержит 96,5% требуемого продукта: Наличие полосы 1785 , соответствующей у-лактоновой группировке, 3598 и 1095 см колебания гидрок- снльной группы и молекулярный ион с 15 величиной гя/Z 286 подтверждают предложенную структуру.
П р и м е р 15. (3,ао/,4й,5о/, 6ас) Гексагидро-5-ацетилокси-4-гидрок- симетил-2Н-циклопента Ц фуран-220 -он формулы 1, где y CHjCO, Е Н. К раствору 350 мг соединения формулы 1, где , Z()C, растворенного в 3 мл пиридина, добавляют 210 мг ацетилхлорида и по25 еле 4-часового перемешивания к реакционной смеси добавляют 0,1 мп воды и перемешивают еще 30 мин. Потом избыток пиридина отпаривают на ротационном вакуумном испарителе и
30 дистилляционный остаток экстрагиру- . ют 2 раза 3 мл хлороформа. Соединение органические фазы промывают насьш1;енным раствором кислого углекислого натрия,, водой, высушивают
35 сульфатом магния и отпаривают растворители. К маслянистому остатку добавляют 2,5 мл разбавленной уксусной кислоты (1:2), и после 6-часового перемешивания после ком40 натной температуры реакционную
смесь частично нейтрализуют и, наконец, зкстрагируют 4 раза 5 мл хлороформа. Соединенные органические экстракты высушивают сульфатом
45 магния, растворители отпаривают и путем хроматографирования остатка на колонке силикагеля получают 156 мг маслообразного продукта с
RP 0,42 в этилацетате и с
Rr 0.61
в смеси этилацетат-метанол (6:1) на пластинке силикагеля.
Вычислено, %:-С 56,07, Н 6 59
СЛО (214,2)
Найдено, %: С 56,17, Н 6,72 Присутствие полосы 1780 см (-лак- тон) и видов ионов с m/Z 214, 156, 154, 139, 60, 59 подтверж ча - ет предложенную структуру.
| Патент ГДР P,S 129652, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1986-01-23—Публикация
1980-09-24—Подача