ксильная труппа, а А, В, Y и п имеют указанные значения, который или выделяют или переводят в сложный эфир.
2,Способ ПОП.1, отличающийся тем, что целевой продукт переводят в сложный эфир воздействием на соединение формулы I, где X - окси группа, диазоалканом или оксирановым производным в апротонном растворителе
3.Способ ПОП.1, отличающийся тем, что целевой продукт
134 ,
переводят в серебряную соль соединения формулы I, где X - ОН, а затем в сложный эфир обработкой, апкилирующим средством.
4. Способ ijon.l, отличающийся тем, что восстановление лактона общей формулы II проводят с помощью диизобутилаЛюмогидрида или натрий-бис(2-метоксиэтокси)алгомогидридом при температуре от О до 80°С.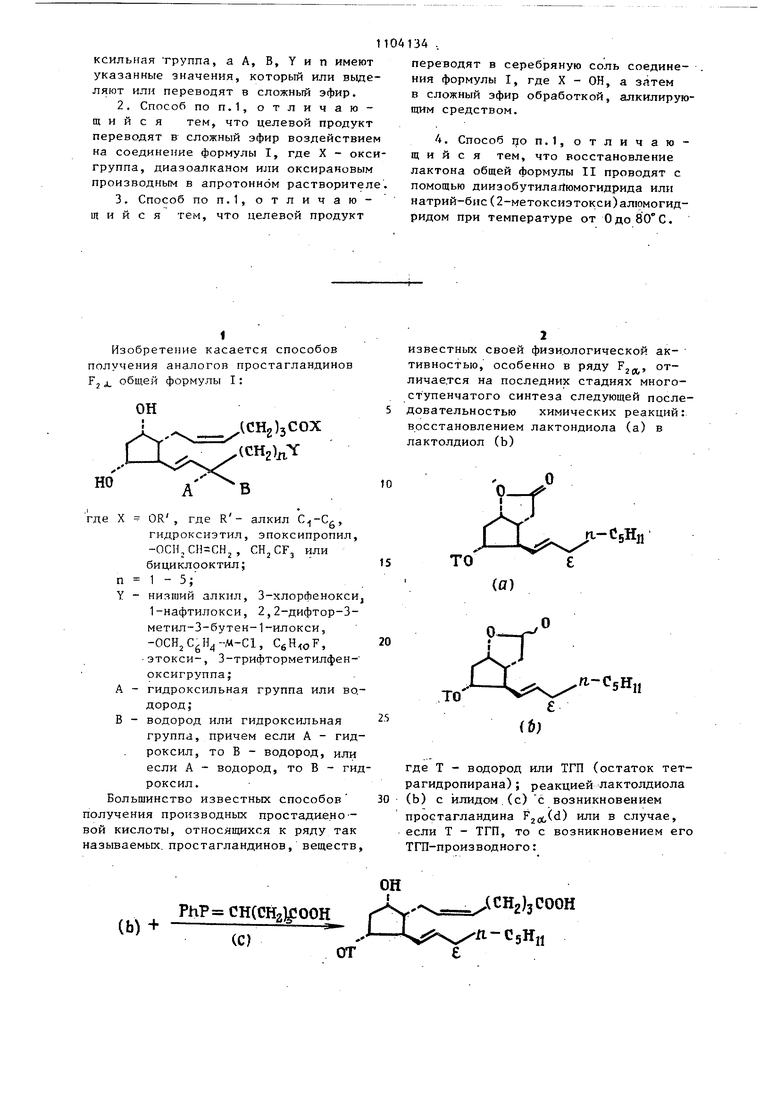













| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных /3 а @ ,4 @ ,5 @ ,6 @ /гексагидро-5-окси-4-оксиметил-2 @ -циклопента/ @ /фуран-2-она | 1980 |
|
SU1206276A1 |
| Способ получения 5-галоген-7-оксиметил-бицикло(2,2,1)гептан-2-она | 1980 |
|
SU1142466A1 |
| Способ получения аналогов природных простагландинов | 1973 |
|
SU665799A3 |
| Способ получения промежуточных соединений для получения простагландинов | 1975 |
|
SU645563A3 |
| Способ получения 11-дезокси-16арилокси- -тетранорпростагландинов или их солей | 1976 |
|
SU679134A3 |
| Способ получения оптически активных производных простагландинов,или их оптических антиподов,или их рацематов | 1977 |
|
SU668598A3 |
| Способ получения простагландина @ 2 @ или его аналогов | 1982 |
|
SU1291587A1 |
| Способ получения производных 13,14-дегидропростагландина в виде рацематов или оптически активных антиподов | 1975 |
|
SU942588A3 |
| Способ получения оптически активных соединений ряда простагландинов или их рацематов | 1974 |
|
SU662008A3 |
| Способ получения аналогов природных простагландинов | 1974 |
|
SU522789A3 |
1. СПОСОБ ПОЛУЧЕНИЯ АНАЛОГОВ ПРОСТАГЛАНДИНОВ F, общей формулы I: ОН I (CH2)3COlt (CHgV А Б OR, где R - алкил , гидроксиэтил, эпоксипропил, -OCHjCH CH2, CHjCFj или бицикл ооктил; п 1 - 5; Y - низший алкил, 3-хлорфенокси, 1-нафтилокси, 2,2-дифтор-3метил-З-бутен-1-илокси, -OCH.CgH -tt-Cl, , этокси, 3-трифторметилфеноксигруппа; А - гидроксильная группа или водород; В - водород или гидроксильная группа, причем если А - гид- роксильная группа, то В водород или если А - водород, то В - гидроксильная группа, заключающийся в том, что лактон общей формулы 11: где п и Y имеют указанные значения; водород или группа .OZ; А водород или группа OZ, В причем если А - группа OZ, то В - водород или если А - водород, то В - группа OZ, где Z-защитная третбутилдиметилсилильная группа, 2,5-диоксигексильная группа, 4-метокситетрагидропиран-4-ильная группа, 2-метокси-2-пропильная группа, 4-фенилбензоильная группа, бензилоксиметильная группа, -СН,ОСИ,СС1, 2 3 (,,, (СНз)2СОС2Нд, CHjСОС Н5-группа; СО восстанавливают в соответствующий лактол, который далее подвергают взаимодействию с илидом общей формулы III: ( CH(CH2)jCOX, где X имеет указанные значения, с последующим удалением защитных группZ кислым гидролизом в водно-органической среде с получением целевого продукта общей формулы I, где X - гидро

1
Изобретение касается способов получения аналогов простагландинов FJ л, общей формулы I:
ОН
Аснг)зсох
(CHgU
Б
X - OR, где R- алкил ,
гидроксиэтил, эпоксипропил, -ОСН,, или бициклооктил; п 1 - 5;
Y - низший алкил, З-хлорфенокси, 1-нафтилокси, 2,2-дифтор-Зметил-3-бутен-1-илокси5-OCH.CgH -M-Cl, , ЭТОКСИ-, 3-трифторметилфеноксигруппа;
А - гидроксильная группа или водород;В - водород или гидроксильная
группа, причем если А - гидроксил, то В - водород, или если А - водород, то В - гидроксил.
ольшинство известных способов чения производных простаднено- кислоты, относящихся к ряду так ваемых, простагландинов, веществ.
известных своей физиологической активностью, особенно в ряду РЗЛ ° личае.тся на последних стадиях многоступенчатого синтеза следующей последовательностью химических реакций: восстановлением лактондиола (а) в лактолдиол (Ь)
О
1-f
о
гг
П.-С5Н1,
(Ь)
где Т - водород или ТГП (остаток тетрагидропирана); реакцией лактолдиола (Ь) с йлидом.(с) с возникновением простагландина Ргоб) или в случае, если Т - ТГП, то с возникновением его ТПТ-производного:
CH(CH2)
(Ь) (С) 3 и последующим освобождением гидроксильных групп на G-11 и С-15 проста диеновой кислоты в том случае, если Т - ТПТ: гидролиз Из указанного вытекает, что эти последние стадии синтеза простагландина проводят или с промежуточными продуктами, в которых присутствующи гидроксильные группы на 11 и 15 ато мах углерода защищены в форме произ водных тетрагидропирана, или же с промежуточными продуктами, в которых эти гидроксилы свободны. Первый способ, где гидроксильные группы зап1ищаются в форме производн го тетрагидропирана (патенты ФРГ № 2709804, № 2736110, № 2437388 № 2234709, № 234569$, патент США № 3933892, патент Англии № 1438093), имеет недостаток, заклю чающийся в том, что в молекуле возн кает следующий асимметричный центр и получается смесь изомерных соединений. Вследствие этого.полученные продукты почти все сиропообразные, что затрудняет их выделение, очистк и Характеризацию, Второй способ (Ж.Хем.Соц.Перкин 1,1973, 2796), по которому не защищаются гидроксильняе группы на атомах углерода 11 и 15 перед дальнейшей синтетической обработкой, отличается повышенным расходом дорогих реагентов, и, кроме того, требуемый продукт трудно выделяется, поскольку он загрязнен балластными веществами, возникшими при реакциях свобо ных гидроксильных групп и избыточных реагентов. На этих известных методах основы вается предлагаемый способ, причем он устраняет недостатки известных способов. Сущность способа производства аналогов простагландина 2 указанной общей формулы заключается в том что на соединение общей формулы II: .(СН2)аТ 344 |Где n,Y имеют указанные значения; А - группа OZ или водород; В - водород или группй OZ, при чем, если А - группа OZ, то В - водород, или если А - водород, то В - группа OZ, где Z - защитная трет.бутилдиметилсилильная группа, 2,5-диоксигексиль-, ная группа, 4-метокситетрагидропиран-4-ильная группа, 2-метокси-2-пропильная группа, 4-фенилбензоильная группа, бензилоксиметильная группа, -CHjOCHjCClj, (СНз)2СОС2Н5-, (CEj)COCRj-, СНзСОС2Н,у-группа после восстановления лактоновойгруппировки в лактол, действуют илидом общей формулы (CgHg)(CHj)3COX, где X имеет указанное значение, с последующим снятием защитных групп Z кислым гидролизом в водно-органической среде с получением целевого продукта общей формулы I, где X - гидроксильная группа, аА, В, Y и п имеют указанные значения, который или выделяют известными методами, или переводят в сложный эфир. Целевой продукт переводят в сложный эфир предпочтительно воздействием на соединение формулы I, где X - оксигруппы, диазоалканом или оксирановым производным в апротонном растворителе или переводом продукта реакции в серебряную соль, которую обрабатывают соответствующим алкилирующим реагентом. При производстве аналога простагландина , предлагаемым способом лактондиольные группировки (а) переводятся в лактолдиольные (Ь) предпочтительно при (0) - (-80)°С комплексным гидридом, предпочтительно диизобутилалюмогидридом или натрий-бис(2-метоксиэтокси)-алюмогидридом. ,.Илид(е) общей формулы (СНг)зСОХ получают из соответствующей фосфониевой соли в среде безводного диметилсульфоксида действием сильных оснований, предпочтительно гидридом натрия или алкиллития. Фосфониевую соль для X, отличающегося от ОН, предпочтительно получать при реакции сложных эфиров 3-гапогенпентановой кислоты с триарилфосфином, причем эфир 5-галогенпентаноБой кислоты приготавливают реакцией соответствующего галогенида кислоты со спиртом.
Поскольку по предлагаемому способу при защите гидроксильных групп на 11 и 15 атомах углерода используют такие соединения, которые.не.вносят в молекулу следующий асимметрический центр, то в большинстве случаев получают кристаллические продукты. Это позволяет более легко осуществить выделение или характери зацию продукта, который получают с количественным выходом.
Следующим существенным преимущестйом защиты гидроксильной группы предлагаемым способом является легко осуществимое устранение этих групп
из молекулы. Например, гидролиз 4метокси-4-тетрагидропиранильной защитной группы протекает в 5-10 раз быстрее, чем гидролиз применяемой до сих пор 2-тетрагилропиранильной группы. Кроме.того, более мягкие условия, особенно более низкая температура и меньшее количество кислоты при реакции, снижают количество побочных продуктов и тем самым устраняют часто трудное выделение требуемого вещества.
Значения радикалов и символов указанных формул I-IV приведены в таблице. Примечание,
П р и м о р . 1. К раствору 325 мг лактона формулы lid в 25 мл свежеперегнанного толуола после охлаткдения до -78 С добавляют в течение 5-10 мин 1,06 мл диизобутилалюмогидрида в толуоле (1,5 и. раствор). Затем реакционную смесь перемешивают в течение 15 мин при той же температуре и разлагают добавлением 2,15 мл метанола, после чего перемешивают 20 мин при комнатной температуре. После добавления 18 мл насыщенного
раствора поваренной соли и 18 мл воды водный слой экстрагируют 3x40 м этилацетата, объединенные экстракты промывают 8 мл насьпценного раствора поваренной соли и высушивают безводным сульфатом магния. После отгонки растворителей маслянистый продукт сушат в вакууме (60 Па) при комнатной температуре. Получают 326 мг лактола Ilia.
К раствору 3,23 г бромила трифенилфосфонийпентановой кислоты в СРН-3-хлорфенил; MOP - 2-метокси-2-пропил; MEM - 2,5-диоксагексш1; DFM - 2,2-дифтор-З-метилЗ-бутен-1-ил; РНВ - 4-Фенилбензоил; ТНГ - 2-тетрагидрофурил; ВСО. - 2-(2,2,2-бициклооктил); NPH - 1-нафтил; НЕТ - 2-гидроксиэтил; ИГР - 4-метокситетрагидропиран-4-ил; ЕРР - 2,3-эпоксипропил; 9 15 МП диметилсульфоксида при переме шивании и комнатной температуре добавляют 5,9 мл диметилсульЛоксида натрия (2,,32 я. раствор) в течение 5-10 мин. После добавления половины объема реакционная смесь окрашивает ся в темно-оранжевый цвет возникающим илидом. В течение следующих 5 мин добавляют 1,26 г лактола фор|мулы Ilia, растворенного ц смеси 30 мл безводного диметилсульфоксида и 3 мл бензола. Затем реакционную смесь перемешивают в течение 3 ч при комнатной температуре, после че го добавляют по каплям 32 мл дистиллированной воды при внешнем охлаждении. Реакционную смесь экстрагируют 3x30 мл этилацетата и рН водного слоя доводят до 3-4 добавлением 1,73 и, щавелевой кислоты. После повторной экстракции смесью гексана и эфира в соотношении 1:1 (в общем 160 мл) соединенные экстракты промывают насыщенным раствором поваренной соли, сушат сульфатом магния и отгоняют растворители в вакууме. После высушивания получают 0,67 г вязкой маслянистой кислоты формулы IVa. Раствор 0,6 г сиропа формулы IVa, 5 мл безводного метиленхлорида смеши вают с безводным порошкообразньпч бромистым цинком (2,25 г) и интенсивно перемешивают при 25 С в течение 12 ч. Посл-е добавления 10 мл воды смесь в вакууме выпаривают до кон систенции пасты, которую экстрагируют 3x30 мл этанола. Соединенные экстракты выпаривают досуха. Из маслянистого остатка (480 мг) после хроматографирования на колонке с силикагелем смесью бензола, метанола и уксусной кислоты в соотношении 32:1: получают в общем 360 мг (85%) .практически чистого продукта формулы 1а. Исходный лактон формулы lid получают следзтощим образом. Раствор 4,18 лактона формулы На в смеси 100 мл тетрагидрофурана и 13 мл метилацетат в атмосфере аргона охлаждают до -79 При перемешивании добавляют раствор 3,12 г трис(2-бутил)литийборгидрида с такой скоростью, чтобы температура не превысила -76 С. После добавления всего количества гидрида смесь перемешивают в течение 75 мин при указанной температуре. Избыток гидри да разлагают добавлением 25 м.п 40%-н го водного раствора уксусной кислоты 13410 К реакционной смеси добавляют 280 мл дихлорметана и 140 мл воды. Органический слой отделяют и выпаривают досуха в вакууме и три раза с добавлением 150 мл метанола. Сырой продукт формулы Не (31,99 г) растворяют в 90 мл дихлорметана и 200 мл сухого метанола. К раствору при п.еремешива- НИИ при комнатной температуре добавляют постепенно в течение 2 ч З, 6 г углекислого калия. Смесь перемешивают еще 1,5 ч, затем добавляют 27 мл 2 н. соляной кислоты, 65 мл воды и 90 мл дихлорметана. После встряхивания водный и органический слои -разделяют. Органический слой после высушивания безводным сульфатом магния выпаривают досуха. Водный слой нейтрализуют твердым кислым углекислым натрием и выпаривают досуха. Сухой остаток 2 раза экстрагируют 25 мл хлороформа, а после ис-парения растворителя сиропообразный остаток соединяют, с остатком, полученным при обработке органического слоя. При фильтрации сырого продукта через слой силикагеля получают 1,78 г кристаллической смеси эпимерных диолов формулы lib и Ilc с т.пл. 109113 С. Смесь разделяют с помощью препаративной жидкостной хроматографии высокого давления (колонка 50x0,6 см, заполненная Лихросорб. Si-5, подвижная фаза - метиленхлорид 85%, ацетонитрил 14,9%, вода 0,1%, скорость 120 мл/ч, фотометрическая детекция (254 нм), дозировка 100 мг смеси спиртов). Менее полярный эпимер формулы Не кристаллизуют из этилацетата, т.пл. 113-115 С. ИК-спектр показывает характеристические полосы поглощения при частотах (CHClj): 3610, .. 3020, 2950, 1771,1598, 1583, 1480, 1285, 1037, 975; (КВг): 2935, 1742, 1598, 1583, 1488, 1380, 1310; 1250, 1081, 1031, 980, 918. В масс-спектре присутствуют следующие структурно-характеристические ионы: м/е 338 (молекулярный ион), 197(30), 193(40), 179(70), 142(100). Более полярный эпимер формулы lib кристаллиззтот из смеси ацетона, эфира и петролейного эфира, т.пл. 125-127 С ИК-спектр показывает характеристические полосы поглощения при следующих частотах (CHClj): 3600, 3015, 2935. 1771, 1598, 1583, 1480, 1285, 111037, 975; (KBr): 2920, 1719, 1597, 1576, U85, 1375, 1251, 1225, 1071, 1030, 980, 909. В масс-спектре присутствуют следующие структурно-харак теристические ионы: м/е 338 (молеку. ион), 197(30), 193(40), 179(70), 142(100). В 10 мл . дихлорметана растворяют 338 мг более полярного диола формулы lib, раствор защищают атмосферой азота, добавляют 374 мг хлорметил(2-метоксиэтил)эфира и 387 мг этилдиидопропиламина1в 2 мл дихлорметана и смесь перемешивают при 20-25 С в течение 4 ч. После этого реакционную смесь разбавляют 10 мл воды, органический слой отделяют и после промывки 5 мл насьпденного раст вора поваренной соли высушивают суль фатом магния, а растворители отгоняют в вакууме. Получают 510 мг продук та, хроматографически однородного (,4, силикагель CFgg. , 2% метанола в хлороАорме), его структура, установленная н ЯМР и МС, находится в соответствии с полученной и отвечает формуле lid. Пример 2. Лак тон формулы Ilf .восстанавливают диизобутилалюмогидри дом по методу,указанному в примере -1. Полученный таким образом лактол формулы Illb (1,1 г) после растворе ния в 25,мл безводного диметилсульфоксида добавляют к илиду, приготов ленному обычным методом из 3,25 г бр мида трифенилфосфинпентановой кисло ты в 15 мл диметилсульфоксида (пример 1). После 3 ч перемешивания при комнатной температуре реакционную смесь обрабатывают обычным способом (пример 1). После тщательного высушивания в глубоком вакууме получают. 0,76 г маслянистой кислоты формулы IVb. Смесь 1,3 г производного формулы IVb и 10 мл смеси уксусная кислотавода-тетрагидрофуран () переме шивают в течение часа при 25 С. При пониженном давлении испаряют растворители и продукт очищается хроматографически на силикагеле. По лучают 0,77 г вещества формулы 1а. - Исходное тетрагидрофурилпроизвод Ное Ilf получают следующим образом, К раствору 1,0 г диола lib в 10 мл тетрахлорметана добавляется 1,86 г тетрагидрофурилдифенилацетата и О,1 г пара-толуолсульфоновой кислот Полученная смесь перемешивается при 3412 в течение 15ч. После добавления 20 мл воды смесь встряхивается три раза с 20 мл гептана. Соединенные гептановые растворы выпариваются дос5тса. Следы влажности устраняются выпариванием с 10 мл бензола. Получают 1,62 г тетрагидрофурилпроизводного формулы Ilf в виде масла, структура которого находится в соответствии с интерпретацией спекФров. Б ИК-спектре полоса при 1775 соответствует лактоновой группировке, а полоса при 963 см - внеплоскостным диформационным колебаниям СН в транс-олеАине, протоновые 5IMPсигналыпри / 5,72 (2Н,транс-олефин), 7,13 (1Н) и 6,85 (ЗН) ароматическое ядро. Пример 3. Лактон Ilg восстанавливают диизобутилалюмогидридом по методу, описанному в примере 1. Раствор полученного лактона Шс (2,52 г) в 62 мл безводного диметилсульфоксида и 7,1 мл бензола добавляют к раствору илида, приготовленного способом, аналогичным примеру 1, из 6,5 г метил 5-трифенилфосфонийпентаноат бромида в 31 мл диметилсульфоксида и 11,9 мл диметилсульфоксиднатрия (2,32 н. раствор). Реакционную смесь перемешивают 3 ч при комнатной температуре и после этого добавляют по каплям 61,8 мл дистиллированной воды при внешнем охлаждении. Реакционную смесь экстрагируют три раза по 60 мл зтилацетатом и рН водного слоя доводят до 3-4 за счет добавления 1,73 н. щавелевой кислоты. После.повторной зкстракции смесью гексан - эфир (1:1), всего.320 мл, соединенные экстракты промывают насыщенным раствором поваренной соли, высушивают сульфатом магния, а растворители отгоняют на ротационном вакуумном испарителе. После досушивания в глубоком вакууме получают 1,15 г вещества формулы IVc, его структура находится в соответствии с интерпре.тацией спектров. В ИК-спектре полосы 3450-3550 см свидетельствуют о присутствии гидроксильной группы, 1736 см - валентные колебания СО в сложном эфире, протоновый ЯМР-спектр показывают сигналы при 8 5,48 (2Н, цис-олефин), 5,78 (2Н, транс-олефин), 8,3-8,5 (1Н). 7,77,9 (1Н),7,2-7,5 (4Н) ,6,85-7,09(1Н), что соответствует ароматическим протонам, К раствору 1,1 г бис(4-метокситетрагидропиран-4-ш1) производного формулы IVc в 30 мл ацетона добавля ют 3 МП 0,1 НС1 и течение реакции наблюдают с помощью тонкослойной хроматографии (система хлороформметанол 100:2). После исчезновения исходного вещества реакционную смес нейтрализуют твердым кисльм углекис лым натрием и выпаривают досуха. Су хой остаток размешивают в смеси хло роформа и метанола и отфильтровываю через слой силикагеля для удаления неорганических солей. Получают сиро пообразный эфир формулы Ib с величи ной Rfr 0,35 (хлороформгметанол 100:5), структура которого подтверж дена с помощью МС, для лекулярный ион при 454,2552. Вычисле но, %: 454,2556. Далее обнар5гжены виды ионов при m/Z 436, 327, 309, 297, 157, Исходный лактон формулы 11 получают растворением 700 мг соответству ющего диола формулы Ilh в 20 мл .дихлорметана со следами П -толуолсульфокислоты в колбе, закрытой медицинской пробкой. После охлаждения до О С в течение 5 мин при перемешивании добавляют из шприца 500 мл 5,6-дигидро-4-метокси-2Н-пирана. Спустя 45 мин к реакционной смеси добавляют 10 мл 1%-ного раствора кислого углекислого натрия и 10 мл метиленхлорида. Органический гглой отделяют, высушивают сульфатом магния, а после фильтрации и отгонки дихлорметана получают 0,75 г слегка кристаллизующего сиропа, который без дальнейшей очистки используется для восстановления. В ИК-спектре не присутствуют полосы, отвечающие ОН-груп пам. Присутствует полоса при 1778см соответствующая Y-лактоновой группировке . Пример 4. Лактон формулы Ili восстанавливают диизобутилалюмо1ГИДРИДОМ по способу, описанному в примере 1. Продукт формулы Hid растворяют в 10 мл безводного димети сульфоксида и в 1 мл бензола и,доба ляют при перемешивании при комнатно температуре к раствору илида, полученного обычным методом (пример 1) из 1,4 г 2-С2,2,2-бициклооктил)-5трифенилфосфонийпентаноат бромида в 6 мл диметилсульфоксида. После стандартной обработки из реакционной смеси получают 0,23 г маслянистого эфира формулы IVd. Защитные группы удаляют методом примера 3 и получают таким образом практически чистый сиропообразный эфир формулы -Ic, структура которого подтверждена с помощью спектров. В протоново,м ЯМР-спектре присутствуют сигналы при 8 5,39 (2Н,. цисолефин), 5,71 (2Н, транс-олефин). В ИК-спектре полосы 3440-3458, 3600 и 1105 см отвечают присутствию гидроксильныхк групп, 1740 см отвечает валентному колебанию карбинильной группы в эфире. В массспектре высокого разрешения для . найден молекулярный ион при 462,3329. Вычислено, %: 462,3333. Исходное производное формулы Hi получают из раствора 1, г диола исходной формулы IIj в 160 мл дихлорметана, к которому добавляют при перемешивании 0,05 мл хлорокиси фосфора ипо каплям добавляют960 мг Изопропенилметилового эфира при комнатной температуре. Ход реакции контролируют с помощью тонкослойной хроматографии. Спустя 30 мин к реакционной смеси добавляют 4 мл насьпценного раствора углекислого натрия. Органический слой отделяют и промывают 2x10 мл насьпценного раствора хлористого натрия. После - высуигавания дихлорметанового раствора сульфатом магния отгоняют растворители и сиропообраз-. ный продукт высушивают при 20 С и 0,1 кПа. Получают 2,1 г продукт.а формулы Hi. В ИК-спектре нет полос, отвечающих присутствию ОН-групп, а найдена интенсивная полоса при 1775 , подтвер кдающая присутствие у-лактона. Пример 5. Раствор лактона формулы Ilk (645 мг и 10 мл толуола) охлаждают до -60 С и потом добавля-;, ют 3 мл диизобутилалюмогидрида в толуоле (приблизительно 1,5 н. раствор), После стандартной обработки (пример 1) получают 642 мг лактона формулы Ille вязкой маслянистой консистенции. ЯМР, масс- и ИК-спектры находятся в соответствии с предложенной структурой, К 820 мг бромида трифенштфосфонийпентановой кислоты, растворенной в 4 мл диметилсульфоксида (в атмосфере азота), добавляют при перемешивании 2,1 tm диметилсульфоксида натрия (1,75 н.раствор). К приготовленному таким образом илиду добавляют 261 мг лактона формулы Ille, растворенного в 7 мл диметилсульфоксида и 1 мл бензола. Затем реакционную смесь перемешивают в течение li ч при комнатной температуре и обрабатывают с- андартным способом. Получают 210 маслянистой кислоты формулы IVe, структура ко.орой подтверждается с помощью спектральных методов. В F ЯМР-спектре присутствует сигнал при S107,39 (2F, CFj), в протоновом ЯМР-спектре - сигналы приfi5,69 (2Н, транс-олефин), 5,23 (2Н, Н--21) в ИК-спектре - полосы 3390 - 3450 см подтверждают присутствие гидроксиль ной группы, в масс-спектре найдены виды ионов m/Z (отн.инт. %): 85(100 41(17), 43(16), 29(12), 121(10), 67(9), 86(8), 27(6), 39(5), 84(5). В 13,2 мл разбавленной уксусной кислоты (2:1) растворяют 210 мг указанной кислоты формулы IVe и реакционную смесь нагревают в течение 2 ч при 35-40°С. После испарения уксусной кислоты и воды Б вакуумном ротационном испарителе (темпера тура около 40 С, 2660 Па) из остатка после стандартной хроматографии получают 87 мг кислоты формулы Id; предложенная структура находится в соответствии со спектрами. Протоновый ЯМР-спектр показывает сигналы при о 1,05-2,83 (18Н, S, 2т, Н-22, Н-12, Н-10, Н-8, Н-7, Н-3, Н-4), 5,08-5,83 (6Н, т, Н-21, цис- и транс-олефин), в F ЯМР-спек ре сигнал при §107,58 (2F2, CFj , триплет Ij,). В ИК-спектре полосы 3360-3450, 3585, 1100 см отве чают присутствию гид1 оксильйой груп пы, 1710 см - соответствует валент ному колебанию СО в карбоксильной функции. I .. К раствору 432,5, мг лактона фор мулы Не в 30 мл дихлорметана доба
ляют 5 мг безводной П-толуолсульфокислоты.и после внешнего охлаждения льдом и.водой добавляют по каплям 324 мг метилизопропенилэфира. После перемешивания в течение часа при комнатной температуре к реакционной смеси добавляют 150 мг твердого кислого углекислого натрия и реакционную смесь обрабатывают согласно примеру 4. Получают 645 мг однородт ного маслянистого лактона формулы Ilk, спектры которого находятся -в соответствии с предложенной струксоль суспендируют в смеси 10 мл сухого эфира и 5 мл абсолютного этано-ла, к смеси добавляют 150 мл эпихлор гидрина-. Смесь кипятят под обратным холодильником в течение 50 ч с целью устранения влажности из воздуха. После охлаждения серебряные .соли отфильтровывают, промывают этанолом, а фильтрат испаряют в вакууме. Из оставшегося масла хроматографией на колонке с силикагелем (хлороформ-метанол) получают 405 мг (84%) сиропообразного эфира форму416турой, в ИК-спектре нет полос, xapaftтеризующих присутствие ОН-групп. Пример 6. В стеклянной ампуле суспендируют 425 мг кислоты формулы 1а в 10 мл высушенного эфира, к смеси добавляют 5 мг сублимированного треххлористого железа, реакционную смесь охлаждают до О С и шприцем добавляют раствор 50 мг этиленоксида в 2 мл высушенногб эфира. Ампулу запаивают и оставляют при лабораторной температуре в течение двух дней. Потом содержимое ампулы выливают в 5 мл воды, эфир испаряют в вакууме, к раствору добавляют 0,5 г карбонатного катионита, смесь перемешивают в течение часа, фильтруют, а фильтрат испаряют в вакууме. Оставшийся маслянистый продукт очищают с помощью колоночной хроматогра фии на силикагеле (хлороформ - мё.танол) и получают так 390 мг .(83%) практически чистого сиропообразного эфира формулы 1е. В протоновом ЯМРспектре присутствуют сигналы при 3,61 и ii,25 (4Н, -CH,jCHj- в эфире), 5,52 и 5,83 (4Н, цис- и транс-олефин), 7,10 (1Н) и 6,85 (ЗН)-протоны в ароматическом ядре, в ИК-спектре полосы при 1728 см отвечают присутствию эфирной функции: 3350-3482, 3610, 1050 и 1108 см отвечают валентным и деформационным колебаниям гидроксильньпс групп. В масс-спектре найдены виды ионов при m/Z: 450, 341, 324, 310,.127, 141 и мблекулярный ион при 468, 1198 (рассчитано для - 468, 1200). Пример 7. К раствору кислоты формулы 1а в 3 мл 50%-ного водного этанола добавляют раствор 180 мг азотнокислого серебра в 2 мл воды, серебряную соль отфильтровывают, промывают водой и этанолом. После высушивания в вакууме серебряную
17
лы If. В ИК-спектре найдены полосы 1742 см, подтверждающие присутствие эфирной группы; 3380 - 3450, 3605 и 1104 см отвечают валентным и деформационным колебаниям гйдроксильной группы. Протоновый ЯМРспектр содержит сигналы при§5,48 и 5,79 (4Н, отвечает цис- и трансолефину), 7, 10 (1Н) и 6,82 (ЗН), Которые отвечают ароматическим протонам.
Пример 8. К смеси 26 г 1,2, 5,6-ди-0-изопропилиден-1С-В-глюкфуранозы и 50 мл сухого пиридина при -78 С добавляют по каплям 22 г хлорида 5-бромвалериановой кислоты. Смесь оставляют при -17 С на 6 ч, при комнатной температуре на 12 ч, после чего ее разлагают водой. Выделившиеся кристаллы 3-0-(5 -бромналероил)-1,2,5,6-ди-О-изопропилидеОС-В)-глюкофуранозы отфильтровывают, промывают водой и сушат в вакууме. Сырой продукт (41 г) растворяют 24,7 г трифенилфосфина в 125 мл сухого ацетонитрила. Реакционную смес кипятят 10 ч без доступа влаги. После выпаривания растворителей получают стеклообразную.массу, которая при стоянии закристаллизовывается. При обработке смеси хлороформэтанолэфиром получают 46 г (70%) твердой фосфониевой соли. Структура вещества находится в соответствии С интерпретацией спектров.
Пример 9. Смесь 1.5 г 2-адамантанола, 40 мл сухого пиридина обрабатывают 22 г хлорида 5 бромвалериановой кислоты согласно примеру 8 Сырой продукт (30 г) переводят тем же способом (в отношении количества химикатов и метода), что и в примере 8, в 45,5 г соответствующей фосфониевой соли (82%). В ИК-спектре имеются полосы 2890-2990, 1400 и 1380 см, соответствующие валентным и деформационным колебаниям СН в и CHj-группах, далее полоса при 1738 см отвечает валентному колебанию СО в эфире. В протоновом ЯМР-спектре сигналы при S 1,55 1,98 отвечают алифатическим протонам, 2,65 (2Н, t, СН), 3,5-4,0 (2Н, СН) и 7,65-7,90 (15 Н, ароматические протоны).
пример 10. Смесь 13,5 г 2-(2,2,2)-бициклооктанола и 40 мл безводного пиридина обрабатьшают 22 г хлорида 5-бромвалериановой кис
0413418
лоты согласно примеру 7. Сырой продукт (29,2. г) растворяют в 75 мл ацетонитрила и способом согласно примеру 7 оставляют реагировать с 5 26,4 г трифенилфосфина в 130 мл ацетонитрила. Вьщеляют 44 г (79%) фосфониевой соли. В ИК-спектре имеются полосы при 2890-2985, 14601380 см , отвечающие валентным и .
0 деформационным колебаниям СН в метил ьных и метиленовых группах, в про. тоновом спектре сигнал при 57,567,95 (15Н, ароматические протоны). Пример 11 . К смеси 13 г,
5 1,2,0-изопропилиденглицерина и
30 мл безводного пиридина при -78 С добавляют по каплям 22 г хлорида 5-бромвалериановой кислоты. Смесь оставляют на 6 ч при -17с и на 12ч
0 при комнатной температуре, после чего ее разлагают водой. Продукт встряхивают с хлороформом (3x100 мл), соединенные хлороформовые экстракты экстрагируют водой, разбавленной
5 соляной кислотой, насыщенным раствором кислого углекислого натрия, водой и сушат безводным сульфатом магния. После фильтрации и выпаривания растворителей получают 30 г сырого 1-0(5 -бромвалероил)-2,3,0изопропилиденглицерола, который переводят в фосфониевую соль реакцией с трифенилфосфином в 200 мл ацетонитрила методом согласно примеру 8. Получают 51 г (85%) кристаллической фосфониевой соли.
Пример 12. Диметил- -3-(2,2дифтор-3-метил-3-бутенокси)-2-оксопpoпилJ-фосфонат.
К раствору сложного диметнлэфира метилфосфорной кислоты (4,96 г) в безводномтетрагидрофуране (80 мл) при интенсивном перемешивании и температуре (-75) - (-80) С по каплям, добавляют 35,9 мл к-бутиллития в гексане (концентрация 1,13 моль) с такой скоростью, чтобы температура реакционной смеси не превышала -66 С. По истечении 15 мин к этой смеси добавляют 4,16 г этилового эфира (2,2-дифтор-З-метил-З-бутенокси)уксусной кислоты, растворенного в 15 мл тетрагидрофурана, причем температура смеси поддерживалась до значения -70 С еще в течение 2ч, а 5 после нагревания смеси до О С смесь окислялась 3,1 мл ледяной уксусной кислоты. После растворения неоргани ческих солей в воде (приблизительно 15 20 мл) и выпаривания растворителей водная фаза экстрагировалась 3 раза 20 мл эфира, соединенные органические фазы промывались10 мл кислого углекислого натрия и высушивались сульфатом магния. После отгонки рас ворителей путем дистилляции получаю 3,5 г маслянистого продукта с т. кип. 119-124 с при давлении 53 Па. (286,2). , Вычислено, %: С 41,97; Н 5,99; Р 10,82. Получено, %: С 42,19; Н 5,48; Р 10,50. ИК-спектр показывает полосу при 1728 см , отвечающую валентному колебанию карбонильной группы в эфире, масс-спектр - характеристические виды ионов при m/Z (отн.инт 152(100), 41(73), 93(70). 109(64), 96(55), 100(42),40(42),124(36),65( М. 286(0,15). р-ЯМР-сигналы при Sl07,64 (t, 2F в CFj-rpynпе), протоновый ЯМР-спектр также находится в соответствии с предложенной структурой. Пример 13. Этил-(2,2-дифтор-3-метил-З-бутенокси)ацетат. Алкоголят натрия, приготовленный из 21 г 2,2-дифтор-З-метил-З-бутено ла и 5,15 г (80%-ного) гидрида натрия в 100 мл безводного диметоксиэтана, добавляют к раствору этилбромацетата (28,4 г) в 20 мл того же растворителя с такой скоростью, чтобы температура реакционной смеси не превышала 40°С. После трехчасового перемешивания реакционную сме оставляют на ночь при комнатной тем пературе. После этого вьщелившиеся соли растворяют в 35 мл дистиллиро ванной воды, органическую фазу отд ляют, а водную фазу экстрагируют 4 раза по 50 мл эфиром. Соединенны органические фазы высушивают сульф том магния и обычньм способом изол ции путем дистилляции остатка при 2,27 к Па . Получают 14,0 г продукт с т. кип. 102-104С. С,,Н . (208,2). Вычислено, %: С 51,92; Н 6,78; F 18,25. - Получено, %: С 50,2; Н 6,76; F 18,55. В масс-спектре найдены виды ионов: m/Z (отн.инт. %): 59(1 21(72), 41(59), 61(52), 31(41), 39(38), 27(34), 89(31), 106(31), 118(24). В ИК-спектре полоса при 1755 см отвечает присутствию СО-г 3420 пы в эфире. Н- и F- ГMP-cпeктpы также находятся в соответствии с предложенной структурой. Пример 14. К суспензии гидрида натрия (0,115 г, 69,4%-ныи в парафиновом масле) в 5 мл диметоксиэтана в атмосфере азота добавляют 1,159 г фосфоната из примера 12 в 20 мл того же растворителя с такой скоростью, чтобы температура не превьшала -5 С. Полученный раствор илида после перемешивания в течение часа охлаждают до (-15) - (-20)с и добавляют эквивaлeнtнoe количество (3,3аа, 4р, 5od,6, 6afl.)-5-1, l-бифенил4-карбоНилокси-4-формилгексагидро2Н-циклопента(Ь)-фуран-2-она. После 20-минутного перемешивания при этой температуре реакционную смесь .перемешивают еще 2 ч при комнатной температуре и, наконец, ее разлагают 10 мл насьпценного раствора хлорида аммония и воды (10 ми). После выпаривания растворителя на ротационном вакуумном испарителе водную фазу экстрагируют 4 раза по 10 мл этилацетата. После обычной обработки экстракта получают 1,164 г енона общей формулы II, где ОСН2СР2С(СНз)СН2; А+В 0; Z C6H5CgH CO- , с т. пл. 75-76 0. В масс-спектре имеются виды ионов m/Z (отн. инт. %): 198(100), 181(98), 177(95), 152(95), 153(83), 182(71), 41(60), 149(57), 57(54), 121(46), молекулярный ион lii/z 510(5,7). В ИК-спектре найдены.. характеристические полосы 1775 см (у-лактоновая группировка), 1717 см шалентное колебание СО в эфире и 1705 см - валентное колебание СО в кетогруппе. В F ЯМР-спектре - сигналы при 107,51 (2F, CFj). Протоновый ЯМР-спектр также находится в соответствии с предложенной структурой - сигналы при S 1,68 (S, ЗН, Н-22), 1,99-3,10 (in,6H, Н-7, Н-8, Н-10, Н-12), З.,80 (t, , 2Н, ), 6,87 (2Н, транс-олефин) 7,35-8,15 (9Н, ароматические протоны) Пример 15. К раствору енрна из примера 14 (510 мг, 1. миллимоль) в безводном тетрагидрофуране (20 мл) под аргоном при (-77) - (-74)с добавляют раствор трис-втор. бутилборгидрида лития (2 мл 1 М толуольного раствора, т.е. 2 миллимоль), и реакционная смесь перемешивается при этой температуре в течение 43 мин., После удал-ения охладительной ванны 21 и клгревания реакционной смеси до температур O-Slc добавляют 30 мл 30%-уксусной кислоты, потом разбавляют водой (20 мл) и. добавляют 30 м дйхлорметана. После отделенияорганического слоя водную фазу экстраги руют тем же растворителем 2 раза по 15 мл, соединенные дихлорметановые растворы промывают водой (10 мл насыщенным раствором кислого углекислого натрия и высушивают сульфатом магния, а растворители выпаривают в вакууме на ротационном испарителе. Сырой маслянистый продукт выпаривают 2 раза с 10 мл метанола и остаток (547,9 мг) хроматографиру ют на колонке силикагеля (20 г сили кагеля, элюент - хлороформ). Получа ют 451,5 мг (88%) хроматографически чистого лактола формулы II (и его эпимера в отношении 45:55), где Y OCHjCFjC(CH3)CHj ; Z QHrCcH CO; ), структура которо го под В1фждена с помощью спектряль ных методов: ЯМР-спсктр при S 106,84 (2F, CF, , t, ), прото новый НМР при 8 1,84 (ЗН, S, Н-22) , 3,23-3,94 (4Н, m-t, Н-16, И-18, ), 5,53-5,79 2П, транс-олефи 7,17-8,15 (9Н, ароматические протоны В ИК-спектре полосы при 3580 см от вечают ОН-группе 1770 см (у-лактон и 1713 см карбониля в эфирн|)й группе. Масс-спектр m/z (отн.инт.%) 151(100), 110(58), 166(43)., 42(43), 44(37), 124(35), 125(31), 77(21), 39(2), молекулярный ион m/z 512(07) Пример 16. К раствору диастереоизомерных-спиртов формулы II (Y OCH2CF,C(CHj)CH, ; из примера 15) в дихлорэтане (770 мг, 1,5 миллимоль в 20 мл дйхлорметана) и абсолютного метанола (41 мл) добавляют растертый прокаленный карбонат калия (544 мг, 3,94 миллимоль), и смесь перемешивают при комнатной температуре в течение 2,5 ч, затем окисляют коиц, соляной кислотой (0,7 мл) и рН реакционной смеси доводят кислым углекис лым натрием. После выпаривания растворителей на ротационном вакуумном испарителе дистилляционный остаток экстрагируют дихлорэтаном для отделения неорганических солей, после выпаривания дихлорэтанового раствора к остатку добавляют ледяную уксусную кислоту и этилацетат, фильтруют с карборафином и снова отпаривают. 3422 Дистилляционный остаток (1692 мг) хроматографируют на колонке силикагеля (элюент хлороформ-метанол) и получают 401 мг (80%) продукта формулы II (Y OCH2CF,,C(CH3)CH2 ; ). Спектральные характеристики находятся- в соответствии с предложенной структурой: F Я№спектр при S 107,46 (2F, CF , t, 1цр 13), ИК-спектр полосами при 3580 см и 3420-3480 см соответствует гидроксильной группе, 1770 соответствует -лактоновой группировке, прртоновый ЯМР-спектр не содержит ароматические протоны, далее при 5 1,86 (ЗН, S, , 5,49-5,63 (2Н, транс-олефин). I Пример 17. Лактон формулы II ( Y c-C5H gF) восстанавливают диизобутилалюмогидридом по способу, описанному в примере 1. Раствор полученного лактола формулы III ( Z C H5CHjOCH ; Y c-CgH F) с (2,2 г) в 50 мл безводного диметилсульфоксида и 5 мл бензола добавляют к раствору илида, приготовленного из 6 г бромида трифенилфосфонийпентановой кислоты в 30 мл диметилсульфоксида таким же способом, как в примере 1. Реакционную смесь перемешивают 3 ч при температуре лаборатории, потом ее разлагают водой при внешнем охлаждении (60мл) и обрабатывают так же, как указано в примере 1. Из соединенных экстрактов выделяют 1,4 г сиропообразного вещества формулы IV ( Z C5H5CH20CH2 ,oF), которое немедленно распускают в 20 мл жидкого аммиака и восстанавливают постепенным добавлением натрия (100%-ный избыток). После обработки обычным .. способом и очистки с помощью препаративной жидкостной хроматографии (колонка 450x10 мм, наполненная Лихросорбом Si-10, мобильная фаза Й-гексан - этанол - уксусная кислота 89:1-0:1, проток 200 мл/ч, детекция UV (Варихром) получают 1,0 г чистого сиропообразного продукта формулы I ( (,F; ), однородного во всех примененных хроматографических системах. (413,5). Вычислено, %: С 63,90} Н 8,29; F 4,59. Получено, %: С 63,72; Н 8,45; F 4,40. В протоновом ЯМР-спектре присутст вуют сигналы при « 6,98-7,28 (10 И, ароматические протоны), 5,68-5,82 (2Н, транс-олефин), в ИК-спектре полоса при 1775 см подтверждает присутствие -лактонового круга. Исходный лактон формулы II ( Z C HjCHjOCH2; ,H,(3F) приготавливают реакцией 3,1 г лактона формулы II (,Н..Р; ), растворенного в 20 мл свежедистиллированного этилдиизопропиламина, с 2,5 экв. бензилхлорметиленэфира при 5 С. Реакционную смесь оставляют при комнатной температуре в течение 12 ч и потом обрабатывают обычным встряхиванием между водой и дихлорметаном. Пример 18. Раствор лактона формулы II (Y OC2Hc; Z CHjOCH2CCl3; в толуоле восстанавливают диизобутилалюмогидридом Полученный лактол реагирует с илидом приготовленным из метил-5-трифенилфосфонийпентаноата так же, как в примере 3. Защитные группы из продукта примера 14 (,j; ,,ОСН2СС1з; , , Y OCjH5) устраняют обычным способом путем восстановления цинком в уксусной кислоте, забуференной трифениламином Продукт очищают жидкостной хроматографией так же, как в примере 5. Сир пообразный метилэфир формулы 1 (Y OCjH5-; ; ) показывает Н-ЯМР- и масс-спектры, одинаковые с аутентичным препаратом Исходный лактон формулы II (, Z CH20CH2СС1,; ) приготавливают реакцией соответствующе го диола с хлорметилтрихлорэтилэфир в тетрагидрофуране в присутствии йодида лития обычным способом. Пример 19. Лактон формулы II (Y CPH CHjO; ) восстанавливают так же, как в примере 1. Продукт формулы III (Y CPH-CH20; ) (0,3 г,) растворяют в 10 мл безводно го диметилсульфоксида и в 1 мл бензола, потом добавляют к расТвору ил да, приготовленному из 0,7 г метил5-трифенилфосфонийпентаноатбромидав ,5 мл диметилсульфоксида реакцией с 1,2 мл диметилсульфоксида натрия (2,3 и. раствор). Реакционная смесь обработана так же, как в примере 1, сырой продукт формулы IV (Х ОСНз; Z THF-0; Y CPH-CH2-О) 1 4 (0,3 г) растворяют в 10 мл смеси уксусной кислоты с водой в соотношении 3:1 и оставляют при комнатной температуре в течение 2 ч. Растворители отпаривают и продукт формулы I (Х ОСНз; CHjO; ) очищают хроматографией на колонке силикагеля в системе хлороформ-метанол-уксусная кислота .100:5:1. Вещества детектируют в элюенте детектором при 254 нм. Получают сиропообразное вещество формулы I (X-OCHj; Y CPHCH20; ). С24Нз2С10б (452,0). Вычислено, %: С 63,77; Н С1 7,84. Получено, %: С 63,50; И 7,28; С1 7, 50. В протоновом ЯМР-спектре сигналы при о 3,53 (2Н, CHj в группировке ), 3,71 (ЗН, СН, в эфире), 4,46 (2Н, в группировке OCHjCgHjCl), 7,17 (1Н) и 6,97 (ЗН) - ароматические протоны, в ИК-спектре полосы 3590 и 3400-3480 см соответствуют гидроксильным группам, полоса 1725 см подтверждает наличие эфирной группы. / Исходный лактон формулы II (Y OCH2Cj,H -M-Cl; ) приготавливают следующим способом. Смесь 1,7 г лактона формулы II (Y OCH2CgH-A(-Cl; ), 20 мг П -толуолсульфоновой кислоты, 4,5 г 2-тетрагидрофуранилэфира дифенилуксусной кислоты и 100 мл тетрахлорметана перемешивается при 40 С до полного исчезнования исходного вещества. Ход реакции контролируют хроматографией (тонкослойной). Смесь нейтрализуют твердым карбона- . том натрия, после часового перемешивания натриевые соли отфильтровывают, раствор отпаривают и полученный продукт формулы II (Y OCH2CgH Cl; ) используется при восстановлении диизобутилалюмогидридом. Пример 20. К раствору 536 м вещества формулы II ( ) в 15 мл безводного дихлорэтана, охлажденному до ,добавляют 400 мг сухого этилвинилэфира в 1 мл 1,2-дихлорэтана, насьщенного . при О С газообразным безводным хлористым водородом. Через 2 ч после исчезновения из реакционной смеси исходного материала (хроматография на тонком слое силикагеля С,элюент бенэол-эта25НОЛ 100:5)реакционная смесь фильтрует через глинозем,и отпаривается досух Сиропообразный продукт формулы II (г СНзСНОС2И5; весом 800 мг не показывает в 11К-спе ре полосы в области 3200-3600 см (отсутствует ОН-группа), а показыва ет интенсивную полосу при 1771 см отвечающую у-лактоновой группировк В масс-спектре обнаружен молекулярный вид иона при m/Z 412, Полученный -лактон восстанавли вают диизобутила.пюмогидридом так, как описано в примере 1, а потом (Полученный лактол при обычных услов ях (пример 5) переводят воздействие илида в требуемый продукт формулы IV ( Z CH3CHOC3H5; ,; ). Получают 412 мг маслянистого продукта, структура ко торого подтверждена с помощью спект ральных методов. В ИК-спектре прису ствуют полосы 3595 см валентного колебания гидроксильной группы, 2890-2960 - валентного колебаНИН СНв СН-, и СН.,-группе, 1355-1460 - деформационного ко лебания СН-группировки, 965 см деформационного колебания СН трансСН СН и 710 см - деформационного колебания СН в цис-СН СН-группировк Пример 21. 380 мг кислоты формулы IV ( Z CHjСНОСзН) растворяют в 10 мл бе водного диметилформамида в колбе, завернутой в алюминиевую фольгу. По том добавляют 200 мг свежеприготовленной сухой окиси серебра и реакционная смесь перемешивается в течение 12 ч, после чего к реакционной смеси добавляют 140 мг свежедистиллированного бромгексана. Ход реакции контролируется тонкослойной хроматографией на силикагеле С в системе хлороформ-изопропиловый спирт-аммиак вода в соотношении 10:15:0,5:1,5. По истечении 6 ч реакционную смесь фильтруют через слой суперцелла, из фильтрата отгоняют летучие вещества при температуре до 60 С при давлеНИИ 2 Па. Дистилляционный остаток хроматографируют на колонке 30 г сил кагеля (100-160, в системе хлороформ этанол 100:5). Получают мг вещества формулы IV (,H, ; ; Е СНзCHOCjН), структура которого находится в соответствии с интерпретацией спектров. 3426 Пример 22. 440 мг вещества формулы II ( У СНзСН2); Z(CH3)2CQCjH5; ), приготовленного из соединения формулы II ( СНзСНг; ) воздействием метилизопропенилэфира, растворяют в 25 мл свежедистиллированного толуола и реакционную смесь потом охлаждают в ванне до (-76) - (-80)°С. Потом при перемешивании добавляют 1,1 эквивалент диизобутилалюмогидрида и после дальнейших 25-30 мин перемешивания при этой темп ературе реакционную смесь разлагают 3 мл метанола и, наконец, после нагревания до комнатной температуры - 20 мл воды. После отделения органического слоя водная фаза экстрагируется 3x25 мл хлороформа, соединенные экстракты высушивают безводным сульфатом магния и после отпаривания растворителей на вакуумном ротационном испарителе получают 410 мг маслянистого продук|Та, масс-спектр которого находится в соответствии с предложенной структурой. Потом вещество перерабатывают без дальнейшей очистки. После растворения в 10 мл безводного диметилсульфоксида раствор добавляют (в атмосфере азота) к раствору илида, приготовленного из 525 мг 2,2,2-трифторэтил 5-трифенилфосфоний бромида и 1,1 мл 2,32 М раствора диметилсульфоксида натрия в 9 мл диметилсульфоксида. После добавления лактола реакционную смесь перемешивают в течение 5 ч при комнатной температуре, потом при охлаждении водой разлагается 6 мл воды и водный слой экстрагируется 6x10 мл этилацетата. Соединенные экстракты промывают насьпценным раствором поваренной соли (3 мл), высушивают и отпаривают растворители. Получают 390 мг продукта формуглы IV (Х ОСНгСГз; Y CH2CHj; Z(CH3)2COC2H5; ) в виде вязкого масла. C,.Oj (608,7). Вычислено,%: F 9,36. Получено,%: F 8,89. В ИК-спектре обнаружена полоса при 1735 см , соответствующая валентному колебанию СО-группы в эфире, и узкая полоса при 3569 см, соответствующая присутствию свободной ОН-груцпы. Пример 23.К раствору 0,536 г (2 миллимоль) соединения формулы II ( ) в 20 мл безводного тетрагидрофурана добавля
Авторы
Даты
1984-07-23—Публикация
1979-08-07—Подача