сн
Изобретение относится к способам определения активности фермента глутаматоксалацетаттрансаминазы (GOT) и глутаматпиру1ваттрансаминазы (GPT) , а также к реагентам, пригодным для проведения этого способа и может быть применено для определения названных ферментов в биологических жидкостях, таких как сыворотка, моча или в др.
Цель изобретения - ускорение анализа.
Определение глутаматоксалацетаттрансаминазы или глутаматп1фуваттрансаминазы осуществляют путем инкубации исследуемого фермента с глутаматом-в буферном растворе с последуюпщм фотометрированйем, для чего 50 ммоль/л глутамата предварительно вводят во взаимодействие с 0,150 ммоль/л окСаната или пирувата соответственно в буферном растворе с рН 7,0-9,0, далее в реакционную смесь вносят 10-300 ммоль/л Jf -аминобутирата с 500-2000 Ед/л аминобутираттрансаминазы, затем добавляют семиальдегиддегидрагеназу. Полученный восстановленньш NADP фотометрируют.
Способ осуществляют следующим образом.
Комбинируют реакции по уравнениям
ПАВ-GT
об -КС -аминобутират
сук-
цинатсемиальдегид +od-глутамат, где GAB-GT-j -аминобутираттрансаминаза; ,сукцинатсемиальдегид + NADP---Sqq д )iji
-S- сукцинат + NADPH + Н , где
SS -AB-DH сукцинатсемиальдегиддегидрогеназа,
и осуществляют реакцию, которую проводят с солью тетразола в присутствии переносчика электронов для повторного окисления NADPH при одновременном образовании окрашенного формазана, который легко можно измерить в видимой части спектра. Это соответствует уравнению:
NADPIl 4- МТТ + К ДиаФораз|
+ NADP/ где МТТ 3-(4,5-диметилтиазолйл-2)-2,5-дифенилтетразолила бромид.
Способ проводят при рН 7-9,5. При более высоких и более низких значениях рН происходит существенно замедление реакции с соответствующим удлинением времени, необходимого для проведения одного теста. Самые хорошие результаты получают при значениях рН в интервале 8-8,6.
Пригодная концентрация буфера лежит в интервале 5-0,5 моль/л, что соответствует концентрации буферной соли в тесте 0,05-6%. Предпочтительно использование буфера концентрацией 10-100 ммоль/л.
В качестве соли тетразола используют МТТ.
Хорошие результаты получены с хлоридом нитроголубого тетразола (NBT) и хлоридом 2-(п-йодофенил)-3-(п-нитрофенил)-5-фенилтетразола (INV). При измерении красителя формазана целесообразно добавлять поверхностноактивные вещества, которые улучшают растворимость красителя.
В примерах используют сокращения: GPT - глутаматпируваттрансаминаза;
GAB-GT - - аминобутираттрансаминаза:
SS-A1-DH - сук1щнатсемиальдегиддегидрогеназа;
GOT - глутаматоксалацетаттрансаминаза,
NADP - никотинамидадениндинуклеотидфосфат;
NADPH - никотинамидадениндинуклеотидфосфат восстановленный;
МТТ - 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолила бромид;
Трис - трис(оксиметил)-аминометан; Тритон RX100 - алкиларилполиэтиленгликолевый эфир.
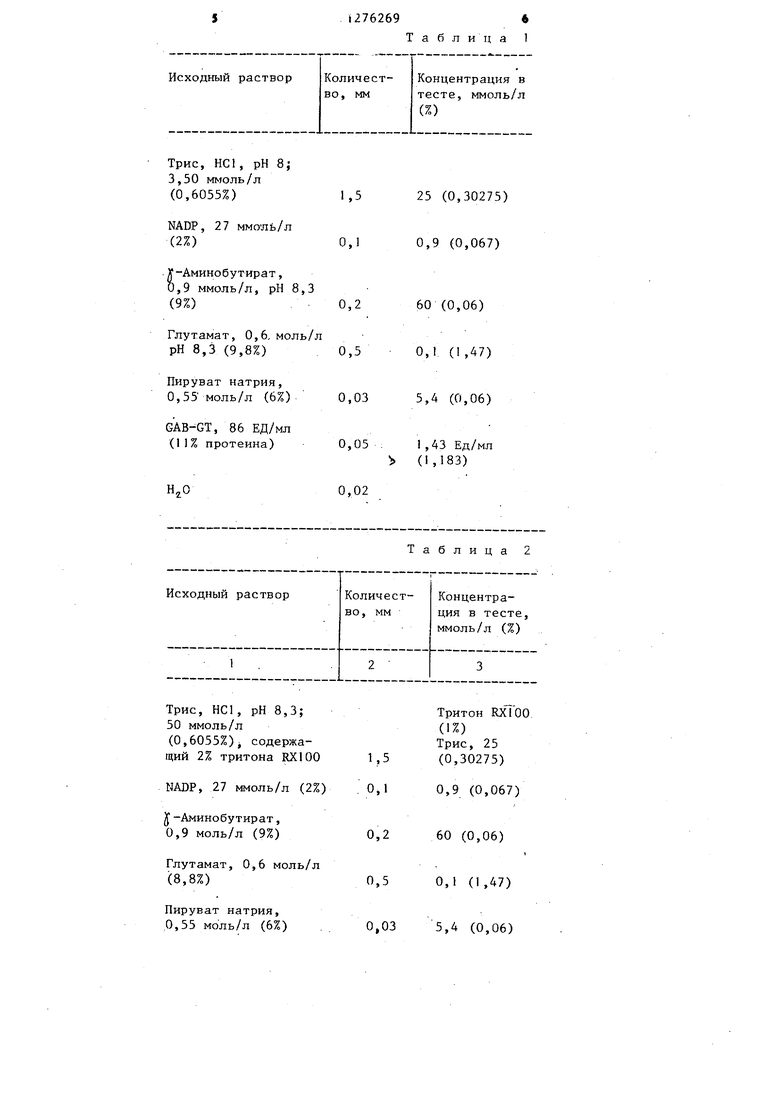
Пример 1. Определение GPT. Образование NADPH является сигналом измерения. Температура 25°С, длина волны 365 нм, тестовый объем 3 мл, 1-сантиметровая кювета.
Данные приведены в табл.1.
Исходный раствор перемешивают. Начинают реакцию с 0,5 мл сыворотки (GPT-обогащенная), перемешивают, 2 мин инкубируют, снимают показания
через 1,2,3 и 4 мин точного вре
мени, далее снимают .показания Е
и Е,
9
На основании полученных данных рассчитывают значение Е/мин.
Активность GPT в пробе рассчитывают по формуле
|ТГ Е. 1,714.
Ед/мл
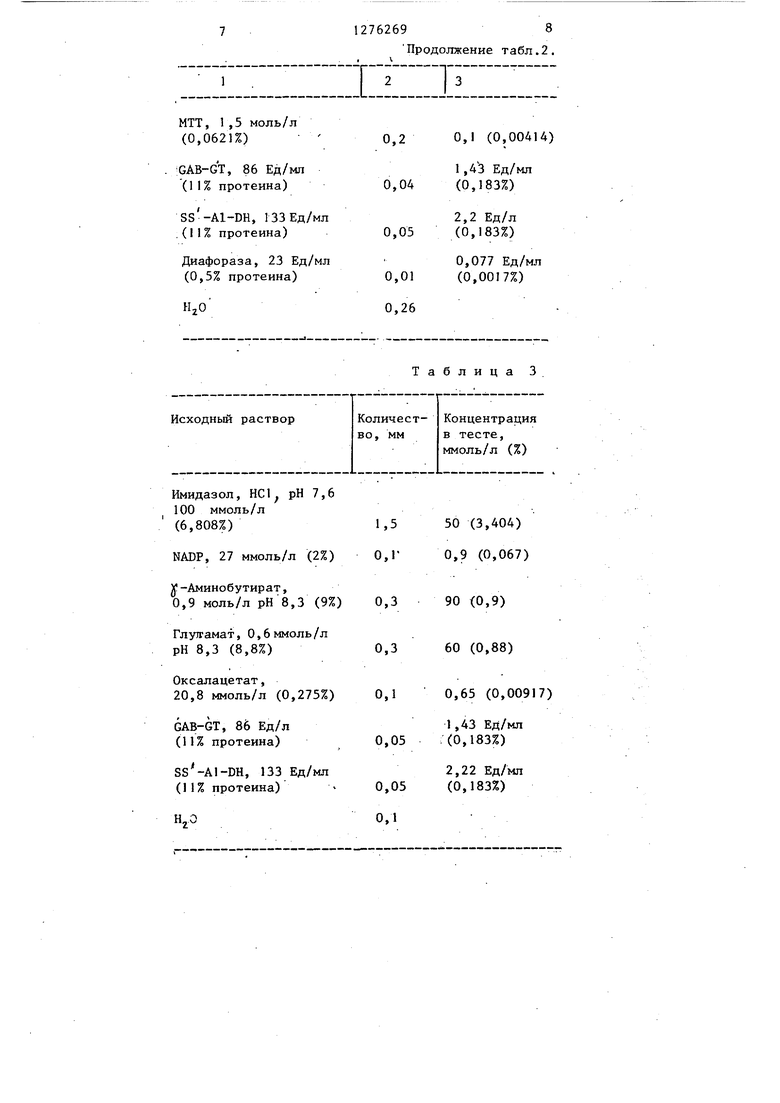
Пример 2. Определение GPT. Образование формазана выбирают в качестве сигнала измерения. Температура 25°С, длина волны 578 нм, тестовый объем 3 мл, кювета толщиной 1 см. Б кювету пипеткой вводят вещества, указанные в табл.2. Исходньш раствор перемешивают. Начинают реакцию с 0,1 мл сыворотки (GPT-обогащенная), перемешивают, 2 мин инкубируют, снимают показачерез 1, 2, 3 и 4 мин точно го времени. Далее снимают показания Е, Е, Е и Е, на основании которых рассчитьгоают значение СРТ-Е/мин Активность в пробе рассчитывают по следующей формуле: ЛЕ 1,796 Ед/мл Пример 3. Определение GPT Образование NADPH принято в качеств сигнгша измерения. Температура изме рения 25 С, длина волны измерения 365 нм, тестовый объем мл, кювета толщиной 1 см. В кювету пипеткой вводят вещества, представленные в табл.3. Исходный раствор перемешивают. Реакцию начинают с 0,5 мл сыворотки (GOT-обогащенная), перемешивают, 2 мин инкубируют, снимают показание Е,, через 1, 2, 3 и 4 мин точно го времени, далее снимают показания Ej, Е 3 4 5 основании полученных данных рассчитывают ЛЕ/мин Активность GOT в пробе рассчитывают по формуле Ед/мл ЛЕ 1 ,717 Пример 4. Определение GOT Образование формазана принято в качестве сигнала измерения. Температура 25 С, длина волныизмерения 578 нм, тестовый объем 3 мл, кювё,та толщиной 1 см. Исходный раствор перемешивают. Реакцию начинают с 0,05 мл сыворот (GOT-обогащенная), перемешивают, 2 мин инкубируют, снинают показани EJ, через 1, 2, 3 и 4 мин точного времени, далее снимают показания Ей .и ЕС Z V 694 АКТИВНОСТЬ GOT в пробе рассчитывают по формуле ЕД/МЛ 3,593. П р е р 5. Определение на тестовой полосе. Пригодную бумагу пропитывают раствором, содержащим все реагенты, приведенные в примере 2, осторожно сушат, укрепляют на ПГ ИГОДРЮМ носителе, запечатывают и разрезают на полосы. После погружения в сьшоротку появляется красно-голубое окрашивание, интенсивность которого пропорциональна активности ОРТ в пробе. Оценку можно проводить сравнением с пригодной шкалой стандартного окрашивания, а также с помощью отражательного фотометра. Пример 6. Определение GOT на тестовой полосе. Пригодную бумагу пропитывают раствором реагентов, приготовленным по примеру 4, осторожно высушивают, укрепляют на пригодном носителе, при необходимости запечатывают и разрезают на полосы. После . погрзгжения в сыворотку появляется kpacHo-голубое окрашивание, интенсивность которого пропорциональна GOT-активности в пробе, Оценку можно проводить сравнением с пригодной шкалой стандартной окраски, а также с помощью отражательного фотометра. Формула изобретения Способ определения глутаматоксалацетаттрансаминазы шти глутаматпируваттрансаминазы путем инкубации исследуемого фермента с глутаматом в буферном растворе с последующим фотометрированием, отличающийся тем, что, с целью ускорения анализа, 50 ммоль/л глутамата предварительно вводят во взаимо-:- действие с 0,1-50 ммоль/л оксаната Или пирувата соответственно в буферном растворе с рН 7,0-9,0, далее в реакционную смесь вносят .10300 ммоль/Я J-аминобутирата и 5002000 Ед/л аминобутираттрансамнназы, затем добавляют семиальдегиддегидрагеназу; полученный восстановленный NADP фотометрируют.
Трис, НС1, рН 8;
3,50 м)оль/л
(0,6055%)
NADP, 27 ммоль/л
(2%)
-Аминобутират, ,9 ммоль/л, рН 8,3 (9%)0,2
Глутамат, 0,6, моль/л
рН 8,3 (9,8%)
Пируват натрия,
0,55 моль/л (6%)
GAB-GT, 86 ЕД/мл (11% протеина)
,02
25 (0,30275) 0,9 (0,067)
60 (0,06) 0,1 (1,47) 5,4 (0,06)
I,43 ЕД/МЛ (1,183)


Изобретение относится к клинической биохимии и предназначено для определения глутаматоксалацетаттрансаминазы и глутаматпируваттрансаминазы и реагента для их определения. Цель изобретения - ускорение способа. К глутамату добавляют пируват и )-аминобутират. При этом буферный раствор имеет рН 7,0-9,0. В реакционную смесь вносят аминобутираттрансаминазу и семиальдегид - дегидрогеназу. Производят фотометриро вание. Затем рассчитывают активность глутаматпируваттрансаминазы. 4 табл,.
Трис, НС1, рН 8,3; 50 ммоль/л (О,6055%)i содержащий 2% тритона RX100
NADP, 27 ммоль/л (2%)
J-Аминобутират, 0,9 моль/л (9%)
Глутамат, 0,6 моль/л (8,8%)
Пируват натрия, 0,55 моль/л (6%)
Таблица 2
Тритон КХГОО
(1%)
Трис, 25 (0,30275)
0,9 (0,067)
0,2 60 (0,06)
0,5 0,1 (1,47)
0,03 5,4 (0,06)
12762698
jZIZiIZZI
0,2 0,1 (0,00414)
1 ,4:3 Ед/мл
0,04 (0,183%)
2,2 Ед/л
0,05 (0,183%)
0,077 Ед/мл 0,01 (0,0017%)
0,26
«. .......«..«|...«.
Количест- Концентрация
Имидазол, HC1 рН 7,6
100 ммоль/л
(6,808%)
NADP, 27 ммоль/л (2%)
у-Аминобутират,
0,9 моль/л рН 8,3 (9%)
Глужамат, 0,6 ммоль/л
рН 8,3 (8,8%)
Оксалацетат,
20,8 ммоль/л (0,275%)
GAB-GT, 86 Ед/л
(11% протеина)
SS-AI-DH, 133 Ед/мл
(11% протеина)
HjO0,1
Продолжение табл.2.
I X
Таблица 3
во, мм в тесте,
ммоль/л (%)
50 (3,404) 0,9 (0,067)
90 (0,9) 60 (0,88)
0,65 (0,00917)
1,43 Ед/мл (0,183%)
2,22 Ед/мл (0,183%)
| Clin Chim | |||
| Acta, 28, 1970, 431-437 | |||
| Biochimic Clinica, 2, 197 Г, 25-36. |
Авторы
Даты
1986-12-07—Публикация
1979-08-06—Подача