Изобретение относится к микробиология и касается, отбора биологически активных соединений (БАС) с антимикробной направленностью.
Целью изобретения является повышение точности снособа.
Способ осу1 1;ествляется следующим образом.
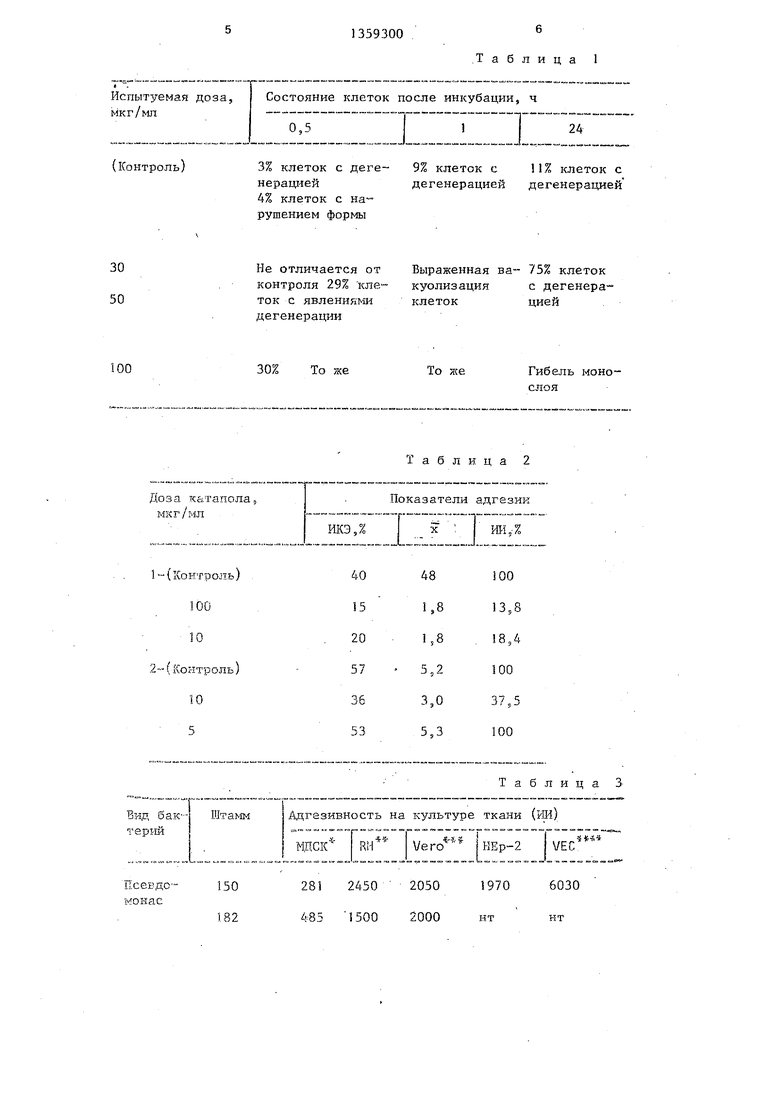
Определяют минимальную токсическую дозу (МТД) БАС, культивируя эпителиальные клетки в среде, содержащей разные дозы БАС. Доза, которая при выбранной экспозиции вызывает изменения в 50% клеток, считается минимальной токсической.
Определяют минимальную ингибирую- щую концентрацию (МИК) биологически активных соединений, культивируя тест-микробы в среде., содержащей разные дозы БАС, Та доза БАС, которая полностью подавляет рост бактерий, считается минимальной ингибирую щей.
Определяют степень подавления адгезии путем совместной инкубации эпителиальных клеток и тест-микроба в среде, содерлсащей дозы БАС ниже или равной МИК, но в 2 и более раз ниже МТД.
Пример 1. Определение антиинфекционной активности и катапола на тест-системе стрептококка группы А и тест-культуры эпителия НЕр-2.
Испытуемый БАС - катионный поли. о
мерный антисептик катапол. Тест-микроб - стрептококк группы А, тип М2, К- 59. Среда для культивирования стрептококка - мясо-пептонный бульон Среда для культивирования ткани - 5%-ньш | гемогидролизат или среда 199 Тест-культура эпителия - 48-часовой монослой НЕр-2.
Определение МТД катапола.
Суспензию эпителиальных клеток НЕр-2 в концентрации 100-200 тыс/мл гзносят в пробирки с покровными стеклами ( мм) в объеме 2 мл на стекло. Монослой эпителия формируется в течение 48 ч при 37 С, после чего культуральную среду сливают и стекла с монослоем инкубируют в среде, содержащей катапол в дозах 1 - 100 мкг/мл (табл.1). Для сравнения монослой и1П :убируют в среде без катапола. Через 30 мин или 24 ч экспозиции среду сливают, монослой фиксируют этанолом и окрашивают азур-эо- зином. Препараты исследу19Т под микроскопом, оценивая состояние клеток (целостность монослоя, отсутствие или наличие дегенеративных изменений
в клетках) по сравнению с контролем.
Из данных табл.1 следует, что
30-минутная экспозиция монослоя с ка- таполом в дозе 50-100 мкг/мл приводит к появлению первых признаков
цитотоксического эффекта (число кле-. ток с явлениями дегенерации в 2 ра- за больше, чем в контроле). При длительной экспозиции (24 ч) основная масса клеток (75%), инкубированных с катаполом в дозе 30 мкг/мл, де- генерирована, что свидетельствует о цитотоксическом эффекте. Большие дозы катапола приводят к гибели всех клеток и разрушению монослоя.
Таким образом, МТД катапола при короткой экспозиции - больше 100 мкг/мл, а при длительной экспозиции - 15 мкг/мл.
Определение МИК катапола.
В питательную среду, содержащую катапЪл в дозах 1,25-25 мкг/мл, вносят одинаковую посевную дозу стрептококка (1-10 КФЕ). Через 24 ч инкубации при отмечают выраженность
роста по помутнению среды в каждой пробирке по сравнению с контрольной (среда без катапола). Степень помутнения среды в процессе роста может быть определена количественно на
спектрофотометре при длине волны проходящего света 650 нм. Для количественного определения числа жизнеспособных клеток из пробирок с заметным помутнением среды готовят
серию десятикратных разведений, высеваемых на чашки с плотной питательной средой. По .числу колоний, формирующихся на чашках через 24 ч инкубации при 37 С, судят о концентрации бактерий в опытной и контрольной пробах. В данном опыте МЖ катапола для стрептококка группы А - 25 мкг/мл.
Определение степени подавления
адгезии катаполом.
В пробирки с монослоем эпителия НЕр-2 вносят 2 мл среды, содержащей катапол в дозах 5-100 мкг/мл и 0,2 мл суспензии стрептококка стандартной густоты (0,1 при длине волны 650 нм). Смесь инкубируют 30 мин при 37 С, клетки монослоя отмывают от неприкрепившихся бактерий многократной сменой физиологического
раствора, фиксируют, окрашивают азур-эозином и исследуют под микроскопом, определяя степень инфици- рованности монослоя сравнительно с контролем (среда без БАС). При этом подсчитывают число инфицированных клеток эпителия (ИКЭ), среднее число кокков на одной эпителиальной клетке (х) и индекс инфицирования монослоя (ИИ), умножая ИКЭ на х, и выражают его в % по отношению к контролю, принимаемому за 100%.
Адгезивные свойства стрептококка группы А, преинкубированного с разными дозами катапола, приведены в табл. 2..
Из таблицы 2 видно, что в двух независимых постановках эксперимента удается получить хороший эффект ингибирования адгезии дозой Ю - 100 мкг/мл. В 2 раза меньшая доза (5 мкг/мл) неэффективна, а использование дозы более 100 мкг/мл приводит к проявлению цитотоксического эффекта и разрушению монослоя.
Адгезивные свойства различных видов бактерий к культуре клеток различного происхождения приведены в табл.3.
Из табл.3 видно, что различные клетки проявляют неодинаковую чувствительность к инфекции исследованными возбудителями, выделенными из клинического материала.
Влияние БАС на адгезию разных видов возбудителей к нормальньм клеткам человека (вагинальньй эпителий) приведено в табл.4.
Как видно из табл.4, антиинфекционная активность БАС выражена по- разному в зависимости от возбудител
Поскольку МТК хлоргексидина для вагинальных клеток равна 100 мкг/мл то титрование антиинфекционной активности начинают с дозы 50 мкг/мл (МТК:2). Эффективные дозы, подавляющие инфекционность псевдомонад, находятся в интервале 5-50 мкг/мл, а выбор дозы определяется тяжестью инфекции.
359300
Катапол активен при стафилококковой и псевдомонадной инфекции, причем по отношению к стафилококковой он эффективен в -интервале 5 - 50 мкг/мл, в то время как по отношению к псевдомонадной - только в дозе 50 мгк/мл.
Катамин - наиболее токсичньш для клеток препарат, что позволяет- erd использовать в концентрации не более 25 мкг/мл.
Таким образом, использование способа позволяет повысить точность определения антиинфекционной активности препаратов за счет приближения способа к условиям макроорганизма, учесть также бактериостатический эффект и влияние препаратов на ад- гезионность возбудителя. Способ не требует использования экспериментальных животных.
25 Формула изобретения
Способ определения антиинфекционной активности биологически активного соединения путем инкубирования различных доз исследуемого биологически активного соединения с тест- культурой микроорганизмов и определения минимальной ингибирующей концентрации его по отношению к тест- микроорганизму, о тличающи й- с я тем, что, с целью повьш1ения точности способа, дополнительно определяют минимальную токсическую дозу исследуемого соединения по отношению к культуре эпителиальных клеток, а затем определяют степень адгезии тест-микроорганизма путем добавления различных- доз исследуемого соединения в систему культура эпителиальных клеток - тест-микроорганизм, при этом используют исходную дозу соединения, не превышающую 50% минимальной токсической дозы, и антиинфекционную активность соединения определяют по степени подавления адгезии тест-микроорганизма.
0
5
0
5
0
Испытуемая доза, мкг/мл
Состояние клеток после инкубации, ч
IIIEIIZIIIE:
0,5
3% клеток с дегенерацией4% клеток с нарушением формы
Не отличается от контроля 29% клеток с явлениями дегенерации
100
30%
То же
Показатели адгезии ИКЭ,% I X I ИРЬ
ZIEII
150 182
281 2450 2050 1970 6030 485 1500 2000 нт нт
Д а б л и ц а 1
9% клеток с 1% клеток с дегенерацией дегенерацией
Выраженная ва- 75% клеток куолизация с дегенера- клеток цией
То же
Гибель моно- слоя
Таблица 2
Показатели а I X I
ZIEII
Таблица 3
Кандида
421
f
Культура клеток почки Культура клеток почки века.
Культура клеток почки ны.
«ft
Эпителий вагины.
Продолжение табл.З
нт
61
76
752
Таблиц а А

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ БАКТЕРИОФАГОВ | 2005 |
|
RU2296163C2 |
| АНТИМИКРОБНОЕ СРЕДСТВО | 2007 |
|
RU2314821C1 |
| СПОСОБ ОЦЕНКИ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ ИММУННЫХ ПРЕПАРАТОВ | 2005 |
|
RU2291425C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ТОКСИЧНОСТИ ХИМИЧЕСКИХ АГЕНТОВ НА КУЛЬТУРАХ ФИБРОБЛАСТОВ КОЖИ И ЛЕГКИХ ЭМБРИОНА ЧЕЛОВЕКА | 1993 |
|
RU2079130C1 |
| Способ выявления СнLамYDIа тRасноматIY | 1990 |
|
SU1723129A1 |
| СПОСОБ ОЦЕНКИ УРОВНЯ СОРБЦИОННОЙ АКТИВНОСТИ СОРБЕНТА | 2004 |
|
RU2298036C2 |
| Способ оценки специфической активности бактериофага c использованием клеточных культур | 2019 |
|
RU2723188C1 |
| ШТАММ LACTOBACILLUS PARACASEI CNCM I-2116 (NCC 2461), ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ ПРЕДОТВРАЩАТЬ КОЛОНИЗАЦИЮ КИШЕЧНИКА ПАТОГЕННЫМИ БАКТЕРИЯМИ, ВЫЗЫВАЮЩИМИ ДИАРЕЮ, И ПРЕДОТВРАЩАТЬ ЗАРАЖЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК КИШЕЧНИКА РОТАВИРУСАМИ, ПИЩЕВОЙ ПРОДУКТ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ДИАРЕЕЙ | 2000 |
|
RU2247569C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОДУКЦИИ ИНТЕРФЕРОНОВ КАК ПАРАМЕТРОВ ВРОЖДЕННОГО ИММУНИТЕТА | 2017 |
|
RU2657808C1 |
| ШТАММ LACTOBACILLUS MUCOSAE ДЛЯ ПОЛУЧЕНИЯ ФЕРМЕНТИРОВАННЫХ ПИЩЕВЫХ ПРОДУКТОВ | 2011 |
|
RU2606770C2 |
Изобретение относится к области микробиологии и касается отбора биологически активных соединений (ВАС) с антимикробной направленностью. Цель изобретения - повышение точности способа за счет приближения способа к условиям макроорганизма. Сущность способа сводится к тому, что определяют МТД - минимальную токсическую дозу ВАС, культивируя эпителиальные клетки в среде, содержащей разные дозы ВАС; параллельно определяют минимальную ингибирующую концентрацию БАС, культивируя тест- микроорганизм в среде, содержащей разные дозы БАС, затем определяют степень подавления адгезии путем совместной инкубации зпителиальиых клеток и тест-микроорганизма в среде, содержащей дозы БАС, в 2 и более раз меньшие МТД. 4 табл. (Л Од СП со со

| Навашин С.М., Фомина И.П | |||
| Рациональная антибиотикотерапия | |||
| М.: Медицина, 1982. |
Авторы
Даты
1987-12-15—Публикация
1986-01-27—Подача