00 01
Изобретение относится к новым билогически активным соединениям poэo-N-(бэтa-xлopэтил)кapбaмoилпeпт дам или их хлоргидратам, обладающим противоопухолевой активностью, которые могут найти применение в медицине.
Цель изобретения - поиск новых
производных пептидной структуры, обладающих более высокой противоопухолевой активностью.
Пример 1, Альфа, эпсилон- -бис-(бэта-хлорэтш1карбамоил)лизил- пролилвалинамид.
736 г (1,6 ммоль) лизилпролилва- линамиддиацетата растворяют в 8 мл диметилформамида и раствор охлаждаю до 0°С, Далее в раствор по каплям добавляют 0,46 мл (3,2 ммоль) триэт амина и 0,34 мл (4 ммоль) бета-хлор этилизоцианата. Реакционную смеСь перемешивают при 0°С в течение 4 ч, после чего ему дают постоять и перегоняют в вакууме. Остаток смешива ют с водой, выпавший в осадок продукт отделяют фильтрованием и сушат Таким образом получают 480 мг указаного соединения. Выход 54%j т, пл, 183-185°С; R 0,75 (смесь м-бута- нола с пиридином, ледяной уксусной кислотой и водой в соотношении 4;1: :1j тонкослойная хроматографическая обработка с использованием Кизельге ля G) ,
Вычислено, %j С 47,82; Н 7,11; N 17,74; С1 12,83.
С17.НззКт05С11 (552,5).
Найдено, %; С 47,90; Н 7,60; N 17,41; С1 13,26.
R 0,82 (этилацетат, пиридин, ледяная уксусная кислота и вода в соотношении 60:20:6:11); Rf 0,72 (бутанол, ледяная уксусная кислота вода в соотношении 4:1:1).
Пример 2. Альфа, эпсилон- -бис- Н-нитрозо-Ы- (бета-хлорэтйл) карбамог-шДлизилпролилв алии амид,
460 мг (1 ммоль) лизилпролилва- линамиддиацетата растворяют в 6 мл диметилформамида, после чего в пригтовленный раствор добавляют 0,28 мп (2 ммоль) триэтиламина ,и 548 мг (2 ммоль) N-нитрозо-бета-хпорэтил- карбамоил-п-нитрофенола, а затем 270 мг (2 ммоль) 1-оксибензотриазо- ла. По истечении 2 ч диметилформами отгоняют в вакууме, остаток растворяют в 30 мл этилацетата и экстраги
Q
S
0 нол 25 30
5
0
5
руют водой. Этилацетатную фазу сушат, упаривают. Остаток обрабатывают безводным диэтиловым эфиром, затем ди- этиловый эфир декантируют и масло высушивают. Полученную таким образом твердую пену чистят в колонке, заполненной силикагелем. Фракции собирают и растворитель отгонйют в вакуз ме. Остаток растирают в порошок в присутствии безводного петролейного эфира и отфильтровьгоают. Таким образом получают 312 мг указанного соединения. Выход 51%.
R{ указанного соединения 0,80 (смесь метанола с этилацетатом в соотношении 1 :3; тонкослойная хроматографическая обработка с использованием Кизельгеля G); Rp 0,79 (бута, ледяная уксусная кислота и вода в соотношении 4:1 si).
R исходного продукта 0,88 (смесь этилацетата с пиридином, ледяной уксусной кислотой и водой в соотношении 240:20:6:11; тонкЪслойная хроматографическая обработка с использованием Кизельгеля G),
185 (N-нитрозогруппа, 397 км),
Вычислено, %s :С1 11,59; N 20,61; С 43,17; Н 6,05.
(611,51).
Найдено, %: С1 11,18; N 20,07; С 43,21; Н 6,02.
П р и м е р 3. Альфа, эпсилон-. -бис- Н-нитрозо-К-(бета-хлорэтил), - карбамоил J-лизилпролилвалинаиид,
К 552 мг (1 ммоль) альфа, эпсилон- -бис-(бета-хлорэтилкарбамоил)лизил- пролилвалинамида добавляют 10 мл 99%ной муравьиной кислоты, после чего в течение 1 ч в эту смесь добавляют по каплям раствор 500 мг нитрита на;трия и 3 мл воды. На следующий день реакционную смесь выпаривают в вакууме. Остаток обрабатывают водой, фильтруют и промьшают водой. Таким образом получают 4бО мг указанного соединения. Выход 75%.
50
55
Rr 0,80
(смесь метанола с этил- ацетатом в соотношении 1:3, тонко- . слойная хроматографическая обработка с использованием Кизельгеля G),
184 (N-нитрозогруппа, 397 нм),
Вычислено, %: С1 11,59; N 20,61; С 43,17; Н 6,05,
CnHjiNsO Cli (611,51).
Найдено, %: С1 11,41; N 20,10; С 43,16; Н 6,04. .
314
П р и м е р 4,
а)Апьфа-Н-нитрозо-Н-(бета-хлор- этил) -эпсил он-трет-бут илоксикарбонил- лизилпролилвалинамид,
614мг (1 ммоль) эпсилон-трет-буток сикарб амоиллизшшр олилв алии амиддози- лата растворяют в 10 мл безводного диметилфорамида, после чего в приготовленный раствор добавляют 0,14 мл (1 ммоль) триэтиламина, 274 мг (1 ммоль) N-нитрозо-бета-хпорэтил- карбамоил-п-нитрофенола и 136 мг (1 ммоль) 1-оксибензотриазола и реакцию проводят аналогично изложенному в примере 2. Таким образом получают 250 мг указанного соединения. Выход 43%.
RP указанного соединения 0,90 (смесь хлороформа с метанолом в соот- ношении 9:1, тонкослойная хроматогра- фическая обработка с использованием Кизельгеля G); R 0,92 (этилацетат пиридин, ледяная уксусная кислота и вода в соотнощении 60:20,6:11); R исходного соединения 0,80 (смесь И-бутанола с ледяной уксусной кислотой и водой в соотношении 4;1:1; тонкослойная хроматографическая обработка с использованием Кизельгеля G). - 90 (N-нитрозогруппа, 397 нм).
Вычислено, %: С1 6,15; N 17,02.
(576,10).
Найдено, %:С1 6,00, N 16,61.
б)Альфа-(Н-нитрозо-Н-(бета-хлор- этил ) -карбамоил -лизилпррлилвалин- .амидгидрохлорид.
200 мг альфа-(Ы-нитрозо-п-(бeтa- xлopэтил)кapбaмoил)-эпcилoн-тpeт-бy- токсикарбонишгазилпролилвалинамнда смешивают с 6 мл 0,17 н.раствора муравьиной кислоты в соляной кислоте и раствору дают постоять в течение 5 мин с последукщим его выпариванием.Остаток растворяют в воде и экстрагируют зтилацетатом. Водный слой лиофшшзи- руют. Таким образом получают 140 мг указанного соединения.
R 0,10 (смесь н-бутанола с ледяной уксусной кислотой и водой в со- отношении 4;1;1, продукт Кизельгель G); R 0,64 (этилацетат, пиридин,- ледяная уксусная кислота и вода в соотношении 60:40:12:22); R О,1 (метанол и этилацетат в соотношении 3:1).
Вычислено, %: С1 13,84; N 19,13; ; С 44,49; Н 6,83.
(512,44).
0
85
с
1 4
Найдено, %:С1 13,72; N 18,81 ; С 44,51; Н 6,80.
88 (N-нитрозогруппа, 397 нм).
Пример 5. Бета-хлорэтилкар- бамоилтгшптофилнорлейцнл-альфа-аспа- рагилфенилаланинамид.
615 мг (1 ммоль) триптофилнор- лейцил-альфа-аспарагилфеншталанин- амидгидрохлорида растворяют в 6 мл безводного диметилформамида, после чего в приготовленный раствор добавляют 0,14 мл (11 ммоль) триэтиламина и 0,1 мл (1,2 ммоль) бета-хлорзтил- изоцината и дальнейшую часть реакции проводят аналогично изложенному в примере 1. Таким образом получают 600 мг указанного соединения. Выход 88%. Т.пл. 201-202 С.
Вычислено, %: С1 5,18; N 14,33; С 57,88; Н 6,14.
(684,19).
Найдено, %: С1 4,94; N 13,78; С 57,86; Н 6,12.
5 Rf 0,70 (бутанол, пиридин, ледяная уксусная кислота и вода в соотношении 4;1:1:1); R 0,69 (этилацетат, , ледяная уксусная кислота и вода в соотношении 60:20:6:11).
.
Пример 6. Н-Йитрозо-М-(бе- та-хлорэTtui)карбамокптрвптофиляорлей- цш1-альфа-аспарагилфенкпалакниамид.
684 мг (1 1Фюпь) бета-хпорзтил- карбамош1-триптофилио1шей1ри1-альфа аспарагилфенилаланинвмнда используют для реакции с раствором 300 мг нитрита натрия и 2 мл сложного эфира аналогично излoжeннo 4y в щжмере 3. Таким образом получают 605 чг указанно го соединения. Выкод 35Z.
tLf « 0,80 (смесь н-бутаиола с .ледяной уксусной кислотой и водой в соотношении 4:1:1, Кизельгель С); R 0,42 (этилацетат, пиридин, ледяная уксусная кислота и вода в соотношении 120:20:6:t1)j Rf 0,72 (бутанол, пиридин, ледяная уксусная кислота и вода в соотношении 4:1:1:1).
Вычислено, %: С1 4,97; N 15,71; N0 4,20; С 55,52; Н 5,75..
C33H4iNB08Cl (713,20).
Найдено,, %: С 4,73; N 15,28; N0 3,87; С 55,50; Н 5,77,
Поскольку Е диапазоне нитрозо- группы имеет место поглощение самого пептида, в данном примере нитрозную группу определяют по методу Лоо и Диона.
Пример 7. N-HHTpo3o-N-(6e- та-хлорэтил)карбамоилтриптофилнорлей- цил-альфа-аспарагилфенилаланинамид.
Аналогично изложенному в примере 1 проводят реакцию 921 г (1,5 ммоль) триптофилнорлейцил-альфа-аспарагил- фенилаланинамидгидрохлорида 0,21 мл (1,5 ммоль) триэтиламина, 420 мг (1,5 ммоль) Ы-нитрозо-бета-(хт1орэтилкарбамоил)-п-нитрофенола и 200 мг (1,5 ммоль) 1-оксибензотриазола. Таким образом получают 800 мг указанного соединения. Выход 75%.
R 0,80 (смесь н-бутанола, ледя- ной уксусной кислоты и воды в соотношении 4J1: 1 Кизельгель G).
Вычислено, %: С1 4,58; N 15,32; N0 3,92; С 55,52; Н 5,75.
Cj H NgOgCl (713,20).
Найдено, %: С1 4,58; N N0 3,92; С 55,51; Н 5,73.
Нитрозную группу определяют по ме1,30 мг (2,6 ммоль) эпсилон-трет- бутилоксикарбонилглициллизилпролилтоду, указанному в примере 6,
Пример 8. N-HHTpo3O-N-(63Ta- 25 валинамида растворяют в 13 мл абсо-хлорэтил)карбамоилтриптофиллейцил- лютированного диметилформамида, а затем в приготовленный раствор добавляют 650 мг (2,6 ммоль) N-нитрозо- -бeтa-xлopэтилкapбaмoил-N-oкcиcyкцин- имида и 0,36 мл (2,6 ммоль) триэтиламина. После перемешивания в течение 15 мин реакционную смесь выпаривают в вакууме. Остаток растворяют в этил- ацетате и экстрагируют водой. Этил-альфа-аспарагилфенилаланинамид (111)
a)633 мг (1 ммоль) триптофиллей- цил-альфа-аспарагил-бета-трет-бутил- эфир)фенилаланинамида дают постоять в 6 мл 2 н.раствора этилацетата в соляной кислоте, после чего добавляют в смесь дизтилового эфира, выпавшие в осадок кристаллы отфильтровьша- ют и промывают диэтиловым эфиром. В результате получают 590 мг (выход 93%) указанного продукта.
Rp 0,70 (бутанол, пиридин, ледяная уксусная кислота и вода в соотношении 4:1:1:1); Rf 0,74 (смесь бутанола с пиридином, ледяной уксусной кислотой и водой в соотношении 30:20:6:24; Кизельгель G); R 0,66 (бутанол, ледяная уксусная кислота и вода в соотношении 4:1:1)j 0,10 (этилацетат, пиридин, ледяная уксусная кислота и вода в соотношении 120:20:6:11).
b)92 1 мг (1,5 ммоль) триптофил- лейцил-альфа-аспарагилфенилаланин- амидгидрохлорида растворяют в 10 мл абсолютированного диметилформамида, затем добавляют 373 мг (1,5 ммоль) Н-нитрозо-бета-хлорэтилкарбамоил-Н- оксисукцинимида и 0,42 мл (3 ммоль) триэтиламина. После перемешивания
в течение- 15 мин диметилформамид отгоняют в вакууме. Остаток растирают в воде, отфильтровывают и промывают
30
ацетатную фазу сушат и выпаривают. В результате получают 1,29 мг (Выход
40
45
указанного продукта.
Rг 0,87.(этилацетат, пиридин, ледяная-уксусная кислота и вода в соотношении 60:20:6:11); Rf 0,82 (смесь хлороформа с метанолом в соотношении 8:2; Кизельгель G); R 0,50 (этилацетат, пиридин, уксусная кислота и вода в соотношении 120:20:6; :11).
Вычислено, %: С1 5,60; N 17,69,
С jH4j-NeOgCl (633,16). .
Найдено, %: С1 5,48; N 17,31.
91 (N-нитрозная группа, 397 нм)«
Ь) Альфа-К-нитрозо-Н-(бета,хлор- этил)карб амоил глициллизил пр олилв алин- амидгидрохлорид (IV).
633 мг (1 ммоль) альфа-Ы-нитрозо- -N-(бета-хлорэтил)карбамоил-эпсилон- -трет-бутилоксикарбонилглициллизил- пролилвалинамида вьщерживают в спокойном состоянии в течение 5 мин в 10 мл 0,14 н. раствора муравьиной, кислоты в соляной кислоте, а затем
55
водой. В результате получают 980 мг (выход 92%) указанного продукта.
R 0,69 (смесь этилацетата с пиридином, ледяной уксусной кислотой и водой в соотношении 30;20:6:11, Кизельгель G); R 0,42 (этилацетат пиридин, ледяная уксусная кислота и вода в соотношении-120:20:6:11); R 0,72 (бутанол, пиридил, ледяная уксусная кислота и вода в соотношении 4:1:1:1).
Вычислено, %: С1 4,97; N 15,71; N0 4,20; С 55,52; Н 5,75, . C H NjOgCl (713,20).
Найдено, %: С 4,58; N 15,32; N0 3,95; С 35,49; Н 5,78.
Пример 9.
а) Апьфа-К-нитрозо-К-(бета,хлор- этил )карбамоил-зпсилон-трет-бутилок- сикарбонилглициллизилпролилвалин- амид.
1,30 мг (2,6 ммоль) эпсилон-трет- бутилоксикарбонилглициллизилпролилацетатную фазу сушат и выпаривают. В результате получают 1,29 мг (Выход
0
5
указанного продукта.
Rг 0,87.(этилацетат, пиридин, ледяная-уксусная кислота и вода в соотношении 60:20:6:11); Rf 0,82 (смесь хлороформа с метанолом в соотношении 8:2; Кизельгель G); R 0,50 (этилацетат, пиридин, уксусная кислота и вода в соотношении 120:20:6; :11).
Вычислено, %: С1 5,60; N 17,69,
С jH4j-NeOgCl (633,16). .
Найдено, %: С1 5,48; N 17,31.
91 (N-нитрозная группа, 397 нм)«
Ь) Альфа-К-нитрозо-Н-(бета,хлор- этил)карб амоил глициллизил пр олилв алин- амидгидрохлорид (IV).
633 мг (1 ммоль) альфа-Ы-нитрозо- -N-(бета-хлорэтил)карбамоил-эпсилон- -трет-бутилоксикарбонилглициллизил- пролилвалинамида вьщерживают в спокойном состоянии в течение 5 мин в 10 мл 0,14 н. раствора муравьиной, кислоты в соляной кислоте, а затем
5
раствор выпаривают. Остаток растворяют в воде и экстрагируют этилацета- том. Водную фазу лиофилизуют. В результате получают 540 мг (выход 95%) указанного продукта.
Rf 0,1 (метанол и этилацетат в соотношении 3:1); Rr 0,65 (смесь этилацетата.с пиридином, муравьиной кислотой и водой в соотношении 60:20 :6:5,5; Кизельгель G); R 0,66 (этилацетат, пиридин, ледяная уксусная кислота и вода в соотношении 60: :40:12:22),
Вычислено, %: С1 12,45; N 19,67; С 42,24; Н 6,67.
C iHjgNgOgClj (569,59).
Найдено, %: С1 12,01; N 18,87; С 42,22; Н 6,69.
84 (N-нитрозная группа,396 нм)
Пример 10. N-HHTpo3o-N-(B- -хлторэтил) карбамоилпролилвалинамид.
1,37 г (5 ммоль) пролилвалинамид- ацетата суспендируют в 15 мл безводного диметилформамида и добавляют при перемешивании и охлаждении снегом 1,4 мл (10 ммоль) триэтиламина и 1,25 г (5 ммоль) сложного N-нитрозо- -Н-(В-хлорэтнл)карбаминовая кислота- -N -оксисукцинимидного эфира. После перемешивания в течение 15 мин при 0°С реакционную смесь разбавляют ледяной водой и осажденное соединение отфильтровывают и промывают холодной водой на фильтре. Продукт сушат в эксикаторе над PjOj.Выход 0,91 г(53;г).
0,8 (смесь хлороформа и метанола в соотношении 8:2, Кизельгель G) Т.пл. 130 С (разложение). ((/)5-gj 49,04 (с 1, МеОН); (rf)s4t- 54,25 (с 1, МеОН).
Вычислено, %: С 44,85; Н 6,33; С1 10,19; N 20,13.
C-fjHiiNsO Cl (347,8).
Найдено, %: С 144,83; Н 6,35;: С1 9,86; N 19,76.
88 (400 нм).
Пример 11. о - N-HHTpo3O-N- -(В-хлорэтил)карбамоил - -трет-бутилоксикарбонилтриптофилглициллизил
пролилВалинамид.
К смешанному раствору из 1,2 г (1,74 ммоль) трет-бутилоксикарбонил- триптофилглициллизилпролилвалинамида и 10 мл безводного диметилформамида добавляют при 0,24 мл 1,74 (ммоль триэтиламина и 400 мг (1,6 ммоль) N- -нитро 3 O-N-(В-хлор этил)карбамоил-N- -оксисукцинимида. Через 0,5 ч реак
Q
5
0
5 Q
О
5
ционную смесь выпаривают. Остаток растворяют в этилацетате и экстрагируют водой. Органический слой высушивают над безводным сульфатом натрия и выпаривают. Выход 1,2 г (85%).
R 0,25 (смесь хлороформа и метанола в соотношении 9: 1).
Вычислено, %: N 17,09; С1 4,33.
CjTHsjN oGjCl (819,37).
Найдено, %: N 16,72; С1 4,01.
Пример 12. а( -(Н-Нитрозо-Н- -(В-хлорэтил)карбамоил)триптофилгли- циллизилпролилвалинамидацетат.
819 мг (1 ммоль) (Ы-нитрозо-Н)- -6- лорэтил)-карбамоил-трет-бутилок- сикарбонилтриптофилглициллизилпролил- валинамйда дают отстояться в течение
5 мин в 10 мл 0,12 Н. муравьиной кислоты с хлористоводородной кислотой, затем раствор упаривают в вакууме. Остаток растворяют в воде, экстрагируют этилацетатом. Водную фазу лиофилизируют, затем лиофилизирован- ньй продукт очищают хроматографией на колонке, заполненной силикагелем в соотношении 60:20.:6:11 смесью из этилацетата, пиридина, ледяной уксусной кислоты и вода. После упаривания элюентной смеси, остаток растворяют в воде и лифолизируют. Таким образом получают 480 мг (63%) соли.
R 0,25 (смесь этилацетата, пиридина, ледяной уксусной кислоты и воды в соотношении 60:20:6:11).
Вычислено, %: С 52,36; Н 6,54; N 17,97; С1 4,55.
(779,27).
Найдено, %: С 52,34; Н 6,54; N 17,00; С1 4,46.
Пример 13. (/-СЫ-Нитрозо-Н- -(В-хлорэтил)карбамоилj- -тpeт-бyтшI- oкcикapбoниллизшlтpиптoфиллeйцилac- пapaгшIфeнилaлaнинaмид .
1,4 г (1,73 ммоль) -трет-бутил- оксикарбониллизилтрип офиллейцилас- парагилфенилаланинамида растворяют в 15 мл безводного диметилформамида при . В процессе перемешивания к смеси добавляют 0,24 мл (1,73 ммоль) триэтиламина и 433 мг (1,73 ммоль) М-нитрозо-К-(В-хлорэтил)карбамоил-К- -оксисукцинимида. После перемешивания в течение 1,5 ч реакционную смесь выпаривают в вакууме, остаток растирают в порошок с водой и фильтруют. Сырой продукт растворяют в этаноле, осаждают водой и фильтруют. Таким образом получают 1,8 г продукта. Выход 67%.
Rf 0,83 (смесь бутанола, пиридина, ледяной уксусной кислоты и воды в соотношении 4:1:1:1).
Вычислено, %: N 14,87; С1 3,76.
, (491,50). : Найдено, %: N 14,74; С1 4,12. ; Пример 14. о/-ГN-F итpoзo N- |-(fl-xлopэтил)кapбaиoиллизилтpиптoфил- |пeйцилacпapaгилфeнилaлaнинaмид. I 941 мг (1 ммоль) /-fN-HHTpo3o-N- ;-(В-хлорэтил) карбамоил1-; -трет-бутил Ьксикарбоншшизилтриптчзфиллейциласпа- рагилфениланинамида растворяют в |10 мл 0,12 н, муравьиной кислоты с 5шористоводородной кислотой. Раствор ыпаривают в вакууме через 10 МРШ. рстаток очищают на колонке с силика- .влем со смесью метанола, этилацетата воды в соотношении 2,5:1:0,5. Таким |эбразом получают 580 мг (69%) указан- Його продукта.
I R 0,66 (смесь бутанола, пириди- На, ледяной уксусной кислоты и воды в {соотношении 4:1:1:1). Вычислено, %: С 55,62; Н 16,30; k 16,64; С1 4,20.
,0.9С1 (841,36).
Найдено, %: С 55,64; Н 6,28; N 15,65; С1 3,96.
Пример. 15. .о(- N-HHTpo3o-N- -(В-хлорэтил)карбамоил J- -трет-бу |гилоксикарб ониллизилпр олилв ал инамид :(используя N-нитрозо-(6-хлорэтил)- |сарбамоил-К-оксисукцинимид) . ; К рас-твору из 614 мг (1 ммоль) Й-лиз(БOK)-пpoвaл-NH,-тозилата и 10.мл безводного диметилформамида добавля- Ьт 0,28 мл (2 ммоль) триэтиламина и 237 г (0,95 ммоль) Ы-нитрозо-(й-хлор этил)карбамоил-Н-оксисукцинимида, После перемешивания в течение 30 мин раствор упаривают в вакууме. Остаток растворяют в этилацетате и дважды экстрагируют водой. Этиладетатную фазу сушат над сульфатом натрия и упаривают в вакууме. Получают 526 мг (86%) продукта.
R 0,92 (смесь этилацетата, пиридина, ледяной уксусной кислоты и вода в соотношении 60:20:6:11).
Найдено, %: N 16,63; С1 6,02.
Пример 16. Осуществляют аналогично примеру 4 с той разницей, что вместо N-нитрозо-(В-хлорэтил)карбамо ил-п-нитрофенола используют N-нитрозо- (В-хлорэтил) кapбaмoилJпeнтaxлop- фенол и раствор экстрагируют насыщенным NaHCO, вместо воды. Конечный продукт растирают в порошок со смесью простого эфира и петролейного эфира и фильтруют. Получают 360 мг (58%) продукта, эквивалентного конечному продукту примера 4.
Пример 17. Осуществляют аналогично примеру 4, но вместо N-нитрозо- (й-хлорэтил)-карбамоил-п-нитрофе- нола используют (N-нитрозо-В-хлор- этилкарбамоил)-Н-оксифталевый имид, таким образом получают 400 мг (64%) конечного продукта, эквивалентного конечному продукту примера 4, 5 П р и м е р 18. Осуществляют аналогично примеру 4, но вместо N-нитрозо- (В-хлорэтил)карб амоил-п-нитрофе- нола используют (N-нитрозо-В-хлор- этилкарбамоил)пентафторфенол. Полу- д чают 510 мг (83%) конечного продукта, эквивалентного конечному продукту примера 4о
Проводят биологические испытания предлагаемых соединений, при этом 5 проводят сравнение с известными ци- тостатическими агентами: 1,3-бис- -(бета-хлорэтил)-1-нитрозомочевина (BCNY) и (2-хлорэтил)-3-нитро- . зоуреидоj-2-диокси-О-глюкопираноза Q (хпорозотицин),
Фармакологическая активность предлагаемых соединений демонстрируется результатами испытаний с использованием в качестве испытуемых соединений (/ ,B-биc- N-нитpoзo-N-(B-xлop- этш1)карбамоил лизилпролилвалинамида (соединение I) и о/ -fN-нитpoзo-N-(B- -xлopэтил)кapбaмoилJлизилпpoлшIвaлин- aмид гидрохлорида соединение II).
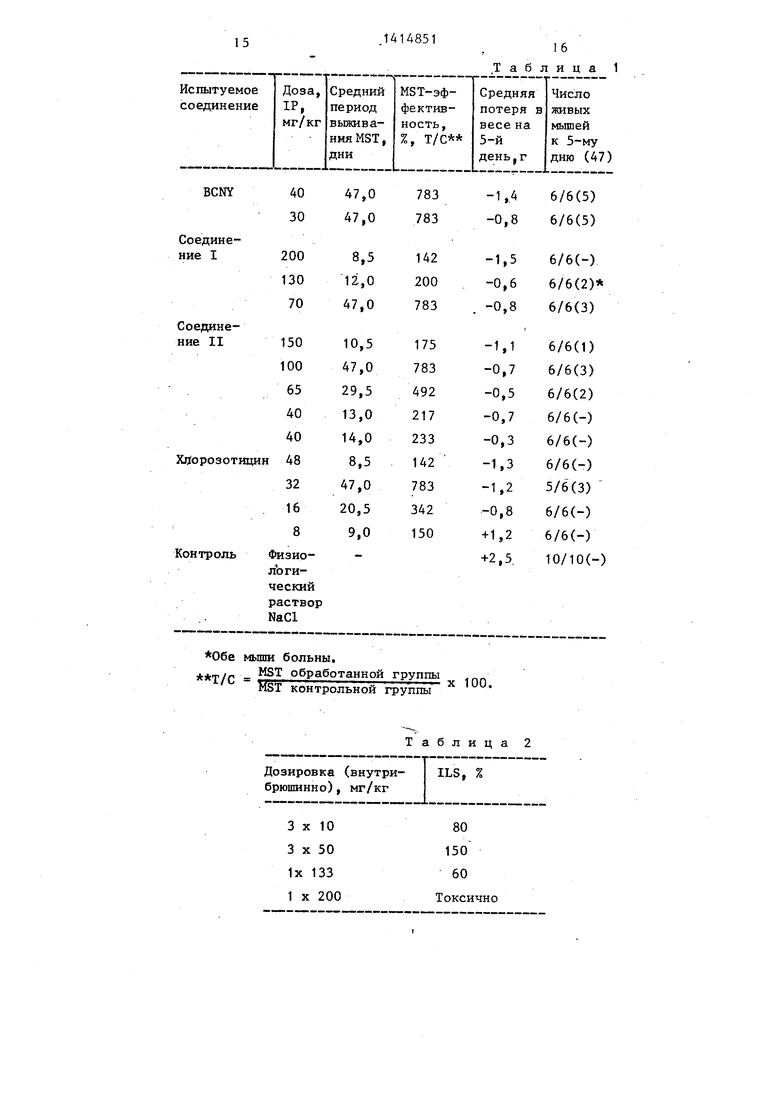
В табл, 1 показанр влияние соединений I и II на внутрибрюшинно имплантированную L 1210-лейкомию, Соединения I и II более активны,чем ВСМУ и хлорозотицин, используемые в качестве сравнительных веществ.
Опухолевый прививочный материал 10 асцитных клеток, внутрибрюшинно. Животное-хозяин - самки мьшей вида CDF, Лечение 3 дня. Токсичность - на 5-й день 4/6 остаются в живых. Критерий - Т/С 7,- 125 - значительная противоопухолевая активность.
В табл, 2 приведены фармакологические свойства соединения II (токсическая доза 133-200 мг/кг внут- рибрюшинно; вещество применяют на мьшах, зараженных L 1210).
Приведенные данные доказьшают,что новые пептидные производные соедине5
0
5
С
ния I и II значительно более активн и менее токсичны, чем BCNY и хлоро- зотицин, используемые в качестве котрольных агентов.
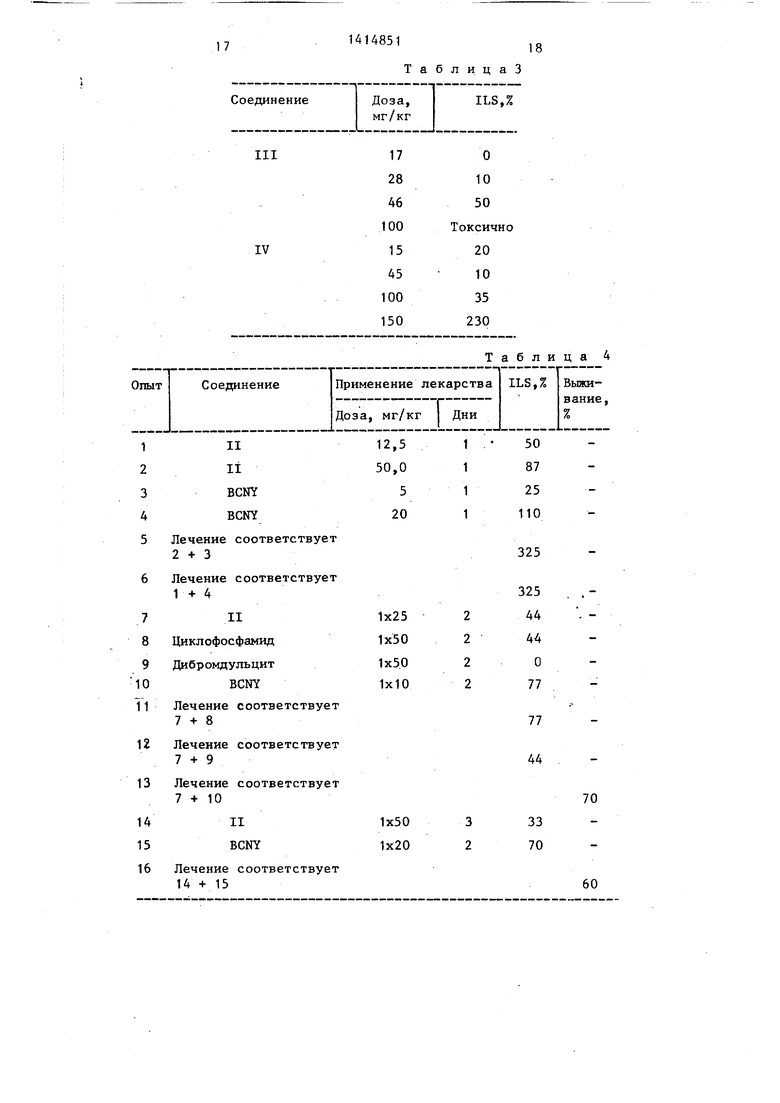
Исследование связи между эффекто и химической структурой соединений, аналогичных соединению II, на мышах зараженных лейкемией L1210, приведе в табл. 3.
Влияние соединения II в комбинации с фармацевтическими агентами на мьпией, зараженных лейкомией L1210 , приведено в табл. 4.
В табл. 5 представлено влияние соединения II на выживание мышей, зараженных лейкемией L1210.
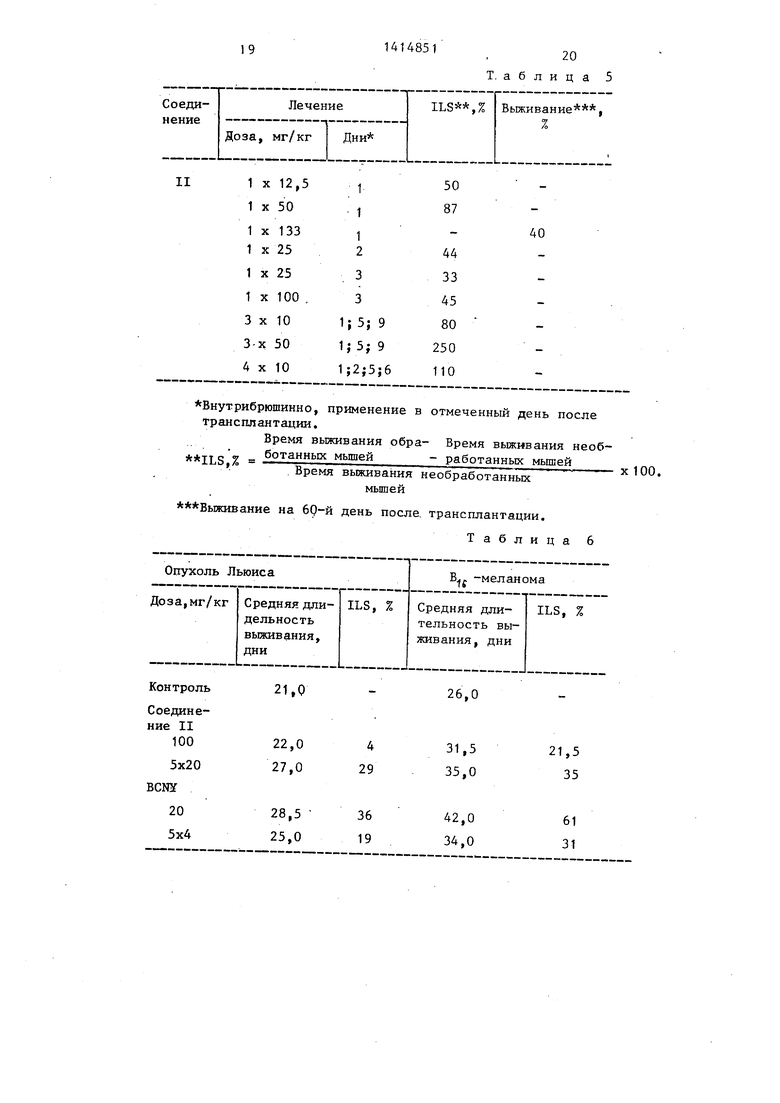
Влияние соединения II на твердую опухоль (табл. 6). опухоль (покожно). Дозировка 100 мг/кг или 5х х20 мг/кг внутрибрюшинно (лечение начинают на следующий день после трансплантации) оказалась неэффективной.
Легочная меланома Льюиса и мела- нома В( -опухоли, дающие на мышах метастазы (i.m.). Внутрибрюшинное применение, начиная со дня, следующего после трансплантации.
Опухолевые ксенографты человека.
НТ18 (амеланотическая меланома).
Контроль - среднее
значение ТД 22,5 дн.
100 мг/кг50,0 дн.(Д
1,0
5x20 мг/кг 56,25 НТ22 (слизистая карценома толсто кишки) .
Контроль17,0дн.
100 мг/кг 24,0 дн.(0,29 5x20 мг/кг 21,3 дн.(0,26 НТ17 (аденоматозная карценома толстой кишки).
Кон троль16,5 дн.
100 мг/кг 14,75дн. (0,0 5x20 мг/кг 5,0 ( Время лечения; при достижении обема опухоли примерно 8 мн. Метод лчения: внутрибрюшинно.
ТД удвоение объема опухоли.
GD задержка роста
1Д(о
где Ке - обработанные, КО - контрол
Влияние пептидо-нитрозомочевино- вых производных на рост экспериментальных твердых опухолей и опухолев ксенографтов человека.
4851
12
Изученные соединения: N-HHTposo-N- -(В-хлорэтил)-карбамоиллизилпролил- валинамид НС1; К-нитрозо-К-(В-хлор- этил)карбамоилглициллизилпролилваяин- амид НС1.
Объекты: экспериментальная твердая опухоль: мышиная опухоль S 180, легочная опухоль Льюиса и мышиная мела- Q нома В ; опухолевые ксенографты человека: амеланотическая меланома НТ18, колоректальная аденокарцинома HT17j колоректальная аденокарцинома НТ22 (слизистая), панкреатическая 5 карцинома НТ27.
Эксперименты на экспериментальных твердых опухолях S 180.
Опухоль разрезают на мелкие кусочки и эти кусочки подкожно трансплан- 0 тируют под шкурку спины мышей разновидности CLFP, Лечение начинают со дня следующего после дня транспланта- .ции. Размер опухолей измеряют кронциркулем, а объем рассчитьтали по их диа- 5 метру. Соединение IIv(внутрибрюшинно) применяемое с дозами 100 мг/кг или 5x20 мг/кг (одна доза в пять дней) не оказывает влияния на рост опухоли.
Легочная опухоль Льюиса. 0 Эту ©пухоль трансплантируют в виде клеточной суспензии в бедренную мьшцу инбридньк мьш1ей С5781 при числе клеток 10 , Растущая опухоль индуцирует регулярные метастазы легких. Лечение начинают в день, следующий после дня трансплантации. Наблюдают выживаемость обработанных и контрольных животных.
в 1 -меланома.
Q Опухоль траксплннтируют под шкуру спины инбридных мышей С5781 в виде кусочков опухолей. Рост опухоли индуцирует метастазы легких. Лечение и оценку действия проводят методом,
5
45
аналогичным описанному для случая легочной опухоли Льюиса.
Результаты, относяшзнеся к LLT и В -меланомам приведены в табл. 7.
Согласно полученным результатам 50 соединение II умеренно удлиняет время жизни животных, включая LLT и В, меланомЫо Степень эффекта ингибиро- вания практически равна эффекту BCNY.
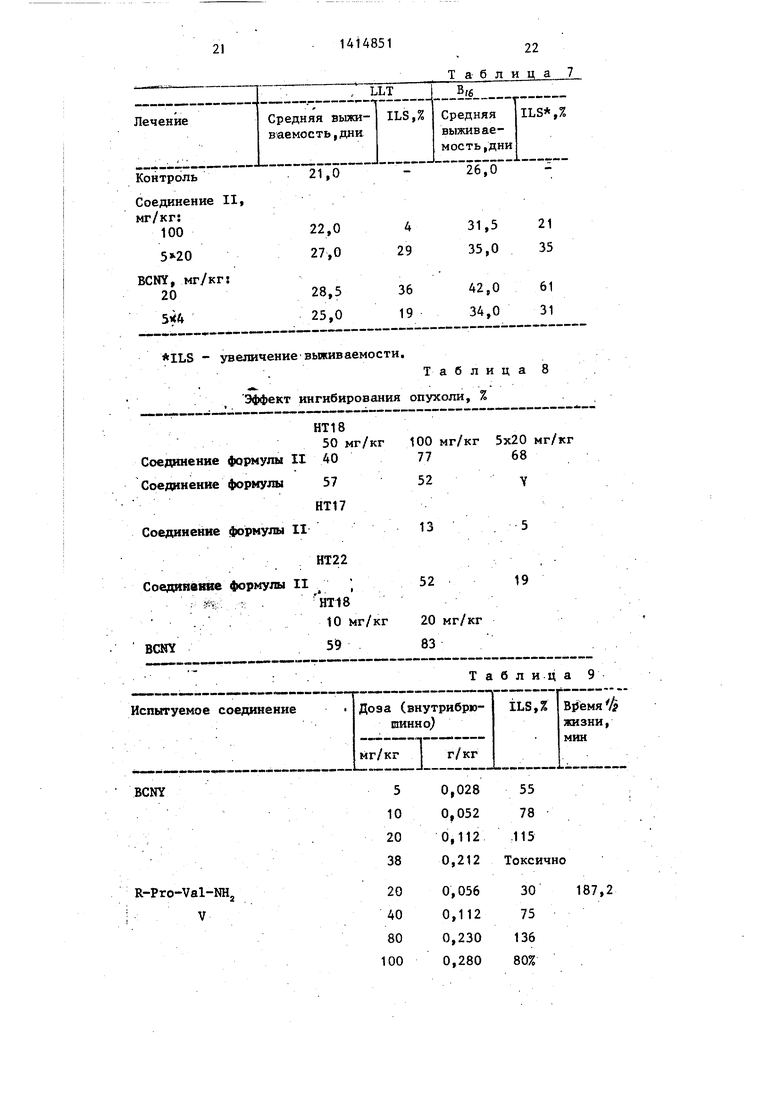
Изучение опухолевых ксенографтов человека.
Кусочки серийно трансплантируемых опухолей (взрослая тимектомия, полное облучение с 8,5 Gy, перестройка
55
мозгового вещества с помощью сингенных медулярных клеток) трансплантируют под шкурку спины искусственно иммунодепрессированных мьпией разновидности СВА/Са,
Внутрибрюшинное введение лекарства начинают тогда, когда опухоли достигают диаметра 0,7-1,0 см и можно наблюдать их прогрессирующий рост. Диаметры опухолей измеряют кронциркулем и их объем рассчитывают на основе их диаметра. (Y f/6xD I средний диаметр). Степень эффекта ингиби- рования опухоли определяют на основании разности объема опухоли измеренного на 21-й день после трансплантации в контрольной и обработанной группе (каждая экспериментальная группа включает по крайней мере шесть опухолей).
Объем обработан - ных опухолей к 21-му дню - объем обработанной
опухоли в о день
X 100%
:Эффект инги:бирования И 00 опухоли Объем контрольной опухоли на 21-й день - объем контрольной опухоли в О день
(100% означает полное ингибирование роста опухоли),
Результаты экспериментов показывают, что пептидонитрозомочевинные производные значительно ингибируют рост амеланотических меленом,тогда как их влияние на рост опухолей толстой кишки и поджелудочной железы несколько ниже (табл, 8),
Опухоль-ингибирующий эффект N-нит розо-(В-хлорэтил)карбамоилпептидных фрагментов на лейкемию мьшей L1210 приведен в табл. 9.
R C1-CH2CH2N-C 0 41
ON на.
- не определялась.
Оценку рпухоль-ингибирующего эффекта относительно L1210 проводят следующим образом, 10 клеток лейкемии L1210 внутрибрюшинно трансплантируют мышам. Лечение начинают в первый день после трансплантации. Соединения, подлежащие изучению, вводят в виде физиологического раствора (NaCl) или 2%-ного буффера твин 80, содержащего 5% диметилсульфокпида.
ILS,%
Выживаемость Выживаемость обработанных контрольных
мьпцей - мышей
Выживаемость контрольных мышей
Критерий: ILS,% - значительный опу- холь-ингибирующий эффект,
Таким образом, на основании представленных данных можно заключить, что предлагаемые соединения являются эффективными цитрстатическими агентами и что эти новые соединения являются более эффективными цитостатич:ес- кими агентами, чем известное BCNY и хлорозотицин.
Причем аналог по структуре; в/, f -бис-(2-хлорэтил)карбамоил-Ьу8-Рго-Val-NHj не обладает цистостатической активностью.
Определение токсичности предлагаемых соединений, проведенное на мьшах вида С 57 BL X DBA , показьшает, что они могут быть отнесены к категории среднетоксичных соединений.
Формула изобретения
N-Hитpoзo-N-(бeтa-xлopэтшI)кapбa- моилпептиды общей формулы
N0 . C1-CH2CH2NCONH R ,
где п 1;
R - Lys Pro Val NH , Trp Leu o Asp Phe NH, Pro Val NH, Gly Lys Pro Val NH, Trp Gly Lys Pro Val NH или n 2; R - Lys Pro Val NH, или их хлоргидраты, обладающие противоопухолевой активностью.
15
1А14851
16 Таблица 1
ТаблицаЗ






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения N-нитрозо-N-(бэта-хлорэтил)-карбамоилпептидов или их кислотно-аддитивных солей | 1982 |
|
SU1424739A3 |
| Способ получения N-нитрозо-N-(бета-хлорэтил)карбамоилпептидов или их солей | 1984 |
|
SU1586520A3 |
| Способ получения полипетидов, содержащих аспарагил-глициновую последовательность | 1973 |
|
SU505352A3 |
| N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИН | 2012 |
|
RU2503657C1 |
| N-ацил-N'-(пиридин-2-ил) карбамиды и их аналоги, проявляющие противораковую и антипролиферативную активность | 2014 |
|
RU2769607C2 |
| АНТИТЕЛА К В7-Н3 И КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2017 |
|
RU2764651C2 |
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА (ADC) И КОНЪЮГАТЫ АНТИТЕЛА И ПРОЛЕКАРСТВА (APDC), СОДЕРЖАЩИЕ ФЕРМЕНТАТИВНО РАСЩЕПЛЯЕМЫЕ ГРУППЫ | 2016 |
|
RU2751512C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ N-БЕНЗИЛИНДОЛ-3-ИЛ-ГЛИОКСИЛОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ), ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ФАРМАЦЕВТИЧЕСКАЯ ФОРМА | 2000 |
|
RU2266280C2 |
| N1/N2-ЛАКТАМНЫЕ ИНГИБИТОРЫ АЦЕТИЛ-КоА-КАРБОКСИЛАЗ | 2011 |
|
RU2540337C2 |
| Способ получения производных аминоглюкопиранозида | 1975 |
|
SU670225A3 |
Изобретение касается замещенных пептидов, в частности М-нитрозо-Н-(Й- -хлорэтил)карбамоилпептидов общей формулы rClCHjCH2-N(NO)-C(0)NH}nR, где п 1 и R-Lys-Prc-Val-NH , Trp-Leu-u( -Asp-Phe-NHj , Pro-Val-NH , Gly-Lys-Pro-Val-NHj, Trp-Gly-Lys-Pro- -Val-NH ; n 2, R Lys-Pro-Val-NHj, или их хлоргидратов, обладающих противоопухолевой активностью, что может быть использовано в медицине. Цель - создание новых более активных пептидов. Их синтез ведут обработкой соответствующего ацетата В-хлорзтилизо- цианатом в присутствии триэтиламина в среде диметилформамида. Новые вещества обладают лучшей активностью в отношении лейкомии L 1210, амелано- тических меланом, легочных опухолей, чем известные цитостатические агенты - хлорозотицин или BCNY. 9 табл. « сл
2+3325
6Лечение соответствует
1+4325
7II1x25 2 44
8Циклофосфамид1x50 2 44
9Дибромдульцит1x5.0 2 О 0 BCNY1x10 2 77
1Лечение соответствует
7 + 877
12Лечение соответствует
7 + 944
13Лечение соответствует 7+10
14II1x50 3 33
15BCNY1x20 2 70
16Лечение соответствует 14 +15
Таблица 4
70
60
19
Соединение
Лечение
Доза, мг/кг Дни
Внутрибрюшинно, применение в отмеченный день после трансплантации.
Время выживания обра- Время выживания необ- ботанных мышей - работанных мышей
ILS,%
Бремя выживания необработанных мышей
Выживание на 60-й день после, трансплантации.
Таблица 6
21,0
22,0 27,0
28,5 25,0
1414851
20 Т, аблица 5
ILS,%
Выживание,
X 100.
26,0
31,5 35,0
42,0 34,0
21,5 35
61 31
21
Контроль
Соединение II, мг/кг:
21,0
ILS - увеличение выживаемости.
ТаблицаВ
Эффект ингибирования опухоли, %
НТ18
50 мг/кг формулы II 40
формулы 57
НТ17 формулы II
НТ22 формулы II / ,
.Л . НТ18
10 мг/кг
59
R-Pro-Val-NH
2
1414851
22 Т а б лица7
26,0
100 мг/кг 5x20 мг/кг 77 68
52 Y
13
52
20 мг/кг 83
19
Т а б л и ц а 9
187,2
fe-Lys-Pro-Val-NHj HCl
II
R-Gly-Lys-Pro-Val-NHj HCl.
IV
R-Trp-Gly-Lys-Pro-Val-NH HCl
VI
R-Trp-Leu-Asp-Phe-NHj III
of, В -бис (2-Хпорэтш|карбаПродолжение табл.9
200
2,5
5,0
50
150
200
25
50
100
200
t2
25
50
100
00
00
5p
100
150
00
0,560 0,024 0,048 0,097 0,195 0,254
0,390 0,043 0,087 0,175 0,351 0,015 0,030 0,061 0,122 .0,244 0,366 0,070 0,140 0,210 0,280
50
75
100
263
60%
27
48
100
20 100 300 60% 60% 160 0
40 230
29,8
25,8
19,9
nd
| Jonston Т.Р | |||
| и др | |||
| J | |||
| Med.chem | |||
| Приспособление к комнатным печам для постепенного сгорания топлива | 1925 |
|
SU1963A1 |
Авторы
Даты
1988-08-07—Публикация
1983-06-20—Подача