1. Область техники, к которой относится изобретение
Изобретение относится к области биологически активных соединений и касается Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина, обладающего противоопухолевой активностью и предназначенного для лечения больных онкологическими заболеваниями. Изобретение может быть использовано в лечебных учреждениях и научно-исследовательских лабораториях.
2. Уровень техники
Nδ-Нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин (1) относится к классу алкил-нитрозомочевин (АНМ) и является АНМ на основе природной аминокислоты - L-орнитина.
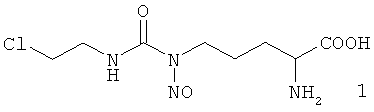
Имеются сведения о гомологе Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина-Nε-нитрозо-Nε-[(хлорэтил)карбамоил]-L-лизине (2) и смеси изомеров положения нитрозо-группы 2/3, в состав которой он входит. Смесь изомеров 2/3 в соотношении 75:25 представляет собой действующее вещество противоопухолевого препарата Лизомустин (Свидетельство на товарный знак «Лизомустин» №236592, зарегистрирован 28.01.2003 г.). Препарат разрешен для лечения онкологических заболеваний [Гос. рег. № ЛС-002311 от 01.12.2006].
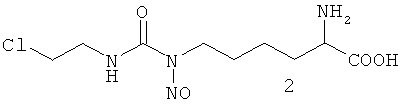
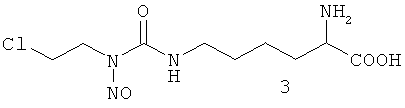
Способ получения смеси изомеров 2/3 описан в патенте РФ №1744946 «Способ получения смеси изомеров 9-(2-хлорэтил)-7-нитрозо-L-гомоцитруллина и 9-(2-хлорэтил)-9-нитрозо-L-гомоцитруллина». Способ получения индивидуальных изомеров 2 и 3 описан в патенте РФ №2408576 «Способ получения индивидуальных Nε-нитрозо-Nε-[(2-хлорэтил)карбамоил]-L-лизина и Nε-[(2-хлорэтил)-N-нитрозокарбамоил]L-лизина» и состоит в препаративном разделении смеси изомеров 2/3 методом ВЭЖХ в обращеннофазовом режиме.
Результаты сравнительного изучения противоопухолевой активности индивидуальных изомеров 2 и 3 и их смеси в соотношении 75:25 (лизомустин) в эксперименте на животных (мыши с перевиваемыми лейкозом L1210 и солидными опухолями LLC, РШМ-5, Са-755, АКАТОЛ, ОЖ-5, гепатома 22с) описаны в патенте РФ № 1834006 «Противоопухолевое средство» и в статье [Левит Г.Л., Радина Л.Б., Краснов В.П., Гопко В.Ф., Никифорова Н.В., Перетолчина Н.М. Nω-Алкилнитрозокарбамоил-α,ω-диаминокарбоновые кислоты. III. Синтез и противоопухолевая активность Nε-нитро-зо-Nε-[N'-(2-хлорэтил)карбамоил]-L-лизина и Nε-[N'-(2-хлорэтил)-N'-нитрозокарбамоил]-L-лизина // Хим.-фарм. Ж., 1996, Т.30 (5), С.23-25]. Было показано, что изомер 3 оказывает высокий противоопухолевый эффект в отношении экспериментальных опухолей. Изомер 2 (гомолог соединения 1) проявляет умеренную активность в отношении ряда опухолей только в высоких дозах (до 1000-1250 мг/кг), а при использовании доз, адекватных по содержанию в лизомустине (150-130 мг/кг), эффекта не было достигнуто ни при одной локализации опухоли. Был сделан вывод о том, что активность смеси изомеров 2/3 (лизомустина) обусловлена действием изомера 3, названного «активным» [Левит Г.Л., Радина Л.Б., Краснов В.П., Гопко В.Ф., Никифорова Н.В., Перетолчина Н.М. Nω-Алкилнитрозокарбамоил-α,ω-диаминокарбоновые кислоты. III. Синтез и противоопухолевая активность Nε-нитрозо-Nε-[N'-(2-хлорэтил)карбамоил]-L-лизина и Nε-[N'-(2-хлорэтил)-N'-нитрозокарбамоил-L-лизина // Хим.-фарм. Ж., 1996, Т.30 (5), С.23-25].
Имеются данные о получении и противоопухолевой активности смеси изомеров положения нитрозогруппы - Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина (1) и Nδ-[(2-хлорэтил)-N-нитрозо-карбамоил]-L-орнитин (4) в соотношении 75:25, преобладающим компонентом которой является изомер 1 [Левит Г.Л., Радина Л.Б., Краснов В.П., Гопко В.Ф., Перетолчина Н.М. Nω-Алкилнитрозокарбамоил-α,ω-диаминокарбоновые кислоты. II. Синтез и противоопухолевая активность нитрозопроизводных Nω-(2-хлорэтил)карбамоил-α,ω-диаминокарбоновых кислот // Хим.-фарм. Ж., 1996, Т.30 (4), С.15-17].
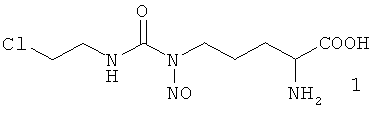
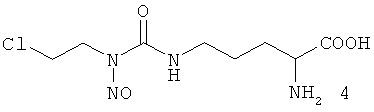
Синтез смеси изомеров 1/4 осуществляют путем карбамоилирования медного комплекса L-орнитина 2-хлорэтилизоцианатом с последующим разложением медного комплекса Nδ-(2-хлорэтилкарбамоил)-L-орнитина сероводородом в кислой среде и нитрозированием полученного производного нитритом натрия при pH 1-2. Соотношение изомеров в смеси определяют методом 1Н ЯМР спектроскопии по характерному сигналу метиленовых протонов группы ClCH2CH2NH изомера 1.
Изучение противоопухолевой активности в эксперименте на животных (мыши с перевиваемьми лимфобластным лейкозом L 1210 и солидными опухолями - аденокарциномой молочной железы (Са-755) и раком легкого Льюиса (LLC)) показало, что смесь изомеров 1/4 оказывает противоопухолевое действие на экспериментальные опухоли. [Левит Г.Л., Радина Л.Б., Краснов В.П., Гопко В.Ф., Перетолчина Н.М. Nω-Алкилнитрозо-карбамоил-α,ω-диаминокарбоновые кислоты. II. Синтез и противоопухолевая активность нитрозопроизводных Nω-(2-хлорэтил)карбамоил-α,ω-диаминокарбоновых кислот // Хим.-фарм. Ж., 1996, Т.30 (4), С.15-17].
Однако сведения о способах получения, свойствах и биологической активности индивидуального изомера 1 (Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитине) в литературе отсутствуют.
3. Сущность изобретения
Сущность изобретения составляет Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин формулы 1
 ,
,
обладающий противоопухолевым действием.
4. Сведения, подтверждающие возможность осуществления изобретения
4.1. Синтез Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина (изомера 1)
Пример 1. К раствору 20 г (0,12 моль) L-орнитина гидрохлорида и 13,5 г (0,24 моль) едкого кали в 130 мл дистиллированной воды добавляют раствор 14,7 г (0,06 моль) меди сернокислой 5-водной в 75 мл воды. После образования ярко-синего раствора медного комплекса L-орнитин при перемешивании и температуре 30°C добавляют по каплям раствор 25,7 г (0,12 моль) 1,3-бис(2-хлорэтил)нитрозомочевины в 130 мл изопропилового спирта. Реакционную массу перемешивают 1 ч при комнатной температуре. Образующийся осадок отфильтровывают, промывают водой и этиловым спиртом, сушат на воздухе и получают 26,2 г (81%) медного комплекса Nδ-[(2-хлорэтил)карбамоил]-L-орнитина.
К раствору 25 г (0,046 моль) медного комплекса Nδ-[(2-хлорэтил)карбамоил]-L-орнитина в 110 мл дистиллированной воды и 17,6 мл (0,205 моль) концентрированной соляной кислоты добавляют 7,93 г (0,063 моль) дигидрата щавелевой кислоты. Реакционную массу перемешивают 30 мин при комнатной температуре. Осадок оксалата меди отфильтровывают, фильтрат охлаждают до 0°C, добавляют 40 мл этилового спирта. При непрерывном перемешивании и температуре реакционной массы 0÷-5°C добавляют по 4 каплям раствор 7,7 г (0,11 моль) натрия азотистокислого в 15 мл воды с такой скоростью, чтобы температура реакционной массы не превышала 0°C. Реакционную массу перемешивают при этой температуре 1 ч, затем отгоняют окислы азота на роторном испарителе. К полученному раствору добавляют 65 мл этилового спирта. Реакционную массу охлаждают до температуры 0-5°C. При постоянном интенсивном перемешивании и температуре 0-5°C реакционную массу нейтрализуют до рН 5-6. Образующийся осадок отфильтровывают, промывают на фильтре водой и этиловым спиртом и сушат при комнатной температуре. Получают 8,1 г (65% считая на медный комплекс Nδ-[(2-хлорэтил)карбамоил]-L-орнитина) смеси изомеров 1/4.
Смесь изомеров 1/4 имеет следующие физико-химические характеристики: Т. пл. 155-156°С (разл.); [α]D +11,7 (С 2,1 н. HCl); 1H ЯМР спектр (D2O, δ, м.д.): 4,19 (т, 0,25×2Н, СН2-N(NO)); 3,88 (м, 0,75×2Н, CH2-N(NO)); 3,78 (с, 0,75×4Н, ClCH2-СН2-NH); 3,77 (м, 0,25×1Н, СН); 3,69 (дд, 0,75×1Н, СН); 3,62 (дд, 0,25×2Н, ClCH2); 3,48 (м, 0,25×2Н, CH2-NH); 2,00-1,87 (м, 0,25×2Н, СН2-СН); 1,83-1,69 (м, 2Н, СН2); 1,61-1,45 (м, 0,75×2Н, СН2-СН2-СН). Найдено, %: С 35,43; Н 5,39; N 20,53; Cl 13,27. C8H15ClN4O4. Вычислено, %: С 36,03; Н 5,67; N 21,01; Cl 13,31. ВЭЖХ (колонка Lichrosorb RP-18, 250×4,0 мм; подвижная фаза 0,01 М KH2PO4-изопропанол 97:3; скорость элюента 0,8 мл/мин; детектирование при 230 нм): 1/4 74,24:25,76 (τ1 9,84 мин; τ4 14,13 мин).
Изомер 1 выделяют из смеси изомеров 1/4 методом препаративной ВЭЖХ в обращено - фазовом варианте на следующем оборудовании: насос Gilson 30525 SC, инжектор Rheodyne 7010 с петлей 2,0 мл, УФ детектор LCD 2070 с фиксированной длиной волны 254 нм, колонка размерами 250×20 мм, заполненная сорбентом марки Reprosil-Pur C18, со средним размером гранул сорбента 10 мкм, удельной поверхностью 300 м2/г и размером пор 100 Å, предварительно уравновешенная подвижной фазой. Температура колонки комнатная (20-24°С). Отбор фракций производят по показаниям детектора и по показаниям самопишущего потенциометра (использован самописец TZ-4620, Чехия), от начала сигнала до выхода показаний на нулевую линию. В качестве подвижной фазы используют раствор изопропилового спирта в воде с концентрацией 3% (неподвижная фаза - октадецил-силикагель) при скорости подачи подвижной фазы 6,0 мл/мин и объеме вводимой пробы не более 2,6 % от объема колонки.
2,0 мл раствора смеси изомеров, содержащей изомеры 1 и 4 в соотношении 74,24:25,76, с концентрацией 20,0 мг/мл в 3,0% водном изопропаноле (подвижная фаза) вводят в колонку препаративного жидкостного хроматографа. Расход подвижной фазы - 6,0 мл/мин. Отбор фракций производят по показаниям детектора и по показаниям самопишущего потенциометра, от начала сигнала до выхода показаний на нулевую линию, средний объем полученных фракций составляет 20,0 мл. Собирают фракцию с временем удерживания 27,0±1,0 мин и после упаривания получают 28,2 мг изомера 1 (выход 95% от содержания изомера 1 в исходном образце). После упаривания фракции с временем удерживания 37,0±1,0 мин получают 9,0 мг изомера 4 (выход 87% от содержания изомера 4 в исходном образце).
Nδ-Нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин (1) имеет следующие физико-химические характеристики: Т.пл. 158-160°С (разд.); [α]D+11,3 (С 2,1 н. HCl); 1Н ЯМР спектр (D2O, δ, м.д.): 3,88 (м, 2Н, CH2-N(NO)); 3,78 (с, 4Н, ClCH2-CH2-NH); 3,69 (дд, 1Н, СН); 1,83-1,69 (м, 2Н, СН2-СН); 1,61-1,45 (м, 2Н, СН2-CH2-CH2). Найдено, %: С 35,84; Н 5,47; N 20,87; Cl 13,24. C8H15ClN4O4. Вычислено, %: С 36,03; Н 5,67; N 21,01; Cl 13,31.
Заявляемое соединение представляет собой светло-желтое кристаллическое вещество, растворимое в 0,1 н. растворе кислоты хлористоводородной, умеренно растворимое в воде, мало растворимое в диметилсульфоксиде, очень мало растворимое в спирте этиловом 95 %, практически нерастворимое в эфире и хлороформе.
4.2. Цитотоксические свойства Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина (1)
Пример 2. Цитотоксическое действие Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитина (1), смеси изомеров 1/4 и изомера 4 (для сравнения) проводят in vitro на клеточных линиях диссеминированной меланомы человека Mel Kor с помощью МТТ-теста. Клеточные линии культивируют в среде RPMI-1640, содержащей 10% телячьей эмбриональной сыворотки, 10мМ HEPES (Sigma, США), 2мМ L-глутамина (Sigma, США), 40 нг/мл гентамицина (ICN, США), 0,1% 1000х раствора аминокислот и 0,1% 1000х раствора витаминов (ПанЭко, Россия), при 37°С в атмосфере 5% CO2. Клетки поддерживают в логарифмической фазе роста постоянным пересевом культуры через 3-4 дня.
Для открепления клеток линии Mel Kor с пластика используют раствор Версена. Клетки отмывают чистой бессывороточной средой RPMI-1640 и пересаживают в 96-луночные плоскодонные планшеты по 4×104 клеток в 180 мкл полной среды RPMI-1640 на лунку.
Через сутки в лунки с клетками добавляют по 20 мкл водного раствора изомера 1, изомера 4 и смеси изомеров 1/4 в различных концентрациях. Планшеты с клетками помещают в инкубатор при 37°С (5% СО2). В качестве контроля используют лунки с клетками, в которые добавляют 20 мкл воды. Через 24, 48 или 72 ч в каждую лунку вносят по 20 мкл раствора МТТ [3-(4,5-диметилтиазолин-2)-2,5 дифенилтетразолий бромид] (маточный раствор 5мг/мл), и инкубируют 4 ч при 37°С в 5% СО2-инкубаторе.
После образования формазана планшеты с клетками центрифугируют, надосадочную жидкость аккуратно удаляют. Осадок растворяют, добавляя в лунки по 200 мкл диметисульфоксида. Планшеты помещают на 5-7 мин в термостат при температуре 37°С. Далее, планшеты встряхивают на шейкере, после чего интенсивность окрашивания среды измеряют на фотометрическом анализаторе иммуноферментных реакций АИФР-01 Униплан (ЗАО «Пикон») при 530 нм. Величина поглощения прямо пропорциональна числу живых клеток.
Выживаемость клеток рассчитывают по формуле: Выживаемость (%) = Оптическая плотность клеток в опыте / Оптическая плотность контрольных клеток × 100 %.
Все эксперименты повторяют не менее 3 раз.
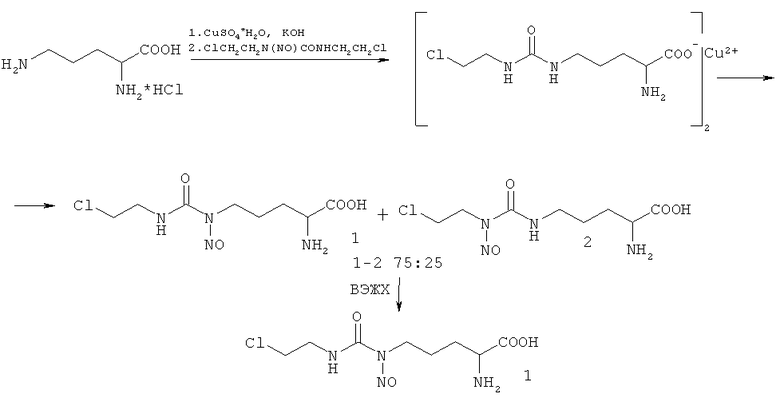
На линии клеток Mel Kor максимальный цитотоксический эффект наблюдался для изомера 1 и для смеси изомеров 1/4 при 72 ч инкубации с самой высокой дозой 1×10-3 М и составил 10% выживших клеток. Для изомера 4 максимальный цитотоксический эффект также наблюдался при инкубации 72 ч и составил 40-45% выживших клеток (Рис. 1).
Средняя величина ЛД50 для изомера 1 и смеси изомеров 1/4 при инкубации в течение 72 ч составила 4×10-4 и 5×10-4 М, соответственно.
Из данных, приведенных выше, видно, что Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин (изомер 1) обладает наиболее выраженной цитотоксической активностью. На линии клеток Mel Kor максимальная цитотоксичность одинакова для изомера 1 и смеси изомеров 1/4, однако, если сравнивать препараты по ЛД50, то при инкубации в течение 72 ч на линии клеток Mel Kor изомер 1 эффективнее, чем изомер 4 и смесь изомеров 1/4.
Таким образом, показано, что противоопухолевое действие смеси 2-хлорэтил-нитрозомочевин на основе L-орнитина (смесь 1/4) обусловлено действием изомера 1 в отличие от смеси 2-хлорэтилнитрозомочевин на основе L-лизина (смесь 2/3), противоопухолевый эффект которой определяет, в основном, изомер 3, а изомер 2 (гомолог изомера 1) существенно менее активен. Сравнение ЛД50 для изомера 1 и смеси изомеров 1/4 показывает, что изомер 4, существенно увеличивая противоопухолевый эффект, увеличивает токсичность. Поэтому, для практического применения более эффективным представляется использование изомера 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИНА | 2015 |
|
RU2601753C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2569729C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДИВИДУАЛЬНЫХ N-НИТРОЗО- N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ЛИЗИНА И N-[(2-ХЛОРЭТИЛ)-N-НИТРОЗОКАРБАМОИЛ]-L-ЛИЗИНА | 2008 |
|
RU2408576C2 |
| СПОСОБ ПОЛУЧЕНИЯ N (2-ХЛОРЭТИЛ)- N НИТРОЗО-L-ГОМОЦИТРУЛЛИНА ИЛИ N (2-ХЛОРЭТИЛ)- N НИТРОЗО-2-ГОМОЦИТРУЛЛИНА ДЛЯ ИНЪЕКЦИЙ | 1995 |
|
RU2111742C1 |
| СПОСОБ СЕЛЕКЦИИ КЛЕТОК IN VIVO С ПОМОЩЬЮ ЛИЗОМУСТИНА | 2010 |
|
RU2425149C1 |
| N-Нитрозо-N-(бэта-хлорэтил)-карбамоилпептиды или их хлоргидраты,обладающие противоопухолевой активностью | 1983 |
|
SU1414851A1 |
| Способ получения N-нитрозо-N-(бета-хлорэтил)карбамоилпептидов или их солей | 1984 |
|
SU1586520A3 |
| Способ получения N-нитрозо-N-(бэта-хлорэтил)-карбамоилпептидов или их кислотно-аддитивных солей | 1982 |
|
SU1424739A3 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1988 |
|
SU1834006A1 |
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2001 |
|
RU2283303C2 |
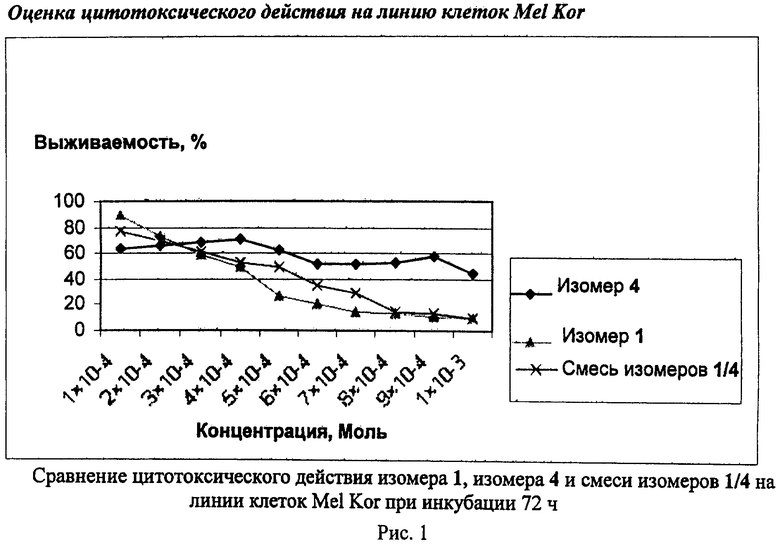
Изобретение относится к области биологически активных соединений, конкретно к Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитину формулы 1 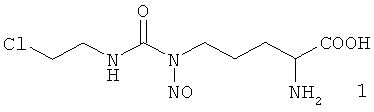 , обладающему противоопухолевым действием. Данное соединение может найти применение для лечения онкологических заболеваний. 1 ил., 2 пр.
, обладающему противоопухолевым действием. Данное соединение может найти применение для лечения онкологических заболеваний. 1 ил., 2 пр.
Nδ-Нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин формулы 1
 ,
,
обладающий противоопухолевым действием.
| ЛЕВИТ Г.Л | |||
| и др | |||
| N-Алкилнитрозокарбамоил-α,ω-диаминокарбоновые кислоты | |||
| II | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| журн., 1996, 30(4), с.15-17 | |||
| SU 1744946 A1, 10.11.1998 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИНДИВИДУАЛЬНЫХ N-НИТРОЗО- N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ЛИЗИНА И N-[(2-ХЛОРЭТИЛ)-N-НИТРОЗОКАРБАМОИЛ]-L-ЛИЗИНА | 2008 |
|
RU2408576C2 |
Авторы
Даты
2014-01-10—Публикация
2012-08-24—Подача