4 ю
4
СО со







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения N-нитрозо-N-(бета-хлорэтил)карбамоилпептидов или их солей | 1984 |
|
SU1586520A3 |
| N-Нитрозо-N-(бэта-хлорэтил)-карбамоилпептиды или их хлоргидраты,обладающие противоопухолевой активностью | 1983 |
|
SU1414851A1 |
| Способ получения производных пиридо/1,2-а/пиримидина или их солей с щелочными металлами или их оптических изомеров | 1980 |
|
SU1024007A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения производных бензимидазола или их солей | 1976 |
|
SU626694A3 |
| Способ получения N-[2-(4-фторфенил)-1-метил]-этил-N-метил-N-пропиниламина в виде рецемата или L-изомера, или их солей | 1986 |
|
SU1609443A3 |
| Способ получения N-[2-(4-фторфенил)-1-метил]-этил-N-метил-N-пропиниламина в виде рацемата, или его L-изомера, или его солей | 1986 |
|
SU1549477A3 |
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1981 |
|
SU1156594A3 |
| Способ получения производных дульцита или их солей | 1981 |
|
SU1205769A3 |
| Способ получения производных @ -(3,3-дифенилпропил)-пропилендиамина или их солей | 1973 |
|
SU1014468A3 |
Изобретение касается замещенных пептидов, в частности получения NHHTpO30-N-(бэта-хлорэтил)карбамоил- пептидов ф-лы I ClCH,(-«-NO)- -C(0)NH }h R, где , R - Lys-Pro- Val-NHj ; Gly-Lys-Pro-Val-NH,; Тгр-Ыт Leu-Asp-Phe-NH ; Trp-Gly-Lys-Pro-Val- Trp-Leu-Asp-Phe-NH,, R - Lys-Pro-Val-NHj, или их кислотно-аддитивных солей, которые могут быть использованы в медицине. Цель - создание новых более активных пептидов. Их синтез ведут из соединений ф-л II и III: (H2N)n-R (II), Cl-CH CHj-N- - 0(0) (III), где Кип имеют указанные значения, с последующим нитрованием с помопуью азотистой кислоты или хлористого нитрозила. Целевой продукт выделяют в свободном виде или в виде соли. Новые пептиды обладают в сравнении с известными аналогами (не содержащими нитрозогруппы) лучшими противоопухолевой активностью и токсичностью ( мг/кг).8 табл, о со
см
Изобретение относится к способу получения М-нитрозо-Ы-(бета-Хлорэтил карРамоилпептидов или их кислотно- аддитивных солей - новых биологичес ки активных соединений, которые могу найти применение в медицине.
Цель изобретения - получение новы производных в ряду пептидов, обладающих более высокой противоопухолевой активностью.
Синтез К-(2-хлорэтил)карбамоилпептидов ,
К 10%-ному раствору пептида, содержащего один эквивалент свободной аминотерминальной функции в г.иметил- формамиде, по каплям при 0 С добавляют 1,1 эквивалента 2-хлорэтилизо- цианата. Реакционную смесь перемешивают в течение 2 ч при О С, а затем отстаивают ночь при комнатной температуре. Диметилформамид отгоняют в вакууме, остаток обрабатывают водой и фильтруют.
Синтез N-/(2-xлopэтил)-N-нитpoзo- карбамоил/-пептидов:
а) Нитрование смесью NaNO /муравьиная кислота.
1 ммоль N-(2-хлорэтил)карбамоил- пеп Л1да растворяют в 8 мл 98-100%-но муравьиной кислоты при О С, охлаждая и перемешивая. По каплям добавляют 300 мг нитрита натрия в 2 мл воды,. Реакционную смесь выстаивают в течение ночи в холодильнике, после чего отгоняют растворитель. Дистилляцион- ный остаток обрабатывают водой и фильтруют. При необходимости продукт можно дополнительно очистить на ко лонке с силикагелем методом хромато- графин;
в) Нитрование с помощью хлористого нитрозила в присутствии трет-бутоксикарбонил (защитной группы).
I
1 ммоль Н-(2-хлорэтил)карбамоил- пептида растворяют в 10 мл безводног пиридина при -20 С. К рас-твору по каплям при перемешивании добавляют
1мл дихлорметана, содержащего 12ммоль хлористого нитрозила. После перемешивания в течение часа реакционную смесь концентрируют в вакууме. Дистилляционный остаток растворяют
в этилацетате и дважды экстрагируют ледяной водой. Органический слой су- шат над сульфатом натрия, раствор отфильтровывают, этилацетат упаривают в вакууме.Дистилляционный остаток выстаивается 2 ч при О С в 5 мл 98100%-ной муравьиной кислоты. Затем к нему добавляют 1 мл муравьиной кислоты, содержащей 0,12 ммоль хлористоводородной кислоты. Полученный раствор выпаривают в течение 10 мин. Дистилляционный остаток растворяют в воде и лиофилизируют, В случае необходимости пpoдVкт может быть очищен методом хроматографии на колонке с силикагелем.
Пример 1, Альфа, эпсилон- бис-(бета-хлорэтилкарбамоил)-лизнл- пролилвалинамид.
Раствор 736 мг (1,6 ммоль) лизил- пролилвалинамиддиацетата в В мл ди- метилформамида охлаждают до О С. Далее в раствор по каплям добавляют 0,46 мл (3,2 ммоль) триэтиламина и 0,34 мл (4 ммоль) бета-хлорэтилизо- цианата. Реакционную смесь перемешивают при в течение 4 ч, после чего дают ей постоять и перегоняют в вакууме. Остаток смешивают с водой выпавший в осадок продукт отделяют фильтрованием и сушат. Таким образом получают 480 мг указанного в названии примера соединения. Выход 54%; т,пл. 183-185 С, R 0,75 (смесь н-бу танола с пиридином, ледяной уксусной кислотой и водой в соотношении 4:1: 1:1; тонкослойная хроматографическая обработка с использованием Кизельге- ля G фирмы Мерк).
Найдено, С 47,90, Н 7,60; N 17,41; С1 13,2С.
С2,Ну,М,05СЦ (552,5)
Вычислено, %: С 47,82; Н 7,11; N 17,74; С1 12,83.
П р и м е р 2. Альфа, эпсилон-бис /N-HHTpo30-N-(бета-хлорэтил)-карбамо- ил/-лизилпролилвалинамид I.
К 552 мг (1 ммоль) альфа, эпсилон- бис- (бета-хлор этил кар бамоил) -л из ил- пролилвалинамида добавляют 10 мл 99%- ной муравьиной кислоты, после чего в течение часа добавляют в эту смесь по каплям раствор 500 мг нитрита натрия и 3 мл воды. На следующий день реакционную смесь выпаривают в вакууме. Остаток обрабатывают водой, фильтруют и промывают водой. Таким образом получают 460 мг указанного в примера соединения; выход 75%.
R, 0,80 (смесь метанола с этилаце- татом в соотношении 1:3, тонкослойная хроматографическая обработка с
использованием продукта Кизелыель G фирмы Мерк).
184 (N-нитрозогруппа, 397 нм).
Найдено, %: С1 11,1; N 20,1П.
С„Н,,ОтС1г (611,51)
Вычислено, %: ГЛ 11,59; N 20,61.
Примерз. Бета-хлорэтилкарба- моил-триптофил-норлейцип-альфа-аспа- рагил-фенилаланинамид,
615 мл (1 ммоль) триптофил-норлей- цил-альфа-аспарагил-фенилаланинамид- гидрохлорида растворяют в 6 мл безводного диметилформамида, после чего в приготовленный раствор добавляют 0,1А мл (1 ммоль) триэтиламина и 0,1 мл (1,2 ммоль) бета-хлорэтилизо- цианата, в дальнейшем реакцию проводят аналогично примеру 1. Таким образом получают 600 мг указанного в названии примера соединения; выход 88%, R 0,72 (смесь н-бутанола, уксусной кислоты, воды в соотношении 4:1:1), т.пл. 201-2024.
Найдено, %: С1 4,94 N 13,78.
C,,H,,N,OC1 (684,19)
Вычислено, %: С1 5,18, N 14,33.
П р и м е р 4. N-HHTpO30-N-(6eTa- хлорэтил)карбамоилтриптофилнорлейцил- альфа-аспарагнл-феннлаланинамид III.
684 мг (1 ммоль) бета-хлорэтнлкар- бамоил-триптофил-норлейцил-альфа-ас -- парагил-фенилаланинамида используют для реакции с раствором 300 мг нитриI,
та натрия и 2 мл воды, как изложено в примере 3. Таким образом получают 605 мг указанного в названии примера соединения. Выход 85%. R 0,80 (смесь н-бутанола с ледяной уксусной кислотой и водой в соотношении 4:1:1, про- до водой. Этилацетатную фазу сушат над
дукт Кизельгель G фирмы Мерк).
Найдено, %: С1 4,73; N 15,28; No 3,87, с 55,50; И 5,77.
,,NjOjCl (713,20)
Вычислено, %: С1 4,97. N 15,71; ,N0- 4,20; С 55,52; Н 5,75.
Поскольку в диапазоне поглощения нитрозогруппы имеет место поглощение самого пептида, нитрозную группу определяют по методу Лоси Диона.
Пример 5. oC-/N-нитpoзo-N- (xлopэтил)-кapбaмoил/-лиэилпpoлилвa- линaмидaцeтaт II,
К 614 мг (1 ммоль) Ь-третичного бутилоксйкарбонил-лизнлпролилвалин- Фракции, содержащие основной про- амидтозилата в 10 мл безводного димел , собирают, упаривают, остаток тилформамида при охлаждении снегом
безводным сульфатом натрия, этилаце- тат отгоняют в вакууме. Остаток отстаивается в течение нескольких часов в 5 мл 98-100%-ной муравьиной кислоты 45 при О С. Затем добавляют 1 мл муравьиной кислоты, содержащей 0,12 ммоль хлористо-водородной кислоты.и через 10 мин упаривают раствор в вакууме. Остаток очищают хроматографией на косо лонке, заполненной силикагелем, при смесью этилацетата, пиридина ледяной уксусной кислоты и воды в соотношении 60:20:6:11.
лиофилизируют путем растворения в воде.
и перемешивании добавляют по каплям 0,14 мл (1 ммоль) триэтипамина и
0,1 мл (1,2 ммоль) /i-хлорэтилияоциа- ната. Реакционной смеси дают отстояться в течение ночи при комнатной температуре, затем растворитель упаривают в вакууме. Остаток очищают хроматографией на колонке, заполненной силикагелем. В качестве элюента используют смесь метанола и этилаце- тата в соотношении 3:1. Фракции, содержащие основной продукт, собирают. Растворитель отгоняют в вакууме. Таким образом получают 430 Mrc)(,-/ N- ((V-хлорэтил)-карбамоил/-третичный бутилоксикарбониллизнлпролилвалина- мида.-.
Выход составляет 78%. R 0,90 (смесь метанола и этилацетата в соотношении 3:1, тонкослойная хромато- графия (Kieselgel G, Merck); R 0,44 (смесь этилацетата, пиридина ледяной уксусной кислоты, воды в соотношении 240:20:6:11, тонкослойная хроматография, Kieselgel Merck Найдено, %: С1 6,56. С„Н,,Ы,0,С1 (547,1) Вычислено, %: С1 6,48. К раствору из 547 мг (1 ммоль) в(.-(Н-(р-хлорэтил)-карбамоил) -Е-трет. бутилоксикарбонил-лизилпропилвалин- ,амида и 10 мл безводного пиридина до- бавляют по капле смесь из 1 мл (1,2 ммоль) нитрозилхлорида и 1 мл дихлорметана при -20 С с одновремен- ным перемешиванием раствора. После перемешивания в течение часа реакционную смесь упаривают в вакууме. 0с- |таток растворяют в этилацетате при 0°С и дважды экстрагир -ют ледяной
безводным сульфатом натрия, этилаце- тат отгоняют в вакууме. Остаток отстаивается в течение нескольких часов в 5 мл 98-100%-ной муравьиной кислоты 45 при О С. Затем добавляют 1 мл муравьиной кислоты, содержащей 0,12 ммоль хлористо-водородной кислоты.и через 10 мин упаривают раствор в вакууме. Остаток очищают хроматографией на косо лонке, заполненной силикагелем, при смесью этилацетата, пиридина ледяной уксусной кислоты и воды в соотношении 60:20:6:11.
Фракции, содержащие основной пр , собирают, упаривают, остаток
лиофилизируют путем растворения в воде.
Выход - 390 мг (72%).
Целевое соединение: R 0,33 (смесь этилацетата, пиридина, ледянсзй уксусной кислоты и воды в соотношении 60:20:6:11) тонкослойная хроматография, Kieselgel G.Merck; R 0,64 (смесь этилацетата, пиридина, ледяной уксусной кислоты, воды; тонкослойная хроматография, Kieselgel G. Merck)
Найдено, %: С1 6,32, N 17,72, С 47,03; Н 7,11.
C,HjgN70TC (536,05)
Вычислено, %: С1 6,61; N 18,29, С 47,01; Н 7,09.
10
Н-нитрозо-Ы-(бета-хлорэтил)-карба моил-триптофил-глициллизилпролилва- г |линамидгидрохлорид VI. Rj 0,25 (этилацетат:пиридин:ледяная уксус1 йя кислота:вода 60:20:2: :11); R 0,64 (бутанол:пиридин:ледяная уксусная кислота:вода 4:1:1:1).
Найдено, %: С 49,71; 5,85; N 17,08; О 15,71; С1 8,88.
С„Н„Ы,„0,С1, (755,77)
Вычислено, %: С 50,85; 6,40; N 18,53; О 14,82; С1 9,83.
Эжилон корр.: 88,40 нм. Измерен
: 86,2 (N-нитрозогруппа, 397 нм). j Ри использовании метанола в качест- В описываемых условиях получены: ве растворителя, концентрация .-(N-(2-xлopэтил)-N-нитpoзoкapбaмoил) 4 моль/л, при ,
триптофил-лейцил-аспарагин-фенилаланинамид IV. Выход 80%. R{ 0, (бутанол:ледяная уксусная кислота:вода 4: :1:1),Rj. 0,72 (бутанол:пиридин:ледяная уксусная кислота:вода 4:1:1:1), R 0,42 (этилацетат:пиридин:ледяная уксусная кислота:вода 120:20:6:11).
Найдено, %: С1 4,81; N 15,43; N0 3,98.
V.,Ne08Cl (713,20)
Вычислено, %: С1 4,97} N 15,71; N0 4,20.
fti«-(N-(2-хл орэтил)-N-нитpoзo-кapбa- мoил)-глицил-лизилпpoлилвaлинaмидгид- poxлopид V. Выход 54%. R 0,65 (этил- ацетат: пиридин:муравьиная кислота: :вода 60:20:6:5,5); Н 0,10 (мета-- НОЛ:этилацетат 3:1); R 0,66 (этил- ацетат :пиридин:ледяная кислота:вода 60:40:12:22)
Найдено, %: С1 12,10} N 19,02.
C,H NeOfcCl (569,59)
Вычислено, %: С 12,45, N 19,67.
Проведены биологические испытания полученных соединений.
20 При изучении влияния соединений на лейкемию L-1210, имплантированную мышам, в качестве тестовых соединений использовали ot ,-биc-/N-нитpoзo-N- / -хлорэтил/-карбамоил/ лиэилпролилва
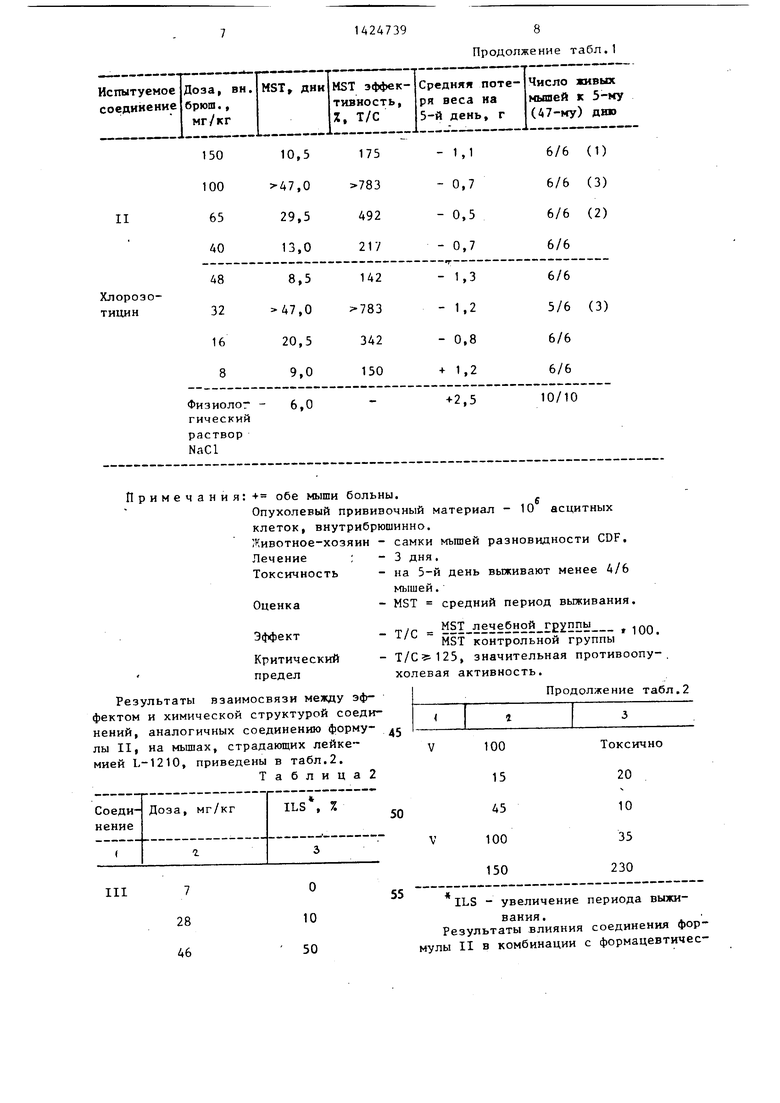
25 линамид (далее в тексте соединение I и f-/Н-нитрозо-Н-/ -хлорэтил/-карба- моил-лизилпролилвалинамид гидрохлорид (далее в тексте соединение II). Полученные результаты приведены в табл.1-4.
В табл.1 показано влияние соединений I и II на внутрибрюшинно имплантированную мышам лейкемию L-1210. Оба соединения оказались более активными, чем 1,3-бис-/ хлорэтил/-1 5 нитрозомочевина (далее в тексте - BCNU) и 2-/3-(2-хлорэтил)-3-нитрозо- уреидо/2-дезокси-О-глюкопираноза (далее в тексте - хлорозотицин), использованные для сравнения.
30
200
130
70
40
0
Н-нитрозо-Ы-(бета-хлорэтил)-карба моил-триптофил-глициллизилпролилва- г |линамидгидрохлорид VI. Rj 0,25 (этилацетат:пиридин:ледяная уксус1 йя кислота:вода 60:20:2: :11); R 0,64 (бутанол:пиридин:ледяная уксусная кислота:вода 4:1:1:1).
Найдено, %: С 49,71; 5,85; N 17,08; О 15,71; С1 8,88.
С„Н„Ы,„0,С1, (755,77)
Вычислено, %: С 50,85; 6,40; N 18,53; О 14,82; С1 9,83.
Эжилон корр.: 88,40 нм. Измерен
Ри использовании метанола в качест- ве растворителя, концентрация 10Проведены биологические испытания полученных соединений.
При изучении влияния соединений на лейкемию L-1210, имплантированную мышам, в качестве тестовых соединений использовали ot ,-биc-/N-нитpoзo-N- / -хлорэтил/-карбамоил/ лиэилпролилвалинамид (далее в тексте соединение I) и f-/Н-нитрозо-Н-/ -хлорэтил/-карба- моил-лизилпролилвалинамид гидрохлорид (далее в тексте соединение II). Полученные результаты приведены в табл.1-4.
В табл.1 показано влияние соединений I и II на внутрибрюшинно имплантированную мышам лейкемию L-1210. Оба соединения оказались более активными, чем 1,3-бис-/ хлорэтил/-1нитрозомочевина (далее в тексте - BCNU) и 2-/3-(2-хлорэтил)-3-нитрозо- уреидо/2-дезокси-О-глюкопираноза (далее в тексте - хлорозотицин), использованные для сравнения.
Таблица 1
6/6
6/6 (2) 6/6 (3) 6/6
Примечания: обе мыши больны.
Опухолевый прививочный материал - 10 асцитных
клеток, внутрибрюшинно.
Животное-хозяин - самки мышей разновидности CDF,
Лечение Токсичность
Оценка
Эффект
Критический предел
Результаты взаимосвязи между эффектом и химической структурой соединений, аналогичных соединению форму- лы II, на мышах, страдающих лейке™ мией L-1210, приведены в табл.2.
Таблица2
III
7
28 46
О 10 50
1А24739
8 Продолжение табл,1
-3 дня.
-на 5-й день выживают менее А/6 мышей.
-MST средний период выживания.
т/С У§1-5 2е5а2й-ЕЕХП1 Ь , юо.
MST контрольной группы
-Т/С 125, значительная противоопухоленая активность.
Продолжение табл.2
ILS - увеличение периода выживания.
Результаты влияния соединения формулы II в комбинации с формацевтическими добавками на мышей, страдающих лейкемией L-1210, приведены и табл.3.
ТаблицаЗ
5 20
1 25
1 « 50 2 1 50 2 1 « 10 2
1 « 50
1 20 3
1 25 1 110
325
325
2 44
2 44
О 77
77
44
33
70
70
&fl
Контроль Соединение II:
100 мг/кг 22,0
Результаты влияния соединения формулы II на выживание мъшей, страдающих лейкемией L-1210, приведены в
табл.4.
Таблица4
5
0
к«Внутрибрюшинное применение в день, указанный после трансплантации.
Время выживания Время выжива- у мьппей лечеб- ния в группе ной группы - без лечения
Время выживания в группе без
лечения X 100
К- -1(4
Выживание на 60-й день после
трансплантации,
Результаты влияния соединения II на твердые опухоли приведены в табл.5.
Таблица5
26,0 4 31,5 21,5
520 МГ/КГ 27,0
Внутрибрюшинное применение с 1-го дня после трансплантации
A)опухоль S,go (подкожно). Дози- ровка 100 МГ/КГ или мг/кг,внут- рибрюшинное введение (начало лечения
в день после трансплантации), оказалось неэффективным.
B)Легочная меланома Льюиса и ме- ланома B,g - метастаэирующие опухоли мышей (i.т.).
С) Опухолевые ксенографты .человеа (S. с.) :
НТ18 (amelanoticus melanoma)
TD CD КОНТРОЛЬ (среднее), дней 22,5 100 МГ/КГ 50,0 1,0 5«20 МГ/КГ 56,25 1,5 НТ22 (крупная карцинома толстой кишки)
Контроль 17,0 100 МГ/КГ 24,0 0,29 МГ/КГ 21,5 0,26 НТ17 (аденома- тозная карцинома толстой кишки) Контроль 16,5 100 МГ/КГ 14,75 0,0 520 МГ/КГ 5,0 0,0 Время начала лечения - наличие
пухоли, имеющей размер примерно
мм .
Способ лечения: внутрибрюшинное
ведение.
ТВ удвоение объема опухоли.
СВ замедление роста
. TD
KO
npo.7o, i;;ve)(Htj
29
35,0
35
0
5
0
5
0
5
Кр-лечебная группа; К -контроль- ная группа.
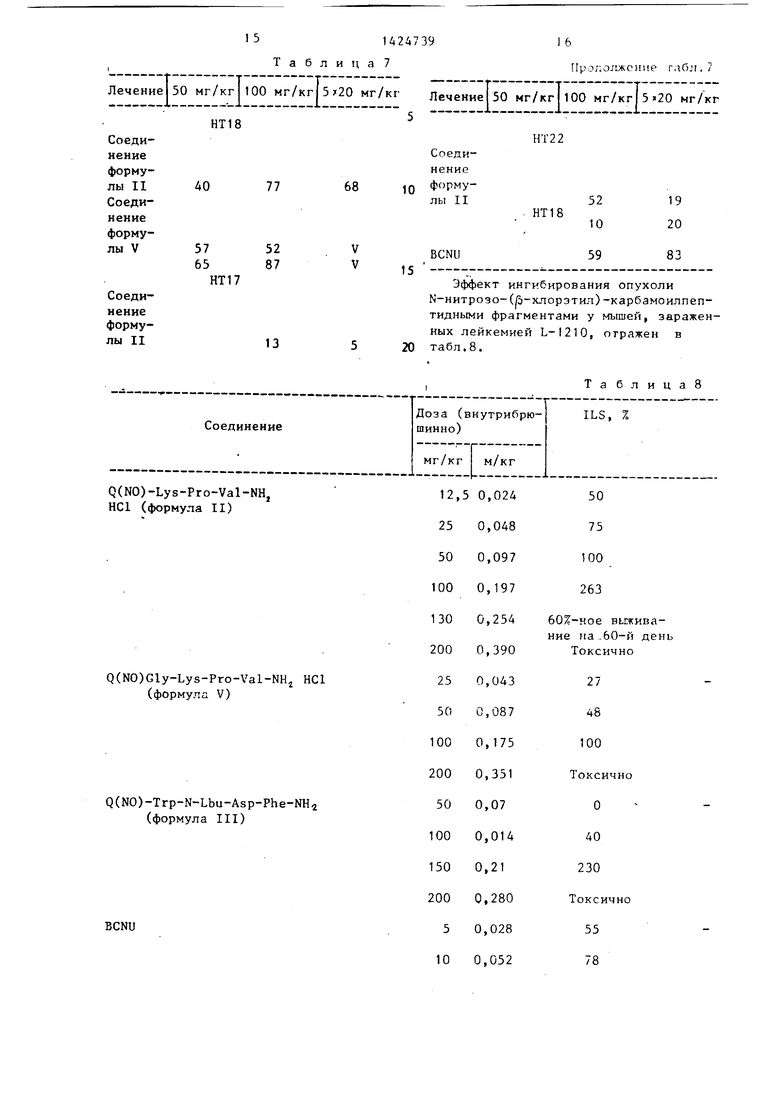
Влияние производных пептид-нитро- зомочсвш .ы на рост экспериментальных твердых опухолей и опухолевых ксено- графтов человека приведены в табл. , 6, 7.
Иccлeдye ыe соединения:
N-HHTpO3o-N-(Л-хлорэтил)-карбамо- ил-лизилпролилвалинамид НС1 (соединение II) ;
Н-нитрозо-Н-(р-хлорэтил)-карбамо- ил-глицил-лизилпролилвалииамид НС1 (соединение V).
Основные объекты:
а)экспериментальная твердая опухоль-: мьшиная опухоль 3,60, легочная опухоль Льюиса и мышиная мела- нома;
б)опухолевые ксенографты человека: амеланотивная меланома НТ18, ко- лоректальная аденокарцинома НТ17, ко- лоректальная аденокарцинома НТ22 (му- цинозн 1я) , карцинома поджелудочной железы НТ27.
Опыты на экспериментальных твердых опухолях: опухоль разрезали на мелкие куски, которые трансплантировали под шкуру на спине мыши разноьидности C1FP. Лечение начинали на следующий после трансплантации день. Размер орухоли измеряли кронциркулем, объем рассчитывали по диаметру.
Соединение II, применяемое ннутри- брюшинно в дозе 100 мг/кг и 520 мг/кг (одна дозировка в течение 5 дней), не оказывало влияния на рост опухоли.
Легочная опухоль Льюиса: опухоль трансплантировали в виде клеточной суспензии в бедренную мышцу инбредных
ьолпей разновидности С57В1 при количестве клеток 10. Растущая опухоль регулярно давала легочные метастазы. Лечение начинали в день, следующий за , трансплантацией. Наблюдали выживаемость животных в лечебной и контрольной группах.
Меланома В|«: опухоль трансплантиU2473914
мышей разновидности СН7В1 в виде кусочков опухоли. Растущая опухоль индуцировала легочные метастазы. Лечение и оценку эффекта осуществляли способом, описанным для легочной опухоли Льюиса.
Результаты, относящиеся к легочной опухоли Льюиса и меланоме B,g, приверовали под шкуру на спине инбредных ю дены в табл.6.
ILS - увеличение периода выживания
JU
Согласно полученным результатам оединение II умеренно увеличивает лительность жизни животных как при пухоли Льюиса, так и при меланоме
на спине ис сированных /СА. Лечени дение) начин гали диамет было наблюд рост. Диаме кронциркуле диаметру. ( 40 метр). Степ опухоли опр еме опухоли после транс и лечебной ментальная ней мере 6
B,j. Степень эффекта ингибирования опухоли практически эквивалентна эффекту от BCNU, используемому в качестве сравнительного соединения.
Изучение опухолевых ксенографтов человека: кусочки опухолей, которые можно серийно трансплантировать (взрослая тимектомия, полное облучение с 8,5 Gy, мозговай перестройка с помощью сингенных мозговых клеток), трансплантировали под щкуру
Объем обработанной Объем обработанной опухоли на 21-и - опухоли в 0-й день день
Объем контрольной опухоли на 21-й день - - Объем контрольной опухоли в 0-й день
(100% полное ингибирование роста опухоли).
Результаты экспериментов показывают, что производные пептидо-нитро- зомочевины оказывают значительное
Таблицаб
на спине искусственно имуннодепрес- сированных мьппей разновидности СВА/ /СА. Лечение (внутрибрюшинное введение) начинали, когда опухоли достигали диаметра 0,7-1,0 см и можно было наблюдать их прогрессирующий рост. Диаметры опухолей измеряли кронциркулем, объем рассчитывали по диаметру. (Y 7/6 D , D - средний диа- метр). Степень эффекта ингибирования опухоли определяли по разности в объеме опухоли, измеренном на 21-й день после трансплантации, в контрольной и лечебной группах (каждая экспериментальная группа включала по крайней мере 6 опухолей).
100
55
ингибирукщее влияние на рост нотивной меланомы, тогда как ние на рост колоректальных и атических опухолей оказалось слабым (табл.7,8).
151424739
Таблица 7
Лечение|50 /кфоО мг/кг|5 20 мг/кг Лечение| 50 мг/кг|100 мг/кг|5 20 нг/кг
г 50 мг/кг 100 мг/кг
НТ18
40
57 65
77
52 87
68
V V
НТ17
13
Q(NO)-Lys-Pro-Val-NHj НС1 (формула II)
Q(NO)Gly-Lys-Pro-Val-NH,j НС1 (формула V)
Q(NO)-Trp-N-Lbu-Asp-Phe-NH2 (формула III)
BCNU
Продолжение глбл.7
| 50 мг/кг|100 мг/кг|5
г 50 мг/кг 100 мг/кг
НТ22
Соединение10 формулы II
НТ18
BCNU
52 10
59
19 20
83
15
Эффект ингибирования опухоли N-нитро3о-(fi-хлорэтил)-карбамоилпептидными фрагментами у мышей, зараженных лейкемией L-I210, отражен в табл.8.
,ТаблицаВ
0,02450
0,04875
0,097100
0,197263
0,254 60%-ное выживание на -60-й день
0,390Токсично
0,04327
0,08748
0,175100
0,351Токсично
0,07О
0,01440
0,21230
0,280Токсично
0,02855
0,05278
Результаты исследований показывают, что полученные по изобретению соединения являются более эффективными цитостатическими агентами, чем BCNU, хлорозотицин,пептидамиды, не содержащие нитрозогруппы.
19U24739
Токсичность полученных соединений составляет - 360 мг/кг (LD, т.е. соединения могут быть отнесены к категсфии среднетоксичных.
п
Формула изобретен
Способ получения N-HKTpO3O-N- (бэта-хлорэтил)карбамоилпептидов щей формулы
I
fciCH2CH2N
NO
где n R
1;
ClCHjCH,NHCONH3- R, где п и R имеют указанные значен нитрозируют с помощью азотистой лоты или хлористого нитрознпа и ц
Lys-Pro-Val-NHj; Gly-LysPro-Val-NH ; Trp-N-Leu-AspPhe-NH,; Trp-Gly-Lys-Pro-Val-20 вой продукт вьщеляют D свободном
NHi; Trp-Leu-Asp-Phe-NHjl виде или в виде соли.
20
или
n 2;
R -Lys-Pro-Val-NH,; или их кислотно-аддитивных солей, отличающийся тем, что пептид или его защищенное производное общей формулы
(H,N)R,
где n и R имеют указанные значения, вводят во взаимодействие с изоциана- том формулы
и полученное соединение
ClCHjCH,NHCONH3- R, где п и R имеют указанные значения, нитрозируют с помощью азотистой кислоты или хлористого нитрознпа и целе
| Вейганд-Хильгетаг | |||
| Современные методы эксперимента в органической химии | |||
| М.: Химия, 1967, с | |||
| Устройство для получения водяного пара и подведения его в толщу горящего топлива | 1921 |
|
SU377A1 |
Авторы
Даты
1988-09-15—Публикация
1982-10-22—Подача