бодном виде или в виде необходимой соли. Новые вещества проявляют активность в отношении золотистого стафилококка при минимальной ингибирующей концентрации 1-60 мкг/см, лечебной дозе CDjo 4-75 мг/кг и токсичности LD, 6 табл.
50
175-1000 мг/кг.

















Изобретение .-касается замещенных гетероциклических веществ, в частности производных синергестинов общей ф-пы I где Y - Н, (, R - 3- или 4-пи- перидиламино- или 3- или 4-пипери- дилтиогруппа, незамещенные в некоторых случаях по азоту в цикле алкилом, или алкиламино- или .алкилтиогруппа, монозамещенные )i ОН, одной или двумя алкиламиногруппами, диалкилами- ногруппой, триалкиламмонием иди 4- или 5-имидазолилом или одним: циклрм, выбранным из шшеразино- (в некоторых случаях замещенного алкилом), пи- перидино-, морфолино- или 1-пирроли- динилом (в некоторых случаях замещенным по азоту цикла алкилом), при использовании С4.4 алкила, прямого или paзвeтвлeнvюгo, или их фармацевтически приемлемых солей, проявляющих фармакологическую активность. Цель - создание новых активных и растворимых в воде веществ указанного класса. Синтез новых соединений ведут реакцией соединения общей ф-лы II R -Н где R - значения, указанные для R, с соединением о0щей III О «Дсн.а,зОо o-V liH N.0« «J где Y см. выше; R и R - разные или равные - Н, CgHj, C.,o -алкил (прямой или разветвленный), в некоторых случаях замещенный ОН-, SH-, пипе- ридино-, анилино-, диалкиламиногруп- пой, где один алкил замещен ОН-груп- пой, или NR,R - пятичленный гетеро- цикл. Целевой продукт выделяют в своi СО ел О) се ы

1
Изобретение относится к области синтеза новых биологически активных соединений, в частности к способам получения производных синергистинов общей формулы I ,
CHi
1
.
JL II
CH-R
де Y - водород или диметиламиногруппа,20
R - 3- или 4-пиперидиламино-,
3- или 4-пиперидилтио-, незамещенные у атома азота цикла алкильным радикалом, алкил- амино- илиалкш1тиогруппа,за- 25 мещенные одним гидросульфо- нилом или одним или двумя ал- киламиногруппами, диалкилами- норадикалом, в некоторых случаях замещенным диалкиламино- 30 радикалом, триалкиламмонием или 4- или 5-имидазолилом или одним из циклов, выбранных среди пиперазино-, незамещенного или замещенного алкилом, МОРФОЛИНО-, пиперидино-, 1-пирролидинилом, 2-, 3- или 4-пиперидилом или 2- или 3-пирролидинилом, причем два последних цикла в некоторых Q случаях замещены у атома азота алкильным радикалом при условии, что алкильные радикалы и алкильные фрагменты содержат 1-4 атома углерода в прямой или разветвленной цепи;
15
20
25 30 Q
или их фармацевтически приемлемых солей.
Целью изобретения является получение новых про1 зводных синергистинов общей формулы I, обладающих преимуществом из-за их способности растворяться в воде в виде солей в терапевтически используемых дозах, сохра0 няя полностью общий спектр активности синергистинов.
Примеры, приведенные в качестве неограничивающих, показывают как изобретение может быть осуществлено
5 на практике. 51МР-спектры приведенных в этих примерах продуктов обладают основными характеристиками, которые являются общими для всех продуктов, и особыми характеристиками, которые являются характерными для каждогогиз продуктов в зависимости от заместителей Y, R и R. В примере 1 приведено отнесение всех протонов молекулы, в следующих примерах упоминаются только cпeцифичeckиe характеристики для различных радикалов. Все протоны обозначены в соответствии с нумера-- цией, указанной в общей формуле
ЗУ З 3tf 3 Нз
.
я «„„ «ЛсНгСНз rtJ-ltf-ls fH ШШ ,lvCH30 NjKCH..j
чбИН
0
Ц о И J
1 Нв г 1 Н4
I HS
Все спектры были -сняты при 250 МГц в дейтерохлороформе, химические сдвиги выражены в миллионных долях по отношению к сигналу тетраметилсилана. В тексте использованы следующие сокращения: с - синглет д - дублет; т - триплет; мт - мультиплет; м - массив; дц - двойной дублет; дт - двойной трипл :т; ддд - двойной двойной дублет; дддд - двойной двойной двойной дублет.
В примерах 2-33 в скобках приведены соответственно химический сдвиг форма сигнала, интегрирование (число протонов, в некоторых случаях с процентным содержанием изомера) и отнесение протонов.
В приведенных примерах импульсной хроматографией называют методику очистки, характериззпощуюся тем, что используют короткую хроматографичес- кую колонку и работают при среднем давлении 50 кПа, используя силикагел с гранулометрией 40-63 мкм.
Пример 1. Реакцию проводят в среде органического растворителя. в присутствии кислоты (например, уксусной кислоты или смеси уксусной и каталитических количеств трифторук- сусной кислот), в присутствии растворителя или без него при температуре между О и 50°С. Предпочтительна температура около 20 С.
В некоторых случаях растворители могут быть выбраны среди органически растворителей, например простых эфи- ров (тетрагидрофуран), спиртов (этанол) или хлорированных растворителей (метиленхлорид или хлороформ).
Новые продукты общей формулы I могут быть очищены известными способами, такими как кристаллизация, хроматография или последовательные экстракции в кислой и основной средах. Из-за чувствительности синергистина к щелочной среде под основной средой понимают достаточно щелочную среду, чтобы высвободить само вещество из его соли присоединения кислоты, т.е. среду, рН которой не превьшает 7,5-8
Новые продукты общей формулы I, в которой R является радикалом, содержащим аминную функцию, могут быть превращены в соли присоединения кислот при действии кислот в таком органическом растворителе, как спирт, кетон, сложный эфир или хлорированный растворитель. Соль выпадает в хэсадок, в некоторых случаях после концентрирования раствора, ее отделяют фильтрованием или декантацией.. Соли присоединения кислот также могут быть получены в виде водных растворов
5
0
5
0
5
0
5
при добавлении водного раствора соответствующей кислоты к продукту общей формулы I.
Новые продукты общей формулы I, в которой R является радикалом, замещенным одной или двумя оксисульфо- нильными группами, могут быть превращены в металлическую соль или соль присоединения -азотистых оснований по методике, аналогичной описанной для солей присоединения кислот, но при заиене кислоты на гидроокись металла или на азотистое основание.
Прибавляют по каплям к раствору 5,5 г 5(-диметиламинометиленпристин- амицина 1д в 60 см уксусной кислоты 5,3 г 2-диметиламиноэтиламина ак, чтобы температура не превьппала . Полученный раствор перемешивают 20 ч при температуре около 20 С, потом недленно выливают в насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагируют 2 раза 750 см всего метиленхлорида. Объединяют органические фазы, сущат над сульфатом магния, фильтруют и концентрируют при пониженном давлении 2,7 кПа при 30 С. Остаток очищают импульсной -хроматог графией (элюент:хлороформ - метанол 90:10 по объему), фракции 10-72 концентрируют досуха при пониженном давлении (2,7 кПа) при 30 С. Таким образом получают 3 г 5(5-(2-диметилами- ноэтил) -аминометиленпристинамицина 3 в виде бежевого порошка, плавящегося при 180 С.
Спектр ЯМР приведен в табл. 1.
Таблица 1
1,30
д
ч
Спектр ЯМР: 0,90 (м, АН, ) 2,50 (м, 1Н, 5Э,), 2,7-3,6 (м, 4Н,
-NH (Cn)iNH-), 3,0 (под массивом, с, ЗН,-МНСН,), 7,15-7,40 (м, 1Н, CHNH -), 9,90 (м, 1Н, -CH-NHCH,).
Готовят 1%-ный водный раствор bS- (2-четиламиноэтил)-аминомет-шен- пристинамицина 1д (продукт AI) в виде гидрохлорида:
Продукт AI0,03 г
0,1 н. соляная
кислота0,31 см
Дистиллированная
водаДо 3 см
П р и м е р 4. Реакцию проводят по методике примера 1, но исходя из 1,84 г пристинамицина 1д и 2,5 см 3-диметиламинопропиламина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему) и концентрирования досуха фракций 12-15 при пониженном давлении (2,7 кПа) при 155°С получают 0,7 г 55-(3-диметиламинопропшт)-ами- нометиленпристинамицина 1д в виде желтого порошка, плавящегося при 155 С.
Спектр ЯМР: 0,80-1,05 (мт, 4Н,
Спектр ЯМР: 1,05 (д, ЗН, -СН-СН,), 2,30 (с, 6Н, -CH,-N(CH3).), 2,45 (д, 1Н, 5/3,), 2,80 (м, 1Н, -clnCH,), 3,30 (под массивом, -NH-CH -), 3,45 (м, 2Н, + 3,), 4,90(м , 1Н, 55,), 7,15-7,40 (м, 1Н, CHNH), 9,90 (м, 1Н, CH-NHT.
10
/ Готовят 1%-ный водный раствор (3-диметиламино-2-проп 1п)-амино- метиленпристинамицина 1д (продукт АК) в виде гидрохлорида:
Продукт АК20 мг
5 0,1 н. соляная
кислота0,2 см
Дистиллированная вода - да 2 см П р и м е р 6, Реакцию проводят 2Q по методике примера 1, но исходя из 2., 76 г 5J-Диметиламинометиленпристин- 1д и 1,33 г 2-диметиламино- пропиламина, после очистки иьшульс- ной хроматографией (элюент:хлоро- 25 форм - метанол 95:5 по объему) и концентрирования досуха фракций 10- 14 при пониженном давлении (2,7 кПа)
2 + ), 1,80 (мт, 2Н, ), при получают 0,85 г (2-диме- 2,35 (с, 6Н к 0,85 - N(CH5)4 изо- тиламинопропил)-аминометиленпристинмер), 2,40 (с, 6Н X 0,Т5 - N(CH5)i 2-й изомер), 2,40-2.60 (мт, ЗН, 5/3 + + , 3,30 (мт, 2Н, -Ш-СН), 3,50 (мт, 2Hi 35, + 58), 4,90 (мт, 1Н, 56,), 9,65 (м, Ш X 0,15 . CH-NK 2-й изомер), 9,90 (м, 1Н х X 0,5 CH-NK 1-й изомер).
Готовят 6,6%-ный раствор 5&-(3-ди- метиламинопропил)-аминометиленприс- тинамицина 1д (продукт -АЛ) в виде гидрохлорида:
Продукт AJ О,1 г
0,2 н. соляная
кислота0,51 см
Дистиллированная
вода .До 1,5 см
П р и м е р 5. Реакцию проводят по методике примера 1, но исходя из 2,76 г 5 -диметиламинометиленпристин- амицина 1д и 3,06 г 1-диметиламино- пропиламина-2, после очистки импульс- .ной хроматографией (элюент: хлороформ - метанол 99:1 по объему) и концентрирования досуха фракций 11-22 при пониженном давлении (2,7 кПа) при 30 с-получают 1,0 г (3-диме- тиламино-2-пропил)-аминометиленприс40
30 амицина I в виде оранжевого порошка, плавящегося при .
Спектр ЯМР: 0,90 (м, 4Н, (
1,05 (д, ЗН, сн-сн,), 2,30 (с, бн;
-СН(СНз)Н(СНз)г), 2,45 (д, 1Н, 5/J,), 2,80 (м, 1Н, -CHCU ), 3,30 (под масг
сивом, 2Н, -NH-CH -), 3,45 (м, 5 ЕЗ + + 35,), 4,90 (м, 1Н, 5&), 7,15-7,40 (м, 1Н, СНМН-), 9,90 (м, 1Н, CH-NH-).
Готовят 10%-ньй водный раствор (2-диметш1аминопрошш) -аминоме- тиленпристинамицина 1д (продукт AZ) в виде гидрохлорида:
Продукт AZ0,03 г
0,1 н. соляная
кислота . 0,31 см
Пример 7. Реакцию проводят до методике примера 1, но исходя из 1,84 г 55-диметиламинометиленпристин50 амицина 1д и 3 j16 г 2-амино-5-диэтил- аминопентана, после очистки импульсной хроматографией (злюент:хлороформ- метанол 90:10 по объему) и концентрирования досуха фракций 15-27 при
55 пониженном давлении (2,7 кПа) при 30°С получают 0,9 г (5-диэтилами- но-2-пентил)-аминометиленпристинами45
тинамицина 1 в виде желтого порошка, цина 1д в виде бежевого порошка, плаплавящегося при 160 С.
вящегося при 160 С.
14560198
Спектр ЯМР: 1,05 (д, ЗН, -СН-СН,), 2,30 (с, 6Н, -CH,-N(CH3).), 2,45 (д, 1Н, 5/3,), 2,80 (м, 1Н, -clnCH,), 3,30 (под массивом, -NH-CH -), 3,45 (м, 2Н, + 3,), 4,90(м , 1Н, 55,), 7,15-7,40 (м, 1Н, CHNH), 9,90 (м, 1Н, CH-NHT.
0
/ Готовят 1%-ный водный раствор (3-диметиламино-2-проп 1п)-амино- метиленпристинамицина 1д (продукт АК) в виде гидрохлорида:
Продукт АК20 мг
5 0,1 н. соляная
кислота0,2 см
Дистиллированная вода - да 2 см П р и м е р 6, Реакцию проводят Q по методике примера 1, но исходя из 2., 76 г 5J-Диметиламинометиленпристин- 1д и 1,33 г 2-диметиламино- пропиламина, после очистки иьшульс- ной хроматографией (элюент:хлоро- 25 форм - метанол 95:5 по объему) и концентрирования досуха фракций 10- 14 при пониженном давлении (2,7 кПа)
при получают 0,85 г (2-диме- тиламинопропил)-аминометиленпристин при получают 0,85 г (2-диме- тиламинопропил)-аминометиленпристин40
30 амицина I в виде оранжевого порошка плавящегося при .
Спектр ЯМР: 0,90 (м, 4Н, (
1,05 (д, ЗН, сн-сн,), 2,30 (с, бн;
-СН(СНз)Н(СНз)г), 2,45 (д, 1Н, 5/J,), 2,80 (м, 1Н, -CHCU ), 3,30 (под масг
сивом, 2Н, -NH-CH -), 3,45 (м, 5 ЕЗ + + 35,), 4,90 (м, 1Н, 5&), 7,15-7,40 (м, 1Н, СНМН-), 9,90 (м, 1Н, CH-NH-).
Готовят 10%-ньй водный раствор (2-диметш1аминопрошш) -аминоме- тиленпристинамицина 1д (продукт AZ) в виде гидрохлорида:
Продукт AZ0,03 г
0,1 н. соляная
кислота . 0,31 см
Пример 7. Реакцию проводят до методике примера 1, но исходя из 1,84 г 55-диметиламинометиленпристин50 амицина 1д и 3 j16 г 2-амино-5-диэтил- аминопентана, после очистки импульсной хроматографией (злюент:хлороформ метанол 90:10 по объему) и концентрирования досуха фракций 15-27 при
55 пониженном давлении (2,7 кПа) при 30°С получают 0,9 г (5-диэтилами- но-2-пентил)-аминометиленпристинами45
вящегося при 160 С.
1456019
Спектр ЯМР: 1,00 (дд, 1Н, З/З), ,25 (мт, 6Н, -N()2), 2,45 (д,
Н, 5|5,), 2,7-3,0 (M..6H,-CH,Nv),
,45 (дд. 1Н, 56), 7,30 (под арома- икой, Cfi-NH-),-7,85 (дд, 1Н, Нб), 0 (м, широкий, 1Н, -NH-CH-).
Готовят 1%-ный водный раствор (5-диэтиламино-2-пентил)-аминоме- иленпристинамицина 1 (продукт AM) виде гидрохлорида:Продукт AM
0,1 н. соляная
кислота
Дистиллированная
вода
Примере. Реакцию проводят о методике примера 1, но исходя из 1,84 г 5Р-диметиламинометиленприс- тинамицина « и 2,28 гН-(2-амино- этш1)-пирролидина, после очистки импульсной хроматографией (элюент:хло- роформ - метанол 98:2 по объему) и концентрирования досуха фракций 15- 24 при пониженном давлении (2,7 кПа) при получают 0,95 г (2-nHp- ролидиноэтид)-аминометиленпристин- амицина 1д авиде желтого порошка, плавящегося при 183 С.
Спектр -ЯНР: 0,90 (мт, 4Н, 2j(v+
0,02 г 0,2 см До 2 см
СН2 4 , 1,80 (мт, 4Н, 2,70
CHg(мт, 6Н, -СНг.-Нхсд ), 3,45 (м, 4Н,
-NH-C%- .+ ), 4,90 (м, 1Н, 5,),,2-7.4 (м, А + 1 Н4 + 1 Н« + + гСН-), 9,90 (мт, 1Н, СН1ЩСКг-),
Готовят 1%-ный раствор 55(2-пир- ролидиноэтил)-аминометиленпристинами- цина 1д (продукт АН) в виде гидрохлорида:
Продукт АН 0,1 н, соляная кислота
Дистиллированная . вода
П р и м е р 9. Реакцию проводят по методике примера 1, но исходя из 2,76 г 55-диметш1аминометиленпристин- амицина 1д и 1,92 г N-(3-aминoпpb- пил)-пиppoлидинa, после очистки импульсной хроматографией (элюент:хлороформ - метанол 95:5 по гобьему) и концентрирования досуха фракций 10- 15 при пониженном давлении (2,7 кПа) при получают 1,25 г (3-пирро10
0,02 г 0,2 см До 2 см
10
-CHjN
лидинопропил)-аминометиленпристинами- цина 1д в виде желтого порошка, плавящегося при 170 С.
Спектр ЯМР: 0,95 (м, 1Н, 5),
.
1,95 (м, 7H. + Зр, -н
f CH CHiCHjNO, 2,45 (д, широкий, 1Н, 0 5 2,80 (под массивом, 6Н,
СНг
ф,30 (мт, 2Н, -NH-CHg), СН 23;50 (мт, 2Н, 3, + 5(г), 4,90 (м, 5 1Н, 5f,), 7,15-7,40 (MJ 1Н, CH-NH-), 9,90 (нт, 1Н, CH-NH-).
Готовят 1%-ный водный раствор 55-(3-пирролидинопропил)-аминометиг
д (продукт АО):
0,03 г Дистиллированная вода3 см
Пример 10. Реак:цию проводят по методике примера 1, но исходя из 2,76 г 5(-диметиламинопристинамицина 1. и 3,85 г Ы-(2-нминоэтил)-пиперидина, после очистки импульсной хроматографией (элюент:хлороформ - мета- иол 99:1 по объему) и концентрирова- ния досуха фракций 13-17 при пониженном давлении (2,7 кПа) при 30 С получают 1,5 г 55-(2-пиперидиноэтил)-амиленпристинамицина I. 20 Продукт АО
нометиленпристинамицина 1д в виде
желтого порошка, плавящегося 35 .
при
Спектр ЯМР: 0,9,0 (м, 4Н, 5), ,-У - -CHj), 2,40
1,60 (мт, 6Н,
40
СНг
(м, бн,
-СНг
сн
SO
55
2,7-3,5 (м, под массивом, 2Н, -NH- -СН„), 3,45 (мт, 2Н, 3 + ), 4,90 (мт, 1Н, 5,), 7,15-7,40 (м, 1Н, -CHNH-), 9,90 (vn, 1H,CH-NH).
Готовят 1%-ный водный раствор (2-пиперидиноэтш1)-аминометилен- пристинамицина 1д (продукт АР) в ви гидрохлорида:
Продукт АР 0,02 г
0,1 н. соляная
кислота0,2 см
Дистиллированная
водаДо 2 см
и
Пример 11. Реакцию проводят по методике примера 1, но исходя из 2,6 г N-(2-aминoэтил)-мopфoлинa и 1,84 г 5§-диметиламинометиленпристин- амицина 1д , после очистки импуьсной хроматографией (элюент:хлороформ - метанол 95:5 по объему) и концентрирования досуха фракций 21-30 при пониженном давлении (2,7 кПа) при 30 С получают 0,8 г (2-морфолиноэтил)- -аминометиленпристинамицина 1д в виде бежевого порошка, плавящегося при
172 С.
Спектр ЯМР: 0,95 (м, 1Н, 5pt),
СНч
2,50 (м, 7Н, 5p,.( 2
СН2
3,30 (м, 1Н, -NH-CJ -), 3,50 (му 1Н,
CHi
3,), 3,70 (мт, Н.оСд,
4,90 (м, 1Н, 5), 7,2-7,4 (м, 1Н, СН-), 9,90 (мт, 1Н, CH-NH-CH2-).
Готовят 1%гный водный раствор 5о-(2-морфолиноэтил)-аминометилен- пристинамицина 1д (продукт АО), в виде гидрохлорида:
Продукт АО0,02 г
0,1 н. соляная
кислота0,2 см
Дистиллированная
водаДо 2 см
Пример 12. Реакцию проводят по методике примера 1, но исходя из 2,76 г диметиланинометиленприс- тинамицина 1д и 3,66 г 2-аминометил- 1-этш1пирролидина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 99:1 по объему) и концентрирования досуха фракций 10-1 при пониженном давлении (2,7 кПа) .при получают 1,3 г 55-(1-этил- -2-пирролидинил)-метиламинометилен- пристинамицина 1д в виде бежевого порошка, плавящегося при 160°С.
Спектр ЯМР: 1,10 (т, ЗН, -CHa-CHj
I 1,60 (м, 4Н, Y ); 1V95 (м, 1Н,
СН-га), 2,8-3,6 (м, 4Н, -CH4N + + -CHa-NH-), 7,15-7,40 (м, Тн,
CBNH-).
Готовят водный 1%-ный раствор 5о-(1-этил-2-пирролидинил)-метилами56019
1 2
ид (продукт 0,02 г 0,2 см До 2 см
10
15
20
нометиленпристинамицина I AR) в виде гидрохлорида:
Продукт AR
0,1 н. соляной
кислоты
Дистиллированная
вода
Пример 13. Реакцию проводят, по методике примера 1, но исходя из 2,77 г 5о-диметиламинометиленпристин- амицина 1 и 3,4 г 3-амино-1-метилпи- перидина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 95:5 по объему) и концентрирования досуха фракций 7-16 при пониженном давлении (2,7 кПа) при 30 С получают 0,8 г 5-(1-мeтшl-3-пиnepи- дил)-aминoмeтилeнщ иcтинaмициria 1д в виде бежевого пороп ка, плавящегося при .
Спектр ЯМР: 0,90 (мт, 4Н, 2 + + ), 1,5-2,10 (мт, 7Н, 2р 4- 2 +
N
+ 3
31, + -/ ;::С112Г. 2,30
СНг-СНг
(с, ЗН, К
СН,), 2,45 (д, 1Н -К
90
5,). 2,65 (мт, 1Н, ,
, . (мт, 4Н )),
3,20 (мт, 7Н, -NCHj в 4 + 3(Ге + Р
нДсн,
или
. 7.15-7,40
-(м, 1Н, СЙКН-), 7,80 (мт, 1Н, 1 Hfl 9,90 (мт, 1Н, CHN-H-), 11,60 (с, 45 широкий, 1Н, ОН).
Готовят 1%-нын водный раствор 55-(1-метил-3-пиперидил)-аминомети- ленпристинамицина 1 (продукт AS) в виде гидрохлорида:
50 Продукт AS .0,02 г
0,1 н. соляная
кислота0,2 см
Дистиллированная вода-До 2 см
55 3-Амино-1-метилпиперидин может быть получен по методике, описанной Werbel L.M., Curry А., Elslagu E.F., Ness С. .terocyclic Chem. 10, 363 (1973).13U5601
Пример 14. Реакцию проводят по методике примера 1, но исходя из 13,8 , г зЭ-диметиламинометиленпристин- амицина 1д и 3,4 г 4-амино-1-метил- пиперидина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 92,5:7,5 по объему) и концентрирования досуха фракций 15-20 при пониженном давлении (2,7 кПа) при получают 4,0 г ,5й-(1-метил-4- -пиперидил)-аминометиленпристинами- цина 1д в виде желтого порошка, плав- вящегося при 208 С.
Спектр ЯМР: 0,40 (м, 4Н, 2y+2pj),i5
5 0
KXjHo- N- ), .35 (с, Г.Н«ЗН, КСНз), 2,45 (д, 1Н, 5.f)-t), 2,90
СНг
у-, 3,20 (под массивом.
СНг
1Н,-СнОм-), 3,50 (д, 1Н, ),
4,85 (под массивом, 1Н, 56), 6,65 (д, 1Н, QHNH-), 9,70 (дд, 1Н х X 0,25 CH-NH 1-й изомер), 10,03 (дд, 1Н X 0, СН-Ш - 2-й изоиер)
Готовят 1%-ный водный раствор (1-метил-4-пиперидил)-аминометиленпристинамицина 1д (продукт AT) в виде V, гидрохлорида:
Продукт AT 0,03 г
0,1 н. соляная
кислота0,3 см
Дистиллированная
водаДо 0,3 см
П р и м е р 15. Реакцию проводят по методике примера 1, но исходя из 0,8 г 55-диметиламинометиленвиргини-г амицина S и 1,02 г 4-амино-1-метилпи- 5 перидина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему) и концентрировании досуха фракций 3-7 при пониженном давлении (2,7 кПа) при получают 0,3, г 5(8-(1-метил-4-пипери- дил)-аминометиленвиргиниамицина S в виде бежевого порошка, плавящегося
П р и м е р 16. Реакцию проводят по методике примера 1, но исходя из 2,76 г 5Р-диметиламинометиленпристин- амицина 1д и 2,15 г 1-(2-аминоэтил)- 20 -4-метилпиперазина, после очистки импульсной хроматографией (злюент: :хлороформ - метанол 95:5 по объему) и концентрирования досуха фракций 10-16 при пониженном давлении . (2,7 кПа) при 30°С получают 0,9 г 5S- 2-(4-метил-1-пиперазинил)-этил - -аминометиленпристинамицина 1д в виде желтого порошка, плавящегося при 150 С.
30 Спектр ЯМР: 1,00 (м, 1Н, 5рг), 2,30 (с, ЗН, VNCH,), 2,50 (м, 9Н, пиперазина + 5/5,). 2,90 (под массивом, -CH,CH,iN), 3,30 (м, 2К, -NH-CH -), 3,50 (м, 2Н, 562 « 3,)
35 4,9о(м,.1Н, 58,), 7,15-7,40 (м, 1Н, CHNH-), 9,90 (м, 1Н, CH-NH7).
1
Готовят 10%-ный водный раствор (4-метил-1-пиперазинил)-этил - 40 аминометиленпристинамицина 1д (продукт AV) в виде гидрохлорида:
Продукт AV 15 мг
0,1 н. соляная
кислота0,15 см
1-(2-Амин6этил)-4-метилпиперазин может быть получен следующим образом.
К раствору 10,0 г гидробромида 2-бромэтиламина ;:в 60 см абсолютного этанола прибавляют 9,75 г N-метил- 50 пиперазина. Полученный раствор перемешивают 16 ч при температуре около 20°С, затем отгоняют этанол при попри 195 С.
ниженном давлении (2,7 кПа) при 30 С. Маслянистьй остаток обрабатывают хлоСпектр яМР: 0,9 (м, 4Н, 2 5),; 55 50 смП, полученную смесь - Г перемешивают в 20 см 10 н. водного
раствора гидроокиси натрия. Водную фазу экстрагируют 3 раза 150 см всего хлороформа. Объединяют органичес2,30 (с, 3H, ), 2,80-3,30
9
(м, 5Н, 3,55 (дд, 1Н, В, -СН|
5
5
), 4,90 (м 1Н, 5,), 7,10-7,40 (м, ароматика + CH-NH-), 7,70 (мм, 1Н, ГНй), 10,1 (м7 1Н, СН-Ш-). Готовят 5%-ный водный раствор (1-метил-4-пиперидил)-аминомети- ленвиргиниамицина S (продукт AU) в виде гидрохлорида:
Продукт AU 0,1 г 0,1 н. соляная кислота 1,05 см Дистиллированная водаДо 2 см
П р и м е р 16. Реакцию проводят по методике примера 1, но исходя из 2,76 г 5Р-диметиламинометиленпристин- амицина 1д и 2,15 г 1-(2-аминоэтил)- 0 -4-метилпиперазина, после очистки импульсной хроматографией (злюент: :хлороформ - метанол 95:5 по объему) и концентрирования досуха фракций 10-16 при пониженном давлении . (2,7 кПа) при 30°С получают 0,9 г 5S- 2-(4-метил-1-пиперазинил)-этил - -аминометиленпристинамицина 1д в виде желтого порошка, плавящегося при 150 С.
30 Спектр ЯМР: 1,00 (м, 1Н, 5рг), 2,30 (с, ЗН, VNCH,), 2,50 (м, 9Н, пиперазина + 5/5,). 2,90 (под массивом, -CH,CH,iN), 3,30 (м, 2К, -NH-CH -), 3,50 (м, 2Н, 562 « 3,)
35 4,9о(м,.1Н, 58,), 7,15-7,40 (м, 1Н, CHNH-), 9,90 (м, 1Н, CH-NH7).
1
Готовят 10%-ный водный раствор (4-метил-1-пиперазинил)-этил - 40 аминометиленпристинамицина 1д (продукт AV) в виде гидрохлорида:
Продукт AV 15 мг
0,1 н. соляная
кислота0,15 см
1-(2-Амин6этил)-4-метилпиперазин может быть получен следующим образом.
К раствору 10,0 г гидробромида 2-бромэтиламина ;:в 60 см абсолютного этанола прибавляют 9,75 г N-метил- 50 пиперазина. Полученный раствор перемешивают 16 ч при температуре около 20°С, затем отгоняют этанол при по151456019 16
кие фазы, сушат над сульфатом натрия, -диметиламиноэтил)-тиометиленпристинфильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получают таким образом 4,5 г 1-(2-амино- этил)-4-метилпиперазина в виде желтого масла. Т.кип. (2,7 кПа) 118-
Пример 17. Реакцию проводят по методике примера 1, но исходя из 4,0 г 5(5-диметиламинометиленпристин- амицина 1д и 0,55 г гистамина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 95:5 по объему) и концентрирования досуха фракций 25-50 при пониженном давлении (2,7 кПа) при 30°С получают 2,0:4 г (4-имидазолш1)-этил - аминометиленпристинамицина 1д в виде желтого порошка, плавящегося при .
Спектр ЯМР: 0,90 (м, 4Н, 2J4- 5р)с), 2,40 (д, пшрокий, 1Н, 5р), 2,90 (под массивом, м, 1Н, 56,), 3,50 (д, 4Н,
амицина 1д в виде желтого порошка, плавящегося при 150 С.
Спектр ЯМР: 0,68 (дц, 1Н, 5(32) 2,32 (с, 6Н X 0,85, -СН(гК(С1Ц) 1-й изомер), 2,35 (с, 6Н х 0,15, , -CH.N(CH-)j 2-й изомер), 2,45 (д, 1Н, 5fi.), 2,65 (мт, 2Н, -SCHj-),
10
3,05 (т, 2Н, -СЦ -NO, 3,43 (дд, 1Н, 5,),-5,15 (в массиве, 5f, ), 7,60 (с, широкий, 1Н, CHS-), 7,83 (мт, 1Н, 1 Н два изомера).
Готовят 1%-ный водньш раствор 5 ( 2-диметиламиноэтил) -тиометнлен- пристинамицина I де гидрохлорида:
Продукт АХ
О,1 н. соляная
киспота
Дистиллированная
вода
Пример 19. Реакцию проводят по методике примера 18, но исходя
20
д (продукт АХ) в ви- 0,1 г 1 см До 10 см .
+ ЗсУ + -NH-CK.1-), 4,80 (под мае-25 из 3,68 г 5с -диметиламинометиленприссивом, 1Н, 5), 6,65 (м, 2Н, Kg + + NH гистамина), 7,50 (с, 1Н, .;Н в положении 2 гистамина), между 7,15 и 7,40 (м, 1Н, СН-Щ-), 9,65 (м, . 1Н X 0,15 CH-NH - 2-й изомер), 9,95 (м, 1Н X 0,85 CH-NH 1-й изомер).
Готовят 10%-ный водный раствор (4-имидазолил)-зтил7-аминоме- тиленпристинамицина 1д (продукт AW) в виде гидрохлорида:
Продукт AW0,1 г
0,1 н. соляная
кислотаДо 1 см
Пример 18. К раствору 1,84 г 5 -диметиламинометиленпристинамицина 1д в 40 см уксусной кислоты прибавляют 2,1 г 2-диметш1аминоэтантиола. Полученньш раствор перемепмвают 20 ч при температуре около 20°С, потом медленно выливают в насьш;енный водный раствор бикарбоната натрия, полученную смесь 3 раза экстрагируют 400 см всего метиленхлорида. Объединяют органические фазы, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном дав- лении (2,7 кПа) при 30°С. Полученный остаток очищают импульсной хроматографией (элюент:хлороформ - метанол 96:4 по объему), объединяют фракции 5 и 6 и концентрируют досуха при пониженном давлении (2,7 кПа) при 30 С. Таким образом получают 0,8 г (235
тинамицина 1д и 8,5 г 2-диэтиламино- этантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 96:4 по объему) и концентри- 30 рования досуха фракций 13-20 при пониженном давлении (2,7 кПа) при 30 С получают 0,85 г 5(-(2-диэтиламино- этил)-тиометиленпристинамицина 1д в. виде бежевого порошка, плавящегося при 192 С,
Спектр ЯМР: О.,65 (дл, 1Н, 5), 1,05 (т, 6Н, -N(,)j, ), 2,42 (д, 1Н, 5,), 2,60 (к, 4Н, -К() , 3,42 (дд, 1Н, 582), 5,10 (под массивом, 1Н, 5Е,), 7,58 (с, широкий, 1Н, CJ-S-), 7,82-(дд, 1Н X 0,85 Г Н 1-й изомер), 7,98 (дд, 1Н х 1 Hg 2-й изомер),
Готовят 1%-ный водный., раствор. (2-диэтиламиноэтил)-тиометилен- пристинамицина 1д (продукт AY).в виде гидрохлорида:
Продукт AY 0,04 г
0,1 н. соляная
кислота0,4 см
Дистиллированная
водаДо 4 см
П р и м е р 20. Реакцию проводят по методике примера 18, но исходя из 3 г 55 -диметиламинометиленпристин40
45
50
55
амицииа 1 и 0,4 г 3-диметиламино- пропантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 92,5:7,5 по объему) и конценамицина 1д в виде желтого порошка, плавящегося при 150 С.
Спектр ЯМР: 0,68 (дц, 1Н, 5(32) 2,32 (с, 6Н X 0,85, -СН(гК(С1Ц) 1-й изомер), 2,35 (с, 6Н х 0,15, , -CH.N(CH-)j 2-й изомер), 2,45 (д, 1Н, 5fi.), 2,65 (мт, 2Н, -SCHj-),
3,05 (т, 2Н, -СЦ -NO, 3,43 (дд, 1Н, 5,),-5,15 (в массиве, 5f, ), 7,60 (с, широкий, 1Н, CHS-), 7,83 (мт, 1Н, 1 Н два изомера).
Готовят 1%-ный водньш раствор ( 2-диметиламиноэтил) -тиометнлен- пристинамицина I де гидрохлорида:
Продукт АХ
О,1 н. соляная
киспота
Дистиллированная
вода
Пример 19. Реакцию проводят по методике примера 18, но исходя
д (продукт АХ) в ви- 0,1 г 1 см До 10 см .
из 3,68 г 5с -диметиламинометиленприс5 из 3,68 г 5с -диметиламинометиленприс5
тинамицина 1д и 8,5 г 2-диэтиламино- этантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 96:4 по объему) и концентри- 0 рования досуха фракций 13-20 при пониженном давлении (2,7 кПа) при 30 С получают 0,85 г 5(-(2-диэтиламино- этил)-тиометиленпристинамицина 1д в. виде бежевого порошка, плавящегося при 192 С,
Спектр ЯМР: О.,65 (дл, 1Н, 5), 1,05 (т, 6Н, -N(,)j, ), 2,42 (д, 1Н, 5,), 2,60 (к, 4Н, -К() , 3,42 (дд, 1Н, 582), 5,10 (под массивом, 1Н, 5Е,), 7,58 (с, широкий, 1Н, CJ-S-), 7,82-(дд, 1Н X 0,85 Г Н 1-й изомер), 7,98 (дд, 1Н х 1 Hg 2-й изомер),
Готовят 1%-ный водный., раствор. (2-диэтиламиноэтил)-тиометилен- пристинамицина 1д (продукт AY).в виде гидрохлорида:
Продукт AY 0,04 г
0,1 н. соляная
кислота0,4 см
Дистиллированная
водаДо 4 см
П р и м е р 20. Реакцию проводят по методике примера 18, но исходя из 3 г 55 -диметиламинометиленпристин0
5
0
5
амицииа 1 и 0,4 г 3-диметиламино- пропантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 92,5:7,5 по объему) и концен,7145601918
трирования досуха фракций 10-17 при ном давлении ( кПа) при 30°С по- пониженном давлении (2.7 кПа) при
5о-(3-диметш130 0 получают 0,85 г
11 Д. f ш ../..J-.- - --
лучают 0,96 г 5д-(3-диметиламино-2- -метилпропил)-тиометиленпристинамицина li в виде бежевого порошка, плааминопропил)-тиометиленпристинамици-j, о
на Т в виде бежевого порошка, плавя-вящегося при 234 С.
щегося при 170°С. .Спектр ЯМР: 0,65 (дд,1Н 5,),
Спектр ЯМР: 0,70 (дд, 1Н, 5(3,),.1,05 (д, ЗН, -dHCH,), 2,25 (с, 6Н,
1,90 (м, 2Н, -S-CH CJaCH NO, 2,20|-N(CH,)2.), 2,40 (д, 1Н, 5/3,), 3,15
(с, .6Н, -N(CH3), 2,40 (д, 1Н, 5(5,).ю и 2,90 (система АВХ, 2Н, 2,90 (м, 2H,.-CH2NO, 3,45 (дд, tH, SSj), 7,65 (с, широкий, 1Н, CH-S-). 1%-ный водный раствор
Готовят
5 S-(3-диметиламинопропил)-тиометилен- пристинамицина I де гидрохлорида:
Продукт AZ
0,1 н. соляная
кислота
Дис тиллир о в а иная
вода
П р и м е р 21. Реакцию проводят, по методике примера 18, но исходя из 1,8 г 5 -диметш1аминометиленвиргинид (продукта AZ) в ви- ig 0,03 г 0,3 смз До 3 см20
-NC), 3,45 (д, широкий, 2Н, 5е), 7,75 (дд, 1Н X 0,80 Г Н 1-й изо- мер), 7,95 (дд, 1Н х 0,20 Г Н 2-й изомер).
Готовят 1%-ньй водный раствор ( З-диметиламино-2-метилпропил ) - тиометиленпристинамицина 1д (продукт ААВ) в виде гидрохлорида:
Продукт ААВ 0,03 г
0,1 н. соляная
кислота0,3 см
Дистиллированная
вода . До 3 смз
3-Диметиламино-2-метилпропант1 ола
амицина S и 0,48 г 3-дйметиламинопро- 25 может быть получен следующим образом, пантиола,. после очистки импульсной хроматографией (элюент:хлор9форм - метанол 95:5 по объему) и концентрирования досуха фракций 5-14 при пониженном давлении (2,7 кПа) при 30 С получают 0,7 г (3-диметиламинопро- пш1)-тиометиленвиргиниамицина S в виде бежевого порошка, плавящегося при
К раствору 5,33 г N,N-димeтил- -З-ацетилтио-2-метилпропиламина в 50 см безводного метанола прибавляют 0,026 г натрия. Полученную смесь 30 кипятят с обратным холодильником в
140°С.
Спектр ЯМР: 0,50 (дд, 1Н, 5/), 2 (м, 2Н, , 2,35 (с, 6Н, -S(C%), Ы(СД;з)), 2,60 (т, 2Н, -SCHiCH CH NO, 3 (т, 2Н,- -SCH.), 3,35 (дд, 1Н, 55), 4,90 (дд, 1Н, 5S,i,5,20 (м, 1Н, 5об), 7,60 (с, широкий, 1Н, CH-S-), 7,80 (дд, 1Н, ГНб).
Готовят 10%-ный водный . раствор 58-(3-диметиламинопропил)-тиометилен- виргиниамицина S (продукт ААА) в ви- уксусной кислоты. Полученную смесь
течение 7ч, потом отгоняют 1 етанол при пониженном давлении (2,7 кПа) при 50°С. Остаток перегоняют при пониженном давлении (2,7 кПа). Таким
2g образом,получают 0,9 г 3-диметилами- но-2-метилпропантиола в виде желтого масла, перегоняющегося при 56 С при давлении 2,7 кПа.
N,N-Димeтил-3-aцeтилтиo-2-мeтил-
40 пропиламин может быть получен следующим образом.
К раствору 29,5 г М,Ы-диметил- -1-хлор-2-метилпропиламина в 120 см изопропанола прибавляют 15,7 см тио
кипятят с обратным холодильником в течение 48 ч, потом отгоняют изопро- панол при пониженном давлении (2,7 кПа) при . Полученный остаток обрабатывают 100 см насьш1енного водного раствора бикарбоната натрия, водную фазу 3 раза экстрагируют 600 см всего этилового эфира. Объединяют органические фазы, сушат над
де гидрохлорида: Продукт ААА 0,2 н. соляная кислота
Дистиллированная вода
0,1 г 0,52 см До 1 см
50
П р и м е р 22. Реакцию проводят по методике примера 18, но исходя из
4 г 5(5 -диметиламинометиленпристинамикипятят с обратным холодильником в течение 48 ч, потом отгоняют изопро- панол при пониженном давлении (2,7 кПа) при . Полученный остаток обрабатывают 100 см насьш1енного водного раствора бикарбоната натрия, водную фазу 3 раза экстрагируют 600 см всего этилового эфира. Объединяют органические фазы, сушат над
1д и 0,7 г 3-диметш1амино-2-ме- 55 сульфатом магния, фильтруют и концен
цина
тилпропантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 94:6 по объему) и концентрирования досуха при понижентрируют досуха. Полученный остаток очищают импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему), объединяют фракции 6-10
ном давлении ( кПа) при 30°С по-
11 Д. f ш ../..J-.- - --
лучают 0,96 г 5д-(3-диметиламино-2- -метилпропил)-тиометиленпристинамицина li в виде бежевого порошка, пла о
и 2,90 (система АВХ, 2Н,
-NC), 3,45 (д, широкий, 2Н, 5е), 7,75 (дд, 1Н X 0,80 Г Н 1-й изо- мер), 7,95 (дд, 1Н х 0,20 Г Н 2-й изомер).
Готовят 1%-ньй водный раствор ( З-диметиламино-2-метилпропил ) - тиометиленпристинамицина 1д (продукт ААВ) в виде гидрохлорида:
Продукт ААВ 0,03 г
0,1 н. соляная
кислота0,3 см
Дистиллированная
вода . До 3 смз
3-Диметиламино-2-метилпропант1 ола
25 может быть получен следующим образом,
К раствору 5,33 г N,N-димeтил- -З-ацетилтио-2-метилпропиламина в 50 см безводного метанола прибавляют 0,026 г натрия. Полученную смесь 30 кипятят с обратным холодильником в
5 может быть получен следующим образом,
уксусной кислоты. Полученную смесь
течение 7ч, потом отгоняют 1 етанол при пониженном давлении (2,7 кПа) при 50°С. Остаток перегоняют при пониженном давлении (2,7 кПа). Таким
2g образом,получают 0,9 г 3-диметилами- но-2-метилпропантиола в виде желтого масла, перегоняющегося при 56 С при давлении 2,7 кПа.
N,N-Димeтил-3-aцeтилтиo-2-мeтил-
40 пропиламин может быть получен следующим образом.
К раствору 29,5 г М,Ы-диметил- -1-хлор-2-метилпропиламина в 120 см изопропанола прибавляют 15,7 см тио уксусной кислоты. Полученную смесь
50
кипятят с обратным холодильником в течение 48 ч, потом отгоняют изопро- панол при пониженном давлении (2,7 кПа) при . Полученный остаток обрабатывают 100 см насьш1енного водного раствора бикарбоната натрия, водную фазу 3 раза экстрагируют 600 см всего этилового эфира. Объединяют органические фазы, сушат над
сульфатом магния, фильтруют и концен
трируют досуха. Полученный остаток очищают импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему), объединяют фракции 6-10
19
и концентрируют досуха при пониженном давлении (2,7 кПа) при . Таким образом получают 5,57 г Ы,Н-ди- метил-З-ацетилтио-2-метилпропиламина
в виде красного масла.
П р и м е р 23. Реакцию проводят по методике примера 18, но исходя из 4 г 5(-диметиламинометиленпри- стинамицина 1д и 1,14 г 2-диметил- амино-2-метилпропантиола, после очистки импульсной хроматографией (элюент:хлороформ - метанол 9218 по объему) и концентрирования досуха при пониженном давлении (2,7 кПа) при ЗО С фракций 12-30 получают 1,4 г 5(-(2-диметиламино-2-метилпропил)- -тиометиленпристинамицина 1д в виде бежевого порошка, плавящегося при
zoo c.
Спектр ЯМР: 0,55 (дд, ,1Н х 0,20 5/512-й изомер), 0,68 (дд, 1НхО,80 изомер), 1,15 (с, 6Н, СССН)) 2,30 (с, 6Н X 0,80 - N (СНз)г -1 - изомер), 2,42 (с, 6Н х 0,2 - NCCH,) 2-й изомер), 2,40 (д, 1Н, 5/i.), 2,80 (под массивом, -5- Ш) 3,42. (дд, 1Н, 5Sj), 7,55 (с, широкий, 1Н, iCH-S), 7,80 (дд, 1Н X 0,80 1 Hg 1-й изомер), 7,98 (дд, 1Н х 0,20 1 Hg 2-й изомер),
Готовят 1 водный раствор (2-диметиламино-2-метилпропил)- -тиометиленпристинамицина 1д (продук ААС) в виде гидрохлорида:
Продукт ААС 0,03 мг
Соляная кислота 0,3 мл
Дистиллированная
водаДо 3 мл
П р и м е р 24. Реакцию проводят по методике примера 18, но исходя из 4 г 5с -диметиламинометиленпристин амицина 1д и 1,1 г 2-(1-пирролиди- нил)-этантиола, после очистки флаш хроматографией (элюент: хлороформ-метанол 96:4 по объему) и концентрирования досуха фракций 9-15 при пониженном давлении (2,7 кПа) при получают 1,3 г. (1-пирр6- лидинил)этш1 -тиометиленпристинамицина 1д в виде бежевого порошка, плавяш,егося при 180 С.
Спектр ЯМР: 0,65 (дд, 1Н, 5),
г- СНг
1,85 (м, 4 H,N I ,2,45 (д, 1Н,
СНг
5|i), 2,75 и 2,90 (м, 8Н, и SCH -), 7,60 (с, широкий, 1Н, .СН456019
20
,
т
- - -S-), 7,85 (дд, 1Н, 1 Нб), 3,43 (дц,
2Н, 5 ).
Готовят 1%-ный водный раствор . (1-пирролнцинил)-этил -тиоме- тиленпристинамицина 1д (продукт AAD)
в виде гидрохлорида:
Продукт AAD 0,03 г 0,1 н. соляная кислота0,3 мл Дистиллированная
10
вода
До 3 мл
П р и м е р 25. Реакцию проводят по методике примера 18, но исходя
,g из-4 г 5-диметиламинометш1енпристин- амицина 1д и 1,74 г 2-(1-метил-2- -пирролидинил)-этантиола, после очистки импульсной хроматографией (элюент: хлороформ-метанол 92:8 по объему)
2Q и концентрирования досуха фракций
: 12-22 при пониженном давлении (2,7 кПа) при 30°С получают 1,33. г 5((1-ме- тил-2-пирролидинил)этил -тиометилен- приотинамицина 1д в виде бежевого по25 рошка, плавящегося при 215 С.
Спектр ЯМР: 0,65 (дд, 1Н, 5/), CHj-CHj
1,4-2,3 (м, 6Н, - CHj-N ), 2,40 (д, 1Н, 5 fit), 2,48 (с; ЗН N-CH, пирроЗОдидина), 3,40 (дд, 1Н, 5), 7,50 (с, широкий, 1Н, СН-), 7,80 (дд, 1Н X 0,85, ГНй 1-й изомер), 8,00 (дд, 1Н X 0,15 I Hj 2-й изомер). Готовят 0,6%-Hbrii водный раствор
35 5S (1-метил-2-пирролидинил-)- -этил1-тиометиленпристинамицина 1д
40
(продукт ААЕ) в виде гидрохлорида: Продукт ААЕ 0,1 н. соляная
0,03 г 0,3 см
До 5 с м
кислота Дистиллированная
вода 1-Метил-2-(2-пирролидинил)-этан-,
тиол может быть получен аналогично 45 методике, приведенной в примере 32 для получения 3-диметиламино-2- ме- тилпропантиола, но исходя из 15,7 г 2-(2-ацетилтиоэтил)-1-метш1Пирроли- дина и 0,07 г натрия. Таким образом получают 12,2 .г продукта в виде красного масла.
2-(2-Ацетилтиоэтил)-1-метилпирро- лияин может быть получен по методике примера 32 для получения N,N-димeтил- -3-ацетилтио-2-метш1Пропиламина, но исходя из 12,7 г 2-(2-хлорэтил)-1- -метилпирролидина и 6,8 см тиоуксус- ной кислоты. Таким образом получают 15,7 продукта в виде красного масла.
50
55
211456019 - 22
П р и м е р 26. Реакцию проводят Продукт ААС по методике примера 18, но исходя 0,1 н. соляная кис- из 3,0 г 5 -диметиламинометиленпри- лота стинамицина 1д и 0,48 г 4-меркапто- -1-метилпиперидина, после очистки импульсной хроматографией (элюент: хлороформ - метанол 90:10 по объему) и концентрирования досуха фракций 15-19 при пониженном давлении Л... ( кПа) при получают 1,2 г (1-метил-4-пиперидил)-тиометилен- пристинамицина IA в -виде желтого порошка, плавящегося при 170 С.
Спектр ЯМР: 0,68. (дд, 1Н, ),
0,03 г 0,03 см
До 3 см
10
СНг-л ,
2,0г.2,2 (м, 4Н,.-СНС .N- li
СН22,30 (с, 3H,N-CHj), 2,46 (д, 1Н, 5Ibi), 2,85 (м, 4Н), 3,05 (мт, 1Н, -S-CH-), 3,40 (дд, 1Н, 51Ь), 5,15 , (д, 1Н, 5(bi), 7,67 (с, широкий, 1Н- CH-S-), 7,85 (дд, 1Н X 0,85 1 Н 1-й изомер), 8,0 (дд, 1Н х 0,15 ГН, 2-й изомер).
Готовят 1%-ньй водный раствор 5о- -(1-метил-4-пиперидил)-тиометилен- пристинамицина 1д (продукт AAF) в виде гидрохлорида
Продукт AAF . 0,05 г 0,1 н.соляная кислота0 5 см Дистиллированная вода До 5 см П р и-м е р 27. Реакцию проводят по методике цримера 18, но исходя из 4 г 5 -диметиламинометиленпристин- амицина If и 0,8 г 1-этил-З-меркап- топиперидина, после очистки импульсной хроматографией (элюент:хлороформ- метанол 92:8 ПО объему) и концентрирования досуха фракций 6-9 при пони- женном- давлении (2,7 кПа) при 30 С получают 1,1 г 5S -(1-этил-З-пипери- дш1)-тиометиленпристинамицина, плавящегося при .
Спектр ЯМР: 0,70 (с, широкий, 1Н, ), 1.20 (т, ЗН - CHjCHq), 2,45 (д, широкий, 1Н, 5р.-,), 2,90 (м, 6Н,
.аяг-
Дис т илл ИР ов ан н ЕЯ вода
П р и м е р 28. Реакцию проводят по методике примера 18, но исходя из 3,0 г 5сГ-диметиламинометиленпристин- амицина 1д и 0,55 г К-(2-меркапто- этил)-Ы,Ы,Н -триметилэтилендиамина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему) и концентрирования 5 досуха фракций 17-24 при пониженном давлении (2,7 кПа) при получают 1,0 г 5S-2 Г(2-Ы-диметиламиноэтш1)- -N-метиламино -этил -тиометиленпри- стинамицина 1д в виде желтого порош- 2Q ка, плавящегося при 160 С.
Спектр ЯМР: 0,68 (дд, 1Н, 5рв), 2,30 (с, ЗН -NOT), 2,40,(д, 1Н,5РО 2,4-3,1 (м, 8H-S(CHi)5, N-(CjJ5)eN)
,10 (под массивом, 1Н, ), 7,.58 25 (с, широкий, 1Н -ClbS-), 7,80 (дд, 1Н, 1 Нб), 3,40 (дд, 1Н, )Готовят 1%-ный водный раствор 5S- С2- (2-диметиламиноэтил)-метилами эт1ш -тиометш1енпристинамицина 1д(про 30 дукт ДАН):
Продукт ДАН0,03 г
Дистиллированная вода До 3 см Н-(2-Меркаптозтил)-Ы,к ,Н -триме- тилэтилендиамин может быть получен „ следующим образом: прибавляют 5,0 г этилкарбоната и 2-меркаптозтила к раствору 10,2 г N,N ,N -триметилэтилендиамина в 4-0 см толуола, нагретого до кипения. После 5 ч кипячения 40 с обратньм холодильником толуол отгоняют при пониженном давлении (2,7 кПа) при и перегоняют оста ток при этом давлении. Получают
Ы-(2-меркаптоэтил)-Ы,н ,N -триметил 45 этилендиамина в виде желтой жидкости, перегоняющейся при 105 С при 2,7 кПа.
П р и м е р-29. Реакцию проводят по методике примера 18, но исходя из 4 г 5 -диметиламинометиленпристи
50
амицина 1 и 2г бис-1,3-(димeтилaми
, )), 7,50 (с, широкий, но)-пропантиола-2, после очистки 1Н СН), 7,80 (дд, 1Н X 0,80 импульсной хроматографией (элюент: 1-й изомер), 7,95 (дд, 1Н х 0,20 Г Н хлороформ - метанол 92:8 по объему)
2-й изомер).
Готовят 1%-ный водный раствор 5о - -(1-этил-3-пиперидил)-тиометиленпри- стинамицина 1д (продукт ААС) в виде гидрохлорида:
gg и концентрирования досуха фракций 32-56 при пониженном давлении (2,7 кПа) при 30°С получают 1,6 г 1,3-(димeтилaминo)-2-пpoпи -тиoмeтшIeнпpиcтинaмицинa 1д в виде
0,03 см
Продукт ААС 0,1 н. соляная кис- лота
До 3 см
0
Дис т илл ИР ов ан н ЕЯ вода
П р и м е р 28. Реакцию проводят по методике примера 18, но исходя из 3,0 г 5сГ-диметиламинометиленпристин- амицина 1д и 0,55 г К-(2-меркапто- этил)-Ы,Ы,Н -триметилэтилендиамина, после очистки импульсной хроматографией (элюент:хлороформ - метанол 90:10 по объему) и концентрирования 5 досуха фракций 17-24 при пониженном давлении (2,7 кПа) при получают 1,0 г 5S-2 Г(2-Ы-диметиламиноэтш1)- -N-метиламино -этил -тиометиленпри- стинамицина 1д в виде желтого порош- 2Q ка, плавящегося при 160 С.
Спектр ЯМР: 0,68 (дд, 1Н, 5рв), 2,30 (с, ЗН -NOT), 2,40,(д, 1Н,5РО, 2,4-3,1 (м, 8H-S(CHi)5, N-(CjJ5)eN),
,10 (под массивом, 1Н, ), 7,.58 25 (с, широкий, 1Н -ClbS-), 7,80 (дд, 1Н, 1 Нб), 3,40 (дд, 1Н, )Готовят 1%-ный водный раствор 5S- С2- (2-диметиламиноэтил)-метиламино- эт1ш -тиометш1енпристинамицина 1д(про- 30 дукт ДАН):
Продукт ДАН0,03 г
Дистиллированная вода До 3 см Н-(2-Меркаптозтил)-Ы,к ,Н -триме- тилэтилендиамин может быть получен „ следующим образом: прибавляют 5,0 г этилкарбоната и 2-меркаптозтила к раствору 10,2 г N,N ,N -триметилэтилендиамина в 4-0 см толуола, нагретого до кипения. После 5 ч кипячения. 40 с обратньм холодильником толуол отгоняют при пониженном давлении (2,7 кПа) при и перегоняют оста- ток при этом давлении. Получают
Ы-(2-меркаптоэтил)-Ы,н ,N -триметил- 45 этилендиамина в виде желтой жидкости, перегоняющейся при 105 С при 2,7 кПа.
П р и м е р-29. Реакцию проводят по методике примера 18, но исходя из 4 г 5 -диметиламинометиленпристин50
амицина 1 и 2г бис-1,3-(димeтилaмино)-пропантиола-2, после очистки импульсной хроматографией (элюент: хлороформ - метанол 92:8 по объему)
но)-пропантиола-2, после очистки импульсной хроматографией (элюент: хлороформ - метанол 92:8 по объему)
gg и концентрирования досуха фракций 32-56 при пониженном давлении (2,7 кПа) при 30°С получают 1,6 г 1,3-(димeтилaминo)-2-пpoпиJI)- -тиoмeтшIeнпpиcтинaмицинa 1д в виде
бежевого порошка, плавящегося при 190°С.
Спектр ЯМР: 0,55 (дд, 1Н х 0,80, 5Ь52-й изомер), 0,67 (дд, 1Н х 0,20 5(521-й изомер), 2,30 (м, 6Н, -N(CH,), 2,8-3,2 (м, 4Н, tf CH( ),j ), 7,62 (м, 1Н, -CH-S-), 7,80 (дд, 1Н X 0,80 1-й изомер), 7,98 (дд, 1Н х 0,20 ГН 2-й изомер).
Готовят 1%-ный водный раствор 5 - бис-1,3-(диметиламино)-2-про- пил -тиометиленпристинамицина 1д (продукт AAI) в виде гидрохлорида:
0,03 г
3
0,3 см До 3 см
Продукт AAI
0,1 н. соляная
кислота
Дистиллированная
вода
П р и м е р 30. Реакцию проводят по методике примера 18, но исходя из 3,0 г 5 -диметиламинометиленпри- стинамицина 1д и 0,58 г 1-(2-меркап тоэтил)- 4-метш1пиперазина, пОсле очистки импульсной хроматографией (элюент:хлороформ - метанол 87,5: :12,5 по объему) и концентрирования досуха фракций 16-30 при пониженном давлении (2,7 кПа) при получают 1,6 г . (4-метил-1-пиперазииил) -этшЛ-тиометиленпристинамицина 1д в виде бежевого порошка, плавящегося при 170 С.
Спектр -ЯМР: 0,56 (дд, 1Н х 0,20 5jij 1-й изомер), 0,68 (дд, -IH х X 0,80 2-й изомер), 2,40 (с, ЗН, NCHj), 2,5-3 (м, 12Н, S (СН7)г + + все - CHj -пиперазина), 3,42 (дд, 1Н, 5, 5,12 (д, широкий, ), 7,60 (с, широкий 1Н, -CHS-), 7,80 (дд, 1Н, 1 Hg смесь двух изомеров).
Готовят 1 %-ный водный раствор - 1.2-(4-метил-1-пиперазинил)-этилЗ -тиометиленпристинамицина 1д (продукт AAJ) в виде гидрохлорида:
Продукт AAJ 0,05 г
0,1 н.соляная
кислота
Дистиллированная
вода
П р и м е р 31. Реакцию проводят по методике примера 18, но исходя из 4,0 г 5(У-диметиламинометилепристин- амицина 1 и 1,5 г 1-(3-меркаптопро- пил)-4-метилпиперазина, после очистки импульсной хроматографией (элюент: хлороформ - метанол 95:5 по Oj6be му) и концентрирования досуха фракцией 24-41 при пониженном давлении
0,5 см
До 5 см
, 2
10
- -
15
20
25
30
35
40
45
3,45 (м, 1Н,
(2,7 кПа) при получают 2,06 г 5 8 (4-метил-1-пиперазинил)-пропил -тиометиленпристинамицина 1д в виде бежевого порошка, плавящегося при .
Спектр ЯМР: 0,68 (дд, 1Н, ), 1,90 (мт, 2Н, -CHaCH,iCH,N), 2,40 (с, ЗН, ), 2,3-2,8 (M,8H-S-CH.,-+
СНе- . )
СН2
562) 7,64 (с, широкий, 1Н X 0,80 CH-S- 1-й изомер), 7,70 (с, широкий, 1Н X 0,20 CH-S 2-й изомер), 7,80 (дд, 1Н X 0,80 ГНв 1-й изомер), 7,98 (дд, 1Н X 0,20 1 Hg 2-й изомер).
Готовят 10%-ный водный раствор 5 (4-метил-1-пиперазинил)-пропил -тиометиленпристинамицина 1д (продукт ААК) в виде гидрохлорида:
Продукт ААК 0,05 г
0,1 и. соляная
кислотаДо 0,5 мл
1-(3-Меркаптопрошш)-4 метилпипе- разин может быть получен по методике аналогичной описанной в примере 32 для получения 3-диметш1амино-2-метил- пропантиола, но исходя из 109 г 1-(3-ацетилтиопропил)-4-метш1пипера- зина и 0,46 г натрия. Получают 64,8 г 1-(3-меркаптопропил)-4-метилпиперази- на в виде желтого .масла, перегоняющегося при при 0,13 кПа.
1-(3-Ацетилтиопропил) 4-метилпи- перазин может быть получек по методике примера 32 для получения Ы,К-ди- метил-З-ацетилтио-2-метилпропилами- на, но исходя из 138 г 1-(3-хлорпро пил)-4-метилпиперазина и 68,5 г тио- уксусной кислоты. Таким образом получают 109 г 1-(3-ацетилтропропил)- -4-метилпиперазина в масла, при О,13 кПа.
виде желтого перегоняющегося при 160 С
50
П р и м ер 32. Реакцию проводят по методике примера 18, но исходя из 4,0 г 5 -диметиламинометиленпри- стинамицина 1д и 1,3 г 3-меркапто- -2-метилпропиламмонийиодида, после очистки импульсной хроматографией (элюент:хлороформ - метанол 80:20 . по объему) и концентрирования досуха фракций 12-22 при пониженном давлении (2,7 кПа) при получают 1,052иодида 5 -(2-метил-З-триметил- аммонийпропил)- тиометиленпристинами25
цина 1д в виде порошка цвета охры, плавящегося при 150 С.
Спектр ЯМР: 1,05-1,35 (м, 8Н, 3. + Зри- -СН-СНа), 2,40 (м, 2Н, 5В,,+ -СН-СН%), 2,90 (мт, ЗН, -S-CH-g-), 3,20 (мт, 7Н. 4NCH3 + + 4р,+ 3(5,- (CH.j)3 ), 3,40 (мт, 9Н, -N®(CH)3 ).
Готовят 1%-ный водный раствор 5 -(2-метил-З-триметиламмонийпро- пил)-тиометиленпристинамицина 1. иодида (продукт AAL) в виде гидрохлорида ;
Продукт AAL О,и/ г 15 0,1 н, соляная кислота
Дистиллированная вода
З-Меркапто-2-метилпропиламмоний- 20 иодид может быть получен по следующей методике. Прибавляют 0,024 г ме- тштата натрия к раствору 3,6 г 3-аце- тш1Тио-2-метилпрош1паммонийиодида в 18 см метанола при температуре око- 25 ло . Полученную смесь кипятят с обратным холодильником в течение 1 ч, потом оставляют на 16 ч при комнатной температуре. Удаляют метанол при пониженном давлении (2,7 кПа) при зо
145601926
-3-ацетилтио-2-мвтилпропиламина в
0,02 г 0,2 см До .2 смпосле 18 ч пе около
35 см ацетонитрила, мешивания при температуре 20 С осадок отфильтровывают, потом сушат. Таким образом получают 3,8 З-ацетилтио-2-метилпропиламмонийио дида в виде белого порошка, плавящ гося при
181 C.
П р и м е р 33. Реакцию проводя по методике примера 18, но исходя из 1,84 г 5 -диметиламинометиленпр стинамицина 1д и 3,28 г 2-меркапто этансульфоната натрия, после очист ки импульсной хроматографией (элю- ент:метиленхлорид - метанол 90:10 по объему) и концентрирования досу ха фракций 6-14 при пониженном давлении (2,7 кПа) при 30°С получа (0,8 г) пристинамицин 1д-5 : 2-ме тилтиоэтансульфоновая кислота. Т. пл. .
ИК-спектр содержит характеристи ческие полосы пристинамицинов: 174 1680, 1650, 1525, 815, 740 и 705 с плюс характеристические полосы гру пы - 5 ОзН (1200 см (широкая) и 1050 см- ).
Готовят 5%-ный водный раствор 58-(-2-оксисульфонилэтил)-тиомети- ленпристинамицина 1д (продукт ААМ) Продукт ААМ 0,1 г Дистиллированная вода До 2 см П р и м е р 34. Реакцию проводя по методике, аналогичной описанной в примере 1, исходя из продукта о щей формулы IV получают производ синергистина общей формулы 1, праве денные в табл.2.
50 С. Остаток перемешивают 1 ч с 35 см изопропанола, белую суспензию фильтруют, потом сушат. Таким образом получают 3,1 г З-меркапто-2-ме- тилпропиламмонийиодида в виде бежевого порошка, плавящегося при 120 С.
3-Ацетилтио- 2-метилпропиламмоний- иодид.может быть получен по следующей методике. Прибавляют 1,4 см мети- лиодида к раствору 3,5 г N,N-димeтшI
CHjCOOH, CFjCOOH, , 20 ч
, , 20 ч
cHjCooH, CF,eooH,
20 C, 48 ч
после 18 ч пере около
35 см ацетонитрила, мешивания при температуре 20 С осадок отфильтровывают, потом сушат. Таким образом получают 3,8 г З-ацетилтио-2-метилпропиламмонийио- дида в виде белого порошка, плавящегося при
181 C.
5
П р и м е р 33. Реакцию проводят по методике примера 18, но исходя из 1,84 г 5 -диметиламинометиленпри- стинамицина 1д и 3,28 г 2-меркапто- этансульфоната натрия, после очистки импульсной хроматографией (элю- ент:метиленхлорид - метанол 90:10 по объему) и концентрирования досу ха фракций 6-14 при пониженном давлении (2,7 кПа) при 30°С получают (0,8 г) пристинамицин 1д-5 : 2-ме- тилтиоэтансульфоновая кислота. Т. пл. .
ИК-спектр содержит характеристические полосы пристинамицинов: 1745, 1680, 1650, 1525, 815, 740 и 705 см плюс характеристические полосы группы - 5 ОзН (1200 см (широкая) и 1050 см- ).
Готовят 5%-ный водный раствор 58-(-2-оксисульфонилэтил)-тиомети- ленпристинамицина 1д (продукт ААМ): Продукт ААМ 0,1 г Дистиллированная вода До 2 см П р и м е р 34. Реакцию проводят по методике, аналогичной описанной в примере 1, исходя из продукта общей формулы IV получают производные синергистина общей формулы 1, праве- - денные в табл.2.
Таблица 2
20 14 14
Ш.СООН, ,
20 С, 20 ч
CHgCOOH, ,
(СН5)гСн1 , 48 ч, .
NR,(CHQ)5SH (CH,i)2
NEiR 2 - iraCH
Использованные продукты формулы IV могут быть получены следующим образом или по аналогичной мето дике,
К раствору 1,84 г Зо-диметиламино- метиленпристинамицина 1д в 20 см уксусной кислоты медленно прибавляют 10 см этанольного раствора 4 н. газообразного ам гаака. Полученный раствор перемешивают 20 ч при температуре около 20°С, потом медленно выпивают в 200 см насыщенного водного раствора бикарбоната натрия. Полученную суспензию 3 раза экстрагируют 300 см всего метилеихлорида, объединяют органические фазы, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном дав36
-N(CH,),jШ.СООН, ,
20 С, 20 ч
20
20
CHgCOOH, 20 C, 20 ч
/ .
CH.COOH, , 10 дней
CHgCOOH, CFgCOOH, , 20 ч
20
14
20
30
лении (2,7 кПа) при 30 С. Полученный 25 остаток очищают флаш -хроматогра- фией(элюент:хлороформ - метанол 92:8 по объему). При концентрировании досуха фракций 11-13 при пониженном давлении (2,7 кПа) при 30 С. получают 1,3 г 5-аминометиленпристин- амицина 1д в виде бежевого порошка, плавящегося при 190 с,
Спектр ЯМР: 0,7-1,10 (мт, 4Н, 2 + 5р,), 7,15-7,53 (мт, 9Н (один из которых обменивающийся), 6 + + 6glHNH5+ СН-Не+ ГН;,+ ГН5), 9,12 (с, широкий, 1Н (обменивающийся),1Н из Ше).
35
40
Аналогичным образом получают соединения приведенные в табл.3.
Таблица 3
створ .в форме хлоргидрата
1) Желтый порошок, 172 С .
37
N-H(CH)Q
Известно, что синергистины, полученные ферментацией, представляют собой лечебные продукты, используемы для лечения многих заболеваний, вызываемых грамположительными бактериями (типа стафилококков, стрептококков, пневмококков, энтерококков) к грамртрицательными бактериями (типа Haemophilus, менингококков и гонококков). Однако эти продукты нераствориюа в водной среде и не могут быть введены оральным путем,а вводятся обычно в виде капсул;.драже или таблеток. Таким образом, невозможно использовать известные синергистины, когда больной не в состоянии глотать, в то время как спектр активности этих продуктов дает точное назначение в большинст2) 5%-ный водный ра- - створ в форме хлоргидрата
-S-CH-(CHj)3N(CtH5),j 1) Бежевый порошок,
2) 10%-ный водный раствор в форме хлоргидрата
ве случаев, например в случаях кома- тозного сепсиса.
0 Так, растворимость природного при- стинамицина 1д такова, что он образует только О,1%-ный водный раствор при рН нейтральном. Виргиниа и- цин (Тип В) в воде растворим до
6 0,01%.
Продукты согласн о изобретению обладают существенным преимуществом из-за их способности растворятьс я 0 в воде в виде солей в терапевтически используемых дозах, сохраняя полностью обгций спектр активности синер- гистинов. Они являются существенно активными In vitro против staphylococ- 35 cue aureus smeth концентрациях между 0,1 и 125 мкг/мп (см. табл. 4).
I/ Т а б л и ц а 4
Соединение для сравнения
Пристин- амицин 1д
Они обычно имеют низкую токсичность . Величина обычно превышает 300 мг/кг на мышах при подкожном введении (см. табл.5).
ТаблицаЗ
30
IПродолжение табл.5
28
220
35
31
500
32
160
Для терапевтического применения можно использовать новые продукты согласно изобретению как таковые, т.е. в виде основания, но для прйменения в виде водных растворов,что является основным- преимуществом продуктов согласно изобретению, особенно выгодно их использовать в виде их фармацевтически приемлемых солей, ,
т.е. нетоксичных при используемых дозах солей.
Биологическая активность in vitro. На серию пластин, каждая из которых содержит известное количество
(20 см) культуральной среды (Muller- Higtonagar), наносят (1/10 этого объема) серию геометрически прогрессирующих (степень 2) разбавлений исследуемого соединения. Пластины
33 145
инокулируют множественным инокуля- тором, который разделил пятно 10 колоний, формируя блоки микроорганизмов в tryptic soy broth, инкуби- рованной в течение 18 ч при 37 С и растворенной (1/100) в той же среде.
После инокуляции пластины были
инкубированы в течение 24 ч при 37 С.
Минимальная ингибирующая концент- рация является самой низкой кондент- рацией, при которой микроорганизмы ингибируются.
Действие в отношении противобрю- шинной инфекции у мьшей.
Мышам было введено внутрибрюшинно 0,5 см взболтанной культуры микроорганизмов 18-часовой вьщержки в сре934
де Brain Heart Jufusion (Defсо), размещенной с 5% hog musin. Это инокулирование вызывает смерть контролируемых жив отны.с в течение 24-48 ч. Испытуемая композиция была дважды введена подкожно с интервалом в 5 ч в день инокуляции, причем первая доза была введена по истечении 1 ч после инокуляции с микроорганизмом. Обычная доза содержала 50 см/кг
50%-ная лечебная доза CDjQ является дозой испытуемого соединения, которая при приеме способствует выживанию 1/2 животных в течение периода - испытаний (8 дней).
Данные по испытаниям представлены в табл 4-.
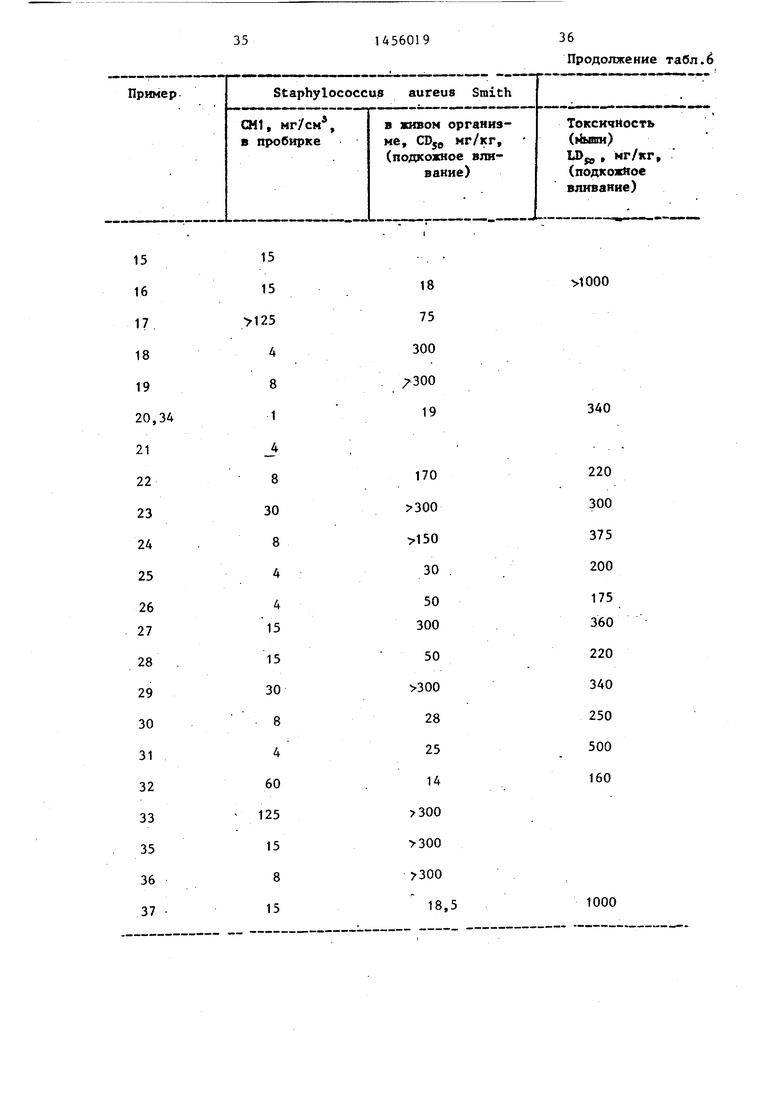
Таблица б
Продолжение табл.6
де у - водород иди дтгметнламияогруппа,
R 3-- ИЛИ 4 -пи11еридиламино-,; 3-- 1гШИ 4--пи11:еридклтио, незаме1 |;еннг,е илн замещен- ные у атома азота цикла ал- кильньш радикаломj алкил- или алкклтиогруппаjse.- мещенные одним гидросульфо-- НИЛОМ или одним или двумя алкиламинорадикалами, диал- киламинорадикалом в некотс- рых случаях замащеиным ди-- алкиламинорадикалом, триал-- килаг-монием или 4- или 5-имидазолилом илн одним из цик
лов 5 выбранных среди пине- разино „ незамещенного или замеИ енного алкилоМэ морфо- лине- J пипериднно- j 1 -пир р о - лидинилоМз , 3- или перидилом или 2- или з-пир-- роошдинилом, причем два пс-- следних цикла,, в некоторых случаях замещены у атома азота алкильным радикалом ри условии,, что алкилькые радикалы и алкильные фраг- t/seHTbS содержат 1-4 атома
где R имеет значения, указанные
для R,
подвергают взаимодействию с соединением общей формулы III
N
Шз
к
Y Hl icHaCHs . ; Сщ 14 }
0
где Y - водород или диметиламиногруппа;К
и Rfi- одинаковые или разные, водород, фенил, ,-алкил, с прямой или разветвленной цепью, в некоторых случаях замещенную гидроксильной, меркапто-, пиперидино-, анилино- или диалкиламино- группой, причем в последней зо крайней мере один из алкилов замещен гидрокси-, или R , и R2 образуют с атомом азота, к которому они присоединены, - пяти- членньй гетероцикл, с последующим вьщелением делевого продукта в свободном виде или в виде фармацевтически приемлемой соли.
| Вейганд-Хштьгетаг | |||
| Кетоды эксперимента в органической химии | |||
| М.: Химия, 1968, с | |||
| АППАРАТ ДЛЯ РАЗРЕЗАНИЯ ПЕРЕДВИГАЮЩЕЙСЯ НА ПОДВИЖНОМ СТОЛЕ ТОРФЯНОЙ ПОЛОСЫ ПРИ ПОМОЩИ НОЖЕЙ, УКРЕПЛЕННЫХ НА ПОВЕРХНОСТИ БАРАБАНА | 1922 |
|
SU602A1 |
Авторы
Даты
1989-01-30—Публикация
1985-12-06—Подача