Изобретение относится к новой конденсированной гетероциклической системе общей формулы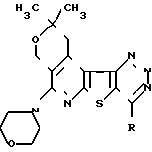 где R Cl (Ia);
где R Cl (Ia);
R NHNHC6H5, (Iб), обладающий противоопухолевой активностью.
Предлагается новая конденсированная гетероциклическая система, содержащая неизвестное ранее сочетание пиранового, пиридинового, тиофенового и триазинового циклов, обладающая противоопухолевым действием.
П р и м е р 1. 3-Амино-2-циан-5,5-диметил-4,5-дигидро-8-(N-морфолино)-7Н-пира- но [4',3':4,5]пиридо[2,3-b]тиофен (II).
К смеси 15 мл 2 н. водного раствора гидроокиси натрия и 40 мл этанола прибавляют 3,44 г (0,01 моль) 5,5-диметил-8-(N-морфолино)-2-меркапто-3-циан-4,5-дигидро- 7Н-пирано [3,4-c]пиридина. Смесь перемешивают до образования гомогенного раствора и по каплям прибавляют 0,75 г (0,01 моль) хлорацетонитрила. Перемешивание продолжают еще 2 ч, поддерживая температуру реакционной смеси при 60оС. После охлаждения реакционную смесь вливают в 100 мл воды, образовавшиеся кристаллы отфильтровывают, промывают водой и сушат. Выход 3,0 г (89,8%), т.пл. 301-302оС (этанол), Rf 0,51 (ацетон-гексан, 1:1).
Найдено, C 59,41; H 5,89; N 16,47; S 9,18.
C17H20N4O2S
Вычислено, C 59,28; H 5,85; N 16,26; S 9,30.
ИК-спектр, ν, см-1: 3250, 3340, 3480 (NH2), 2210 (CN), 1650 (NH2 деф.), 1580 (С=С аром.).
ПМР-спектр (пиридин-Д5), δ, м.д. 7,1 (2Н, с, NH2), 4,9 (2Н, с, 7-СН2), 3,75-3,95 (4Н, т, СН2-О-СН2), 3,5 (2Н, т, 4-СН2), 3,2-3,4 (4Н, т, CH2-N-CH2), 1,3 [6H, c, 5-(CH3)2]
П р и м е р 2. 2,2-Диметил-1,2-дигидро-5-(N-морфолино)-8-хлор-4Н-пирано[4',3':4,5] пиридо[2,3-b]тиено[3,2-d]-9,10,11-триазин (Ia).
К охлажденному раствору 3,44 г (0,01 моль) 3-амино-2-циан-5,5-диметил-4,5-дигидро-8-(N-морфолино)-7Н-пирано [4',3':4,5]пиридо[2,3-b]тиофена (II) в смеси 13 мл соляной и 13 мл ледяной уксусной кислот при перемешивании прибавляют раствор 1,0 г (0,016 моль) азотистокислого натрия в 15 мл воды. Перемешивание продолжают еще 2 ч при комнатной температуре, затем смесь прибавляют к 100 мл ледяной воды, полученные кристаллы отфильтровывают, промывают водой, сушат. Выход 3,2 г (81,8%), т.е. 236-237оС (метанол), Rf 0,64 (ацетон гексан пиридин, 1:4:1).
Найдено, C 52,27; H 4,48; N 17,99; S 8,25; Cl 8,80.
C17H18N5O2SCl
Вычислено, C 52,10; H 4,63; N 17,87; S 8,18; Cl 9,04.
ИК-спектр, ν, см-1: 1580 (С-Саром), 1120 (С-О-С).
ПМР-спектр (ТФУК), δ, м.д. 4,6 (2Н, с, 4-СН2), 3,7-3,9 (4Н, м, СН2-О-СН2), 3,3-3,65 (6Н, м, СН2-N-СН2, 1-СН2), 1,2 [6H, c, 2-(CH3)2]
П р и м е р 3. 2,2-Диметил-1,2-дигидро-5-(N-морфолино)-8-фенилгидразино-4Н- пирано[4',3':4,5]пиридо[2,3-b]тиено[3,2-d] 9,10,11-триазин (Iб).
К суспензии 3,91 г (0,01 моль) 2,2-диметил-1,2-дигидро-5-(N-морфолино)-8-хлор- 4Н-пирано[4',3':4,5]пиридо[2,3-b]тиено- [3,2-d]-9,10,11-триазина в 30 мл абсолютного этанола прибавляют 2,16 г (0,02 моль) фенилгидразина и кипятят 9 ч. Охлаждают, осадок отфильтровывают, промывают водой и сушат. Выход 3,86 г (83,3%), т.пл. 207-208оС (ДМСО), Rf 0,61 (пиридин-этанол-эфир, 1:3:1).
Найдено, C 59,87; H 5,59; N 20,91; S 7,02.
C23H25N7O2S
Вычислено, C 59,59; H 5,44; N 21,14; S 6,91.
ИК-спектр, ν, см-1: 3330, 3200 (NH), 1600, 1570 (С6Р5, С=Саром).
ПМР-спектр, (ДМСО-Д6), δ, м.д. 8,8 (1Н, с, NH), 6,8-7,4 (5Н, м, С6Н5), 4,8 (2Н, с, 4-СН2), 3,4-4,0 (8Н, м, СН2-О-СН2, СН2-N-СН2), 2,6 (2Н, м, 1-СН2), 1,4 [6H, c, 2-(СН3)2]
Биологические исследования проводили на белых беспородных мышах и крысах обоего пола массой 18-20 и 90-110 г соответственно, а также на мышах линии С57BI/6 известными методами.
Соединения Iа и Iб вводили животным внутрибрюшинно в виде суспензии, приготовленной в 0,5%-ном растворе карбоксиметилцеллюлозы, соединение сравнения 5-фторурацил применяли в эквитоксических дозах в 0,9%-ном растворе хлорида натрия.
Острую токсичность изучали на мышах. При этом установлена абсолютно смертельная доза: ЛД100 соединения Ia > 2500 мг/кг, ЛД100 соединения Iб 2500 мг/кг.
Противоопухолевую активность определяли на мышах и крысах с перевиваемыми опухолями: карциносаркомой Уокера, аденокарциномой молочной железы (СА 755), карциномой легкого Льюис (11 С), саркомой 45 и 180. Лечение животных с СА 755 и 11 С начинали через 72 ч после перевивки, а с остальными опухолями на 4-5-е сутки их роста. Соединения вводили мышам ежедневно в течение 5-6 дней, крысам 8 дней. Контрольные и подопытные группы состояли из 6-10 животных. Терапевтический эффект оценивали по проценту торможения роста опухоли (Т,) по сравнению с контролем. Полученный цифровой материал подвергали статистической обработке методом Стъюдента-Фишера.
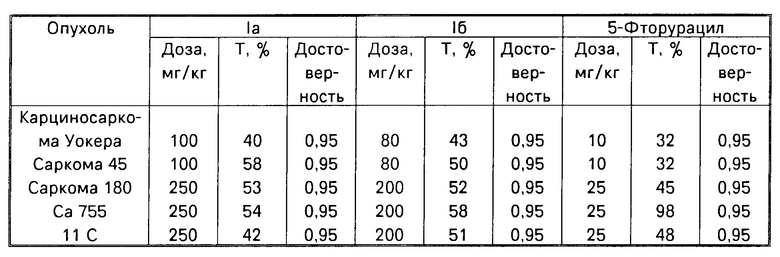
В химиотерапевтических экспериментах установлено, что соединения Iа и Iб проявляют слабую противоопухолевую активность в отношении карциносаркомы Уокера, угнетая ее рост на 40-43% При этом терапевтический эффект 5-фторурацила составляет 32% В опытах с 11 С соединения Iа и Iб оказывают одинаковое с 5-фторурацилом действие, ингибируя рост опухоли на 43,51 и 48% соответственно. В таблице приведены полученные результаты.
В дозах 180-250 мг/кг соединения Ia и Iб вызывают умеренное торможение роста (50-58% ) аденокарциномы 755, сарком 45 и 180. При этом лечебное действие 5-фторурацила на саркомах 45 и 180 менее выражено (32 и 45%) и лишь на Са 755 превышает 90%
Таким образом, соединения Ia и Iб обладают умеренной противоопухолевой активностью наряду с низкой острой токсичностью, что позволяет использовать описываемый класс соединений для поиска новых лекарственных средств для онкологической практики.
Изобретение касается гетероциклических веществ, в частности 2,2 -диметил-1,2-дигидро -5-(N-морфолино) -8-хлор- или фенилгидразино -4Н-пирано [4′,3′:4,5] пиридо[2,3 -b]тиено[3,2-d] -9,10,11-триазинов, обладающих противоопухолевым действием, что может быть использовано в медицине. Цель создание активной новой гетероциклической системы. Ее синтез ведут реакцией 5,5-диметил- 8-(N-морфолино) -2-меркапто-3- циан-4,5- дигидро-7Н- пирано[3,4-с] пиридина с хлорацетонитрилом с последующей циклизацией полученного продукта с помощью NaNO2 в присутствии HCl и выделением целевого продукта, который затем может быть обработан фенилгидразином. Выход, т.пл.°С, брутто-ф-ла: 81,8, 236-237, C17H18N5O2SCl 83, 3, 207-208, C25H25N7O2S. Новые соединения малотоксичны и тормозят рост опухолей: карциономы Уокера, саркомы 45, саркомы 180. 1 табл.
2,2-Диметил-1,2-дигидро-5-(N-морфолино)-8-хлор-или фенилгидразино-4Н-пирано [4′,3′:4,5] пиридо (2,3-b) тиено (3,3-d) 9,10,11-триазины общей формулы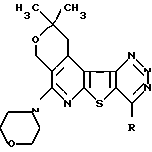
где R Cl или NHNHC6H5,
обладающие противоопухолевым свойством.
| ЭЛЕКТРОЛИТ ДЛЯ ЭЛЕКТРОХИМИЧЕСКОГО ОСАЖДЕНИЯ ПЛАТИНЫ | 1971 |
|
SU423887A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-08-20—Публикация
1988-10-17—Подача