Изобретение относится к новой конденсированной гетероциклической системе, представленной производными 1-амино-8,9-дигидро-8,8-диметил-3,6Н-пиразоло[3,4-b] пирано[4',3'-d] пиридина или их гидрохлоридами, обладающими противосудорожной активностью.
Целью изобретения является новая конденсированная гетероциклическая система, содержащая сочетание пиранового, пиридинового и пиразолового циклов, обладающая ценным фармакологическим действием.
П р и м е р 1. 2,2-Диметил-5-пропионилтетрагидропиран-4-он (IV).
К раствору 19,7 г (0,1 моль) 2,2-диметил-4-(N-морфолино)-2,3-дигидро-6Н-пирана, 11,9 г (0,12 моль) триэтиламина в 140 мл сухого бензола при перемешивании по каплям прибавляют 11,1 г (0,12 моль) хлорангидрида пропионовой кислоты, поддерживая температуру смеси при 35оС. Смесь оставляют еще на 1 ч при той же температуре и на 12 ч при 20-22оС. Затем к смеси прибавляют 50 мл 20%-ного раствора соляной кислоты и кипятят 30 мин с обратным холодильником. После охлаждения водный слой отделяют, бензольный промывают водой до нейтральной реакции. К водному слою прибавляют 10%-ный раствор гидроокиси натрия до рН 5-6 и экстрагируют дважды бензолом. Соединенные бензольные слои сушат над сернокислым магнием, отгоняют бензол, остаток перегоняют, выход 10,5 г (57,3%); т.кип. 120-123оС (15 мм рт.ст.).
Найдено, C 64,81; H 8,34.
C10H16O3
Вычислено, C 65,12; H 8,75.
ИК-спектр, ν см-1: 1750, 1720 (CO); 1620 (С=C).
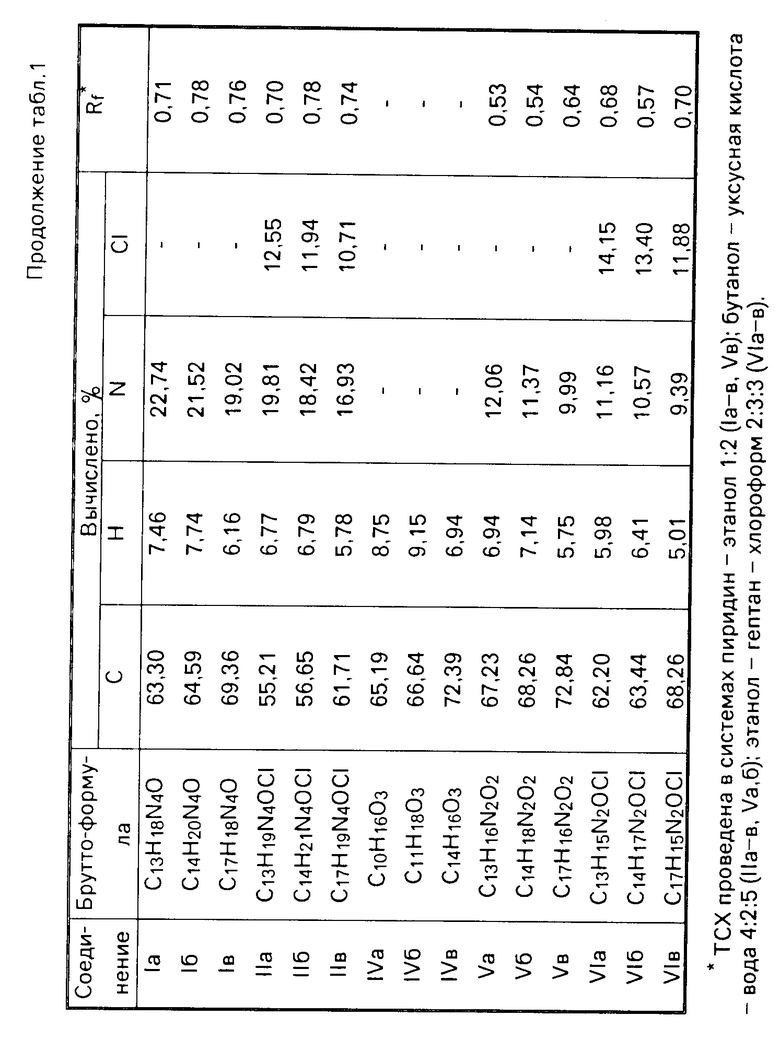
Соединения IV б и IVв получают аналогично примеру 1 из 19,7 г (0,1 моль) 2,2-диметил-4(N-морфолино)-2,3-дигидро-6Н-пирана и 0,12 моль хлорангидрида изомасляной и бензойной кислот. Данные о выходах, элементном анализе и физико-химических свойствах приведены в табл.1 и 2.
П р и м е р 2. 5,6-Дигидро-5,6-диметил-3-оксо-4-циан-1-этил-8Н-пирано[3,4-c] пиридин (Vа).
К раствору 18,4 г (0,1 моль) 2,2-диметил-5-пропионилтетрагидропиран-4-она (IVа), 13,6 г (0,16 моль) цианацетамида в 70 мл этанола прибавляют 4,2 мл диэтиламина. Смесь оставляют на 48 ч при 20-22оС, затем отгоняют этанол, к остатку прибавляют 50 мл воды. Образовавшиеся кристаллы отфильтровывают, промывают водой и сушат. Перекристаллизовывают из этанола, выход 12,8 г (55,2%); т.пл. 300-301оС; Rf 0,53 (бутанол уксусная кислота вода, 4:2:5).
Найдено, C 67,07; H 6,76; N 11,94.
C13H16N2O2
Вычислено, C 67,23; H 6,94; N 12,06.
ИК-спектр, ν см-1: 3240 (NH); 2240 (CN); 1650 (CO); 1600 (C C aр).
ПМР-спектр (ДМСО-D6), δ м.д. 4,6 (2Н, т, CH2O); 2,8 (2H, т, CH2); 2,4 (2Н, кв. J 7 Гц, CH2CH3); 1,2 (6H, c, 2CH3), 1,1 (3H, т. J 7 Гц, CH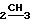 ).
).
Соединения Vб и Vв получают аналогично примеру 2 из 0,1 моль соответствующего 5-замещенного 2,2-диметилтетрагидропиран-4-она (IVб и Vв). Данные о выходах, элементном анализе и физико-химических свойствах представлены в табл.1 и 2.
П р и м е р 3. 5,6-Дигидро-6,6-диметил-3-хлор-4-циан-1-этил-8Н-пирано[3,4-c] пиридин (VIa).
Смесь 23,2 г (0,1 моль) 5,6-дигидро-6,6-диметил-3-оксо-4-циан-1-этил-8Н-пирано[3,4-c] пиридина (Va) и 150 мл хлорокиси фосфора кипятят с обратным холодильником на водяной бане в течение 3 ч. Затем излишек хлорокиси фосфора отгоняют досуха, к остатку при охлаждении ледяной водой и перемешивании прибавляют небольшими порциями 200 мл 10%-ного водного раствора гидроокиси калия. Образовавшиеся кристаллы отфильтровывают, промывают водой и сушат, выход 22,9 г (91,2% ); т.пл. 147-148оС из метанола, Rf0,68 (этанол гептан хлороформ, 2:3:3).
Найдено, C 62,12; H 5,87; N 11,21; Cl 14,11.
C13H15N2OCl
Вычислено, C 62,20; H 5,98; N 11,16; Cl 14,15.
ИК-спектр, ν см-1: 2240 (CN); 1580 (C C ар.).
ПМР-спектр (CDCl3, δ м.д. 4,7 (2Н, т. CH2O); 2,8 (2Н, т. CH2); 2,6 (2Н, кв. J 7 Гц,  CH3); 1,2 (2H, c, 2CH3); 1,1 (3H, т. J 7 Гц, CH
CH3); 1,2 (2H, c, 2CH3); 1,1 (3H, т. J 7 Гц, CH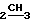 ).
).
Соединения VIб и в получают аналогично примеру 3 из 0,1 моль соответствующего 1-замещенного 5,6-дигидро-6,6-диметил-3-оксо-4-циан-8Н-пирано[3,4-c] пиридина (Vб и Vв). Данные о выходе, элементном анализе и физико-химических свойствах представлены в табл.1 и 2.
П р и м е р 4. 1-Амино-8,9-дигидро-8,8-диметил-5-этил-3Н,6Н-пиразоло[3,4-b] пирано[4',3'-d]пиридин (Ia).
Смесь 2,5 г (0,01 моль) 5,6-дигидро-6,6-диметил-3-хлор-4-циан-1-этил-8Н-пирано[3,4-c] пиридина (VIa), 10 мл гидразингидрата, 50 мл этанола кипятят с обратным холодильником, в течение 5 ч. Отгоняют этанол и избыток гидразингидрата, к остатку прибавляют 50 мл воды, образовавшиеся кристаллы отфильтровывают, промывают водой и сушат, выход 2,3 г (99,1%); т.пл. 268-269оС из этанола: Rf 0,71 (пиридин этанол, 1:2).
Найдено, C 63,21; H 7,63; N 22,70.
C13H18N4O
Вычислено, C 63,30; H 7,40; N 22,74.
ИК-спектр, ν см-1: 3390, 3280, 3200 (NH NH2); 1640 (NH деф.), 1600 (С=С ар.).
ПМР-спектр (ДМСО-D6), δ м. д. 5,2-5,4 (3Н, м. NH, NH2); 4,8 (2H, c. CH2O); 3,2 (2H, c. CH2); 2,7 (2H, кв. J 6 Гц, 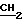 CH3); 1,3 (6H, c. 2CH3); 1,2 (3H, т. J 6 Гц, CH
CH3); 1,3 (6H, c. 2CH3); 1,2 (3H, т. J 6 Гц, CH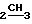 ).
).
Соединения Iб и Iв получают аналогично примеру 4 из 0,01 моль соответствующего 1-замещенного 5,6-дигидро-6,6-диметил-3-хлор-4-циан-8Н-пирано[3,4-c] пиридина (VIб и VIв). Данные о выходе, элементном анализе и физико-химических свойствах представлены в табл.1 и 2.
П р и м е р 5. Гидрохлорид 1-амино-8,9-дигидро-8,8-диметил-5-этил-3Н, 6Н-пиразоло[3,4-b] пирано[4',3'-d]пиридина (IIа).
Смешивают 2,5 г (0,01 моль) соединения Iа, полученного в примере 4, с 5 мл 20%-ного водного раствора хлористоводородной кислоты и нагревают при 70оС в течение 5-10 мин до образования прозрачного раствора. После охлаждения к реакционной смеси прибавляют 30 мл этанола, отфильтровывают выпавшие кристаллы, промывают этанолом и сушат, выход 2,4 г (87,7%); т.пл. 261-262оС из этанола; Rf 0,70 (бутанол уксусная кислота вода, 4:2:5).
Найдено, C 55,32; H 6,56; N 19,89; Cl 12,66.
C13H19N4OCl
Вычислено, C 55,21; H 6,77; N 19,81; Cl 12,55.
ИК-спектр, ν см-1: 3140, 3320, 3360 (NH, NH2); 1630 (NHдеф.); 1620 (С=С ар.).
Соединения IIб и IIв получают аналогично примеру 5 из 0,01 моль соответствующего соединения Iб и Iв. Данные о выходе, элементном анализе и физико-химических свойствах приведены в табл.1 и 2.
Судорожными моделями для исследования фармакологических свойств соединений Iа-в, IIа-в служат максимальный электрошок, коразоловые, стрихниновые судороги и ареколиновый тремор. Соединения Iа-в и пуфемид вводят во взвеси с карбоксиметилцеллюлозой внутрибрюшинно за 45 мин, а растворимые в воде соединения IIа и в за 30 мин до инъекции судорожных агентов и нанесения электрического раздражения. Определяют острую суточную токсичность веществ при внутрибрюшинном введении у мышей. 50% эффективные (ЭД50) и 50% летальные (ЛД50) дозы вычисляют по методу Литчфильда и Уилкоксона.
Соединения изучают в дозе 200 мг/кг, кроме соединения IIб (доза 200 мг/кг токсична), которое вводят в дозе 100 мг/кг. В табл.3 приведены данные антикоразоловой активности и токсичности исследованных соединений. Как видно из табл. 2, по антагонизму в отношении коразола среди изученных пиразолов наиболее активно соединение IIб, которое в дозе 100 мг/кг проявляет 60%-ный эффект. Соединение Iв проявляет слабую антикоразоловую активность, однако его гидрохлорид (соединение IIв) оказался активным по всем изученным тестам. Соединение IIв в дозе 200 мг/кг в 2/3 раза увеличивает латентный период появления стрихниновых судорог. У контрольных животных латентный период составляет в среднем 5 (4,03-5,97) мин, на фоне соединения IIв 14 (9,96-18,04) мин, тогда как пуфемид в дозе 200 мг/кг полностью предупреждает судорожный припадок, вызываемый стрихнином.
Если критерием антагонизма к ареколиновому тремору взять ослабление сильного трехбалльного тремора до одного балла, то соединение IIа в дозе 125 (58-250) мг/кг проявляет 50%-ную эффективность. Пуфемид развитию ареколинового тремора не препятствует. Соединение IIв в дозах 200-250 мг/кг полностью предупреждает тонический компонент максимального электрошока. Параметры противосудорожной активности и токсичности соединений IIв и пуфемида представлены в табл.4.
Таким образом, представители нового класса химических соединений 8-замещенные пиразоло[3,4-b] 3-амино-5,5-диметил-4,5-дигидро-1Н,7Н-пирано [4',3': 4,5] пиридина и их гидрохлориды обладают антикоразоловым действием, а гидрохлорид пиразоло[3,4-b]3-амино-4,5-дигидро-5,5-диметил-8-фенил-1Н,7Н- пирано[4', 3': 4,5] пиридина проявляет также антагонизм к электрошоку, стрихнину и обладает слабым центральным М-холинолитическим действием.



Изобретение относится к гетароциклическим соединениям, в частности к 5-замещенным 1-амино- 8,9-дигидро- 8,8-диметил-3,6Н- пиразоло[3,4-b] пирано [4′,3′-d] пиридинам ф-лы  , где а) R- C2H5; б) R - изо - C3H7; в) R-C6H5 или их гидрохлоридам, которые обладают противосудорожной активностью. Цель выявление новых соединений этого класса, обладающих указанных действием. Получение ведут реакцией 2,2-диметил -4-(N-морфолино) -2,3-дигидро-6Н-пирана с хлорангидридами карбоновых кислот, циклизацией полученных 5-ацил-2,2- диметилтетрагидропиран-4-онов с цианацетамидом в 1-алкил(арил)- 6,6-диметил-5,6- дигидро-3-оксо -4-циан-8Н -пирано[3,4 c]пиридины, превращением последних в соответствующие хлорпроизводные и циклизацией их гидразингидратом с последующим переводом в гидрохлориды. 4 табл.
, где а) R- C2H5; б) R - изо - C3H7; в) R-C6H5 или их гидрохлоридам, которые обладают противосудорожной активностью. Цель выявление новых соединений этого класса, обладающих указанных действием. Получение ведут реакцией 2,2-диметил -4-(N-морфолино) -2,3-дигидро-6Н-пирана с хлорангидридами карбоновых кислот, циклизацией полученных 5-ацил-2,2- диметилтетрагидропиран-4-онов с цианацетамидом в 1-алкил(арил)- 6,6-диметил-5,6- дигидро-3-оксо -4-циан-8Н -пирано[3,4 c]пиридины, превращением последних в соответствующие хлорпроизводные и циклизацией их гидразингидратом с последующим переводом в гидрохлориды. 4 табл.
5-Замещенные 1-амино-8,9-дигидро-8,8-диметил-3,6Н-пиразоло [3,4-b] пирано [4′, 3′-α] пиридина общей формулы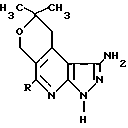
где а) R C2H5,
б) R изо-C3H7,
в)R C6H5
или их гидрохлориды, обладающие противосудорожной активностью.
| Замконарезной станок | 1951 |
|
SU94175A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-09-10—Публикация
1988-05-16—Подача