Изобретение относится к органической химии, а именно к новой конденсированной гетероциклической системе, представленной производными 2,2-диметил-1,2-дигидро-4Н-пирано [4,3-d]фуро[2,3-b]пиридина общей формулы 1 где R CH3, R1 R2 H (I);
где R CH3, R1 R2 H (I);
R CH3, R1 п-Br и R2 H (II);
R C6H5, R1 R2 H (III);
R C6H5, R1 п-Br и R2 H (IV);
R CH3, R1 H
и
и R2 CO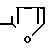 (V)
(V)
R C6H5, R1 H и R2
CO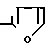 (VI)
(VI)
R C6H5, R1 п-Br и R2 COОH3 (VII);
R C6H5, R1 п-Br и R2 COCCl3 (VIII), обладающими противоопухолевой активностью, которые могут быть использованы в медицине.
Наиболее близкими по структуре к соединениям формулы 1 являются 4-замещенные 3-амино-6-фенил-2-этоксикарбонилфуро[2,3-b] пиридины, о биологических свойствах которых нет сведений.
Аналогом по биологической активности выбран противоопухолевый препарат 5-фторурацил.
Предлагается новая конденсировання гетероциклическая система, содержащая неизвестное ранее сочетание пиранового, пиридинового и фуранового циклов, обладающая потивоопухолевым действием.
Предлагаемые производные 2,2-диметил-1,2-дигидро-4Н-пирано[4,3-d]-фуро[2,3-b] пи-ридинов получают взаимодействием 5,6-дигидро-6,6-диметил-3-оксо-1-фенил- (метил)-4-циан-8Н-пирано[3,4-c] пиридинов с замещенными фенацилбромидами, циклизацией полученных 3-фенацилокси-5,6-дигидро-6,6-диметил-1-фенил(метил)-4-циан-8Н- пирано[3,4-c] пиридинов этилатом натрия в 5,8-дизамещенные 3-амино-1,2-дигидро-2,2-диметил-4Н-пирано[4,3-d]фуро[2,3-b] пиридины с последующим переводом последних в соответствующие амиды под действием хлорангидридов кислот.
Строение синтезированных соединений доказано элементным анализом, ИК-, ПМР-спектроскопией и масс-спектрометрически. Чистота проверена тонкослойной хроматографией на пластинках Silufol UV-245, проявитель пары йода.
9-Амино-8-бензоил(п-бромбензоил)-2,2-диметил-1,2-дигидро-5-метил (фенил)-4Н-пирано[4,3-d] фуро[2,3-b] пиридины (соединения I-IV) представляют собой желтые кристаллические вещества, без запаха, растворимые в диметилсульфоксиде, плохо растворимые в воде, этиловом спирте.
9-Ациламино-8-бензоил(п-бромбензо-ил)-2,2-диметил-1,2-дигидро- 5-фенил(метил)-4Н-пирано[4,3-d] фуро[2,3-b]пиридины (соединения V-VIII) представляют собой белые кристаллические вещества, без запаха, растворимые в диметилсульфоксиде, хлороформе, нерастворимые в воде, этиловом спирте.
П р и м е р 1. 5,6-Дигидро-1,6,6-триметил-3-фенацилокси-4-циан- 8Н-пирано[3,4-c]пиридин (IX).
К раствору 1,7 г (0,03 моль) гидроокиси калия в 30 мл этилового спирта прибавляют 6,4 г (0,03 моль) 5,6-дигидро-3-оксо-1,6,6- триметил-4-циан-8Н-пирано[3,4-c] пириди-на (XIII). Смесь кипятят с обратным холодильником 30 мин, затем отгоняют этиловый спирт досуха, к остатку прибавляют 6,4 г (0,032 моль) фенацилбромида и 40 мл ацетонитрила. Смесь кипятят при перемешивании в течение 2 ч, охлаждают, прибавляют 100 мл воды, выпавшие кристаллы отфильтровывают, промывают водой и сушат. Выход 6,4 г (66,3%), т.пл. 195-196оС (этанол), Rf 0,62 (пиридин-этанол, 1:3).
Найдено, С 71,37; Н 5,68; N 8,17.
C20H20N2O3.
Вычислено, С 71,40; Н 5,94; N 8,32.
ИК-спектр, ν см-1: 2220 (CN), 1700 (CO), 1590 (С Сар).
ПМР-спектр (CDCl3), δ м.д. 7,2-8,1 (5Н, м, С6H5); 5,65 (2Н, с, СН2СO); 4,6 (2Н, т, СН2O); 2,85 (2Н, т, СН2); 2,1 (3Н, с, СН3); 1,35 (6Н, с, 2СН3).
Соединения X-XII получают по примеру 1 из 0,03 моль соответствующего 1-замещенного-5,6-дигидро-6,6-диметил-3-оксо-4- циан-8Н-пирано[3,4-c]пиридина (XIII-XIV) и 00,032 моль фенацил- (п-бромфенацил)бромида. Данные о выходах, элементном анализе и физико-химических свойствах представлены в табл. 1 и 2.
П р и м е р 2. 9-Амино-8-бензоил-1,2-дигидро-2,2,5-триметил -4Н-пирано[4,3-d]фуро[2,3-b]пиридин (I).
К раствору этилата натрия, полученного из 0,23 г (0,01 моль) металлического натрия и 20 мл этанола, прибавляют 3,4 г (0,1 моль) 5,6-дигидро-1,6,6-триметил-3-фенацилок- си-4-циан-8Н-пирано [3,4-c]пиридина (IX). Смесь кипятят с обратным холодильником в течение 1 ч. После охлаждения выпавшие кристаллы отфильтровывают, промывают водой и сушат. Выход 2,7 г (80,5%), т. пл. 262-263оС (диоксан). Rf 0,58 (пиридин-этанол, 1:2).
Найдено, С 71,26; Н 5,84; N 8,80.
С20H20N2O3.
Вычислено, С 71,40; Н 5,94; N 8,32.
ИК-спектр, ν см-1: 3320, 3450 (NH2); 1620 (CO), 1600 (С Сар).
ПМР-спектр (пиридин), δ м.д. 7,2-8,4 (7Н, м, С6Н5, NH2); 4,55 (2Н, т, СН2); 3,05 (2Н, т, СН2); 2,23 (3Н, с, СН3); 1,05 (6Н, с, 2СН3).
М+ 336 (масс-спектрометрически).
Соединения II-IV получают по примеру 2 из 0,01 моль 1-замещенного-5,6-дигидро-6,6-диметил-3-фенацил-(п-бромфенацил) -окси-4-циан-8Н-пирано[3,4-c] пиридина (X-XII). Данные о выходах, элементном анализе и физико-химических свойствах приведены в табл. 1 и 2.
П р и м е р 3. 8-Бензоил-1,2-дигидро-2,2,5-триметил-9 -фуроиламино-4Н-пирано[4,3-d]фуро[2,3-b]пиридин (V).
Смесь 1,7 г (0,005 моль) 9-амино-8-бензоил-1,2-дигидро-2,2,5 -триметил-4Н-пирано[4,3-d] фуро[2,3-b] пиридина (I), 0,8 г (0,006 моль) хлорангидрида фуран-2-карбоновой кислоты и 20 мл диоксана кипятят с обратным холодильником в течение 25-30 ч. Отгоняют растворитель, к остатку прибавляют этиловый спирт, образовавшиеся кристаллы отфильтровывают, промывают этиловым спиртом и сушат. Выход 1,8 г (86,3%), т.пл. 231-233оС (этанол), Rf 0,49 (гексан-ацетон-хлороформ, 5:2:1).
Найдено, C 69,71; Н 4,99; N 6,68.
C25H23N2O3.
Вычислено, С 69,95; Н 4,92; N 6,52.
ИК-спектр, ν, см-1: 3200 (NH), 1660, 1630 (С=0), 1590 (С Сар).
ПМР-спектр (CDCl3), δ м.д. 8,2-8,4 (2Н, м, 2СН); 7,3-7,8 (5Н, м, С6Н5); 6,5-6,7 (1Н, м, СН); 4,8 (2Н, т, СН2O); 3,1 (2Н, т, СН2); 2,5 (3Н, с, СН3); 1,4 (6Н, с, 2СН3).
Соединения VI-VIII получают по примеру 3 из 0,005 моль 5-замещенного 9-амино-8-бензоил-(п-бромбензоил)-1,2-дигидро- 2,2-диметил-4Н-пирано[4,3-d] фуро[2,3-b] пиридина (II-IV) и 0,006 моль хлорангидрида соответствующей кислоты. Данные о выходах, элементном анализе и физико-химических свойствах приведены в табл. 1 и 2.
Биологические исследования проводили на белых беспородных мышах и крысах обоего пола массой 18-20 и 90-110 г соответственно, а также на мышах линии С57Вl/6 известными методами. Всего в опытах использовано 180 крыс и 120 мышей.
Ввиду плохой растворимости соединения I-VIII вводили животным внутрибрюшинно в виде суспензии, приготовленной в 0,5%-ном растворе карбоксиметилцеллюлозы, 5-фторурацил использовали в эквитоксических дозах в 0,9%-ном растворе хлорида натрия.
Максимально переносимые дозы (МПД) соединений определяли на мышах при однократном внутрибрюшинном введении веществ.
Противоопухолевую активность изучали на крысах с перевиваемыми опухолями саркомой 45 и карциносаркомой Уокера. Терапевтическую эффективность относительно активного соединения (II) определяли также на мышах с саркомой 37 и раком легкого Льюис.
Лечение животных начинали на 3-5-е сутки после перевивки опухолей. Соединения вводили крысам ежедневно в течение 8 дней в дозе 100 мг/кг, мышам в течение 5-6 дней в дозе 200-250 мг/кг.
Опытные и контрольные группы состояли из 6-8 и 8-10 животных соответственно. Терапевтический эффект оценивали по проценту торможения роста опухолей (Т,).
Полученный цифровой материал подвергали статистической обработке по методу Стъюдента-Фишера.
Изучение острой токсичности показало, что МПД соединений превышает 2500 мг/кг, для 5-фторурацила это значение соответствует 102 мг/кг.
В химиотерапевтических опытах установлено, что все соединения за исключением соединения II проявляют слабую (I, III и IV) или умеренную (V-VIII) противоопухолевую активность в отношении саркомы 45, ингибируя ее рост на 41-45 и 50-55% соответственно (см. табл. 3).
В опытах с карциносаркомой Уокера большинство соединений (I, IV, VII и VIII) вызывало слабое торможение роста опухоли (30-43%), а соединения V и VI оказались практически неэффективными.
Среди соединений формулы I относительно эффективным оказалось соединение II, которое в дозе 100 мг/кг проявило высокую противоопухолевую активность в отношении саркомы 45, ингибируя ее рост на 76% В аналогичных условиях эксперимента терапевтический эффект 5-фторурацила составляет 32%
Дальнейшее изучение противоопухолевой активности соединения II показало, что в дозе 200-250 мг/кг оно оказывает выраженное терапевтическое действие в отношении рака легкого Льюис (61%) и достоверно ингибирует рост саркомы 37 (48% ). Лечебный эффект 5-фторурацила на указанных моделях составляет соответственно 60 и 71%
Таким образом, представители нового класса химических соединений производные 2,2-диметил-1,2-дигидро-4Н-пирано[4,3-d]фуро[2,3-b]пиридина наряду со слабой токсичностью обладают противоопухолевыми свойствами.



Использование: в качестве противоопухолевых веществ в медицине. Сущность изобретения: продукт - производные 2,2-диметил-1,2-дигидро-4Н-пирано [4,3 d] фуро [2,3 b] пиридина общей формулы 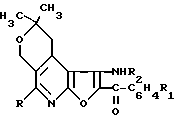 где при R CH3, R1=R2-H; R1 N-Br и R2 H, R1 H и R2 C(O) CH- CH CH O; при R C6H5, R1=R2-H; R1 n Br и R2 H; R1 H и R2 C(O) C CH CH CH O; R1 n Br и R2-C(O)CH3; R1 n Br и R2-C(O)CCl3. Максимальная переносимая доза > 2500 мг/кг, степень ингибирования саркомы 45 на 41 45% карциносаркомы Уокера на 30 43% Реагент 1 3 фенацилокси-5,6-дигидро-6,6-диметил-1-фенил(метил)-4-циан-8Н-пирано [3,4 c] пиридин; реагент 2: КОН, реагент 3: фенацилбромид. Условия: кипячение (30 мин) в этаноле, отгонка досуха этанола, добавление реагента 3 и кипячение в ацетонитриле (2 ч). Реагент 4: C2H5ONa, реагент 5: 3-фенацилокси-5,6-дигидро-6,6-диметил-1-фенил(метил)-4-циан-8Н-пирано[3,4 c пиридин. Условия: циклизация при кипячении (1 ч). Получают соединения I IV. Соединения I VII получают переводом соединений I IV в соответствующие амиды действием хлорангидридов соответствующих карбоновых кислот при кипячении в диоксане (25 30 ч). 3 табл.
где при R CH3, R1=R2-H; R1 N-Br и R2 H, R1 H и R2 C(O) CH- CH CH O; при R C6H5, R1=R2-H; R1 n Br и R2 H; R1 H и R2 C(O) C CH CH CH O; R1 n Br и R2-C(O)CH3; R1 n Br и R2-C(O)CCl3. Максимальная переносимая доза > 2500 мг/кг, степень ингибирования саркомы 45 на 41 45% карциносаркомы Уокера на 30 43% Реагент 1 3 фенацилокси-5,6-дигидро-6,6-диметил-1-фенил(метил)-4-циан-8Н-пирано [3,4 c] пиридин; реагент 2: КОН, реагент 3: фенацилбромид. Условия: кипячение (30 мин) в этаноле, отгонка досуха этанола, добавление реагента 3 и кипячение в ацетонитриле (2 ч). Реагент 4: C2H5ONa, реагент 5: 3-фенацилокси-5,6-дигидро-6,6-диметил-1-фенил(метил)-4-циан-8Н-пирано[3,4 c пиридин. Условия: циклизация при кипячении (1 ч). Получают соединения I IV. Соединения I VII получают переводом соединений I IV в соответствующие амиды действием хлорангидридов соответствующих карбоновых кислот при кипячении в диоксане (25 30 ч). 3 табл.
Производные 2,2-диметил-1,2-дигидро-4Н-пирано[4,3-d]фуро[2,3-b]пиридина общей формулы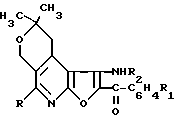
где R CH3, R1 H и R2 H;
R CH3, R1 п-Br и R2 H;
R C6H5, R1 H и R2 H;
R C6H5, R1 п-Br и R1 H;
R CH3, R1 H и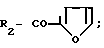
R C6H5; R1 H и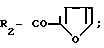
R C6H5, R1 п-Br и R2 COCH3 или R C6H5, R1 п-Br и R2 COCCl3,
обладающие противоопухолевой активностью.
| Переводчикова Н.И | |||
| Клиническая химиотерапия опухолевых заболеваний | |||
| М.: Медицина, 1976, с.60. |
Авторы
Даты
1995-09-20—Публикация
1990-08-20—Подача