Изобретение относится к неорганической химии, в частности к способам стабилизации перекиси водорода, которая находит применение в качестве отбеливающего материала при производстве тканей.
Цель изобретения - повышение эффективности стабилизации перекиси водорода и обеспечение возможности проведения процесса в присутствии катионов металлов переменной валентности.
П р и м е р 1 (прототип). В реактор с мешалкой, термостатированный при 60оС, загружают водный раствор перекиси водорода с начальной концентрацией 0,36 моль/л и ацетат кобальта с концентрацией 2˙10-3моль/л. Остаточную концентрацию перекиси водорода определяют иодометрически. Через 40 мин с момента начала процесса остаточная концентрация перекиси водорода составляет 0,124 моль/л. Степень распада перекиси водорода
CP = 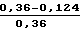 · 100% = 65,6%.
· 100% = 65,6%.
П р и м е р 2. Процесс проводят, как в примере 1, при 62оС. Начальная концентрация перекиси водорода 0,38 моль/л. В начальный момент реакции вводят полиэтиленгликоль (ПЭГ) (мол.м 2000) в количестве 1,0˙10-3 моль/л (молярное соотношение кобальт : ПЭГ =0,2:1), через 25 мин концентрация перекиси водорода составляет 0,34 моль/л. Степень распада перекиси водорода
CP = 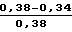 · 100% = 10,5%.
· 100% = 10,5%.
Степень стабилизации (СС) перекиси водорода по сравнению с распадом перекиси водорода в отсутствие ПЭГ составляет
CC = 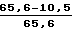 · 100% = 84,0%.
· 100% = 84,0%.
По сравнению со способом-прототипом механизм действия стабилизатора полиэтиленгликоля принципиально другой. Если известный способ предполагает ингибирование радикально-цепного распада Н2О2 путем введения ингибиторов хиноидной структуры, то в предлагаемом способе введение ПЭГ приводит к стабилизации Н2О2 в основном за счет комплексообразования ПЭГ с катионами металлов переменной валентности с образованием неактивного в процессе распада Н2О2 комплекса.
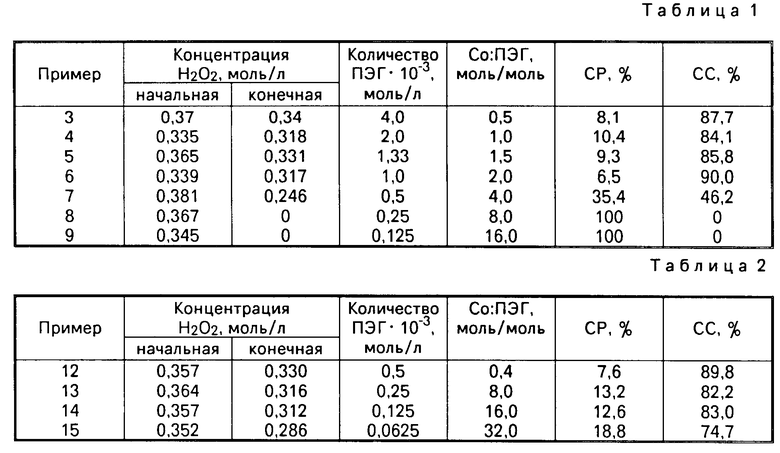
П р и м е р 3-9. Процесс проводят, как в примере 2. Используют ПЭГ с мол.м. 2000 при различной его концентрации и при различном содержании катионов кобальта в системе. Результаты приведены в табл.1.
П р и м е р 10. Проводят процесс, как в примере 2. Используют ПЭГ с мол.м. 6000. Начальная концентрация катионов марганца составляет 2˙103моль/л. Начальная концентрация пероксида водорода равна 0,357 моль/л. При 60оС через 40 мин СР 8,6%; СС 8,3%.
П р и м е р 11. Процесс проводят, как в примере 2, используют ПЭГ с мол. м 6000 в количестве 1,0˙10-3 моль/л (молярное соотношение железо : ПЭГ = 2,0). Через 25 мин концентрация перекиси водорода составляет 0,317 моль/л (начальная концентрация перекиси водорода 0,359 моль.л). СР 11,7%; СС 84,2% .
П р и м е ры 12-15. Процесс проводят, как в примере 1, используют ПЭГ с мол. м. 15000 при различной концентрации ПЭГ и при различном содержании катионов кобальта в системе. Результаты приведены в табл.2.
Оптимальные результаты получают при использовании ПЭГ с мол.м. 2000-15000, что подтверждается примерами 2-7 (мол.м. 2000), примерами 10 и 11 (мол. м. 6000) и примерами 12-15 (мол.м. 15000). Увеличение молекулярной массы выше 15000 приводит к образованию менее стабильного комплекса ПЭГ и Ме, это, в свою очередь, приводит к снижению степени стабильности, что иллюстрируется следующим примером.
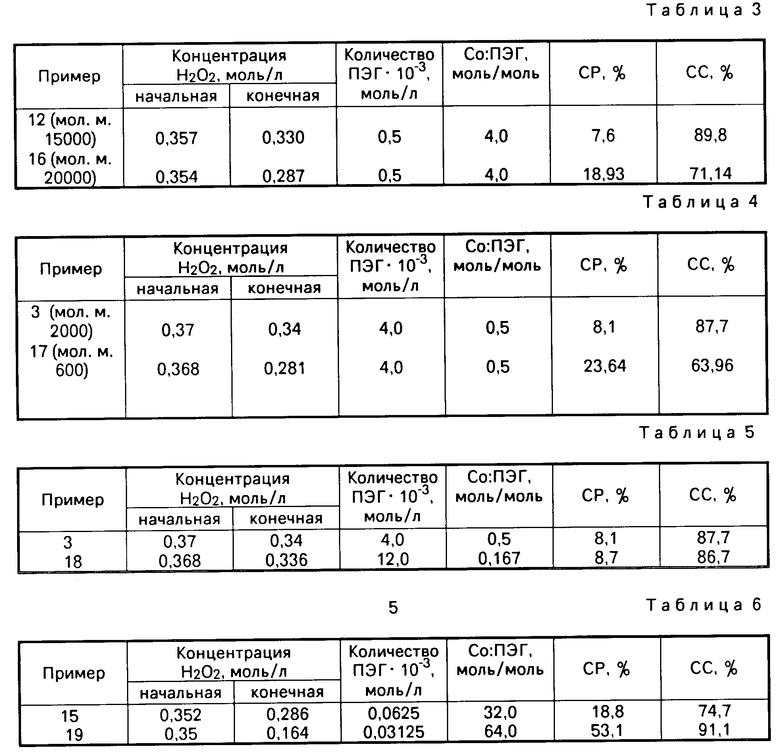
П р и м е р 16 (сравнительный). Процесс проводят, как в примере 12. Используют ПЭГ с мол.м. 20000. Результаты представлены в табл.3.
Таким образом, увеличение молекулярной массы выше 15000 нецелесообразно. Применение ПЭГ с мол.м. менее 2000 не приводит к достижению поставленной цели. Это иллюстрируется примером 17, который сравнивают с примером 3.
П р и м е р 17. Процесс проводят, как в примере 3, с использованием ПЭГ с мол.м. 600. Результаты представлены в табл.4.
Таким образом, уменьшение молекулярной массы приводит к резкому снижению степени стабилизации.
Количество вводимого ПЭГ является существенным признаком предлагаемого способа. В случае применения ПЭГ с мол.м. 2000 (см. примеры 3-9) положительный эффект может быть достигнут при использовании ПЭГ в количестве (0,5-4,0)˙10-3 моль/л (см. примеры 3-7). При меньшем количестве ПЭГ с этой молекулярной массой (2000) положительный эффект не достигается (примеры 8 и 9). Однако при увеличении мол.м. до 15000 (см. табл.2) положительный эффект может быть достигнут и при меньшем количестве ПЭГ, вплоть до 0,0625˙10-3 моль/л (пример 15). Возможность снижения количества ПЭГ при одновременном увеличении молекулярной массы может быть объяснена образованием полиметаллических комплексов в случае применения ПЭГ с большой молекулярной массой, т. е. в этом случае с одной молекулой ПЭГ комплексуется несколько катионов металлов. Использование ПЭГ с достаточно низкой молекулярной массой (2000), т. е. с невысокой подвижностью цепи, не приводит к получению таких полиметаллических комплексов, поэтому для достижения поставленной цели необходимо использовать большие количества ПЭГ.
Увеличение количества ПЭГ выше 4,0˙103 не увеличивает степени стабилизации, а приводит лишь к неоправданным затратам ПЭГ, что иллюстрируется дополнительным примером 18.
П р и м е р 18. Процесс проводят, как в примере 3. Результаты приведены в табл.5.
Снижение количества ПЭГ менее 0,0625˙10-3 моль/л даже в случае применения ПЭГ с высокой молекулярной массой (15000) не приводит к достижению поставленной цели, что иллюстрируется примером 19.
П р и м е р 19. Процесс проводят, как в примере 15. Результаты приведены в табл.6.
Как следует из табл.6, при больших молярных соотношениях металла и ПЭГ не достигается поставленная цель (см. пример 19). Уменьшение этого соотношения до менее чем 0,2:1 не повышает степени стабилизации, а приводит лишь к неоправданным затратам ПЭГ (см.пример 18).
Таким образом, предлагаемый способ позволяет повысить степень стабилизации с 59,4% (по прототипу) до 90% и проводить процесс в присутствии катионов металлов переменной валентности, которые катализируют распад перекиси водорода. Предлагаемый способ стабилизации перекиси водорода особенно эффективно применять там, где перекись водорода используют как сильную окислительную систему и перед непосредственным началом процесса хранят в металлических контейнерах из нержавеющей стали.
| название | год | авторы | номер документа |
|---|---|---|---|
| Буровой раствор | 1986 |
|
SU1530098A3 |
| Способ подготовки хлопчатобумажных тканей | 1988 |
|
SU1721147A1 |
| Способ получения водорастворимого катионоактивного полимера | 1987 |
|
SU1564156A1 |
| ТОПЛИВНАЯ КОМПОЗИЦИЯ | 1982 |
|
RU2014347C1 |
| Способ получения покрытого с поверхности изделия и композиция для покрытия изделия | 1987 |
|
SU1729284A3 |
| Сополимеры,содержащие звенья @ -оксида диалкиламиноэтилметакрилата в качестве стабилизаторов жидких дисперсий и способ их получения | 1983 |
|
SU1122672A1 |
| Раствор для стабилизации глинистых пластов | 1988 |
|
SU1755709A3 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ СЛИПАНИЯ ПОРОШКА ТРИЭТИЛЕНДИАМИНА, СУЛЬФАТА АММОНИЯ ИЛИ ХЛОРИДА АММОНИЯ | 1991 |
|
RU2041217C1 |
| СПОСОБ БЕЗВОДНОГО ПОЛУЧЕНИЯ АЛЬДЕГИДОВ C-C | 1989 |
|
RU2024481C1 |
| КАТАЛИЗАТОР (СО)ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ И СПОСОБ (СО)ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ | 1989 |
|
RU2054435C1 |
Изобретение относится к неорганической химии, в частности к способам стабилизации перекиси водорода. Цель изобретения - повышение эффективности стабилизации перекиси водорода и обеспечение возможности проведения процесса в присутствии катионов металлов переменной валентности. Способ включает введение в раствор стабилизатора, в качестве которого используют полиэтиленгликоль с мол.м. 2000 - 1500 в количестве (0,0625-4)×10-3моль/л при молярном соотношении катиона металла переменной валентности и полиэтиленгликоля 0,2 - 32 : 1. 6 табл.
СПОСОБ СТАБИЛИЗАЦИИ ПЕРЕКИСИ ВОДОРОДА в водных растворах, включающий введение в раствор стабилизатора - кислородсодержащего соединения, отличающийся тем, что, с целью повышения эффективности стабилизации перекиси водорода и возможности проведения процесса в присутствии катионов металлов переменной валентности, в качестве кислородсодержащего соединения используют полиэтиленгликоль с мол.м. 2000 - 15000 в количестве 0,0625 - 4 · 10-3 моль/л при молярном соотношении полиэтиленгликоля и катиона металла переменной валентности 1 : 0,2 - 32.
| Стабилизаторы перекисных соединений | 1978 |
|
SU727562A1 |
Авторы
Даты
1994-07-30—Публикация
1986-12-25—Подача