Изобретение относится к химии фосфоpоpганических соединений с С-Р-связью, конкретно к производным гуанидино-(1-гидрокси)алкилиден-1,1-бис-фосфоновых кислот формулы I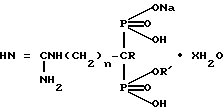
где 1) R H, R' H, n 0, x 1;
2) R H, R' Na, n 0, x 2;
3) R OH, R' H, n 2, x 1;
4) R OH, R' Na, n 2, x 2,5;
5) R OH, R' H, n 3, x 1,5;
6) R OH, R' Na, n 3, x 2,
обладающим ингибирующим действием на 5'-нуклеотидазу, что предполагает их использование в медицине.
Целью изобретения является повышение ингибирующего действия на 5'-нуклеотидазу гуанидиновых производных бис-фосфоновых кислот.
Поставленная цель достигается новыми соединениями формулы 1, которые по ингибирующему действию на 5'-нуклеотидазу превосходят все известные аналоги.
Cоединения 1 получают путем взаимодействия аминоалкилиден-(1-гидрокси)-1,1-бис-фосфоновых кислот с избытком S-этилизотиуронийбpомида в водно-щелочной среде при 50-55oС в течение 10 15 ч, обработкой фильтрата реакционной смеси уксусной кислотой с целью выделения и очистки мононатриевых солей гуанидиноалкилиден-1,1-бис-фосфоновых кислот (Ia), которые действием едкого натра переводят затем в динатриевые соли (Iб):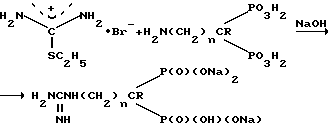
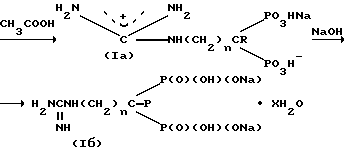
где R, n и х имеют указанные значения.
Новые соединения Ia, Iб представляют собой бесцветные кристаллические вещества, растворимые в водных растворах щелочей. В воде при обычной температуре соединения Iб лучше растворимы, чем соединения Iа. Водные растворы соединений Ia, Iб устойчивы при нагревании до 100oС.
П р и м е р 1. Моногидрат мононатриевой соли гуанидинометилен-1,1-бис-фосфоновой кислоты (ГМБФК-Na).
К раствору 25,9 г (0,135 моль) аминометилен-бис-фосфоновой кислоты в 172 мл 4 н.раствора едкого натра при 55oС и энергичном перемешивании 3 ч прикапывают раствор 56 г (0,27 моль) S-этилизотиуронийбромида в 60 мл воды. Затем нагревание и перемешивание продолжают еще 12 ч. Остывший раствор фильтруют, осадок на фильтре промывают ацетоном и отжимают. Полученный продукт растворяют в 480 мл воды (рН раствора 9 9,5), прибавляют уксусную кислоту до рН 3 по рН-метру, а затем приливают 450 мл этанола и выдерживают смесь 12 ч при 5 7oС. Выпавший осадок отфильтровывают, приливают 100 мл этанола, 50 мл ацетона, сушат на воздухе. Выход 20 г. Выделенный продукт с целью очистки растворяют при нагревании (70 80oС) и перемешивании в 300 мл воды, прибавляют небольшое количество активированного угля, перемешивают, фильтруют. К фильтрату приливают 150 мл этанола, перемешивают, выдерживают при 5 7oС 5 ч, отфильтровывают осадок, промывают на фильтре 20 мл этанола и 20 мл ацетона. Сушат в вакууме при 80oС/0,08 мм рт.ст. 3 ч. Выход ГМБФК-Na 15,9 г (43%).
Найдено, C 8,85; 8,80; H 3,35; 3,75; N 15,20; 15,39; P 22,64; 22,81; Na 8,6; H2O 6,1.
C2H10NaN3O7P2.
Вычислено, C 8,79; H 3,66; N 15,39; P 22,68; Na 8,4; H2O 6,59.
В ИК-спектре ГМБФК-Na характерно наличие полос поглощения ν-NH- 3200 см-1, νP = 0 1215, 1180 см-1, в отличие от исходных имеется полоса поглощения иминогруппы при 1705 см-1.
По данным ЯМР спектров на ядрах 31P сигнал фосфоновых групп в водном растворе ГМБФК-Na лежит при 11,66 м.д. (дублет с I 6,6 Гц).
П р и м е р 2. Дигидрат динатриевой соли гуанидинометилен-1,1-бис-фосфоновой кислоты (ГМБФК-Na2).
Суспендируют 6 г ГМБФК-Na в 40 мл воды (начальный рН раствора 5,3) и при перемешивании на магнитной мешалке прибавляют 22,2 мл 1 н.раствора едкого натра, рН раствора 8,04. К мутному раствору прибавляют небольшое количество активированного угля, перемешивают, фильтруют. К фильтрату прибавляют четырехкратный объем этанола, выдерживают помутневший раствор при 5 - 7oС 12 ч, отфильтровывают осадок, промывают его 50 мл этанола и 20 мл ацетона. Сушат 2 ч при 80oС/ 0,08 мм рт.ст. Выход 4,8 г (66%) моногидрата динатриевой соли гуанидинометилен-бис-фосфоновой кислоты, до 360oС не плавится.
Найдено, C 7,68; 7,51; H 3,40; 3,53; N 13,56; 13,46; P 19,74; Na 13,87; H2O 11,1.
C2H17Na2N7O8P2.
Вычислено, C 7,67; H 3,54; N 13,42; P 19,78; Na 14,69; H2O 11,52.
В ЯМР 31Р-спектре водного раствора ГМБФК-Na2 химсдвиг фосфоновых групп лежит при 12,29 м.д. (дублет с I 18,4 Гц).
П р и м е р 3. Моногидрат мононатриевой соли 3-гуанидино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты (ГГПБФК-Na).
К раствору 9,4 г (0,04 моль) 3-амино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты в 51 мл 4 н.раствора едкого натра при перемешивании и температуре 45 55oС прикапывают в течение часа раствор 14,8 г (0,08 моль) S-этилизотиуронийбромида в 30 мл воды. Затем перемешивание и нагревание продолжают еще 6 ч. К реакционной массе прибавляют небольшое количество активированного угля, фильтруют. К остывшему фильтрату прибавляют уксусную кислоту до рН 3 до рН-метру, прибавляют 40 мл метанола и выдерживают 12 ч при 5 7oС. Выпавший осадок отфильтровывают, промывают на фильтре 80 мл метанола и кристаллизуют из 500 мл воды, т.пл. 258 260oС после двухчасовой сушки при 80oС и остаточном давлении 0,06 мм рт.ст. Выход моногидрата ГГПБФК-Na 7,3 г (57%).
Найдено, C 14,73; 14,78; H 4,65; 4,80; N 12,84; 13,00; P 19,27; 19,44; Na 7,06; H2O 5,37.
C4N14NaN3O8P2.
Вычислено, C 15,15; H 4,44; N 13,25; P 19,53; Na 7,25; H2O 5,68.
В спектрах ЯМР 31Р сигнал фосфоновых групп ГГПБФК-Na 18,09 м.д. (триплет с I 13,0 Гц) в водном растворе сдвинут на 0,7 м.д. в слабое поле по сравнению с соответствующим сигналом исходного соединения.
В ИК-спектре характерно появление полосы иминогруппы в области 1720 - 1705 см-1. Частоты 1180, 1100 см-1 соответствуют νP = 0 и νP-0.
П р и м е р 4. Динатриевая соль 3-гуанидино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты гидрат (1/2,5) (ГГПБФК-Na2).
К раствору 3 г (0,008 моль) моногидрата мононатриевой соли 3-гуанидино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты в 30 мл воды (начальный рН 4,14) при охлаждении и перемешивании прибавляют 9,51 мл 1 н.раствора едкого натра (рН 8,03). Взбалтывают полученный раствор с небольшим количеством активированного угля, фильтруют. К фильтрату прибавляют пятикратный избыток этанола, выдерживают помутневший раствор 12 ч при 5 - 7oС. Декантируют водно-спиртовой раствор, остаток растирают с 25 мл этанола, выдерживают 12 ч при 5 7oС и фильтруют. Осадок на фильтре отмывают 25 мл этанола, сушат в вакууме при 0,08 мм рт.ст. в течение 2 ч. Выход 2,8 г (77%) динатриевой соли ГГПБФК-Na2.
Найдено, C 12,45; 12,51; H 4,43; 4,34; N 11,27; 11,42; P 17,12; Na 11,80; H2O 11,5.
C4H16Na2N3O9,5P2.
Вычислено,)% C 12,72, H 4,57; N 11,20; P 16,51; Na 12,53; H2O 12,29.
В ЯМР-спектре 31P сигнал фосфоновых групп динатриевой соли лежит при 17,777 м.д. (триплет с I 14,7 Гц), т.е. сдвинут на 0,7 м.д. в слабое поле по сравнению с исходным веществом.
П р и м е р 5. Мононатриевая соль 4-гуанидино-1-гидроксибутилиден-1,1-бис-фосфоновой кислоты гидрат (1/1,5) (ГГБФК-Na).
Соединение получают, как в примере 3, до стадии добавления метанола. Вместо метанола прибавляют к подкисленной смеси 50 мл этанола, выдерживают 12 ч при 5 7oС, сливают водно-спиртовой раствор. Остаток растирают с эталоном до кристаллизации продукта. Выход 9,39 г (73%). Растворяют полученный продукт при нагревании в 250 мл воды, фильтруют, приливают 22 мл этанола (до помутнения), выдерживают 12 ч при 5 7oС и фильтруют. Остаток на фильтре отмывают 70 мл этанола, сушат в вакууме при 80oС и остаточном давлении 0,1 мм рт.ст. 2 ч. Выход аналитически чистого ГГБФК-Na 6 г (49%), т.пл. 206oС.
Найдено, C 18,02; 18,00; H 5,50; 5,47; N 11,80; 11,96; P 18,00; 17,97; Na 6,59; H2O 7,82.
C5H17NaN3O8,5F2.
Вычислено, C 17,65; H 5,04; N 12,35; P 18,21; Na 6,76; H2 7,94.
В спектре ЯМР 31P сигнал фосфоновых групп ГГБФК-Na лежит при 18,03 м.д. (триплет с I 11,77 Гц).
В ИК-спектре ГГБФК-Na в отличие от исходного соединения имеется полоса поглощения иминогруппы при 1710 см-1, P 0 соответствуют частоты 1180, 1090 см-1.
П р и м е р 6. Дигидрат динатриевой соли 4-гуанидино-1-гидроксибутилиден-1,1-бис-фосфоновой кислоты (ГГБФК-Na2).
К раствору 1,6 г ГГБФК-Na в 10 мл воды (начальный рН 3,6) при перемешивании на магнитной мешалке прибавляют 4,5 мл 1 н.раствора едкого натра (рН раствора 7,99), прибавляют небольшое количество активированного угля, взмучивают, фильтруют. К фильтру приливают четырехкратный избыток этанола, выдерживают 12 ч при 5 7oС, отфильтровывают осадок, промывают на фильтре 3 мм этанола, сушат при 80oС и остаточном давлении 0,05 мм рт.ст. 2 ч. Выход 1,3 г (94%) дигидрата динатриевой соли ГГБФК-Na2.
Найдено, C 16,03; 15,91; H 4,90; 5,07; N 11,06; 11,25; P 16,87; 17,07; Na 13,09; H2O 9,50.
C5H15Na2N3O8P2.
Вычислено, C 16,18; H 4,61; N 11,37; P 16,69; Na 12,38.
В ЯМР спектре 31P водного раствора динатриевой соли химический сдвиг фосфоновых групп находится при 18,38 м.д. т.е. сдвинут на 29 м.д. в слабое поле по сравнению с аналогичным сдвигом исходного соединения.
П р и м е р 7. Оценка влияния гидратов натриевых солей гуанидино-(1-гидрокси)алкилиден-1,1-бис-фосфоновых кислот на активность 5'-нуклеотидазы, связанной с сарколеммальной фракцией сердца, в сравнении с фосфокреатином.
Испытания ингибирующего действия указанных замещенных алкилиден-1,1-бис-фосфоновых кислот проводили на выделенной и высокоочищенной фракции сарколеммальной мембраны клеток миокарда крысы. Для испытаний было использовано 5 крыс линии "Вистар" массой 200 300 г. После декапитации животных сердца извлекали из грудной клетки и помещали в холодный (4oС) буфер 1, содержащий 20 мМ имидазол-HCl, рН 7,4, 0,3 М сахарозу и 0,3 мМ имидазол-HCl, рН 7,4, 0,3 М сахарозу и 0,3 мМ дитиотрейтол. В дальнейшем все этапы выделения проводили при 4oС. Ткань желудочков сердец 5 крыс (одно выделение) измельчали ножницами и гомогенизировали в 50 мл буфера 1 с помощью гомогенизатора "Virtis-45" при 20000 оборотов в минуту дважды в течение 30 с с интервалами в 30 с между гомогенизациями. Полученный гомогенат цетрифугировали 60 мин при 40000 об/мин в роторе Ti-45 (Beckman). Супернатант отбрасывали, а осадок ресуспендировали в 50 мл буфера 1 с помощью гомогенизатора Поттера-Элвехейма (тефлон-стекло) и центрифугировали при тех же условиях. После этого супернатант отбрасывали, а полученный осадок ресуспендировали в 15 мл буфера 1 и наслаивали по 5 мл в пробирку на линейный градиент сахарозы на 20 мМ имидазол-HCl, рН 7,4, 0,3 мМ дитиотрейтола (0,25 М 2,00 М), полученный с помощью Density gradient former, Beckman. Градиенты центрифугировали в течение 15 ч при 24000 об/мин в роторе SW 27 (Beckman).
Верхний слой градиентов после центрифугирования отбирали, доводили объем 20 мМ имидазол- HCl:0,3 мМ дитиотрейтол до 30 мл и центрифугировали в течение 90 мин при 40000 об/мин в роторе "Ti-50" (Beckman). Супернатант отбрасывали, а осадок ресуспендировали в 0,5 мл буфера 1 и использовали в экспериментах в качестве фракции сарколеммальной мембраны.
Активность 5'-нуклеотидазы определяли с помощью измерения скорости образования [3H] -аденозина из [3H]-АМФ по методу Авруха и Валлаха. Измерение активности 5'-нуклеотидазы, связанной с сарколеммой, проводили при 37oС в течение 10 мин в присутствии n-нитрофенилфосфата, что позволило избежать влияния неспецифических фосфатаз на измеряемую активность. Среда измерения содержала 50 мМ имидазол-HCl, 15 мМ Mg(CH3COO)2, 5 мМ п-нитрофенилфосфат, 0,4 мМ [3H] -АМФ. Измерение проводили при различных значениях рН среды (от 8,0 до 6,0). Фосфокреатин и соединения I добавляли в среду измерения в концентрации 10 мМ. Объем инкубационной среды составлял 0,2 мл. Реакцию начинают добавлением 8 10 мкг фракции сарколеммальной мембраны и останавливают через 10 мин добавлением 50 мкл 0,25 М раствора ZnSO4 и 50 мкл 0,25 М раствора Ba(OH)2. Пробы центрифугируют в течение 10 мин при 20000 об/мин в роторе IS-4,2-(Beckman). Из супернатанта отбирают аликвоты, добавляют в сцинтилляционную жидкость ЖС-8 и измеряют уровень радиоактивности на счетчике Rach-Beta (LKB). В качестве контроля используют пробы, инкубированные в аналогичных условиях, но без добавления белка. Результаты проведенных экспериментов выражали в процентах ингибирования 5'-нуклеотидазной активности, вычисляемой по формуле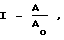
где Аo активность 5'-нуклеотидазы без добавок;
А активность 5'-нуклеотидазы в присутствии фосфокреатина или одного из испытываемых соединений.
Было изучено влияние следующих производных гуанидино-(1-гидрокси)алкилиден-1,1-бис-фосфоновых кислот:
1. Динатриевая соль гуанидинометилен-1,1-бис-фосфоновой кислоты дигидрат, ГМБФК-Na2.
2. Мононатриевая соль 3-гуанидино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты моногидрат, ГГПБФК-Na.
3. Динатриевая соль 3-гуанидино-1-гидроксипропилиден-1,1-бис-фосфоновой кислоты гидрат (1/2,5), ГГПБФК-Na2.
4. Мононатриевая соль 4-гуанидино-1-гидроксибутилиден-1,1-бис-фосфоновой кислоты гидрат (1/1,5), ГГБФК-Na.
5. Динатриевая соль 4-гуанидино-1-гидроксибутилиден-1,1-бис-фосфоновой кислоты дигидрат, ГГБФК-Na2.
Из результатов, приведенных в табл.1, видно, что все испытанные соединения эффективно угнетают активность 5'-нуклеотидазы, причем в отличие от фосфокреатина их ингибирующий эффект наблюдается при всех изученных значениях рН среды, увеличиваясь при сдвиге рН с 8,0 до 6,0.
В сравнении с эталоном фосфокреатином все новые соединения обладают значительно более выраженным ингибирующим действием на активность 5'-нуклеотидазы.
П р и м е р 8. Токсичность соединений определяли на 8 белых мышах обоих полов массой 19 20 г при внутримышечном способе введения. В качестве показателя токсичности взята величина ЛД50 среднесмертельная доза, выраженная в мг на 1 кг живой массы. Пpепаpаты готовили в виде водных растворов или эмульсий. Учет гибели животных проводили через 24 ч.
Результаты опытов обрабатывали по методу Литчфилда и Уилкинсона в модификации Рота. Данные этих испытаний представлены в табл.2 и для сравнения приведена величина ЛД50 фосфокреатина.
Таким образом, новые гидраты натриевых солей гуанидино-(1-гидрокси)алкилиден-1,1-бис-фосфоновых кислот обладают более сильным ингибирующим действием на 5'-нуклеотидазу, чем фосфокреатин. ТТТ1
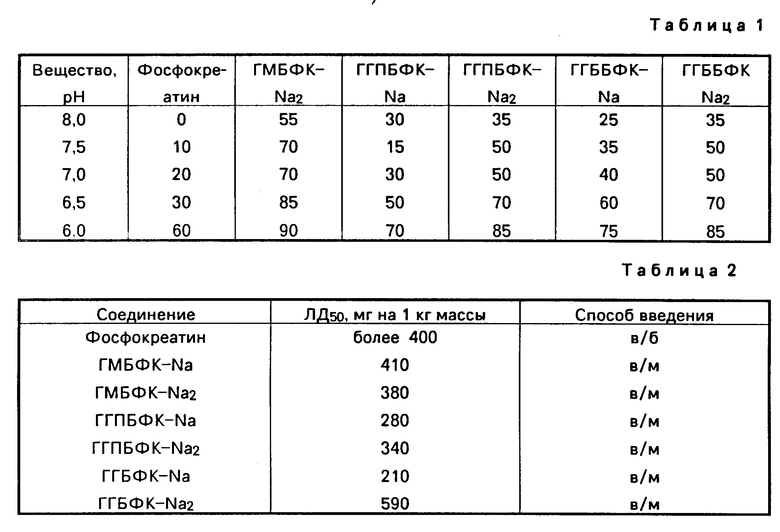
Изобретение относится к химии фосфорорганических соединений, в частности к гидратам натриевых солей гуанидино-1-(гидрокси)алкилиден-1,1-бис-фосфоновых кислот ф-лы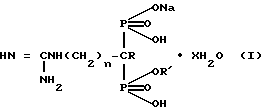
где 1) R = H, R' = H, n = 0, x = 1;
2) R = H, R' = Na, n = 0, x = 2;
3) R = OH, R' = H, n = 2, x = 1;
4) R = OH, R' = Na, n = 2, x = 2,5;
5) R = OH, R' = H, n = 3, x = 1,5;
6) R = OH, R' = Na, n = 3, x = 2,
обладающим ингибирующим действием на 5'-нуклеотидазу, которые могут быть использованы в медицине. Цель - выявление более активных соединений. Получение ведут из аминоалкилиден-1-(гидрокси)-1,1-бис-фосфоновых кислот и избытка S-этилизотиуронийбромида в водно-щелочной среде при 50 - 55oС в течение 10 - 15 ч, обработкой фильтрата реакционной смеси уксусной кислотой с целью выделения и очистки мононатриевых солей гаунидиноалкилиден-1,1-бис-фосфоновых кислот, которые действием едкого натра переводят затем в динатриевые соли. Новые соединения обладает более сильным ингибирующим действием на 5'-нуклеотидазу, чем фосфокреатин. 2 табл.
Гидраты натриевых солей гуанидино(1-гидрокси)алкилиден-1,1-бис- фосфоновых кислот общей формулы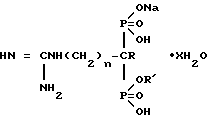
где 1) R и R' водород, n 0, x 1;
2) R водород, R' Na, n 0, x 2;
3) R ОН, R' водород, n 2, х 1;
4) R OH, R' Na, n 2, x 2,5;
5) R OH, R' водород, n 3, x 1,5; 6) R ОН, R' Nа, n 3, х 2,
обладающие ингибирующим действием на 5'-нуклеотидазу.
| Преображенский А.Н | |||
| и др | |||
| Исследование возможного механизма защитного действия фосфокреатина на ишемический миокард | |||
| - М: Биохимия, 1986, 51, N 4, c.675-682. |
Авторы
Даты
1996-08-20—Публикация
1989-01-27—Подача