рируют под пониженным давлением. К остатку добавляют этилацетат f и полученные кристаллы собирают фильтрова-
лонки концентрируют, к нему добавляют этанол, а затем добавляют 0,2 мл концентрированной соляной кислоты. Рлст-
вор концентрируют и полученные крис- та. шы собирают фильтрованием, получают 0,3 г (4tf,9O хлористоводородной соли I-имидазолил)метил -3, 5,6- триме гип-- I , r-fiii ioxiiHOHj .
Физические свойства и спектр ядерного магнитного резонанса этого соединения приведены в табл.3.
Пример 11 (соединение 23). Смесь 3,6 г (17,9 ммоль) (3-пиридил)- -(2-тиснил)- метанола, 2,74 г (1 8,0 ммоль) 2,3,5-триметилгидрохинона, 2,3 мл ме- тансульфокис юты и 45 мл дихлорэтана перемешивают при 60 С в течение 2ч.
После охлаждения к реакционной смеси добавляют подный раствор бикарбоната натрия, органическую фазу отделяют и водную фазу экстрагируют Хлороформом. Экстракт добавляют к ор ганической фате, встряхивают с 50 мл водного раствора 5,8 г (21,5 ммоль) хлорного железа и слегка подщелачивай ют с помощью родного раствора бикарбо- ната натрия, из которого отделяют ор- паническую фазу. Органическую фату промывают подои, сушат, концентрируют и очищают хроматографией на колонке силикагеля (тгичапотат), получают 6,0 г (92, ТО 2 П-пиридил)-(2-тие иил)метил -3,5,6-триметил 1,4-бензо- хинона.
Физические свойства и спектр ядерного магнитного резонанса описанного выше соединения приведены в табл.3.
Пример 12. (другой способ no- лучетшн соединения 7). Раствор 1,2 г (3,7 ммоль) 2- (3-пиридил)(2-тиенил)- метил -3, 5,6-триметил 1,4 бензохинона в 20 мл этанола нагревают с обратным холодилт,пиком в присутствии 24 г никеля Рэнея (К-6) в течение 5 ч. После охлаждения катализатор удаляют фильтрованием, фичьтрат концентрируют, повторно растворяют в этилацетате и встряхивают I- раствором 1,2 г хлорно- го железа в 10 мл воды. Смесь слегка подщелачивают бикарбонатом натрия, из нее отделяют органический слой, промывают его водой, сушат и концент- рпруют. Остаток очищают хроматографией на колонке силикагеля (этилаце- тат:и опрошшовый эфир 1:1), получают 0,8 г (72,5%) (3 пиридилпентшт7 - 3, 5,6-тримет игг- 1 , 4-бензохинона (соеди нение 7) .
Пример 13. 7 (2,5-Диметокси- 3,4, 6-триметилфснил)--7-(3-пиридил)- гептановуго кислоту (1,0 г, 2,6 ммоль)
полученную м.шмере 1 1 , растворяют в 47%-ном водном бромистом водороде (5 мл) и раствор нагревают при температуре флегмы в течение 2 ч. После завершения реакции реакционную смесь охлаждают. Раствор подщелачивают би карбонатом натрия и продукт экстрагируют этилацетатом. Экстракт промывают водой, сушат и выпаривают под вакуумом. Полученный гидрохинон окисляют воздухом и растворитель выпаривают, получают 7-О,5,6-триметил- 1 ,4-бен- зохинон-2-ил)-7-(3-пиридил)гептано- вую кислоту (0,8 г, 86,8%) после кристаллизации из этйлацетата, т.пл. 126-127°С.
Аналогичным способом получают 8- (3,5,6-тр име тил-1 ,4-6 е н з охин ) 8-(3-пиридил)-октановую кислоту, т.пл.113-114°С из 8(2,5 диметокси- 3,4,6- гриметилфенил)-8-(3-пиридил)октановой кислоты.
Фармакологические испытания.
Пример фармацевтической композиции :
A.Капсулы
1.Соединение 50 мг
2.Очень тонкий порошок целлюлозы 30 мг
3.Лактоза37 мг
4.Стеарат магния 3 мг Компоненты смешивают и вкладывают
в желатиновые капсулы.
B.Мягкие капсулы
1.Соединение 17 50 мг
2.Кукурузное масло 100 мг
По известной методике компоненты 1 и 2 смешивают и вкладывают в мягкие капсулы.
C.Таблетки
1.Соединение 18 50 мг
2.Лактоза34 мг
3.Кукурузный крахмал10,6 мг
4.Кукурузный крахмал (паста) 5 мг
5.Стеарат магния 0,4 мг
6.Кальциевая кар- боксиметилцеллюлоза20 мг
По известной методике эти компоненты смешивают напрессуют с помощью машины для формовки таблеток.
Опыт 1 . Ингибирование 5,-липоксиге назы. Ю7 клеток RBL-1 (крысиные ба зофильные лейкемийные клетки) суспан- дируют в 0,5 мл МСМ (плодкормовой клеточной среды) . К суспензии последова-
20
тельно добавляют раствор, содержащий 0,5 мл МСМ, 50 мкг арахидоновой кислоты, 10 мкг А-23187 (кальциевого ио1 нофора, Элли Лилли), добавляют раствор хинонового соединения в этаноле при конечной концентрации 1; 0,1; 0,01 или 0,001 мкмоль исследуемого соединения, и оставляют реагировать при 37 С в течение 20 мин. После реакции добавляют 4 мл этанола, содержа щего 1,4 диметокси-2-метил-3-(3-ме- токсипропил)-нафталин в качестве внутреннего стандарта, хорошо перемешивают при встряхивании и оставляют при комнатной температуре на Ю мин. Затем смесь центрифугируют в течение 10 мин (2000 об./мин) и отделяют поверхностный слой. Поверхностный слой концентрируют досуха при пониженном давлении. К концентрату добавляют
0,5 мл 60% -ного водного метанола.
100 мкл этого раствора подвергают высокоэффективной жидкостной хроматографии для количественного анализа 25 5-НЕТЕ (5-оксиэйкозатетраеновой кис- 1 лоты). Количество 5-оксиэйкозатетраеновой кислоты анализируют путем измерения поглощения при длине волны 273 нм с помощью монитора ультрафиолетового поглощения.
Ингибиторный эффект образования 5-оксиэйкозатетраеновой кислоты выражают соотношением: 1- Ь(а) 100, где а - высота пика или площадь пика, обуслов- ленная внутренним стандартом при отсутствии хинонового соединения, Ь - высота пика или площадь пика, обусловленная внутренним стандартом при наличии хинонового соединения.
Результаты подтверждают эффективное ингибирование образования 5-оксиэйкозатетраеновой кислоты, данные приведены в табл.3.
Опыт 2. Ингибирование синтетазы .с тромбоксана А(ТХА). В качестве препарата синтетазы тромбоксана А 2 используют тромбоцитную микросому лошади, обработанную индометационом (обработанная индометацином и лошадиная тромбоцитная микросома:1РМ) по способу Нидлмана. К 60 мкл раствора 1РМ в 50 мл трис-буфера (рН 7,5), содержащего 140 мкг белка, добавляют 60 мкл растеора, содержащего лекарство в различных концентрациях, и выдерживают при комнатной температуре в течение 5 мин. Используют 100 мкл этой смеси, к ним добавляют при ле
(О
.5
40
50
55
-
Ю
20
251
.с
(О
.5
40
50
5
Лна 5
Аг(ТХАг) .
ДЯНОМ охлаждении 0 MKJI буфера, I
держащего 30 мг простагллндина Пл(РПН), и смесь составляют при
мин, чтобы получить трчмбоксам
Реакцию останлгпшпают путем добавления 500 мкл трис-буфера, и 50 мкл полученного раствора подвергают радиоиммуноанализу тромбокс.ша ,) стабильного метаболита ТХА. - Скорость ингибирования (%) сннтетачы ТХА2 определяют по разности скорости образования ТВХ между необработанной и обработанной группами,
Результаты опытов с некоторыми показательными соединениями приведены в табл.5.
Опыт 3. Ингибирование образования липидной перекиси в мозговом гомоге- нате крысы.
Методика: У крыс Spragul-Dawlеу (самцы, возраст 9-15 нед), анестезированных с помощью пентобарбитала (50 мг/кг внутрибрюшинное введение). вскрывают вены и вырезают ткань головного мозга. Ткань гомогенизируют в фосфатном буфере (рН 7,4) и испол«-- зуют в качестве 5% гомогената (по лесу) . Мозговой гомогенат оставляют для реакции при 37°С в течение 1 ч и количество образовавшейся липидной перекиси определяют методом с тиобарби- ,туровой кислотой по методике Окава. Лекарство добавляют к 5%-ному гомоге- нату перед проведением реакции при
37°С
в течение 1 ч с тем, чтобы ко-
концентрация -стала
или
нечная
10 моль/л. Ингибирование образования липидной перекиси выражают в виде скорости ингибирования в процентах от количества, полученного в групппе, обработанной растворителем (ДМСО). Результаты приведены в табл.5.
Опыт 4. Влияние на появление аритмии желудочков под действием мишени - повторной перфузии у крыс.
Методика: Опыт проводят на крысе Spragul-Dawlеу (самцы, 11-12-недель- ного возраста). Крысе орально вводят лекарство или воду в дозе 5 мл/кг и анестезируют через 1 ч пентобарбита- лом (50 мг/кг, внутрибрюшинная инъекция) . Крыс подвергают терокатомиии при искусственном дыхании, и левую переднюю нисходящую венечную артерию перевязывают на 5 мин, после чего повторно наполняют на 10 мин. Определяют частоты проявления желудочковой тахикардии, фибрилляции желудоч-
коп и остановки сердца в течение 10 мин повторной перфузии.
Результаты приведены в табл.6. Соединение 1 при оральном введении в дозе 30 мг /кг существенно подавляют появление тахикардии желудочков, фибрилляции желудочков и остановки сердца.
Опыт 5. Влияние на приступ ишемии мозга в спонтанно гииертензивных крысах.
Методика: Спонтанно гипертензивной крысе (самец, 20 - 23-недельного возраста) орально вводят соединение или воду в дозе 5 мл/кг и через 1 ч ее анестезируют пентобарбиталом. Двусторонние общие сонные артерии перевязывают, и измеряют продолжительность времени от момента перевязки до появ- ления приступа (судорога, поддергивание и т.д.).
Результаты приведены в табл.7. Со- единение 1 при оральном введении в дозе 30 мг/кг существенно удлиняет время п,о появления приступа ишемии мозга. Укачанное соединение проявляет защитные действия против ишемии мозга
Опыт 6. Эффект уменьшения белка в моче у крыс,у которых адриамицином вызван нефроз.
Методика: Опыт проводят на крысе Sprague-D iwley (самец, 5-недельного возраста). Адриамицин вводят внутривенно в дозе 7,5 мг/кг через 2 нед мочу собирают в течение 24 ч после того, как орально вводили воду в дозе Ю мл/кг. Определяют полное содержание белка в моче и содержание альбумина в моче. Крысы, у которых пол- ное содержание белка в моче составляет 20 мг/ЮО г/24 ч или выше, отбирают для опыта. Контрольной группе вводят одну ооду (носитель) в дозе 10 мг/кг/день, а другой группе соединение 18 внодят в дозе 50 мг/кг/ /день (10 мл/кг, вода) раз в день в течение 2 нед. После лечения лекар-. ством в течение 1 нед или 2 нед собирают мочу за 24 ч, чтобы определить полное содержание белка в моче и содержание альбумина. Через 2 нед берут кровь из грудинной аорты крысы при анестезии пентобарбиталом (50 мг/кг, внутрибрюшинная инъекция), чтобы оп- ределить уровень плазменного холес- i терина.
Результаты приведены в табл.8. Полный белок в моче в контрольной
группе возри Ian через 2 неп обработки по сравнению с величиной до обработки, а уринарный альбумин возрастает, как через 1 нед, так и через 2 нед после обработки по сравнению с величиной до обработки. В группе соединения 18 ни полный белок в моче, ни уринарный альбумин не отличаются от соответствующих величин до обработки. Кроме того, уровень сыво роточного холестерина через 2 нед заметно снижается при обработке соединением 18, Эти результаты доказывают, что соединение 18 улучшает состояние нефроза, вызванного адриами- цином.
Опыт 7. Эффект улучшения гломеру- лонефрита у крыс.
Методика: Нефритных крыс получают по способу Матсунага, используют крыс Sprague-Dawley (самцы, 5-недельного возраста) . Крысу иммунизируют предварительно путем подкожной инъекции смеси 3 мг сывороточного альбумина кролика и равного объема полной добавки Фройнда и через 2 нед после этой внутривенно вводят сывороточный альбумин кролика в дозе 1 мг/крысу по три раза в неделю в течение 8 нед. Затем собирают мочу за 24 ч, чтобы определить полный белок в моче и ури- парный альбумин. Для опытов отбирают крыс, у которых полный белок в моче составляет 20 мг/ЮО г/24 ч или более Контрольная группа получает одну воду (носитель) в дозе 10 мл/кг/день, а другая группа получает соединение 18 в дозе 50 мг/кг день (10 мл/кг, воды) один раз в день в течение 2 нед. Через 1 или 2 нед обработки собирают мочу за 24 ч, чтобы определить полный белок в моче и уринарный альбумин.
Результаты приведены в табл.9. По сравнению с контрольной группой в группе соединения 18 проявляется уменьшение полного белка в моче и ури парного альбумина. Эти результаты доказывают, что соединение 18 улучшает нефрит..
Опыт 8. Антагонизм к рецептору тромбоксана ) .
Методика: Спиральную полоску из аорты кролика (шириной 2-3 мм, длиной примерно 3 см) подвешивают в растворе Кребса-Гензелейта при нагрузке 2 г. Раствор Кребса-Гензелейта насы-
шдют смесью газов 95% 0 - 5% CO и ( нагревают при 37°С. Исследуют ингиби- рование сокращений сосудистой полоски вызванных миметическим веществом рецептора тромбоксана Л, U 46619 (tO моль/л), при предварительной об- работке соединением 13 за 30 мин до этого.
Результаты приведены в табл.10. Соединение 13 ингибирует сосудистое сокращение . вызванное U - 46619, на 14% при )ль/л и на 86% при концентрации Ю моль/л, что показывает существенный антагонизм рецептора тромбоксана А2.
Опыт 9. Токсикологическое исследо-- вание в крысах.
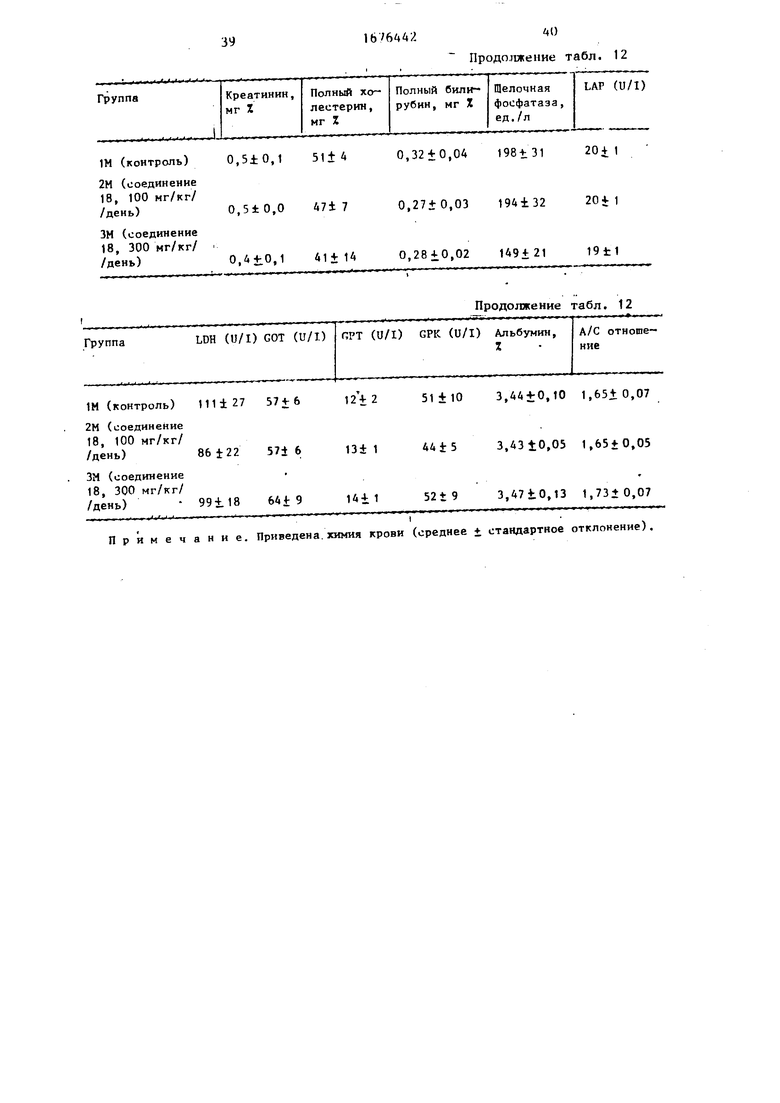
Методика: используют (5-недельных самцов мышей Wiscar. Крысам орально вводят соединение 18 раз в день в течение 14 дн.при дозах 100 и 300 мг/кг/ /10 мл воды в виде суспензии с 5%-ной аравийской камедью. Контрольным кры- сам дают один носитель (10 мл/кг воды). После двухнедельной обработки, после последней дозы крыс морят голодом в течение ночи, а затем анестезируют этилацетатом и кровь из брюшной аорты собирают в обработанный гепари- ном шприц, плазму отделяют для исследования химии крови. Параметры крови, такие, как полный белок, глюкоза, кальций, мочевинный азот, креатинин, полный холестерин, полный билирубин, щелочная фосфотаза (ALP), лейциновая аминопептидаза (IAP), лактат дегидро- геназа (LDH) глутаминовая оксалоук- .сусная трансаминаза (GOT), глутамино- вал пировиноградная трансаминаза С (GPT), креатинфосфокиназа (СРК), альбумин и отношение А/Г (А/С) анализируют с помощью автоанализатора (Хитачи 716). Органы, такте как печень, почки, сердце, легкие, селезенка, надпочечники, тимус, яички, головной мозг и гипофиз, были вырезаны и взвешены. Некоторые органы (печень, почки, сердце, легкое, селезенка) фикси- руют в 10%-ном нейтральном растворе формалина для гистологических исследований. Без взвешивания фиксируют также костный мозг. Эти зафиксированные органы также окрашены Гематоксили- ном-эозином для гистологических исследований .
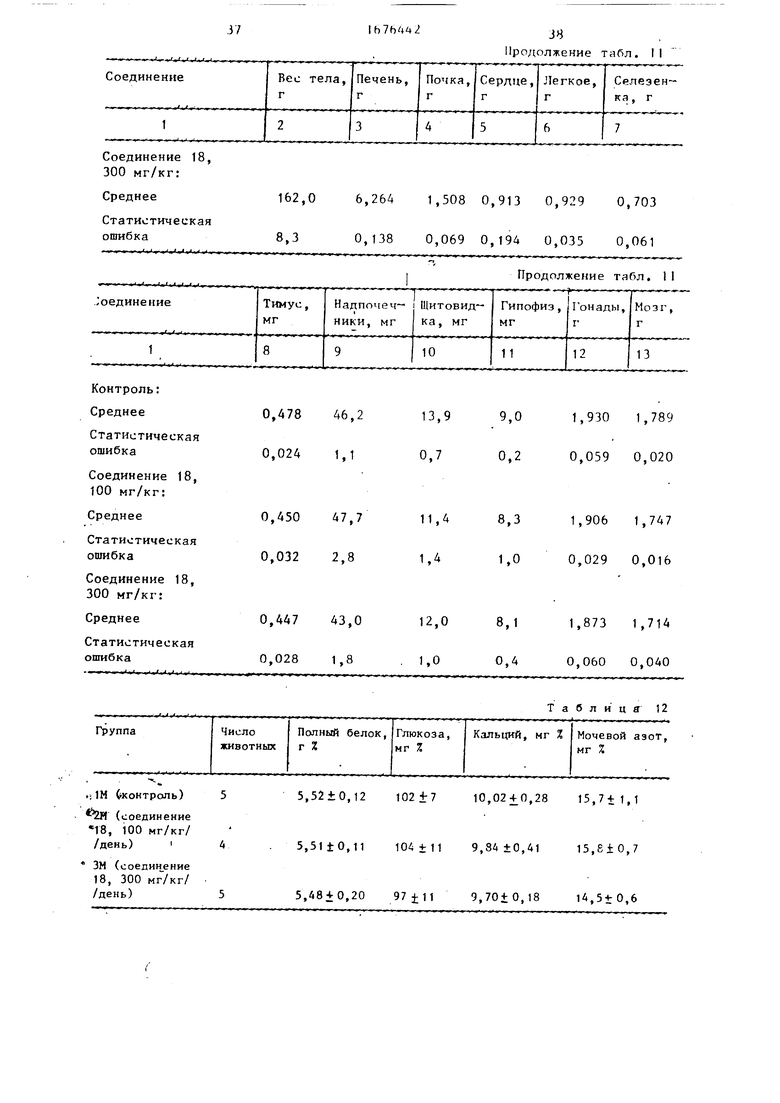
Результаты: Крысы, которые получают соединение 18 (300 мг/кг), обладают тенденцией к снижению неся ifi.i, но изменение несущественно (т.|бп.11). Обе дозы (ЮО и 300 мг/кг) не длют существенных изменений веся какого- либо органа (табл. 9) и HI- длют ичмг- нФний в химии крови (табл.10). R группе, в которой вводят 300 мг/кг соединения 18, одна из пяти крыс проявляет слабую спленомегалию и увеличенный экстрамедулярный гемопоэз. В других органах не проявляется изменений (табл.13).
Получаемые соединения обладают ма- лой,,токсичностью, и низким побочным действием поэтому соединения сами по себе либо фармацевтические композиции, полученные путем смешивания их с известными фармацевтически допустимыми носителями или наполнителями или т.п. (например, таблетки, капсули, включая мягкие капсулы и микрокппеу- лы, жидкие препараты, инъекции, суппозитории) можно безопасно вводить орально или парентерально. Дозу изменяют в зависимости от больного, ко торого нужно лечить, от пути введения от симптомов и т.д. Например, при оральном введении взрослому больному при тромбозе единичная дозировка обычно составляет 0,1 - 20 мг/кг живого веса, предпочтительно 0,2 - 10 мг/кг живого веса, которую желательно давать 1-3 раза в день.
Получение исходных соединений. Пример 14. Раствор 10,0 г (63,3 ммоль) 3-бромпиридина в 100 мл эфира охлаждают до - 78°С, к нему добавляют по каплям при перемешивании 40 мл (64 ммоль) 1,6 моль/л раствора н бутиллития в гексане. По окончании добавления смесь перемешивают еще в течение 1 ч при температуре от -78 до комнатной температуры. К реакционной смеси добавляют водный раствор хлорида аммония и полученное вещество экстрагируют этилацетатом. Экстракт про- Iмывают водой и сушат, растворитель выпаривают. Остаток очищают хроматографией на колонке силикагеля (CHClj: МеОН 9:1) и перекристаллизовывает из смеси этилацетата и изопропилового эфира, получают 8,0 г (77%) 4-(3-пи ридил)-4-оксобутанолл, точка плавления 36-37е С.
Аналогичным образом 5-(3-пиридил)- 5-оксопентанол (/1%) и 6-(3-пиридил)- 6-оксогексанол (57%) получают из о -
1 1676
валеролак гона и ич Ј, -капролакчона соответственно .
Пример 15. Раствор 12,5 г (69,8 ммоль) спиртового производного, полученного в примере 14, и 12,6 мл (90,7 ммоль) гриэгиламина в 100 мл ди- метилформамида охлаждают льдом, к ним медпснно добавляют по каплям при пере- мешивапни 1,1 г (83,8 ммоль) трнметил , xjiopcujiana. Смесь перемешивают в тече- лие Ю мин посте окончания добавления и рачбармпкп иоцой, из полученной CMC- си продукт пкстрагируют ттилацетатом. Экстракт проммвают водой, сушат и вы- паривают растворитель. Остаток отго- няют иод почиженньгм давлением, получают 13,4 г (76,67) 1(3 пириднл)-4- триметилситилоксибутан- 1-она (т .кип, при 1 мм рт.ст. 126-130°С).2
Аначогичн гм способом получают 1 - (3-пирид1ш)5 и 1СШШЛОКСИИСН- тан-1- in (т.кнп. гфи 1 мм рг.ст. 134- 138°С) я ,црн ;ч О-б-триметилси- ЛИЛСКС.НА екс,Н1-1-оп (.кии. при 1 мм 2 рт.ст , 4f -16 i0O .
П р и м о р 16. Реактив 1риньяра готовят из 7,7} 1 (29,3 ммоль) 1-бром- 2 , 5-дит гсксн- ) 5 6-трнметокепбенчо- ла, /00 MI - ,8 ммоль) магния и з 50 мл те i рапшрпфурана при 65 С и полученный pact вор охлаждают до О С, к этой смей1 дпбав 1яют по при перемешивании раствор 6,0 г (23,9 пмочь) i нчил чфпрного производ- ного, по учечно1о в примере 1), в 10 мл тс грлтдгч Фурана. Смесь перемешивают при чтмнтюй температуре в течение 1 ч ос ie окончания добавления, к ней дои 1П.МПОТ ноцу и проводят экст- рагировпнис г шацегатом. Экстракт промыв л. 1 и cvi-i ir (MgSO), растворитель выпариткл . К остатку добавляют 1 Ct м ( 0 мл) и ч. Раствор со- лянс н Mi ч-in ( 10 мл), смесь переме- д шязарл4 ь т- I-5 1 ч. Реакционную смесь tu чи- ч-рчру Ч под пониженным давленном и н чн пмуюг бикарбонатом naipi., ш по ту {онноп смеси продукт
экст рат нру-,т i j 1 инаце гатом . Экстракт npoiii ifl чн Т an t и н сушат, и растворитель выпаривают. Остаток растворяют в 80 мл уксуснип кислоты, к раствору добавляют 1S мп серной кислоты и смесь порсч щи i ir при 80 С в течение 30 мнч . MPLпр охлажпсгия и осторожного доПав и ннп 60 г бикарбоната натрия смон ь .г бпвляют водой, из смеси продукт ч1.- i рат иругот- этилацета
2
lh
,Q 20
25
зо . Qдз
50
5
том. Экстр,ii i домывают водным раствором бикарбоната натрия, а затем водой и сушат MgSO, из полученной смеси выпаривают растворитель. Остаток очищают хроматографией на колонке сичикагечя (CHCl :ELOAc 1:1),получают 6,09 г (63,8%) 1-ацетокси-4 (2,5-диметокси-З,4,6-триметилфенил)- б-(З-пиридил) -Здбутена (масло).
Аналогичным способом готовят 1 - ацстокси-5-(2,5-диметокси-3,4,6-три метилфенил)5(3 пиридил)4-пентен н 1-ацетокси-6-(2,5-диметокси-З,4,6- гриметилфенил)-6-(3 пиридил)-5-гек- сан.
Пример 17„ Раствор 1,0 г (2,7 ммоль) бутенового производного, полученного в примере 16, в Ю мл уксусной кислоты подвергают каталитическому восстановлению при 80°С в присутствии 0,4 г 5%-ного палладирован- ного угля в качестве катализатора. После окончания реакции катализатор удачяют фильтрованием, и фильтрат концентрируют под пониженным давлением. Остаток растворяют в этилацетате, промывают водным раствором бикарбоната натрия, а затем водой и сушат, из полученной смеси выпаривают растворитель. Остаток очищают на колонке си- ликагеля (этилацетат), получают 750 мг (74,6%) 1-ацетокси-4-(2,5 диметокси- 3,4,6-триметилфенил)-4-(3-пиридил)бутана (масло).
Аналогичным способом готовят 1- ацетокси-6-(2,5-диметокси 3,4,6-три- мстилфенил)-б-(З-пиридил)гексан и 1-ацетокси-5-(2,5 диметокси-3,4,6- триметилфенил)-5- 3-пиридил)-пентан.
Пример 18. К раствору 0,7 г (1,88 ммоль) бутанового производного, полученного в примере 17, в 3 мл метанола добавляют раствор 0,3 г (7,50 ммоль) гидрата окиси натрия в 3 мт воды и смесь перемешивают при комнатной температуре в течение 30 мин, затем добавляют воду. Продукт экстрагируют этилацетатом и экстракт промывают РОДОЙ, сушат и концентрируют. Остаток очищают на короткой колонке силикагеля (этилацетат), получают 0,5 г (80,5%) 4(2,5 диметокси-3,4,6 триметилфенил)-4-(3 пиридил)-1-бута- пола (масло).
Аналогичным способом получают 5- (2,5-диметокси 3,4,6-гриметилфенил)- 5-(3 пиридил)-1-пентанол (т .пл .99- ЮО°С) и 6-(2,5 пиметокси 3,6,6-триметилфенил) 6-(3-пиридил)1-гексанол (т.пл.90-91вС).
Пример 19. Раствор 10,0 г (63,3 ммоль) 3 бромпиридина в 100 мл эфира охлаждают до -78 С, к смеси по каплям добавляют 40 мл 1,6 моль/л (64 ммоль) гексанового раствора н-бу- тиллития. Смесь перемешивают в течение 15 мин после окончания добавления к ней по каплям добавляют раствор 7,25 г (67,7 ммоль) гептанитрила в 15 мл эфира, и смесь перемешивают при температуре от -78°С до комнатной еще в течение 1 ч. К реакционной смеси (добавляют водный раствор хлористого аммония и из смеси продукт экстрагируют этилацетатом. Экстракт промывают водой и сушат, и растворитель выпаривают. Остаток очищают хроматографией на колонке силикагеля (элюирование изопропиловым эфиром), получают 3,9 г (36%) 3-гептаноилпиридина (масло).
Аналогичным образом 3 пропионилпи ридин и 3-пентаноилпиридин получают посредством реакции с пропионитрилом и с валеронитрилом соответственно.
Пример 20. Реактив Гриньяра получают из 693 мг (28,3 г-атом) магния, 7,6 г (29,3 ммоль) 1-бром 2,5- диметокси-3,4,6 триметилбензола и тет- рагидрофурана при 65°С и охлаждают смесь до 0°С, к ней добавляют по каплям раствор 3,75 г (21,9 ммоль) 3-геп- таноилпиридина в 10 мл тетрагидрофура- на. После окончания добавления реакционную смесь перемешивают при комнатной температуре в течение 1 ч, к ней добавляют воду и экстрагируют этилаце- татом. Экстракт промывают водой, су- шат и концентрируют. Остаток очищают хроматографией на колонке силикагеля (иэопропиловый эфир) и перекристалли- эовывают из гексана, получают 3,2 г (30%) 1-(2,5 диметокси-3,4,6триметилфенил)-1-(3-пиридил)гептанола, т.пл. 109-110 С.
Аналогичным способом получают 1- (2,5 диметокси 3,4,6-триметилфенил)- 1-(3-пиридил)пропанол и 1-(2,5-диме- токси- 3,4,6-триметилфенил)(3-пири- дил)пентанол.
Пример 21. К раствору 2,5 г (6,74 ммоль) спиртового производного, полученного в примере 20, в 20 мл ук- сусной кислоты добавляют 2,5 мл концентрированной серной кислоты и смесь нагревают при 80°С в течение 1 ч. После охлаждения осторожно добавляют
6,8 г карбоната калия, смесь рл П.тп ляют водой и экстрагируют этилацетатом. Экстракт промывают водой, водным раствором бикарбоната натрия и сушат, из смеси выпаривают растворитель. Очистка на короткой колонке сн- ликагеля (изопропиловый эфир) дает 2,2 г (92,5%) 1-(2,5 диметокси 3,4,6 триметилфенил)-1-(3-пиридил)-1-геп тена.
Пример 22. Гептеновое произ- водное, полученное в примере 21 в количестве 1,2 г (3,4 ммоль) гидрогенн- в 12 мл уксусной кислоты в прн сутствии 0,6 г 5%-ного палладирован- ного угля при 80 С, Реакционную смесь анализируют в помощью токнкослойной хроматографии. После окончания реакции катализатор удаляют фильтрованием и фильтрат концентрируют, к нему добавляют этилацетат и промывают его насыщенным водным раствором бикарбоната натрия. Органическую фазу с ушат, из нее выпаривают растворитель. Оста- ток очищают хроматографией на колонке силикагеля (изопропиловый эфир: гексан 2:1), получив 1,1 г (91,2%) 1- (2,5-диметокси-3,4,6-триметилфенил) 1-(3-пиридил)гептана (масло).
Аналогичным способом получают 1- (2,5-диметокси-3,4,6-триметилфенил) - 1-(3-пиридил)пропан и 1-(2,5-диметок- си-3,4,6-триметилфенил)-1-(3 пири- дил)пентан.
Пример 23. Раствор 525 мг (1,6 ммоль) бутанольного производного, полученного в примере 18, и , 0,33 мл (2,4 ммоль) триэтиламина в 3,5 мл дихлорметана охлаждают до О С, к смеси при перемешивании добавляют 0,15 мл (1,94 ммоль) метансульфонил- хлорида. Реакционную смесь перемешивают при этой же температуре в течение 30 мин, к смеси добавляют воду и отделяют органический слой, водный слой экстрагируют дихлорметаном, а экстракт смешивают с описанным органическим слоем. Полученный органический слой промывают водой, сушат и концентрируют. Остаток растворяют в 5 мл ди- метилсульфоксида, к нему добавляют 148 мг (2,9 ммоль цианистого натрия, и смесь перемешивают при 80 С в течение 2 ч. К реакционной смеси добавляют воду, из смеси продукт экстрагируют этилацетатом. Экстракт промывают во дои и сушат, из смеси выпаривают растворитель. Остаток очищают хроматогря-
фией на колонке гиликагеля, получают 445 мг (82,5%) 4 циано 1(2,5 диметок- ,4 , 6-тримстш фемил) -1 -(3 пиридил) - бутана (масло).
Анатогичным способом готовят 5-ци- ано-1-(2,5-димс-токеи-З,4,6 триметил- фенил)1-(3-пнридип)пентан (масло) , 6 циано 1(2,5 диметокси 3,4,6 триме тилфенип)-1(3-ппридил)гексан (масло) и 7-циано-1-(2,5 диметокси-3,4,6- тримстилфенил)-1-(3 пирндил)-гептан (масло).
Пример 24. К раствору 445 мг (1,32 ммоль цианопроизводпого, полу ценного в примере 23, в 3 мл метанола добавляют раствор 1,5 г (37,5 ммоль) гидроокиси натрия в 5 мл йоды и смесь нагревают с обратным холодипышком в течение 3 ч. Реакционную смесь охлаж- дают, разбавляют водой, нейтрализуют 2 н. раствором соляной кислоты и экстрагируют этилацетатом. Экстракт промывают нодой, сушат и концентрируют. Остаток очищают хроматографией на колонке силпкагеля (CHClj:MeOH 9:1), получают 400 мг (85,1%) 5(2,5- диметоксн-3,4,6-трпметилфенил)-5-(3- пиридил)пентановой кислоты, т.пл. 82-84°С.
Аналогичным образом получают fc(2,5- диме,токси-3,4, 6 триметилфенил)-6-(3- пиридил)гексановую кислоту (т.пл.183- 184°С) , 7-(2,5-диметокси 3,4,6-триме тилфонил)-7-(3-пиридил)-гептановую кислоту (масло) и 8-(2,5-диметил- 3,4,6-тримгтилфснил)-8-(3-пиридил)октановую кислоту (масло).
П р и м е р 23. Раствор 5,0 г (17,8 ммоль) 2-бром-1,4-диметокси-3- метилнафталина в 30 мл тетрагидрофу- рана охлаждают до -78 С, к нему по каплям добаппяют 11,2 мл (17,9 ммоль) 1,6 моль/л н-Сттпллитиевого раствора в гексане, и смесь перемешивают при этой же температуре в течение 10 мин после окончания добавления. Затем к реакционной смеси по каплям добавляют 1,3 г (17,8 ммоль) диметилформамида и смесь перемешивают при комнатной температуре в течение 1 ч после окончания добавления. Воду добавляют к реакционной смеси, из смеси продукт экстрагируют этилацетатом. Экстракт промывают водой, сушат и концентрнру- ют. Остаток очища ют хроматографией на колонке силикагеля (гексан:изопропи- ловый эфир 8:2) и закристаллизовывают из смеси гексана и изопропилового
5
10
15
0 5 30
644220
эфира, пол 1 i .1 2,0 г (48,9%) 2-фор- мил-1,4 димсiокси 3-метил няфталина, т.пл..
Пример 26. Раствор 1,0 г (2,82 ммоль) гептенового производного, полученного в примере 21, .в 20 мл смеси ацетонитрила и воды (1:1) охлаждают льдом, к смеси по каплям при перемешивании добавляют раствор 4,1 г (7,48 ммоль) цериевого нитрата аммо-1 ния в 15 мл смеси ацетонитрила и воды (1:1). Смесь перемешивают при этой же температуре в течение 30 мин после окончания добавления, слегка подщелачивают с помощью водного раствора бикарбоната натрия и экстрагируют этилацетатом. Экстракт промывают водой и сушат, растворитель выпаривают. Остаток отделяют хроматографией на колонке силикагеля (изопропиловый эфир):сначала элюируют 313 мг (Е)-1- (3,5,6-триметилбензохинон-2 ил)-1- (3-пиридил)-гептана, а затем элюи- руют 395 мг (Z)-1-(3,5,6-триметилбен- зохинон-2-ил)-1-(3-пиридил) гептена.
Аналогичным образом получают(Е), (Z)7(3,5,6 триметилбензохинон-2 ил) 7(3-пиридил)гептеновую кислоту.
Физические параметры описанных соединений приведены в табл.4.
Пример 27. 1,4-Диметокси- 2,3,5-триметилбензол в количестве 9,00 г (50 ммоль) растворяют в (60 мл) и перемешивают при ледяном охлаждении. После добавления 14,4 г (,5 ммоль)дихлорметилметилового эфира добавляют по каплям при перемешивании в течение 15 мин 13,8 мл (50x2,5 ммоль) четыреххлористого титана, растворенного в СН2С12 (30 мл). После перемешивания еще в течение 15 мин при ледяном охлаждении ледяную баню удаляют и смесь перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в колотый лед (примерно 200 г) и интенсивно перемешивают в течение 30 мин. Слой СН С12промывают водой (3 раза) и сушат (ygS04) , из смеси выпаривают . Остаток перекристаллизовывают из смеси изопропилового эфира и гек- сана (1:1), получают 6,18 г 2,5-диме токси-3,4,6 триметилбензальдегида.. Маточный раствор концентрируют, остаток очищают хроматографией на колонке силикагеля (60 г) (эпюируют изопропи- ловым эфиром), получают 3,70 г 2,5-
диметокси-3, 4, 6-триметилбензальдег и- да. Выход 9,88 г (95%), т.пл.
К раствору 20 г (96 ммоль) 2,5-ди метокси-3,4,6-триметилбензальдегида в 200 мл этанола добавляют 1,8 г (47,6 ммоль) боргидрида натрия и смес перемешивают в течение 30 мин. К реакционной смеси добавляют соль и продукт экстрагируют этилацетатом. Экст- ракт промывают водой и сушат, из него выпаривают при пониженном давлении растворитель. Остаток эакристаллизо- вывают из иэопропилового эфира, получают 18,6 г (92,1%) 2,5 диметокси- 3,4,6-триметилбензилового спирта, т.пл.121-122°С.
Раствор 16,5 г (78,5 ммоль) 2,5- диметокси-3,4,6-триметилбензилового спирта в 90 мл тетрагидрофурана ох- лаждают до О С, к нему при перемешивании добавляют 14,2 г (52,5 ммоль) трибромида фосфора. После перемешивания при этой же температуре в течение 30 мин реакционную смесь разбавляют водой и экстрагируют изопропиловым эфиром. Экстракт промывают насыщенным водным раствором бикарбоната натрия и сушат, из полученной смеси выпаривают растворитель. Остаток перекрнс- таллизовывают из метанола, получают 17,2 г (80,0%) 2,5-диметокси-3,4,(- триметилбензилбромида, т.пл.71-72°С.
Раствор 15,5 г (98,1 ммоль) 3- бромпиридина в 200 мл этилового эфи- ра охлаждают до -78°С, к смеси по каплям добавляют 61,3 мл (98,1 ммоль) н бутиллития (1,6 моль/л раствор в гексане). В течение 20 мин после окончания добавления смесь перемеши- вают при этой же темаературе, а затем добавляют по каплям раствор 26,8 г (98,1 ммоль) 2,5-диметокси-3,4,6- триметилбензилбромида в 100 мл этилового эфира. После перемешивания в те- чение 1 ч при температуре от -78°С до комнатной реакционную смесь разбавляют водой и экстрагируют этилацетатом. Затем экстракт обратно экстрагируют с помощью 2 н. раствора соляной кис- лоты, водный слой слегка подщелачивают насыщенным водным раствором бикарбоната натрия и проводят экстракцию этилацетатом. Экстракт промывают водой, сушат и концентрируют. Остаток очищают хроматографией на колонке си- ликагеля (этилацетат), получают 22,8 г (85,8%) 3-(2,5 диметокси 3,4,6- триметилбенэил)-пиридина.
Аналогичным способом ИСМРПЬ . - формип-1 , 4-диметокси- V-мп и пмфт шн в качестве исходного tujmecvn.i и промежуточные соединения ( 1 , i-дм- метокси-3 метилнафт п 1 -метанол (т. пл. 122-1 21° С, и 2-(1 ,4 диметпкгп-1 метплнафтил) -метичбррмид (т.пл. 7(| 80°С) синтеризуют 3-Ј( ,4-димоток-- си-3 метилнафтил5 -метилпиридпн.
Пример 28. К рлствору 490мг (7,33 ммоль) имидазола и 2,0 г (7,33 ммоль) 2,5-диметокси },4,h-три- метилбензилбромидл в 12 мл димотил- фовмамида добавляют 1,2 мл три-чтил- амина, и смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Ткстрлкт промывают водой и сушат, нч него выпаривают растворитель. Остаток очищают хроматографией на колонке снли-- кагеля (хлороформ:метанол 1:1) и по- рекристаллизовывают нч изопропипочогг. эфира, получают 0, г (47,37,) 1(/, .- диметокси-3, 4 , 6-трнметилбрнчил)нг1нд,1 зола, т.пл.82-83°С.
Пример 29, К перемошина м-му тетрагидрофурановому раствору (40 мл) 7-(2,5 диметокси-3,4,6-трн- метилфенил)-7-(3-пиридил)гентаиовой
кислоты (3,0 мг, 7,8 ммопь), полученному в примере 24, доблпляют при ледяном охлаждении алюмогидрид лит1, t (450 мг, 11,9 ммоль). Реакционную смесь нагревают до комнатном температуры и ее перемешивают в течение 30 мин. После этого к реакционной смеси осторожно добавляют воду и продукт экстрагируют этилацетатом. Экстракт промывают водой, сушат и выпаривают под вакуумом, получают . 7-(2,5-диметокси-3,4,6-триметилфенил) 7-(3-пиридил)гептанол (2,3 г, 79,6/0 в виде масла после хроматографирова- ния неочищенного продукта на силика геле.
В табл.12 приведены результаты испытаний по биологической активности соединений 18, в табл.14 сравнительные данные по биологической активное- ти с известными соединениями.
Таким образом, способ позволяет получать хиноновые производные с низкой токсичностью и обладающие способностью ингибировать сннтетазы тром- боксан А, антагонизма рецептора тром- боксана Ал, поэтому могут они быть использованы в медицине для лечения
и профилактики болезней у млекопитающих, таких как тромбоз, коронарные болезни вызванные сокращением или подергиванием артериальной гладкой мускулатуры в сердце, в легких, в мозгу и в почке, нефрит, легочная недостаточность, бронхиальная астма, псориаз, воспаление, немедленная аллергия, артериосклероз, жировая пе чень, гепатит, цирроз печени, гипер- чувствительный пневмонит, иммунодефицит, болезни сердечно-сосудистой системы (инфаркт миокарда, мозговой удар нефрит и т.д.), из-за нарушений тка- ней, ферментов и клеток, вызванных активными кислородными частицами (перекиси, гидроокисные радикалы, липо- идные перекиси и т.д.), и рак, причем они полезны в качестве таких лекарств как противотромботические средства, средства против сужения сосудов, ан- тиастматическое средство, антиаллер- гические средства, терапевтические средства против псориаза, средства дл улучшения деятельности сердца, мозга и сердечно-сосудистой системы, терапевтические средства для лечения нефрита, средства удаления активного кислорода, противораковые средства, средства для улучшения контроля продуктов арахидонового каскада и т.д.
Формула изобретения
Способ получения хиноновых произ- водных общей формулы
з;
CH-(CH2)n-tz-(CH2)
R4
где R и R - одинаковые или различные, метил, метокси или вместе образуют -СН СН-СН СН-;
R 3 метил;
R, - пиридил, имидазопил;
R - водород COOri, CHjjOH, СН2ОСОСН3;
s
R
где R - метил, водород; п 0-6;
га 0-1 ;
k 0,1;
отличающий с я тем, что соединение общей формулы
R7
УУ
R2-Y1-CH-(CH2)(CHz) OR6 Ьц
где R||-R, n, m, k имеют указанные значения,
Rg - водород, метил;
Rf - гидроксил метокси, подвергают взаимодействию с окисляющим агентом.
П р и о р и к а м:
т е т по п р и з и а-
30.01.86 при Z 40
23.04.86 при Z
JGL s



















Изобретение относится к кетонам, в частности к получению хиноновых , т производных (R4)-(CH2)ft-Јz гДе( А --С C(R)-C(0)-C(RI)C(R)-C(0) при R, R .Ј - одинаковые или различные каждый метил, метоксн или вместе образуют R1- метил; пиридил, имидаэолил; . СООН. СН2ОН, CHiOCOCH3; Z, - -С СН-СН С -S; -С6Н4-; R С Cjf CH-CH C-CH CH, где R - метил, Н,п 0-6; k 0,1; которые проявляют ингибирующее действие синтетазы тромбоксана Аг, антагонизм к рецептору тромбоксана А ингибирование 5 липоксигеназы и ак-- цептирование активных кислородных частиц. Цель - разработка способа по- лучения соединений, обладающих ука эанным действием. Получение ведут реакцией окисляющего агента с срединени ем I, где (ORx)-C(R2) г C(R4)-CH(RT)CR3. 14 табл. 2 fe
C,gH,7N02;
масло
1,63 (ЗН, d, J 3,0 Гц); 1,97 СЗН, S); 2,00 (6Н, S): 4,50 (1Н, guartet, I 6 Гц); 7,27 (1Н, dd, J 7.S ,,.5 Гц); 7,67 (1Н, dt, J 7,5 (f, 1,5 Гц): Я,45 (1Н, dd, J 4,, 1,5 Гц); 8,4/ (1(1, d, J 1,5 Гц).
Таблица 1
C27H2rN04, масло
C24H2,N04, 205-207°С
Ct5 l«N04l 199-201°С
, 82-84 С
1,30 (ЗН, с, J 7,0 Гц); 1,92 (6Н, S); 1,97 (ЗН, S); 2,03 (ЗН, S); 2,10 (ЗН, d, J 1,5 Гц); 4,25 (2Н, q, J 7,0 Гц); 5,90 (1Н, S); 7,17 (2Н, ABd, J 7,5 Гц); 7,37 (2Н, ABd, J 7,5 Гц); 7,50 (1Н, dt, J 7,5,, 1,5 Гц); 7,67 (1Н, т); 8,47 (JH, d, J 1,5 Гц); 8,50 (1Н, dd, J 5,1,5 Гц)
В лиметилсульфоксиде - d,.: 1,83(3H, S); 1,90 (ЗН, S); 1,93 (ЗН, 3, J 1,0 Гц); 2,50 (2Н, т); 2,70 (2Н, т); 5,80 (1Н, S); 7,03 (2Н. d, J 7,5 Гц); 7,18 (2Н, d, J - 7,5 Гц); 7,27 (1Н, dd, J 7,5о 4,5 Гц); 7,50 (1Н, dt, J 7,50, 1,5 Гц); 8,37 (211, т)
2,03 (6Н, S); 2,13 (ЗН,d, J 1,0 Гц);
5,90 (1Н, S); 7,17 (2Н,d, J 7,5 Гц);
7,30 (1Н, dd, J 7 ,-58,4,5 Гц); 7,40 (2Н, d, J 7,5 Гц); 7,60 (1Н, dt, J 7,5(9; 1,5 Гп);
7,77 (1Н, S); 8,47 (1Н,d, J 1,5 Гц);
8,57 (Ш, dd, J 4,5$,1,5 Гц); 10,40 (1Н, широкий S)
1,60 (2Н, т); 1,93 (ЗН, S); 1,97 (ЗН, S);
2,10 (2Н, S); 2,25 (2Н, т); 2,38 (2Н, с,
J 6,8 Гц); 4,30 (1Н, с, J 7,5 Гц);
7,27 (HI, dd, J 7,5 .
4,5 Гц); 7,75 (1H.dc, J 7,, 1,5 Гц);
7,80 (1Н, широкий S); 8,43 (1Н, dd, J 4,5и,
1,5 Гц); 8,53 (1Н, d, J 1,5 Гц)
масло
снгон
с„и„1го,,
104-105°С
Таблице
1,93 (ЗН, S), 2,00 (ЗН, S), 2,10 (ЗН,
S), 2,20 (2Н, т), 4,23 (1Н, с, J - 7,5 Гц), 7,20 (1Н, dd, J - 7,56,
4,5 Гц); 7,70 (1Н, dc, J - 7,5, 1,5 Гц);
8,40 (1H, dd, J - 4,5&, 1,5 Гц), 8,47
(1H, d, J - 1,5 Гц)
1,10-1,80 (4H, т), 1.93 (ЗН. S): 1,97 (ЗН, S): 2,08 (ЗН, S); 2,0027
снгосо
Me
С4, HtfN04, масло
10
соон
с н„но4,
68-69вС
11
снгон
С лЛ FNCXJ масло
СН2ОСОМе 6
, ftn-fti r
60-61е С
13
СООН6,9,12 С, H,j-N04,
126-127°С
14
ClyHlS.NOt, 66-67°С
15
С,Н„М02, 57-56°С
16
А,7.9
С,,Н,. 44-456С
Н
хлоргидрат
C,6H,gN02Cl 188-191°С
Н8
хлор гид-- рат
C,jH,6N02Cl, 164-167°С
Ib7b442
2Н Продолжение табл. 2
2,АО (2Н, m); 3,60 (2H, с, Л - 6,0 Гц); 4,23 (1Н, с, J - 7,5 Гц); 7,23 (1Н, dd, J - 7,5fi, 4,5 Гц); 7,70 (1Н, dc, J -7,5J, 1,5 Гц); 8,37 (1Н, dd, J 4,5$, 1,5 Гц); 8,47 (1Н, d, Л - 1,5 Гц)
1,20-1,80 (4Н, т); 1,97 (ЗН, S); 2,00 (ЗН, S); 2,03 (ЗН, S); 2,13 (3H.S); 2,00- 2,40 (2Н, га): 4,06 (2Н, с, J - 6,8 Гц); 4,27 (111, с, J - 7,5 Гц); 7,27 (1Н, dd, J - 7,5(9, 4,5 Гц); 7,75 (1Н, dc, J - 7,5#, 1,5 Гц), 8,47 (1Н, dd, J - 4,50, 1,5 Гц); 8,53 (Ш, d, J - 1,5 Гц)
1,0-1,80 (4Н, т); 1,97 (ЗН, S) ; 2,00 (ЗН, S); 2,13 (ЗН, S); 1,90-2,40 (2Н, т); 2,33 (2Н, С, J - 6,8 Гц); 4,23(1Н, с J -7,5 Гц); 7,27 (1Н, dd, J 7,5, 4,5 Гц) 7,77 (1Н, dt. J 7,5$, 1,5 Гц); 8,50
(1Н, dd, J ,5 , 1,5 Гц), 8,53 (1Н, d, J - 1,5 Гц); 8,80 (1Н, широкий S)
1,20-1,70 (6Н, га); 1,97 (ЗН, S); 2,00 (ЗН, S); 2,13 (ЗН, S); 2,00-2,40 (2Н, га); 3,60 (211, с, Л 6,0 Гц); 4,27 (1Н, с, Л -7,5 Гц); 7,25 (1Н, dd, J - 7,5&, 4,5 Гц) 7,75 (Ш, dc, J - 7,5, 1,5 Гц); 8,47 (1Н, dd, J - 4,5 Н$, 1,5 Гц); 8,53 (1Н, d, Л «
-1,5 Гц).
1,10-1,80 (6Н, т); 1,97 (ЗН, S); 2,00 (ЗН, S); 2,03 (Н, S); 2,13 (ЗН, S) ; 1,80-2,30 (2Н, га); 4,03 (2Н, с, J - 6,0 Гц); 4,23 (2Н, с, J - 7,5 Гц); 7,23 (1Н, Jd, J - 7,5 4,5 Гц); 7,73 (Ш, dc, Л - 7,5Ј, 1,5 Гц); 8,47 (Ш, dd, J - 4,Si1, 1,5 Гц); 8,53- (1Н,
d, Л - 1 ,5 Гц)
1,10-1,80 (611, т); 1,93 (ЗН, S);1,98 (ЗН, 2,13 (ЗН, S); 1,90-2,40 (2Н, п); 2,30 (2Н, Л 6,8 Гц); 4,23 (1Н, с, Л - 7,5 Гц); 7,2 (1Н, dd, Л 7,5$, 4,5 Гц); 7,80 (1Н, dc, -7,5,, 1,5 Гц), 8,47 (Ш, dd, Л 4,,
1,5 Гц); 8,53 (1Н, d, Л - 1,5 Гц); 9,85(1H
2,03 (6Н, S); 2,10 (ЗН, S); 3,87 (2Н, S); 7,20 (1Н, dd, Л - 4.5S, 7,5 Гц); 7,53 (1Н, dt, Л - 7,5Ј, 1,5 Гц), 8,47 (1Н, dd, Л
-4,5, 1,5 Гц); 8,52 (1Н, d, Л - 1,5 Гц)
0,93 (ЗН, с, Л « 7,5 Гц); 1,97 (ЗН, S); 2,00 (ЗН, S); 2,10 (6Н, S); 2,27 (2Н, g, Л -7,5 Гц); 4,17 (1Н, t, Л 7,5 Гц); 7,23 (1Н, dd. Л 7,5}, 4,5 Гц); 7,70 (1Н, dt.
с 7.5S, 1,5 Гц); 8,40 (1Н, dd, Л - 4,5, 1,5 Гц); 8,47 (1Н, d, Л 1,5 Гц)
0,87 (ЗН, с, Л - 6,0 Гц); 1,30 (ЮН, т); 1,95 (ЗН, S); 2,00 (ЗН, 5); 2,10 (2Н, S); 4,23 (Ш, с, Л 7,5 Гц); 7,18 (1Н, dd,. Л - 7,5$, 4,5 Гц); 7,70 (1Н, dtf; Л -7,ьЈ, 1,5 Гц); 8,40 (1Н, dd, Л 4,5$, 1,5 Гц); 8,48 (1Н, d, Л 1,5 Гц)
1,73 (3H, d, Л - 7,5 Гц); 1,90 (ЗН, S); 2,03 (ЗН, S); 2,20 (ЗН, S); 4,48 (1Н, q, Л 7,5 Гц); 7,93 (1Н, dd, Л - 7,5, 4,5 Гц); 8,40 (1Н, d, Л - 4,5 Гц); 8,67 (1Н, S); 8,70 (Ж, d, Л 4,5 Гц)
2,00(ЗН,S); 2,03 (ЗН, S); 4,10 (2Н, S);
7,92(1Н,dd, Л - 7,5$, 4,5 Гц); 8,36
(1Н,d, Л- 4,5 Гц); 8,70 (1Н, S); 8,75
(1Н,d, Л- 4,5 Гц)
ч с л н u i t
Примечание. Знаменатель представляет собой число используемых крыс, а числитель - число крыо$ прояв ляющих нарушение сердечной деятельности. Показатель испытания: X испытания, р 0,05; ,01.
Таблица 5
J3
Ih Таблица 7
Группа
Доза, мг/кг, перорально
Контрольная группа Соединение 130
Примечание. Каждая группа состояла из 5 опытов. Т - испытание по стьюденту: р 0,01.
Контроль,(вода
10 мл/кг/день пе-
рорально, п 7)
Полный белок в
моче, мг/100 г/24 ч 72 ±2870 17
Уринарный альбумин23 Ј10374-12
Сывороточный холес-
терин, мг/дл-Соединение 18 (50 мг/кг/день, перорально,
Полный белок в
моче, мг/100 г/
/24 ч76 ±28
55± 17 25 ±10
Уринарный альбумин28 ±14
Сывороточный холестерин, мг/дл
Примачание. Спаренный Т-тест по отношению к неличине до обработки рЈ0,05; р 0,01. Т-тест Стьюдента по отношению к контрольному значению ,05.
34
Период времени до по явления ишемнческого приступа Т, мин
122+20
Таблица 8
87 4-24
51 ±17 131 4- 39
55± 17 25 ±10
59±9
31 ±7
4
М
Контрольная группа (вода, 10 мл/кг/день, перорально, п 3)
Полный белок в моче,
мг/100 г/24 ч654 21
Уринарный альбумин
Группа соединения 18 (50 мг/кг/день, орально, п 4)
Полный белок в моче, мг/100 г/24 ч75428 374- 8 48 ±16
Уринарный альбумин
Примечание. Спаренный по отношению к величине до обработки, ,05.
Таблица Ю
Примечание. Среднее значение Ј стандартная ошибка.
U 46619: (5Z, 9оЈ, 1Ы, 13Е, 15S)-15- ,11(эпоксиметано)проста -5,13- диен-1-кислота.
Контроль: Среднее
Статистическая ошибка
Соединение 18, 100 мг/кг:
Среднее
Статистическая ошибка
176,16,684 1,749 0,774 0,949 0,694
3,8
4,2
0,166 0,033 0,017 0,038 0,032
170,36,347 1,579 0,709 0,872 0,673
0,222 0,106 0,023 0,025 0,030
Таблица 9
654 21
33 Ј15
60 ±20 744-9 31±15 3347
45±21
1715 24112
Таблица 11
0,166 0,033 0,017 0,038 0,032
0,222 0,106 0,023 0,025 0,030
Соединение 18, 300 мг/кг:
Среднее
Статистическая ошибка
162,06,2641,508 0,913 0,929 0,703
8,3
0,138 0,069 0,194 0,035 0,061
Контроль:
0,138 0,069 0,194 0,035 0,061
Продолжение тябл. II
39
1М (контроль)0,5±0,1 51±4
2М (соединение 18, 100 мг/кг/ /день)0,5± 0,0 47i 7
ЗМ (соединение
18, 300 мг/кг/ .
/день)0,4tO,1 41+140,2840,02 149± 2119t1
Ш (контроль) 111±27 57+612 ± 251 ± 103,44±0,Ю 1,65±0,07
2М (соединение 18, 100 мг/кг/ /день)86±22 574613± 144 i 53,43 ±0,05 1,,05
ЗМ (соединение 18, 300 мг/кг/ /день) 99+18 64f9I4i 152193,47 ±.0,13 1,73±0,07
Примечание. Приведена.химия крови (среднее ± стандартное отклонение).
Продолжение табл. 12
0,32 + 0,04 1981312041
0,27+0,03 194±3220+1
Селезенка
Расширение красно пульпы
Конгестия (расширение синуса)
Эк страмедулляр-- ный гепопоэз
Атрофия белой пульпы
Печень, изменение паренхим альных клеток
Почка
Расширение лоханки
Сердце
Изменение кардиал ных клеток
Легкое Изменение Костный мозг
Разрастание эритро- Власта
Примечание. Значение оценки: - - отрицательно; + - слабая, ++ - умеренная, - сильная. Крыса Мб умерла
ввиду ошибки в введении во время опыта. Использовали самцов крыс з возрасте 5 нед, они получали орально соединение 18 в течение 2 нед. Контрольные ;:рысы получали раствор аравийской камеди при дозе 10 мл на кг веса тела.
/
Н3с уусн3
H3C Sr4CH-(CH2)}1-R5 ° Rl
А (соеди- - нение 13) N
COOH48
Таблица 14
87
94
| Shi bouta et Biochera Pharmacol, 1979, 28,3601 | |||
| Oxawa et al Annalytical Uiochera, 1979, 95,551 | |||
| ЩЕКОВАЯ ДРОБИЛКА | 0 |
|
SU171251A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1991-09-07—Публикация
1987-01-29—Подача