Изобретение относится к медицинской вирусологии, в частности к разработке диагностических и лечебно-профилактических препаратов.
Цель изобретения - получение высокорепродуктивного штамма ротавируса человека (РВЧ).
Штамм депонирован в Государственном центре патогенных микроорганизмов МЗ СССР (Вирусы), номер депонента ГКВ №2172.
Характеристика штамма.
Название вируса штамма: ротавирус человека, штамм Минск-86.
Место в универсальной системе: семейство ротавирусов, род ротавирусов, ротави- русы человека.
Штамм выделен из фекалий ребенка с диагнозом острой кишечной инфекции.
Физико-химические свойства: криптограмма, размер 65-70 нм, РНК двухцепочечная.
Генетические признаки: геном, сегментированный из 11 сегментов, так называемый длинный электрофоретип.
Прочие свойства: адаптирован в культуре клеток МА-104, вызывает ЦПЭ через 2 сут после инфицирования, не агглютинирует эритроциты морской свинки и человека.
Антигенные свойства. В тестах иммуно- ферментного анализа, встречного иммуноэ- лектроосмофореза, иммуноэлектронной микроскопии отмечается специфическое взаимодействие с иммунными поликлональOs00 VJ Os
CJ
ными сыворотками к штаммам Wa, SA 11 ротавирусов; в иммуноферментном анализе к 4 и более раз активнее с гомологичной антисывороткой, чем штамм Wa с антисывороткой к штамму Минск-86.
Эпидемический штамм ротааируса человека Минск-86 адаптирован к пе ревиваемой культуре клеток МА-104. По своим свойствам шгамм отличается от других штаммов: ротавируса человека Wa и обезьян SA-11, Штамм Минск-86 характеризуется высокой репродукционной способностью (10 -10 ) и может быть использован при разработке и производстве диагностических и лечебно-профилактических препаратов.
Ниже приведены примеры, иллюстрирующие способ получения штамма Минск- 86 и анализ его свойств.
П р и м е р 1. Выделение вируса, адаптация к культуре клеток МА-104.
Выделение вируса. Обработанную фре- оном-113 10%-ную суспензию фекалий, приготовленную на растворе Хенкса, центрифугируют при 3000 об/мин в течение 30 мин +4°С. С целью дополнительной очистки суспензии ее центрифугируют при 6000 об/мин 30 мин. Надосадочную жидкость переносят в стерильные флаконы и хранят при -20°С. Наличие вируса в суспензии подтверждают методами ЭМ, ВИЭ- 0В (электронная микроскопия, встроечный иммуноосмоэлектрофорез).
Адаптация к культуре клеток МА-104. Пенициллиновые фпаконы с перевиваемой 4-дневной культурой клеток МА-104 промывают солевым растиором Хенкса для удаления остатков сыворотки ростовой среды. На выросший слой клеток вносят по 0,2 мл 10%- ной суспензии фекалий, обработанной смесью антибиотиков (100 ед/мл пенициллина, 100 мг/мл стрептомицина), а также трипсин (5 мкг/мл) и инкубируют в течение 30 мин. Флаконы центрифугируют в угловом роторе при 1000 об/мин 1 ч. Затем содержимое флаконов сливают и вносят по 1,0 мл поддерживающей среды (смесь равных обь- емов среды 199 и среды Игла с добавлением трипсина (2,5 мкг/мл). Флаконы помещают в роллерную установку и инкубируют при 37°С в течение 2-3 сут. О репродукции вируса судят по ЦПЭ (цитопатическому эффекту). Содержимое пенфлаконов 2-кратно замораживают-оттаивают (для разрушения клеток), полученные лизаты в дальнейшем используют для следующего пассажа в культуре клеток (по опис энному методу), а также для определения титра вируса. По данным электронной микроскопии в полученных клеточных лизагах обнаруживают вирионы
диаметром 65 70 им с характерной для ротавирусов структурой Проведенные расчеты показывают, чго концентрация пирионов в кульгуральной среде достигает 10 lg/мл.
Большинство вирусных частиц имеет не
проницаемую для контрастирующего вещества сердцевину, однако у части из них оно заполняет центр вириона, свидетельствуя о принадлежности к так называемым пустым неинфекционным частицам.
П р и м е р 2. Определение титра вируса.
Для определения титра вируса в полученной таким образом вируссодержащей
культуральной жидкости готовят ряд десятикратных разведений от 10 до 10 (на растворе Хенкса). Титрование проводят на пенициллиновых флаконах с перевиваемой 4-дневной культурой клеток МА-104. Культивирование проводят по схеме, изложенной в примере 1, использованной для адаптации вируса, за исключением того, что для заражения вносят по 0,1 мл каждого разведения вируса. Титр вируса определяют на 4 сут по
ЦПЭ.
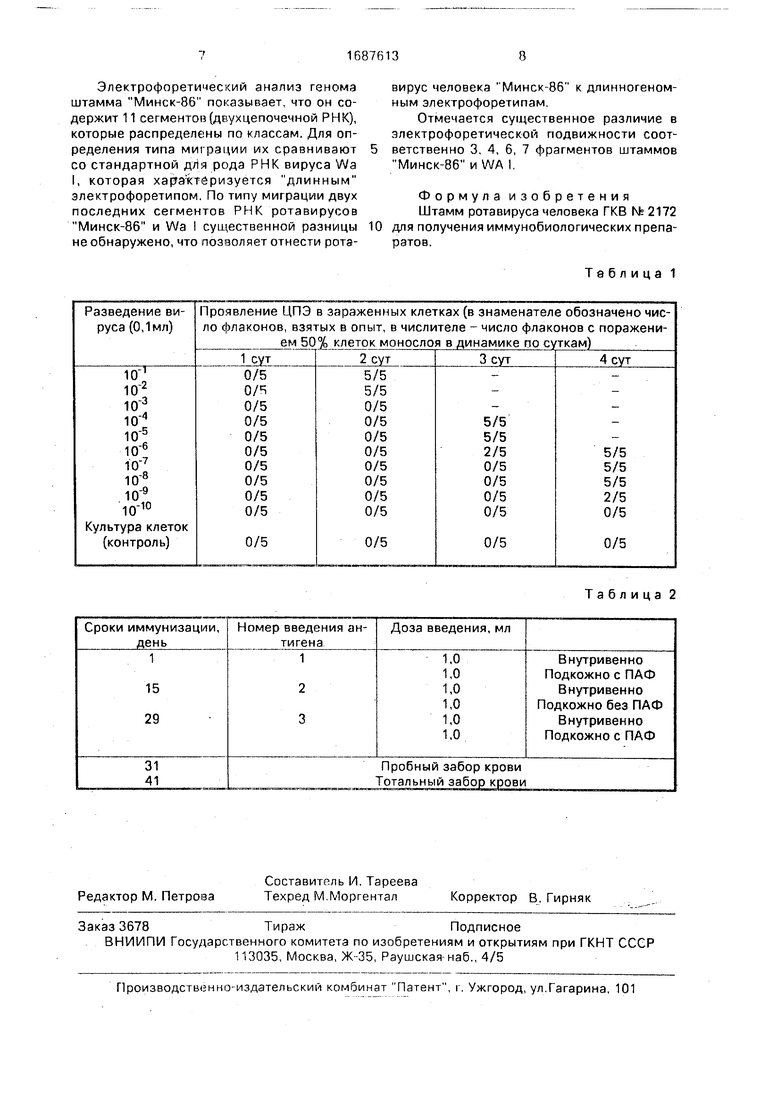
В табл.1 приведены результаты титрования инфекционной активности штамма Минск-86 ротавируса человека. ТЦДвов 1 ,96±0,18.
ТЦД50 рассчитывают статистически по
Риду и Менчу в модификации Кербера. Расчеты выполняют по программе WF.
П р и м е р 3. Определение гемагглюти- нирующей способности вируса Минск-86.
Реакция гемагглютинации РГА. Ставят реакцию с 0,5% эритроцитами морской свинки и 0 (1) группы крови человека на 0,5 М фосфатном буфере (ФСБ) по общепринятой методике, В качестве положительного контроля применяют штамм ротавируса обезьян (SA-11), сконцентрированный в 100 раз, В сравнительных опытах со штаммами Минск-86 и SA-11 ротавируса обезьян установлено, что в отличие от SA-11 выделенный штамм не вызывает агглютинации 0.5%-ной взвеси эритроцитов человека и морской свинки.
П р и м е р 4. Изучение антигенных
0 свойств штамма РВЧ Минск-86.
а. Антигенные свойства штамма Минск-86 исследуют с помощью иммунной электронной микроскопии. Для проведения иммунной электронной микроскопии
5 готовят следующие разведения ряда иммунных сывороток: 1/10 1/50, 1/100, 1/1000. Полученные разведения сывороток смешивают с вирусной суспензией в соотношении 10:1 соответственно и оставляют на 1 ч при комнатной темпер-муре После этого проводят негативное контрастирование образовавшихся иммунных комплексов. В качестве контрольной используют нормальную сыворотку морской свинки.
Иммунная микроскопия показывает, что иммунные сыворотки (как полученные на РВ SA-11, так и на штамм Минск-86) в разведениях 1:50-1:1000 образовывают специфические иммунные комплексы (вероятно из-за наличия общих антигенных групп). Но иммунная сыворотка, взятая в качестве отрицательного контроля, специфического комплексообразования не дает со штаммом РВЧ Минск-86.
б.Антигенную активность штамма РВЧ Минск-86 изучают также методом встречного иммуноэлектроосмофореза (ВИЭОФ). С помощью ВЙЭОФ исследуют штамм, а также сыворотки морской свинки, иммунизированной этим штаммом. В качестве положительного контроля применяют:
1.Антиген - сконцентрированный в 100 раз рота вирус обезьян SA-11.
2.Антитела - сыворотки морских свинок, иммунизированных культуральным РВ АГ из штамма SA-11.
ВИЭОФ проводят на 1%-ном геле ага- розы в веронал-мединаловом буферном растворе (рН 8,8, ионная сила 0,025).
ВИЭОФ между штаммом Минск-86 и гомологичной сывороткой, а также сывороткой, полученной на вирус SA-11, дает четкие линии преципитации, специфичность которых подтверждается отсутствием таких преципитатов при взаимодействии неиммунных сывороток с вирусом и иммунных - с культурой клеток, на которой репродуцируется вирус. Титр сывороток в этой реакции составляет 1:64-1:128.
в.Создание тест-системы для твердофазного иммуноферментного анализа на ос- нове штамма ротавируса человека Минск-86.
Основные компоненты системы: рота- вирусный антиген, специфическая антиро- тавирусная сыворотка, иммуноглобулин, используемый для сенсибилизации твердой фазы, антиротавирусный пероксидазный коньюгат.
Ротавирусный антиген. Используют ви- руссодержащую взвесь на основе штамма Минск-86, адаптированного к культуре клеток МА-104.
Культуру клеток МА-104 выращивают роллерным способом в 0,5-литровых флаконах до образования полного монослоя. Ви- руссодержащую жидкость перед заражением обрабатывают трипсином в конечной концентрации 5 мкг/мл и инкубируют при комнатной температуре. Из флаконов сливают
среду роста, а монослой трижды промывают раствором Хенкса.
Вируссодержащую жидкость вносят в каждый флакон в разведении 10 -10 по 5 10 мл и инкубируют в термостате 1 ч при 37°С в роллерной установке. Содержимое сливают и вносят по 50 мл поддерживающей среды (среда Игла и среда 199 в равном соотношении с добавлением 2,5 мкг/мл
10 трипсина, 100ед/мл пенициллина, 100 мкг/мл стрептомицина, 0,03% L-глютамина). Зараженную культуру инкубируют при 37°С в течение 48 ч до появления максимального цитопатического эффекта (поражение 905 100% клеток). Флаконы подвергают 3-кратному замораживанию-оттаиванию для разрушения клеток. Обломки клеток удаляют низкоскоростным центрифугированием при 3000 и 6000 об/мин (по 30 мин), получен0 ную надосадочную жидкость используют для дальнейшей работы.
Специфическую антиротавирусную сыворотку получают путем гипериммунизации кроликов ротавирусным антигеном (табл.2).
5 Для иммунизации вируссодержащую суспензию концентрируют, добавляя 8% поли- этиленгликоля (М. 6000) и 0,15 М NaCI. Инкубируют 18ч при 4°С, после чего центрифугируют при 6000 об/мин 30 мин. Оса0 док ресуспензируют в 1/1000 объема исходного количества вируссодержащей суспензии.
В табл.2 приведена схема гипериммунизации,
5 Выделение антиротавирусного иммуноглобулина проводят осаждением риванолом и сульфатом аммония по общепринятым методикам.
П р и м е р 5. Определение электрофо0 ретической подвижности фрагментов генома штамма РВЧ Минск-86.
Выделение вирусной РНК. Для выделения нуклеиновых кислот (после удаления клеточного дебриса центрифугированием
5 при 8000 об/мин 10 мин) очищенную вирусную суспензию обрабатывают 1%-ным до- децилсульфатом натрия в течение 10 мин при интенсивном перемешивании. Последующими экстракциями водонасыщенным
0 раствором фенола, хлороформом и эфиром проводят депротеинизацию. Полученный препарат РНК хранят при 4°С.
Электрофорез РНК в полиакриламид- 5 ном геле. Фрагменты РНК ротавирусов раз- . деляют с помощью электрофореза в 7,5 - 10%-ном разделяющем полиакриламидном геле в прерывистой системе по Лемли при силе тока 10 мА в течение 16ч. Гель окрашивают раствором серебра.
Электрофоретический анализ генома штамма Минск-86 показывает, что он содержит 11 сегментов(двухцепочечной РНК), которые распределены по классам. Для определения типа миграции их сравнивают со стандартной дл я рода РНК вируса Wa I, которая характеризуется длинным электрофоретипом. По типу миграции двух последних сегментов РНК ротавирусов Минск-86 и Wa I существенной разницы не обнаружено, что позволяет отнести ротавирус человека Минск-86 к длинногеном- ным электрофоретипам.
Отмечается существенное различие в электрофоретической подвижности соот- ветственно 3. 4, 6, 7 фрагментов штаммов Минск-86 и WA I.
Формула изобретения Штамм ротавируса человека ГКВ № 2172 для получения иммунобиологических препаратов.
Таблица 1


| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ РОТАВИРУСА ЧЕЛОВЕКА ДЛЯ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ СЫВОРОТОК | 1991 |
|
RU2026345C1 |
| Способ адаптации ротавируса группы А человека к росту на перевиваемых культурах клеток животных | 2018 |
|
RU2692604C1 |
| Штамм-реассортант аренавирусов Ласса и Мопейя для получения иммунобиологических препаратов | 1991 |
|
SU1778176A1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЭШЕРИХИОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2403063C1 |
| МЕТОД ПЕРВИЧНОЙ ИЗОЛЯЦИИ ШТАММОВ ВИРУСА ГРИППА A, ШТАММ VIRUS A/DUCK/NOVOSIBIRSK/56/05 H5N1 ДЛЯ ПРИГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ, ПРОФИЛАКТИЧЕСКИХ И ЛЕЧЕБНЫХ ПРЕПАРАТОВ, ДЛЯ ОЦЕНКИ ПРОТИВОВИРУСНОЙ АКТИВНОСТИ РАЗЛИЧНЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2309983C2 |
| ШТАММ ВИРУСА ГЕПАТИТА А ДЛЯ ПРИГОТОВЛЕНИЯ ВАКЦИННЫХ И ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2008 |
|
RU2405037C2 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ПАРАГРИППА-3, ВИРУСНОЙ ДИАРЕИ, РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ, РОТА- И КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395298C1 |
| ШТАММ РОТАВИРУСА ПТИЦ ДЛЯ ПРОИЗВОДСТВА ДИАГНОСТИКУМОВ | 1995 |
|
RU2078821C1 |
| Штамм вируса геморрагической лихорадки с почечным синдромом 2-го серотипа, используемый для специфической лабораторной диагностики | 1985 |
|
SU1319554A1 |
| Способ инактивации культурального ротавируса человека | 2019 |
|
RU2738404C1 |
Изобретение относится к медицинской вирусологии, в частности к разработке диагностических и лечебно-профилактических препаратов. Цель изобретения - получение высокорепродуктивного штамма ро- тавируса человека. Ротавирус человека Минск-86 характеризуется следующими свойствами: размер 65-70 нм, геном - двухцепочечная сегментированная (11 фрагментов) РНК. Вирус не обладает ге- магглютипирующей активностью. Штамм Минск-86 характеризуется высокой репродуктивной способностью - титр 109-1010 ГЦДбо/мл. Штамм депонирован в Государственном центре патогенных микроорганизмов МЗ СССР (Вирусы), номер депонента ГКВ Ns 2172. 2 табл. Ё
Таблица 2
| Букринская А.Г | |||
| и др | |||
| Морфологическая характеристика ротавирусов и структура их генома | |||
| - Вопр | |||
| вир., 1986, № 2, 190-197 | |||
| Васильева В И | |||
| и др | |||
| Выделение ротави- руса человека на культуре клеток почек зеленых мартышек | |||
| - Вопр | |||
| вир., 1986, № 3, с | |||
| Способ приготовления искусственной массы из продуктов конденсации фенолов с альдегидами | 1920 |
|
SU360A1 |
Авторы
Даты
1991-10-30—Публикация
1989-12-19—Подача