Изобретение относится к химии соединений хинуклидинового ряда, в частности к новым гидрохлоридам производных 3-замещенного хинуклидина общей формулы I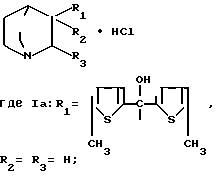 ,
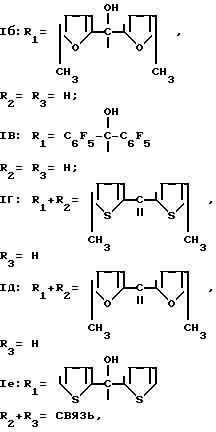
,
обладающим антисекреторной и противоязвенной активностью.
Целью изобретения является выявление в ряду производных хинуклидина веществ, обладающих высокой антисекреторной и противоязвенной активностью.
Пример 1. Получение гидрохлорида (хинуклидин-3)-ди-(5-метилтиенил-2)карбинола (Ia).
а) Получение (хинуклидил-3-)-ди-(5-диметилтиенил-2)карбинола.
К эфирному раствору 0,22 моль бутиллития, полученному из 5,45 г (0,78 г-ат) лития и 29,4 г (0,32 моль) н-бутилхлорида в 160 мл безводного эфира, в атмосфере аргона при 0 - 5oC и интенсивном перемешивании прибавляют 24 г (0,24 моль) 2-метилтиофена. Затем смесь перемешивают еще 15 мин при комнатной температуре. Охлаждают до (-60)-(-50)oC и в течение 1 ч прибавляют раствор 22,35 г (0,12 моль) 3-карбэтоксихинуклидина в 45 мл безводного эфира, перемешивают еще 30 мин и разлагают реакционную массу 250 мл воды при 10 - 15oC.
Осадок полученного основания отфильтровывают и промывают водой (2x100 мл) и 50%-ным водным ацетоном (2x50 мл).
Получают 21,3 г (46,5%) технического основания, которое перекристаллизовывают из смеси 1 л ацетона и 100 мл 96%-ного этанола с 2 г активированного угля.
Получают 14,8 г (70,5%) (хинуклидил-3)-ди-(5-метилтиенил-2) карбинола в виде бесцветных кристаллов с т.пл. 155 - 156oC.
б) Получение целевого продукта Ia.
Полученное основание кипятят (14,8 г) с 1,5 г активированного угля в 500 мл 96%-ного этанола, полученный раствор фильтруют, охлаждают до 10 - 15oC, подкисляют соляной кислотой до pH 5 - 6, выдерживают 15 ч при 0oC. Образующийся осадок отфильтровывают.
Получают 15,1 г (92%) соединения Ia, которое очищают повторной перекристаллизацией из 500 мл безводного этанола с 1,5 г активированного угля.
Получают 6,8 г (45%) гидрохлорида (хинуклидил-3)-ди-(5-метилтиенил-2) карбинола, свойства которого приведены в табл.1.
Пример 2. Получение гидрохлорида (хинуклидил-3)-ди-(5-метилфурил-2) карбинола (Iб).
а) Получение (хинуклидил-3)-ди-(5-метилфурил-2)карбинола.
Смесь 85,85 г (1,05 моль) 2-метилфурана и 45,7 г (0,45 моль) триэтиламина, очищенных перегонкой над натрием, при (-10)-(-5)oC и перемешивании прибавляют к эфирному раствору 0,7 моль н-бутиллития. Смесь выдерживают 1 ч при комнатной температуре, охлаждают до 5 - 8oC и за 2 ч прибавляют раствор 62,3 г (0,34 моль) 3-карбэтоксихинуклидина в 100 мл безводного эфира, перемешивают 2 ч при 5 - 8oC. Смесь выдерживают 15 ч при комнатной температуре.
После обработки реакционной смеси по примеру 1а получают 61,5 г (60%) технического основания (хинуклидил-3)-ди-(5-метилфурил-2)карбинола. 14 г этого основания перекристаллизовывают из 300 мл ацетона с 1,5 г активированного угля.
Получают 11 г (78,6%) (хинуклидил-3)-ди-(5-метилфурил-2)карбинола, т.пл. 148 - 149oC (после трехкратной перекристаллизации из ацетона).
б) Получение целевого продукта Iб.
Полученное основание (11 г) растворяют в 55 мл безводного этанола, подкисляют спиртовым раствором хлористого водорода по примеру Iб.
Получают 10,3 г (83,5%) гидрохлорида (хинуклидил-3)-ди-(5-метилфурил-2)карбинола (см. табл.1).
Пример 3. Получение гидрохлорида (хинуклидил-3)дипентафторфенилкарбинола (Iв).
а) Получение (хинуклидил-3)дипентафторфенилкарбинола.
К эфирному раствору н-бутиллития (0,127 моль), полученному по примеру 1, добавляют раствор 23,52 г (0,14 моль) пентафторбензола в 50 мл эфира при (-55) - (-50)oC и перемешивании. Смесь выдерживают при этой температуре 15 мин. Затем прибавляют раствор 11,82 г (0,065 моль) 3-карбэтоксихинуклидина в 20 мл эфира в течение 15 мин и снова выдерживают при (-55) - (-50)oC 15 мин. Затем дают смеси нагреться до 0oC, после чего ее разлагают 100 мл воды.
Образующийся осадок отфильтровывают, промывают 50 мл эфира и 50 мл волы.
Получают 12,5 г (41%) технического (хинуклидил-3)дипентафторфенилкарбинола с т. пл. 115 - 120oC.
б) Получение целевого продукта Iв.
4,73 г (0,01 моль) полученного основания суспендируют в 25 мл метанола и при интенсивном перемешивании добавляют спиртовый раствор хлористого водорода до pH 5 - 6. К образовавшемуся гомогенному раствору прибавляют 100 мл безводного эфира. Смесь выдерживают 18 ч при 0oC и выпавший осадок отфильтровывают.
Получают 3,54 г (69%) соединения Iв, которое очищают растворением в 28 мл метанола с последующим осаждением 130 мл безводного эфира.
Получают 3,05 г (86%) гидрохлорида (хинуклидил-3)дипентафторфенилкарбинола (см. табл.1).
Пример 4. Получение гидрохлорида 3-[ди(5-метилтиенил-2)метилен]хинуклидина (Iг).
8,8 г гидрохлорида (хинуклидил-3)-ди-(5-метилтиенил-2)карбинола, 160 мл этанола, 80 мл воды и 20 мл 20%-ной соляной кислоты кипятят 2 ч, упаривают до половины объема, выдерживают 48 ч при 0oC и отделяют осадок.
Получают 7,6 г (86%) соединения I г с т.пл. 243 - 246oC.
4,1 г полученного вещества перекристаллизовывают из 100 мл 96%-ного этанола в присутствии 0,4 г активированного угля.
Получают 3,1 г (76%) гидрохлорида 3-[ди(5-метилтиенил-2)метилен]хинуклидина (см. табл.1).
Пример 5. Получение гидрохлорида 3-[ди(5-метилфурил-2)метилен] хинуклидина (Iд).
6,02 г гидрохлорида (хинуклидил-3)-ди(5-метилфурил-2)карбинола растворяют в 320 мл изопропанола при кипячении, подкисляют соляной кислотой до pH 2 - 2,5 и кипятят 1 ч. Смесь охлаждают до 20 - 30oC, прибавляют 320 мл ацетона, выдерживают 17 ч при 0oC и осадок отделяют. Получают 5,63 г (88%) соединения I д.
4,5 г полученного вещества перекристаллизовывают из 8 мл безводного этанола в присутствии 0,4 г активированного угля.
Получают 2,7 г (60%) гидрохлорида 3-[ди(5-метилфурил-2)метилен]хинуклидина (см. табл.1).
Пример 6. Получение гидрохлорида ( Δ2 -дегидрохинуклидил-3)-ди-(тиенил-2)карбинола (Iа).
а) Получение ( Δ2 -дегидрохинуклидил-3)-ди-(тиенил-2)карбинола.
К эфирному раствору 0,29 моль н-бутиллития, полученному по примеру 1, при 0 - 5oC и перемешивании прибавляют 82,8 г тиофеновой фракции, содержащей 0,31 моль тиофена, выдерживают 15 мин при комнатной температуре, охлаждают до (-40) - (-35)oC и в течение 30 мин прибавляют раствор 20,65 г (0,11 моль) Δ2 -дегидро-3-карбэтоксихинуклидина в 40 мл эфира. Смесь выдерживают 20 мин, дают температуре подняться до комнатной и далее обрабатывают по примеру Iа.
Получают 28 г (84%) основания с т.пл. 198 - 204oC, которое очищают перекристаллизацией из 1,05 л безводного этанола с добавкой 2,8 г активированного угля.
Получают 21 г (75%) ( Δ2 -дегидрохинуклидил-3)-ди-(тиенил-2)карбинола с т.пл. 214 - 215oC.
б) Получение целевого продукта Iе.
Полученное основание 12,5 г (0,04 моль) кипятят с 1,3 г активированного угля в 570 мл безводного этанола, фильтруют, охлаждают до 25 - 30oC и подкисляют спиртовым раствором хлористого водорода до pH 6 - 7. Смесь выдерживают 2 ч при 0oC и отделяют образовавшийся осадок.
Получают 9,73 г (70%) гидрохлорида ( Δ2 -дегидрохинуклидил-3)-ди-(тиенил-2)карбинола (см. табл. 1).
Исследование антисекреторной активности проводят на крысах-самцах массой 160 - 200 г по методу Шая. Исследование противоязвенной активности проводят на крысах-самцах массой 160 - 180 г на моделях язвенного повреждения желудка, вызванных:
- введением внутрибрюшинно 300 мг/кг гистамина,
- введением в желудок 1 мл абсолютного этанола.
ЛД50 определяют на мышах-самцах массой 16 - 18 г при введении в желудок и рассчитывают по методу Литчфилда-Уилкоксона.
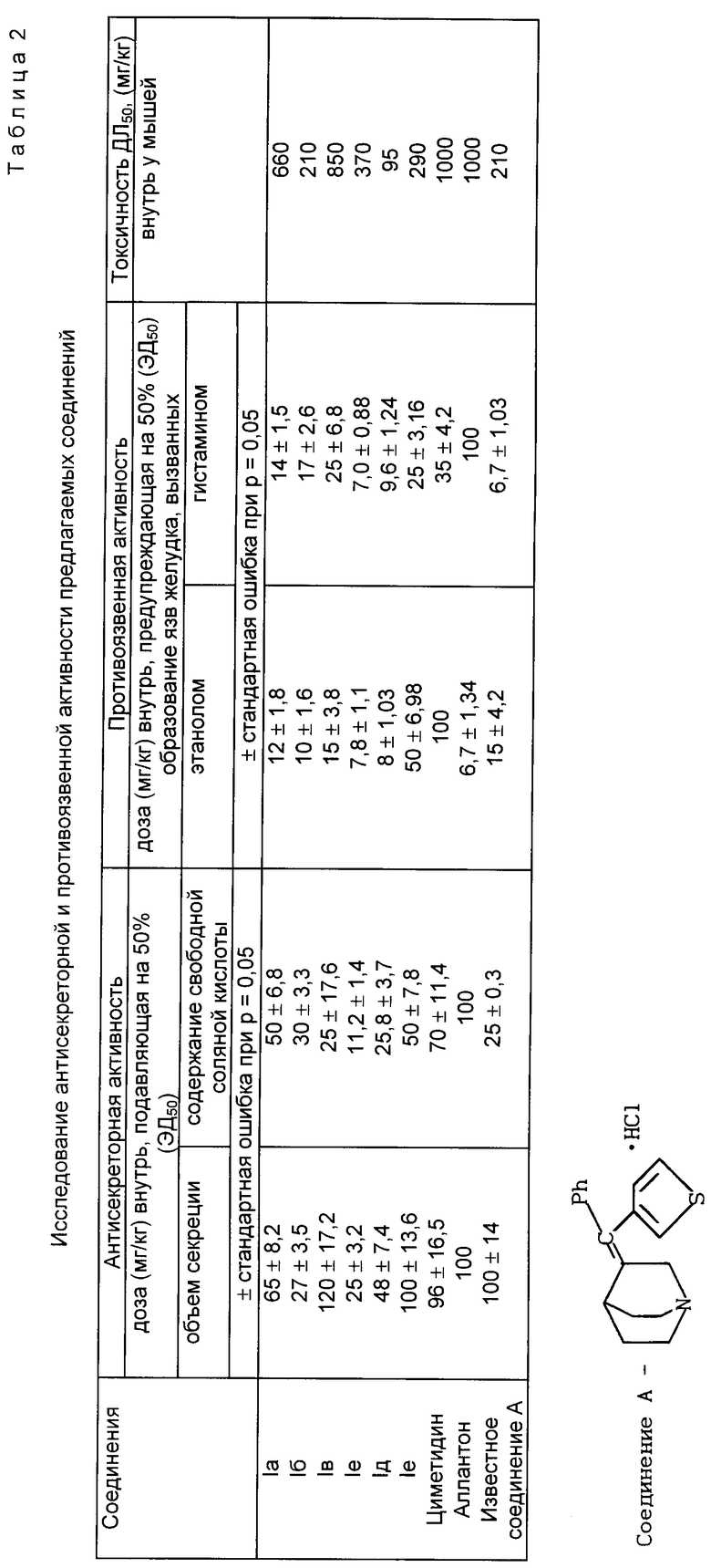
Соединения Iа-е по антисекреторной и противоязвенной активности сравнивают с известным зарубежным препаратом циметидином, относящимся к производным имидазола, и отечественным гастропротективным (гастрозащитным) препаратом аллантоном (препарат из корней девисила высокого).
Результаты сравнительных исследований антисекреторной и противоязвенной активности предлагаемых соединений и названных лекарственных препаратов представлены в табл.2.
Каждое соединение изучают в 3-4 дозах. Каждую дозу каждого препарата вводят 5 - 6 животным.
На основании полученных экспериментальных результатов рассчитывают величину ЭД50 (эффективная доза, при которой на 50% подавляется секреция и предотвращается образование язвенных повреждений слизистой оболочки желудка) и стандартную ошибку средней арифметической этой дозы.
В результате исследования установлено, что все соединения оказывают антисекреторное действие.
По влиянию на объем желудочной секреции соединения Iа,б,г,д в 1,5 - 4 раза эффективнее циметидина, аллантона и известного соединения А (см. табл. 2). Соединение Iв проявляет такую же активность, как эталонные препараты, и не отличается от известного соединения A.
Все соединения Iа-е снижают содержание свободной соляной кислоты в желудочном соке и превосходят по этому показателю циметидин и аллантон. Причем наибольшую активность проявляет соединение I г, эффект которого в шесть раз сильнее, чем у циметидина, и в 2 раза, чем у известного соединения A.
Соединения предупреждают образования язв желудка у крыс после введения (1 мл в желудок) абсолютного этанола (проявляют защитные свойства в отношении слизистой оболочки желудка, т.е. обладают гастропротективным действием) и в этом случае превосходят циметидин в 2 - 12,5 раза, а соединения 1 г и д не уступают аллантону - специфическому гастропротектору и в два раза эффективнее известного соединения A.
На модели язв желудка, вызванных внутрибрюшинным введением гистамина у крыс, соединения Iа-е превосходят по активности в 1,4 - 5 раз циметидин, более чем в 1,4 - 14 раз аллантон. Соединение 1г по этому показателю не уступает известному соединению A.
Ниже приведены результаты исследований токсичности предлагаемых соединений.
Соединения Iа,в,г обладают в 1,5 - 4 раза меньшей токсичностью, чем известное соединение A. По классификации токсичности химических веществ соединения Iа и в можно отнести так же, как циметидин и аллантон, к малотоксичным, а соединения 1б,г,д,е по этой же классификации к группе умеренно токсичных веществ, как и известное соединение A.
Таким образом, предлагаемые соединения или близки по противоязвенной активности (1г и д) к известному соединению A или превосходит (Iа,б,в,е) циметидин и аллантон, а также обладают более широким, чем циметидин (не предупреждает образования язв желудка, вызванных этанолом абсолютным) и аллантон (не защищает слизистую от воздействия гистамина), спектром этого действия.
Кроме того, соединения 1а, б, в, д, е либо близки по антисекреторной активности к известному соединению A или превосходят (1г) его, а также все соединения I обладают более сильным ингибирующим действием на желудочную секрецию, чем циметидин и аллантон. В связи с этим можно предполагать возможность создания препаратов в ряду производных 3-замещенного хинуклидина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОХЛОРИДЫ ПРОИЗВОДНЫХ 3-ДИАРИЛ(АРИЛГЕТЕРОАРИЛ)МЕТИЛЕНХИНУКЛИДИНА, ОБЛАДАЮЩИЕ АНТИСЕКРЕТОРНОЙ И ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 1986 |
|
SU1365678A1 |
| Средство, обладающее противоязвенной активностью | 1988 |
|
SU1831338A3 |
| (3aR,4aS,8aR,9aR,E)-3-АРИЛИДЕН-8a-МЕТИЛ-5-МЕТИЛЕН-ДЕКАГИДРОНАФТО[2,3-b]ФУРАН-2(3Н)-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2413724C1 |
| 13-Е-(2,4-ДИОКСО-1,2,3,4-ТЕТРАГИДРОПИРИМИДИН-5-ИЛ) ЭВДЕСМАНОЛИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2536870C1 |
| НИТРАТНЫЕ СОЛИ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1999 |
|
RU2228331C2 |
| Способ получения производных пиримидина или их фармацевтически приемлемых солей | 1982 |
|
SU1195906A3 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРО-2-НАФТИЛАМИНА | 1990 |
|
RU2086535C1 |
| 2-САХАРИНИЛМЕТИЛГЕТЕРОЦИКЛИЧЕСКИЕ КАРБОКСИЛАТЫ ИЛИ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ ЭТИХ СОЕДИНЕНИЙ ОСНОВНОГО ХАРАКТЕРА ИЛИ ОСНОВНО-АДДИТИВНЫЕ СОЛИ ЭТИХ СОЕДИНЕНИЙ КИСЛОТНОГО ХАРАКТЕРА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ АКТИВНОСТЬ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1992 |
|
RU2078081C1 |
| ПРОИЗВОДНЫЕ 3-ТРИФТОРМЕТИЛ-1-КАРБА-1-ДЕТИА-3-ЦЕФЕМ-4-КАРБОНОВОЙ КИСЛОТЫ И ПРОМЕЖУТОЧНЫЙ ПРОДУКТ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2089551C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛА | 2000 |
|
RU2176243C2 |

Изобретение касается гетероциклических соединений, в частности гидрохлоридов (хинуклидил-3)-ди-(5-метилтиенил-2, или 5-метилфурил-2, или пентафторфенил)карбинола, или 3-[ди-(5-метил-2 или 5-метилфурил-2-)метилен]хинуклидина, или Δ2 -дегидрохинуклидил-3)-ди-(тиенил-2)карбинола, обладающих антисекреторной и противоязвенной активностью, что может быть использовано в медицине. Цель - создание новых более активных соединений указанного класса. Синтез ведут реакцией н-бутиллития с 3-карбэтоксихинуклидином или Δ2 - дигидро-3-карбоэтоксихинукдидином и 2-метилтиофеном, или 2-метилфураном в присутствии триэтиламина или пентафторбензолом, или тиофеном в среде органического растворителя с последующей обработкой полученного соединения спиртовым раствором HCl, или при необходимости полученное целевое соединение растворяют в изопропаноле или водном этаноле, подкисляют HCl и кипятят 1 - 2 ч. Выход, %, т. пл. oC, брутто-ф-ла: а) 13,6, 240 (разл.), C18H23NOS2 • HCl; б) 30,9, 210 (разл.), C18H23NO3•HCl; в) 24,3, 80 (разл.); C20H13NOF10 • HCl; г) 65,4, 253, C18H21NS2 • HCl; д) 52,8, 209, C18H21NO2 • HCl; е) 44,1, 160 (разл. ), C16H17NOS2 • HCl. Новые соединения при ЛД50 = 95 - 850 мг/кг по противоязвенной и антисекреторной активности или близки, или превосходят структурный аналог: циметидин и аллантон. 2 табл.
Гидрохлориды производных 3-замещенного хинуклидина общей формулы I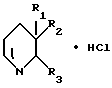
где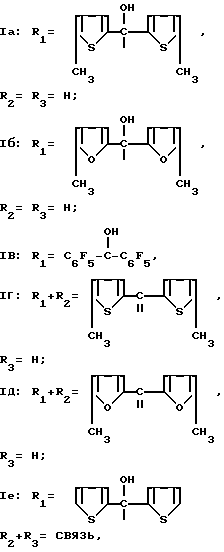
обладающие антисекреторной и противоязвенной активностью.
| ГИДРОХЛОРИДЫ ПРОИЗВОДНЫХ 3-ДИАРИЛ(АРИЛГЕТЕРОАРИЛ)МЕТИЛЕНХИНУКЛИДИНА, ОБЛАДАЮЩИЕ АНТИСЕКРЕТОРНОЙ И ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 1986 |
|
SU1365678A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-03-20—Публикация
1989-03-03—Подача