ел С

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 2-замещенных производных 4Н-1-бензопиран-4-она | 1990 |
|
SU1721052A1 |
| НОВЫЕ СПОСОБЫ ПОЛУЧЕНИЯ ПРОПАН-1-СУЛЬФОНОВОЙ КИСЛОТЫ {3-[5-(4-ХЛОР-ФЕНИЛ)-1Н-ПИРРОЛО[2,3-b]ПИРИДИН-3-КАРБОНИЛ]-2,4-ДИФТОР-ФЕНИЛ}-АМИДА | 2011 |
|
RU2575478C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА АКТИВИН-РЕЦЕПТОРОПОДОБНОЙ КИНАЗЫ | 2020 |
|
RU2826600C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-[2-(2,4-ДИМЕТИЛФЕНИЛСУЛЬФАНИЛ)ФЕНИЛ]ПИПЕРАЗИНА | 2012 |
|
RU2608307C2 |
| Способ получения @ , @ -ненасыщенных кислот | 1990 |
|
SU1836325A3 |
| Способ получения 1,6-гексеновых дикислот | 1990 |
|
SU1826965A3 |
| Способ получения эфиров @ -замещенных бензойных кислот и гидрохинона | 1991 |
|
SU1816758A1 |
| РАДИОАКТИВНО МЕЧЕННЫЕ ПРОИЗВОДНЫЕ 2-АМИНО-6-ФТОР-N-[5-ФТОР-ПИРИДИН-3-ИЛ]-ПИРАЗОЛО[1, 5-А]ПИРИМИДИН-3-КАРБОКСАМИДА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРА ATR КИНАЗЫ, ПРЕПАРАТЫ НА ОСНОВЕ ЭТОГО СОЕДИНЕНИЯ И ЕГО РАЗЛИЧНЫЕ ТВЕРДЫЕ ФОРМЫ | 2015 |
|
RU2719583C2 |
| СПОСОБ КРОСС-СОЧЕТАНИЯ ИНДОЛОВ | 2005 |
|
RU2430916C2 |
| ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРИМИДИНА И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2015 |
|
RU2703300C2 |
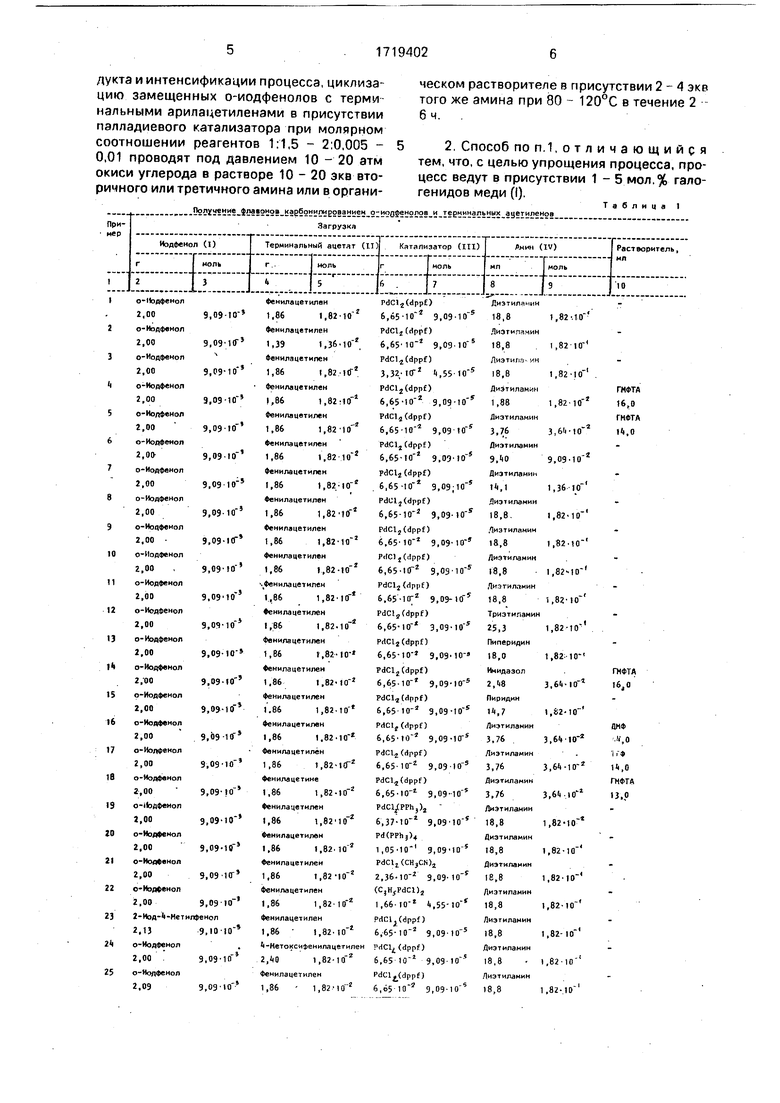
Изобретение касается химии гетероциклических соединений, в частности способа получения 2-фенил-4Н-1-бензопиран-4-она и его производных и может быть использовано в фармакологии. Цель - увеличение выхода целевых продуктов и интенсификация процесса. Его ведут гетероциклизацией о-иодфенола с терминальным арилацетиле- ном в присутствии палладиевого катализатора при молярном соотношении реагентов 1:(1,5 - 2,0) : (0,005 - 0,01) под давлением окиси углерода 10-20 атм в растворе 10 - 20 экв. вторичного или третичного амина или в органическом растворителе в присутствии 2 - 4 экв. того же амина при 80- 120°С в течение 2-6 ч. При добавлении в реакционную смесь 1 - 5 мол.% галогенидов меди (I), температуру реакции можно снизить до 50 - 90°С. Выход целевых продуктов возрастает в 1,5-2 раза, а время проведения процесса уменьшается в 2 - 6 раз. 1 з.п. ф-лы, 2 табл.
Изобретение относится к усовершенствованному способу получения 2-фенил-4Н- 1-бензопиран-4-она (флавона) и его производных (флавонов) формулы
где RI - фенил, незамещенный или замещенный низшей алкоксигруппой;
R2 - атом водорода или низший алкил, которое может быть использовано в фармакологии.
Известен способ получения флавона окислительной гетероциклизацией 2 -окси- халконов под действием двуокиси селена в среде амилового спирта при 150°С в течение 12 ч.
Недостатками прототипа являются невысокие выход целевого продукта, и скорость проведения процесса - продолжительность реакции составляет 12 и более часов.
Цель изобретения - повышение выхода целевого продукта, а также интенсификации процесса.
Поставленная цель достигается тем, что циклизацию замещенных о-иодфенолов с терминальными арилацетиленами в присутствии палладиевого катализатора при мо-. лярном соотношении компонентов 1:1.5 - 2:0, 005 - 0,01 проводят под давлением 10 - 20 атм окиси углерода в раст воре 10 - 20 экв. вторичного или третичного амина или в органическом растворителе в присутствии 2 - 4 экв. того же амина при 80 -- 120°С в течение 2 - 6 ч.
ю
J о го
Пример 1. В автоклав из нержавеющей стали емкостью 100 мл, снабженный магнитной мешалкой и электрообогревом, загрузили 2,00 г (9,09 10 моль) о-иодфе- нола, 1,86г(1,82 моль) фенилацетиле- на, 18,8 мл (1,82 моль) диэтиламина и
6,65- 10 . г (9,09- моль) PdCl2(dppf) (dppf 1,1 -бис(дифенилфосфино)ферро- цен). Автоклав заполнили 20 атм окиси углерода и нагревали до 120°С. Выдерживали при этой температуре в течение 2 ч. После охлаждения до комнатной температуры автоклав разгрузили, содержимое пропустили через короткий слой (20 г) окиси алюминия (акт, П по Брокману), слой окиси алюминия промыли эфиром (Зх 10мл). Элюат упарили, остаток перекристаллизовали из гексана. Выход флавона 1,63 г (80,8%). Т.пл. 98 - 99°С, лит.т.пл, 99°С.
П р и м е р 23. Аналогично примеру 1, из 2,13. г (9,10 моль) 2-иод-4-метилфено- ла, 1,86 г (1,82 моль)фенилэцетилена,
18,8 мл (1,82- моль) диэтиленамина и 6,65 10-2 г (9,09 моль) PdCl2(dppf) получили 1,44 г (67,0%) 6-метилфлавона (перекристаллизация из этанола), Т.пл. 120 -. 120,5оС, лит.т.пл. 119 - 121,5оС.
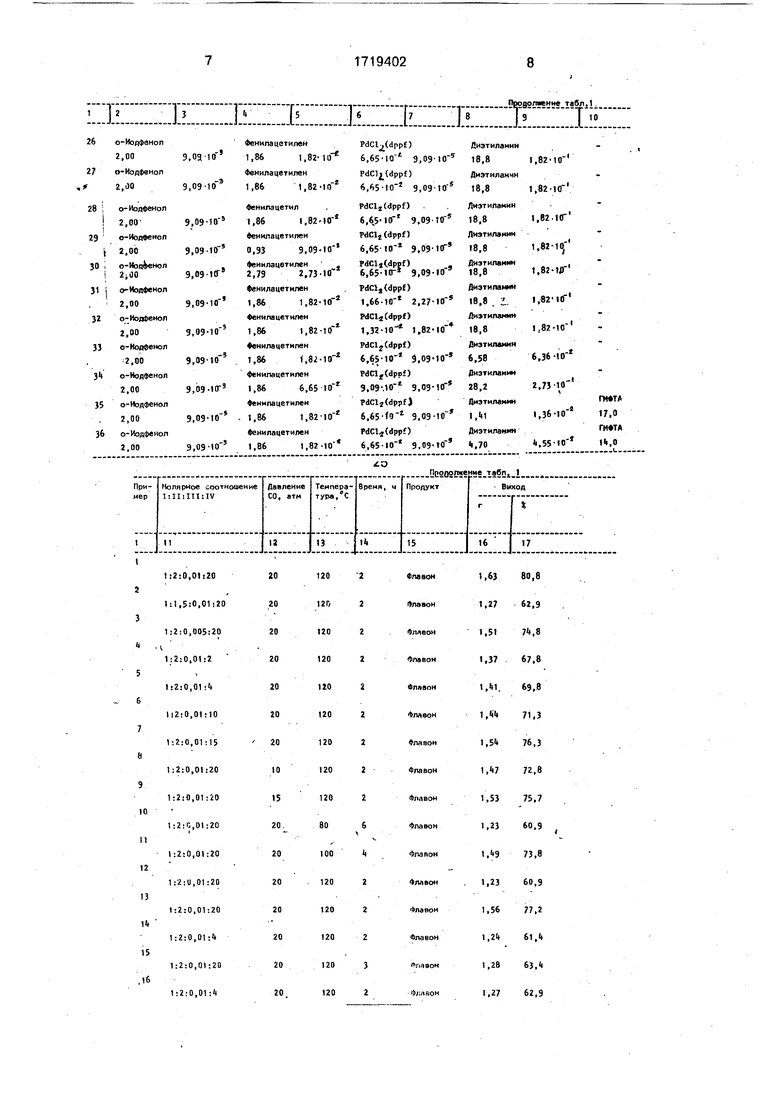
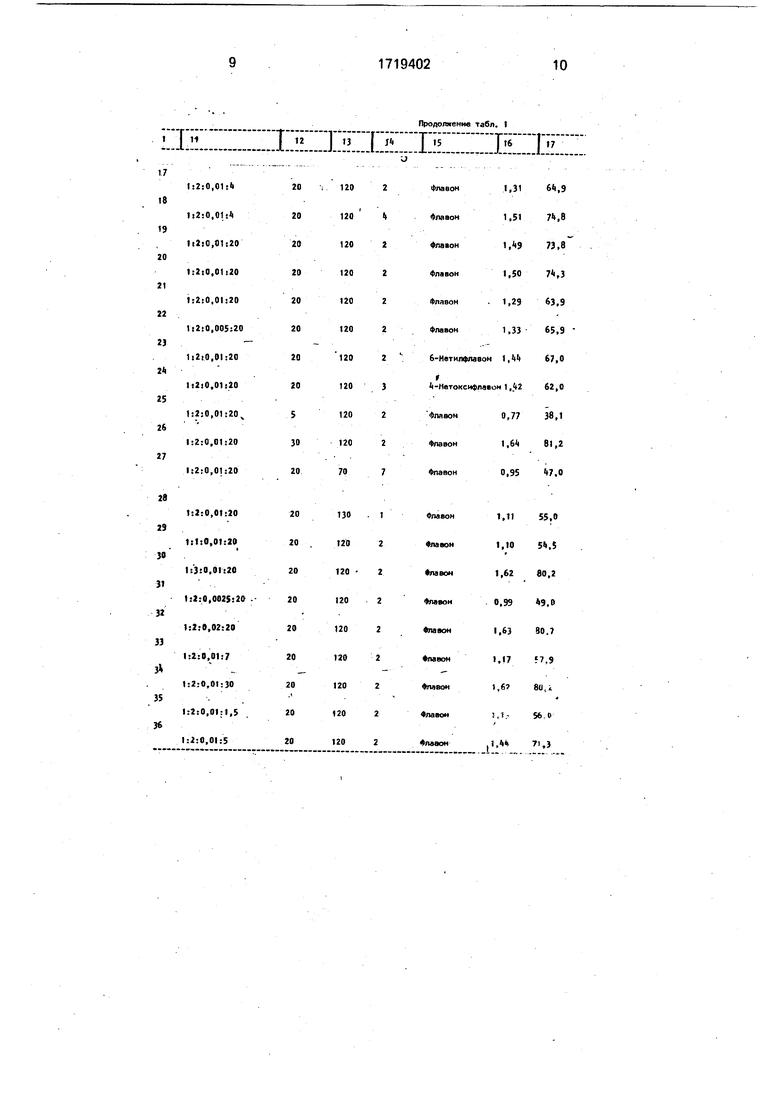
Примеры 1 - 36 приведены в табл.1. Из данных табл.1( видно, что уменьшение давления окиси углерода ниже 10 атм (примеры 8,25), уменьшение температуры реакции ниже 80°С (примеры 10, и 27), уменьшение количества терминального ацетилена ниже 1,5 экв. в расчете на о-иод- фенол (примеры 2,29), уменьшение количества палладиевого катализатора ниже 0,005 экв. (0,5 мол.%) (примеры 3,31), а также уменьшение количества амина ниже 2 экв. в присутствии органического растворителя (примеры 4,35) и ниже 10 экв. при использовании амина в качестве растворителя (примеры 6,33) приводит к уменьшению выхода флавона. Увеличение давления выше 20 атм (примеры 1.26), увеличение температуры выше 120°С (примеры 1,28), увеличение количества терминального арилацетилена выше 2 экв. (примеры 1,30), увеличение количества палладиевого катализатора выше 0,01 экв. (1 мол.%)(примеры 1,32), з также увеличение количества амина выше 4 экв. в присутствии органического растворителя (примеры 5,36) и выше 20 экв. при использовании амина в качестве растворителя (примеры 1,34) не приводит к увеличению выхода флавона. Таким образом., оптимальными условиями проведения реакций являются давление 10 - 20 атм окиси углерода, температура 80 - 120°С при молярном соотношении компонентов о-иодфенол: терминальный арилацетилен: катализатор- : -2:0,005 -0,01 в присутствии 2-4 экв. вторичного или третичного амина и органического растворителя или в присутствии 10-20 экв, амина при использовании его в качестве растворителя.
Использование предлагаемого способа позволяет повысить выход целевого продукта до 60 - 80% (прототип 30 - 45%). Кроме
того, сокращается время проведения реакции до 2 - 6 ч (прототип 12 ч) и уменьшается температура реакций до 80 - 120°С (прототип 140 - 150°С):
Конкретные примеры с использованием
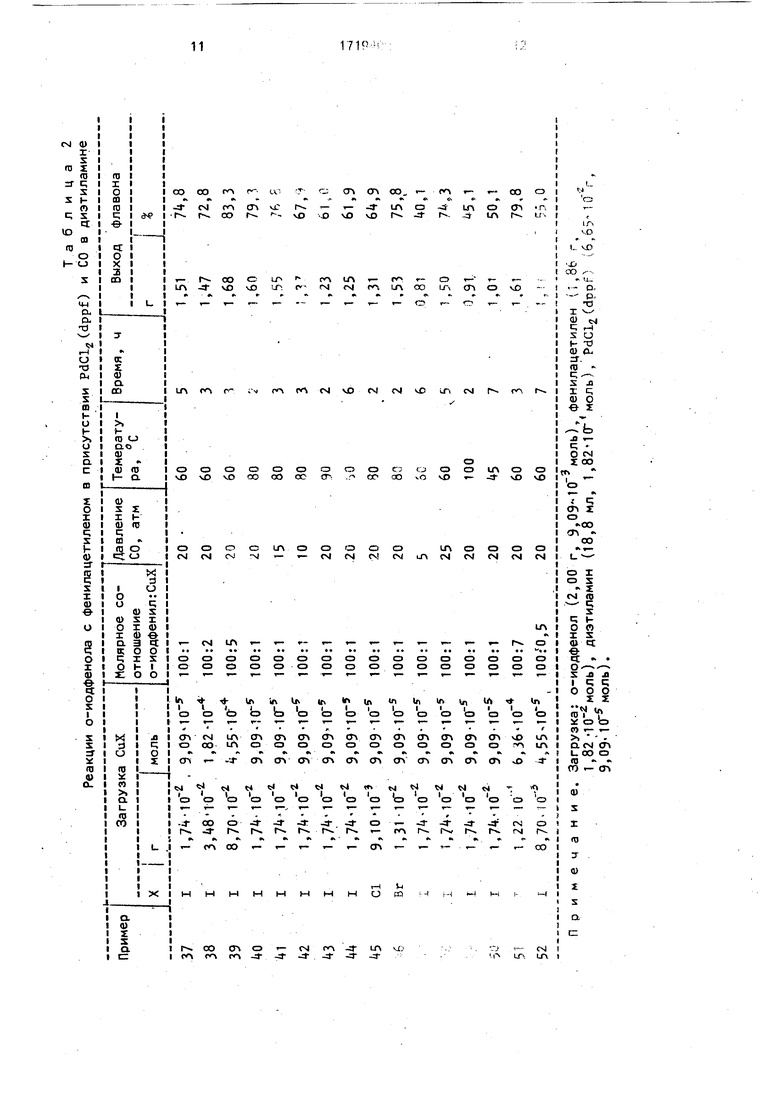
добавок галогенидов меди (I) приведены в табл.2.
Из данных табл.2 следует, что добавки галогенидов меди (I) позволяют снизить температуру этих реакций. В присутствии галогенидов меди (I) уменьшение давления
окиси углерода ниже 10 атм (примеры 42,
;47(, уменьшение температуры ниже 50°С
(примеры 44, 50), увеличение температуры
выше 90°С (примеры 43, 49), уменьшение
количества галогенидов меди (I) ниже 1 мол.% в расчете на о-иодфенол (примеры 37, 52) приводит к уменьшению выхода флавона. Увеличение давления окиси углерода выше 20 атм (примеры 37, 48), увеличение
количества галогенида меди выше 5 мол.% в расчете на о-иодфенол (примеры 39,51) не приводит к увеличению выхода флавона. Таким образом, оптимальными условиями проведения этих реакций в присутствии добанок галогенидов меди являются давление 10-20 атм окиси углерода, температура 50 - 90°С при молярном соотношении о-иодфе- нол:галогенид меди (I) 100:1 - 5.
Использование добавок галогенидов
меди (I) позволяет снизить температуру реакции карбонизирования о-иодфенолов и терминальных арилацетиленов в присутствии аминов и комплексов палладия до 50 - 90%.
Фор мул а изобретения
Способ получения 2-фенил-4Н-1-бёнзо- пиран-4-она и его производных формулы
О R2
где RI - фенил, незамещенный или замещенный низшей алкоксигруппой,
R2 - атом водорода или низший алкил, включающий гетеро.циклизацию о-оксиза- мещенных производных ароматических соединений при нагревании в органическом растворителе, отличающийся тем, что, с целью повышения выхода целевого продукта и интенсификации процесса, циклизацию замещенных о-иодфенолов с терми нальными арилацетиленами в присутствии палладиевого катализатора при молярном соотношении реагентов 1:1,5 - 2:0,005 - 0,01 проводят под давлением 10 - 20 атм окиси углерода в растворе 10 - 20 экв вторичного или третичного амина или в органи- генидов меди (I),
2, Способ по тем, что, с целью цесс ведут в прис
ческом растворителе в присутствии 2-4 экв того же амина при 80 120°С в течение 2 6ч. .
2, Способ по п. 1,отличающийся тем, что, с целью упрощения процесса, процесс ведут в присутствии 1 - 5 мол.% галоТаблица 1
Продолжение табл. I
«-3
римечание. Загрузка: о-иодфенол (2,00 г, 9, моль), фенилацетилен (1,86 г.
1,82-10 моль), диэтиламин (18,8мл, 1,82 10 моль), PdCl-(dppf) (6,, 9,09- 10 5 моль).
«-3
м
| Mahal H.S., Ral H.S., Venkatarama К | |||
| - I | |||
| Chem | |||
| Soc., 1935, p,866. |
Авторы
Даты
1992-03-15—Публикация
1990-05-11—Подача