Изобретение относится к биотехнологии, в частности к способам ферментативной изомеризации глюкозы, и может быть использовано в пищевой промышленности для получения фруктозы.
Целью изобретения является удешевление способа.
Способ заключается в пропускании раствора глюкозы через колонку с адсорбцион- но-иммобилизованной на гранулированной DEAE-целлюлозе GDC глюкозоизомеразой с последующим получением содержащих фруктозу растворов. Для поддержания постоянной активности глюкозоизомеразы в колонке необходимо периодически добавлять новые порции растворимого фермента,
так как в противном случае содержание фруктозы в растворе снижается. С целью эффективного связывания этих порций фермента с анионообменником на нем сначала адсорбируют фермент в количестве 10-50% от максимальной емкости DEAE-целлюло- зы, а затем периодически добавляют глюко- зоизомеразу до тех пор, пока общее количество введенного фермента не достигнет максимальной емкости DEAE-целлюлозы. Изобретение позволяет удешевить способ на 50-62%, так как при одинаковой мощности установки для изомеризации глюкозы в предлагаемом способе используются 3 колонки вместо 6-8 колонок по известному способу.
vi ю о N
SO
го
со
Пример 1. Для осуществления способа используют гранулированную DEAE-цел- люлоэу марки GDC, а также микробную глюкозоизомеразу. Определение адсорбционной емкости целлюлозы в отношении глюкозоизомеразы показывает, что на 1 г сухого сорбента сорбируется около 584 международных единиц (межд.ед.) фермента.
Начальное фиксирование фермента нз гранулированной DEAE-целлюлозе GDC,
Носитель GDC частично загружают растворимой изомераэой примерно до 25% до пустимой нагрузки. Готовят суспензию GDC (14,8 г сухой основы) в деионизированной воде и значение рН устанавливают равным до 6,0-7,1. Суспензию деаэрируют в условиях вакуума водяного аспиратора при комнатной температуре в течение 60 мин и затем заливают в стеклянную колонку с двойными стенками Glass AdjustachromK размером один дюйм в диаметре на 12 дюймов длины, имеющую стеклянное дно. Слой уплотняют на глубину 3,54 дюймов (90 мм). Стеклянные бусинки помещают на верх слоя (4 дюйма или 101 мм) для распределе- ния потока. Гранулированную DEAE-целлю- лозу загружают посредством накачки 145 мл (2600 межд.ед. глюкозоизомера) растворимой изомеразы, проходящей вниз через слой со скоростью 1 мл/мин при комнатной температуре.
Температуру водяной рубашки на колонке устанавливают равной 61 °С. 50% -ный раствор кристаллической целлюлозы при значении рН 7,8, содержащим 5 мМ МдЗСм и 5 мМ NaHSOa, пропускают вниз через слой фиксированной изомеразы со скоростью потока 0,4 мл/мин. Колонка работает 16 ч. Для анализа берут пробу выходящего материала и активность фиксированной изомеразы определяют по следующему уравнению:
с R . е -lom
.(1)
где Et - общая активность фиксированной изомеразы, межд.ед.;
R - скорость потока, мл/ч,1
С - концентрация моносахарида, г/мл;
Кг - постоянная скорости реакции при 61°С (0,019 г/межд.ед. изомеразы глюкозы /ч);
I - Степень изомеризации выходящего потока оавна концентрация фруктозы
концентрация моносахарида
10 - входящего потока равно 0 для кристаллической декстрозы;
U - I при равновесии равно 0,510 при 61°С.
Степень ио еризации I измеряют по- ляриметрией снедающим образом. Образцы входящего в колонку потока и выходящего потока разбавпч ог 20-кратно деионизированной водой и выдерживают в течение 1 ч до достижение, равновесия при вращении. Измерения на вращение проводят на поляриметре модели Перкин Элмер 241 при25°С при длине волны ртутного источника 576 нм. Прибор устанавливают на нуль с водой в ячейке и получают показания в градусах вращения разбавленного входящего и выходящего потоков.
Активность иммобилизованной изомеразы, определенную данным методом анализа, составляет 1548 межд.ед. глюкозоизомеразы и это указывает на то, что 60% от 2600 межд.ед. растворимой глю- козоизомерэзы, загруженной на носитель, составляет активность фиксированной изомеразы.
50%-ный растсюр гидролиза кукурузного крахмала, содержащий 95% декстрозы на сухой основе твердых веществ, 5 мМ MgS04 и 5 мМ NaHSOa, доводят до рН 7,8 и пропускают в нижнем потоке через слой фиксированной изомеразы при 64°С. Начальный поток через колонку вычисляют по уравнению (1), Конверсия во фруктозу составляет примерно 4 %. Этот поток со скоростью примерно 17 мл/ч поддерживают постоянным за исключением времени анализа активности иммобилизованной изомеразы. Содержание фруктозы в выходящем потоке измеряют в основном методом, который применяют для определения степени изомеризации.
% фруктозы 100 Id,
где d - содержание моносахарида в выходящем потоке, выраженное как доля твердых частиц на сухой основе.
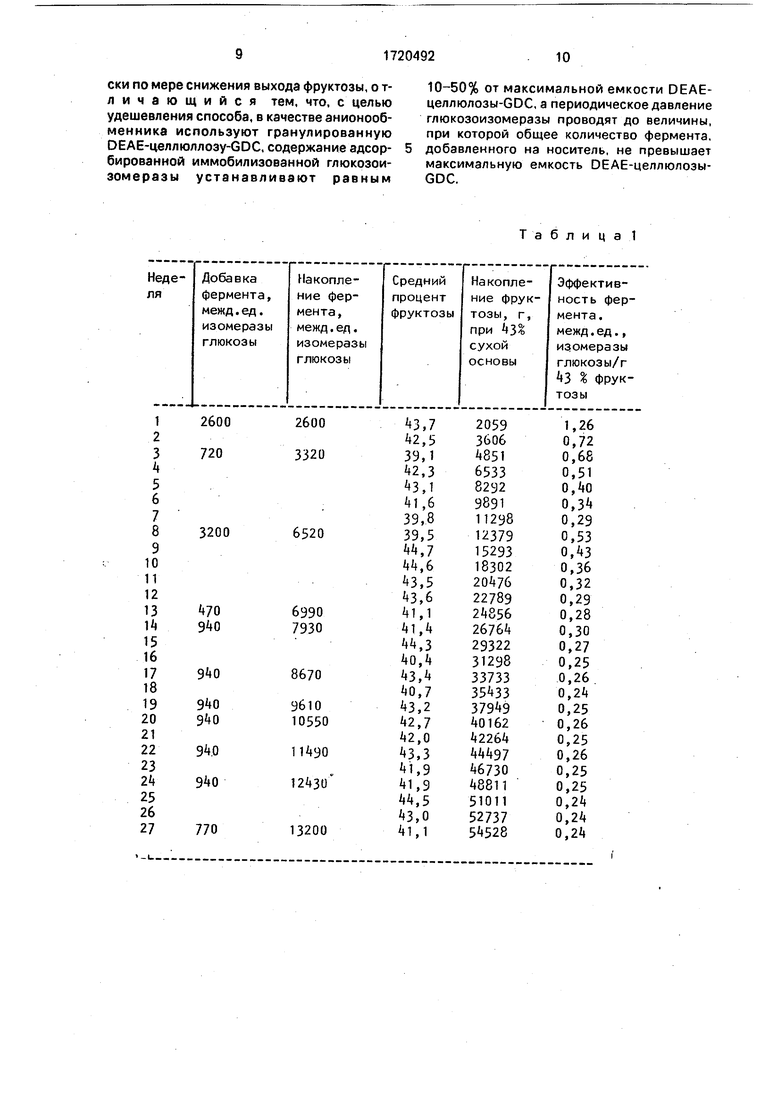
Уровень фруктозы постепенно уменьшается в течение 16 дней до примерно 40%, после чего осуществляют первую добавку растворимого фермента. Анализ активности показывает, что для компенсирования потерянной активности и увеличения конверсии фруктозы до 44% требуется примерно 800 межд.ед. изомеразы глюкозы.
Соответственно 40 мл фермента (720 межд.ед. изомеразы глюкозы) добавляют в 126 мл 50%-ного раствора кристаллической декстрозы, содержащего указанные соли. Подачу в колонку переключают на раствор декстрозы, содержащий фермент, и пропускают раствор со скоростью 0,3 мл/мин до истощения. Обнаружено, что выходящий из колонны поток во время процесса адсорбции фермента не со- лержит растворимую изомеразу (определено путем выдерживания в термостате выходящего материала в течение 16 ч при 61 °С и измерения повышенного содержания фруктозы). Раствор кристаллической декстрозы продолжают применять как питающий рас- твор для анализа дополнительной активности фиксированной изомеразы. Затем снова переключают на подачу гидролизата из кукурузного крахмала и уровень фруктозы в выходящем потоке восстанавливается до 44%.
Такая последовательность постепенного снижения уровня фруктозы в выходящем потоке до примерно 40%, затем переключение на подачу раствора кристаллической де- кстрозы для анализа фиксированной изомеразы, добавка растворимого фермента через питающий поток декстрозы, повторный анализ активности фиксированной изомеразы и переключение на подаму гидролизата кукурузного крахмала продолжается в течение 17 недель, В течение остальных 10 недель испытаний последовательность изменяется, исключая анализ активности фиксированной изоме- разы до и после добавки фермента. Затем периодически добавляют постоянное количество растворимого фермента. Уровень содержания фруктозы в течение этого времени изменяется только между произ- вольно установленными пределами 40- 44%, при этом скорость потока поддерживают постоянной.
Через 7,5 недель работы активность фермента в колонке удваивается без значи- тельного влияния на работу системы, за исключением увеличения скорости потока для достижения выхода 40-44% фруктозы. После 13 недель работы уровень солей в питающем потоке гидролизата кукурузного крахмала снижают до 1 мМ МдЗОз (с 5 мМ) и 2 мМ NaHSOa (с 5 мМ).
Анализ для 24 недель испытания выходящего потока, взятого во время загрузки фермента, показывает, что по- следняя добавка фермента дает значение поглощенного общего фермента 649 межд.ед. изомеразы глюкозы/г, близкое к его способности, измеренной вначале как 684 межд.ед. изомеразы глюкозы/г.
Во время последующих загрузок потеря активности увеличивается, хотя адсорбируется достаточное количество свежего фермента для поддерживания свыше 40% конверсии фруктозы. Тот факт, что фермент все же адсорбируется после превышения начально измеренной способности, указывает на то, что некоторая часть инертного фермента может де- сорбироваться.
В табл. 1 представлены данные по производству фруктозы и добавке фермента в 27-недельных испытаниях. Количество полученной фруктозы выражено в граммах от 43% сиропа фруктозы на сухой основе.
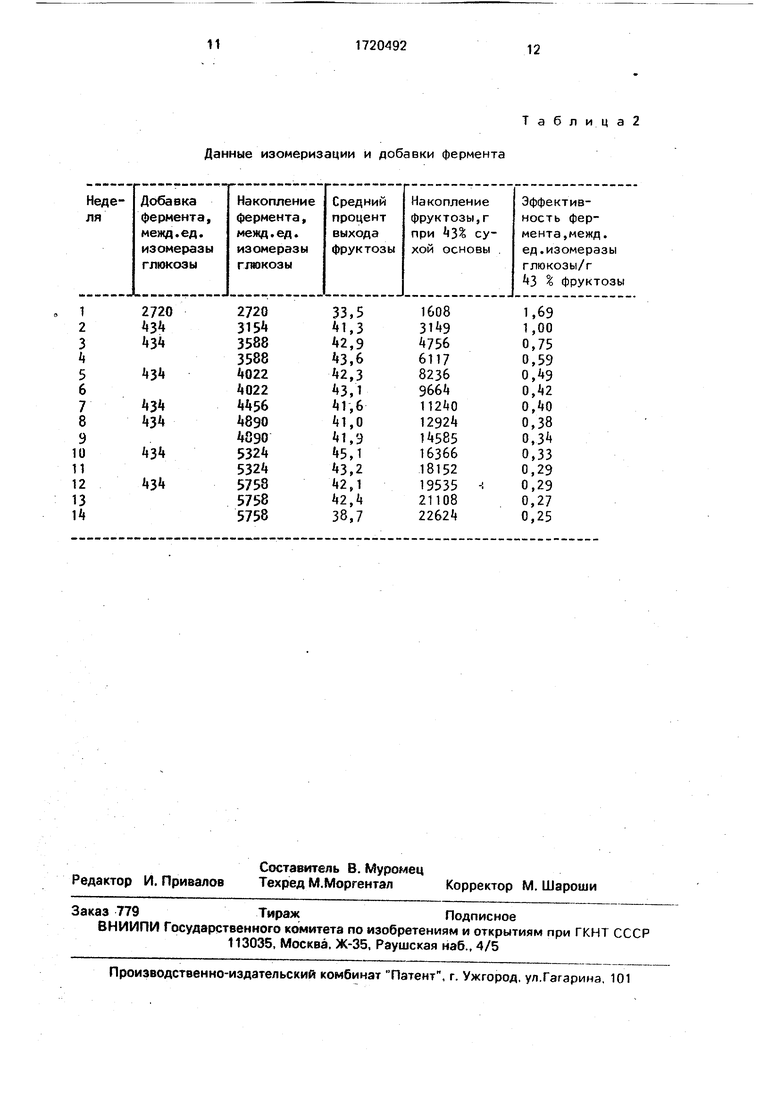
П р и м е р 2. Осуществляют загрузку колонки, в результате которой растворимая глюкозоизомераза, применяемая для частичной загрузки носителя в начале и во время последующих добавок, имеет высокую чистоту. Операции, осуществляемые в колонке, аналогичны примеру 1, т.е. скорость потока гидролизата кукурузного крахмала поддерживается постоянной, а периодические добавки растворимого фермента в растворе кристаллизованной декстрозы осуществляют через питающий трубопровод.
Таким образом, в течение 14 недель поддерживают конверсию фруктозы в пределах 40-44%. Загрузка рафинированного гидролизата кукурузного крахмала с 45% твердых веществ содержит примерно 95% декстрозы, 1,5 мМ MgS04 и 2,0 мМ NaHSOa. Значение рН входящего материала доводят до 7,8 для получения выходящего потока с рН 7,5, температура слоя фиксированного фермента равнялась 60°С.
Как описано в примере 1, в стеклянную колонку добавляют носитель GDC (на сухой основе 7,75 г). Носитель загружают очищенным ферментом примерно до 25% допустимой нагрузки посредством накачки нисходящего потока 50%-ным раствором кристаллической декстрозы (рН 7.8; 5 мМ MgS04, 5 мМ NaHSOa), содержащим 136 мл очищенного фермента, разработанного 1:40 (2720 межд.ед. изомеразы глюкозы) со скоростью потока 0,4-0,7 мл/мин. В выходящем потоке растворимый фермент не обнаружен. Поток раствора кристаллической декстрозы (рН 7,8; 5 мМ MgS04, 5 мМ №Н50з) используют для анализа, а рубашку колонки снабжают водой, так что температура слоя колонки равна 60°С.
Активность иммобилизованного фермента, определенная методом анализа, который описан в примере 1, равна 1686 межд.ед. глюкозоизомеразы.
Гидролизат кукурузного крахмала пропускают через слой фиксированного фермента, при этом поток регулируют таким образом, чтобы можно было получить 40- 44% конверсии фруктозы. Скорость потока поддерживают постоянной, т.е. примерно 0,35 мл/мин на протяжении всего испытания. Так как уровень фруктозы уменьшается со временем из-за инактивации фермента,
то в 50%-ный раствор кристаллической декстрозы (рН 7,8; 5 г-моль MgS04, 5 г-моль Май 50з) добавляют примерно 20 мл аликво- ты разбавленной и очищенной растворимой изомеразы, содержащей 434 межд.ед. глю- козойзомеразы, причем раствор накачивают через слой со скоростью примерно 0,4 мл/мин. После адсорбции подачу переключают снова на гидролизат кукурузного кразмала.
В табл. 2 представлены данные по изомеризации и добавке фермента. Как и в примере 1, постоянную конверсию фруктозы поддерживают при постоянной скорости потока посредством периодической добав- ки растворимой изомеразы.
П р и м е р 3. Осуществляют чагрузку колонки, при этом использованэ растворимая глюкозоизомераза высокой чистоты с тем, чтобы первоначально загруз-пи носи- тель на 10% его полной емкости и для последующих добавлений. Растворимый фермент, носитель и операции с колонкой такие, как в примере 2, однако используется другая степень начальной загрузки.
В 7,75 г носителя из примера 2 добавляют растворимый фермент в количестве примерно 10% его емкости при помощи нагнетания по переточной трубе 50%-но- го раствора кристаллической декстрозы (рН 7,8; 5 мМ MgS04, 5 мМ №НЗОз), содержащего 55 мл очищенного фермента из примера 2, разбавленного в пропорции 1:40 (1088 межд.ед. активности) с объемной скоростью 0,4-0,7 мл/мин. Активность им- мобилизованного фермента составляет 762 межд.ед, в пересчете на активность при абсорбировании 70% фермента.
Гидролизат кукурузного крахмала пропускают через слой фиксированного фер- мента и поток регулируют таким образом, чтобы обеспечить степень превращения фруктозы 40-44%. Объемную скорость поддерживают постоянной на уровне примерно 0,14 мл/мин на протяжении всего испыта- ния. Когда содержание фруктозы снижается со временем из-зй распада фермента, порцию примерно в 20 мл разбавленного очищенного фермента, содержащего 434 межд.ед., добавляют в 50%-ный раствор кристаллической декстрозы (рН 7,8; 5 мМ MgSO4, 5 мМ NaHSOa) и этот раствор нагнетают через слой со скоростью примерно 0,4 мя/мин. После адсорбции колонку снова переключают на постоянный гидроли- зат. Постоянную степень превращения фруктозы поддерживают при постоянной объемной скорости при помощи периодических добавлений растворимой изомеразы.
П р и м е р 4, Осуществляют загрузку колонки, при этом используют растворимую гяюкозоизомеразу высокой чистоты для начальной загрузки носителя до 50% полной емкости и для последующего добавления. Растворимый фермент, носитель и операции с колонкой те же, что в примере 2 за исключением степени начальной загрузки.
В 7,75 г носителя из примера 2 добавляют растворимый фермент в количестве примерно 50% его емкости при помощи нагнетания по переточной трубе 50%-но- го раствора кристаллической декстрозы (рН 7,8; 5 мМ MgS04, 5 мМ NaHSOa), содержащего 270 мл очищенного фермента из примера 2, разбавленного в отношении 1:40 (5440 межд.ед.) с объемной скоростью 0,4- 0,7 мл/мин. Активность иммобилизованного фермента составляет 3264 межд.ед..при выражении активности в пересчете на адсорбирование 60% фермента.
Гидролизат кукурузного крахмала пропускают через слои фиксированного фермента, а объемную скорость регулируют таким образом, чтобы обеспечить степень превращения фруктозы 40-44%. Объемную скорость поддерживают постоянной на уровне примерно 0,70 мл/мин в течение всего испытания. Когда уровень фруктозы падает со временем из-за разрушения фермента, порцию в примерно 20 мл разбавленного, очищенного фермента из примера 2, содержащего 434 межд.ед., добавляют в 50%-ный раствор кристаллической декстрозы (рН 7,8; 5 мМ МаНЗОз) и раствор нагнетают через указанный слой со скоростью примерно 0,4 мл/мин. После адсорбции сырье снова переключают на постоянный гадролизат. Постоянную степень превращения фруктозы поддерживают при постоянной объемной скорости при помощи периодического добавления растворимой изомеразы.
При мощности установки 200 т/день для получения 42%-ного раствора фруктозы используют 3 колонки.
Таким образом, использование предложенного изобретения позволяет значительно удешевить способ получения фруктозы за счет применения 3 колонок вместо 6-8 (т.е. удешевление на 50-62%) при одинаковой мощности установки (200 т/день).
Формула изобретения
Способ ферментативной изомеризации глюкозы во фруктозу, заключающийся в пропускании раствора глюкозы через колонку, содержащую глюкозоизомеразу, им- мобилизованную адсорбцией на ачионообменнике, причем растворимую глюкозоизомеразу добавляют периодически по мере снижения выхода фруктозы, о т- личающийся тем, что, с целью удешевления способа, в качестве энионооб- менника используют гранулированную ОЕАЕ-целлюллозу-ООС, содержание адсор- бированной иммобилизованной глкжозои- зомеразы устанавливают равным
10-50% от максимальной емкости DEAE- целлюлозы-GDC, а периодическое давление глюкозоизомеразы проводят до величины, при которой общее количество фермента, добавленного на носитель, не превышает максимальную емкость DEAE-целлюлозы- GDC.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ изомеризации глюкозы во фруктозу | 1983 |
|
SU1523056A3 |
| Способ изомеризации глюкозы во фруктозу | 1972 |
|
SU649328A3 |
| Способ получения сиропа, содержащего глюкозу и фруктозу | 1982 |
|
SU1449014A3 |
| Способ получения ферментного препарата глюкоизомеразы | 1977 |
|
SU1024014A3 |
| Способ получения иммобилизованной глюкозоизомеразы | 1978 |
|
SU1028251A3 |
| Способ энзиматического превращенияглюКОзы BO фРуКТОзу | 1976 |
|
SU797582A3 |
| Способ получения глюкозоизомеразы | 1978 |
|
SU764617A3 |
| Способ получения концентрата глюкозоизомеразы | 1986 |
|
SU1575946A3 |
| Способ получения фруктозы | 1978 |
|
SU1072817A3 |
| Способ получения фруктозы | 1974 |
|
SU623525A3 |
Изобретение относится к биотехнологии, в частности к способам ферментативной изомеризации глюкозы, и может быть использовано в пищевой промышленности для получения фруктозы. Целью изобретения является удешевление способа. Способ заключается в пропускании раствора глюкозы через колонку с адсорбированной на гранулированной DEAE - целлюлозой (GDC) глюкозоизомеразы с последующим получением содержащих фруктозу растворов. На колонке сначала адсорбируют 10-50% фермента от максимальной емкости анионооб- менника, а для поддержания постоянной активности глюкозоизомеразы в колонке периодически проводят добавление новых порций фермента до тех пор, пока общее количество введенного фермента не достигнет максимальной емкости сорбента. Использование изобретения позволяет удешевить способ на 50-62%. 2 табл, СП С
Таблица 1
Данные изомеризации и добавки фермента
б л и ц а 2
| Иммобилизованные форменты/Под ред | |||
| И.В.Березина и др | |||
| М., 1976, т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
| Патент США № 3960663 | |||
| кл | |||
| Регулятор давления для автоматических тормозов с сжатым воздухом | 1921 |
|
SU195A1 |
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
Авторы
Даты
1992-03-15—Публикация
1985-08-01—Подача