Изобретение относится к энзимологии и может быть использовано при определении активности ферментов, катализирующих в субстратах образование перекиси водорода в микробиологической промышленности, медицине, фармакологии и других отраслях науки и техники.
Активность ферментов определяют по количеству расщепленного субстрата или образованию определенного количества продукта за единицу времени 1 мг фермента; по числу микролитров субстрата, потребляемого (в стандартных условиях) в течение 1 ч на 1 мг фермента; числом микромолей или молекул субстрата, прореагировавшего за 1 мин на 1 мг фермента.
Эти способы многостадийны и продолжительны по времени. Для их исполнения необходимы редкие и дорогие реактивы, специалисты, приборы и оборудование.
Известен способ определения активности L-лизин-а -оксидазы в- культуре гриба рода Trichoderma sp. по 0,04%-ной перекиси водорода.
Способ заключается в том. что фермент L-лизин-а-оксидазу получают путем культивирования штамма Trichoderma harzianum Rifai F-180 в 250 мл колбе с 10 г пшеничных отрубей, 7 мл 11,4%-ного МаМОз. 10 мл Н20 при 28°С в течение 14 дн. З.атем в колбу добавляют 10 мл НаО, в течение 2 ч культуру встряхивают на Schutelaparat-327. (Prend ПНР) и отжимают через хлопчатобумажную ткань, а водный экстракт центрифугируют от спор и мицелия и определяют активность L-лизин- а -оксидазы. Реакционная смесь содержит, об.% на 1 мл: 0,5 М трис - HCI 15-30, 5 мкМ L-лизин 50-55, 0,04%-ная пе- роксидаза 4-5, 0,5%-ный 0-дианизидингид- рохлорид 4-5, водный экстракт культуры 12-20.
Смесь инкубируют аэробно при 37°С 20 мин и охлаждают. Реакцию заканчивают добавлением 1 мл 0,8 н.НС и последующим охлаждением пробы до комнатной температуры. Оптическую плотность окрашенных растворов замеряют на спектрофотометре при 540 нм. Нижняя граница чувствительности 40,1 нмоль, воспроизводимость ±0,1 нмоль. За единицу активности фермента принято количество фермента, каел
с
S
Ј
тализирующего образование 1нмоль перекиси водорода за 1 мин в стандартных условиях.
Однако этот способ также сложен и продолжителен по исполнению. Используемый в реакции реактив 0-дианизидингидрохло- рид является высокотоксичным веществом. Он, как и пероксидаза, является дорогостоящим и редким веществом. Точность способа невелика, поскольку нельзя утверждать, что за время инкубирования реакция завершилась полностью.
Цель изобретения -удешевление, упрощение, ускорение способа определения активности фермента, повышение его точ- ности и безопасности для человека.
Поставленная цель достигается использованием нового состава реакционной смеси, содержащей, об.% на 1 мл: фосфатный буфер 0,7-0,8, водный раствор L-лизина концентрацией 1,46 мг/мл 0,1, водный экстракт культуры 0,1-0,2.
Смесь инкубируют аэробно при 37°С 20 мини в нее дополнительно вводятО,1-0,8%- ный раствор люминола с рН 10,0-13,8, содержащий гемин из расчета 0,04-10 мг/л раствора люминола при соотношении реакционной смеси и люминолгеминового состава 1:10. Результат оценивают люмино- метрическим методом.
Исключение из реакционной смеси HCI, 0-дианизидингидрохлорида, перокси- дазы повышает безопасность способа для человека и удешевляет его. А использование люминолгеминового состава в смеси повышает чувствительность способа, так как люминол (5-амино-2,3-дигидро-1,4-фта- лазиндион) в щелочной среде в присутствии таких катализаторов, как медь, кобальт и наличие в ней перекиси водорода дает яркое свечение. Особенно резко оно усиливается в присутствии гемина, который является для перекиси водорода одним из самых сильных из всех известных в природе катализаторов. При введении в реакционную смесь люминолгеминового состава при наличии в ней перекиси водорода возникает перенос электрона (гомолиз)
Fe3+ + + HaO
Fe2+ + H20a- Fe3+ + НО
и последующие реакции
НО +Н202- Н20 + Н02 Н02 + + 02.
В процессе последних реакций комбинации свободных радикалов образуются короткоживущие соединения типа ассоциированного и неассоциированного Ван-дер- Ваальсовского комплексов кислорода, обладающие избыточной энергией, которая трансформируется люминолом в световую по реакции
он
.. c4+(v k
Для регистрации квантов света используют анализатор, чем повышается точность определений.
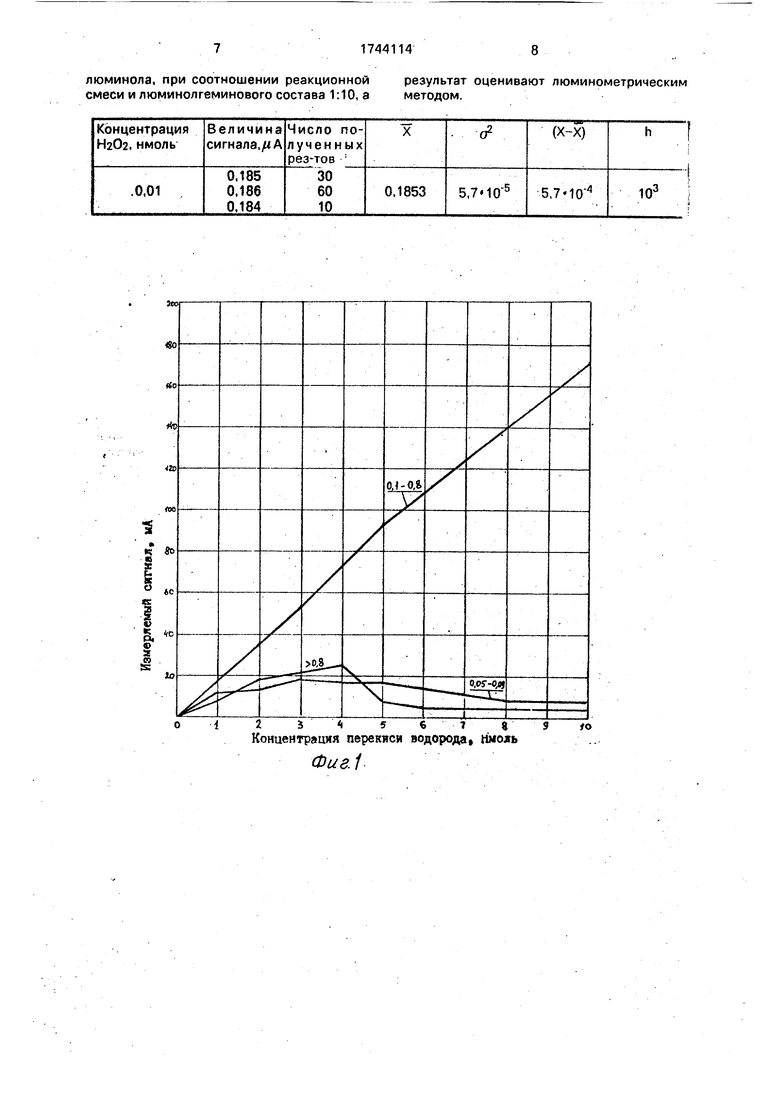
Диапазон эффективных концентраций люминола в щелочи и гемина в растворе люминола определяли следующим образом.
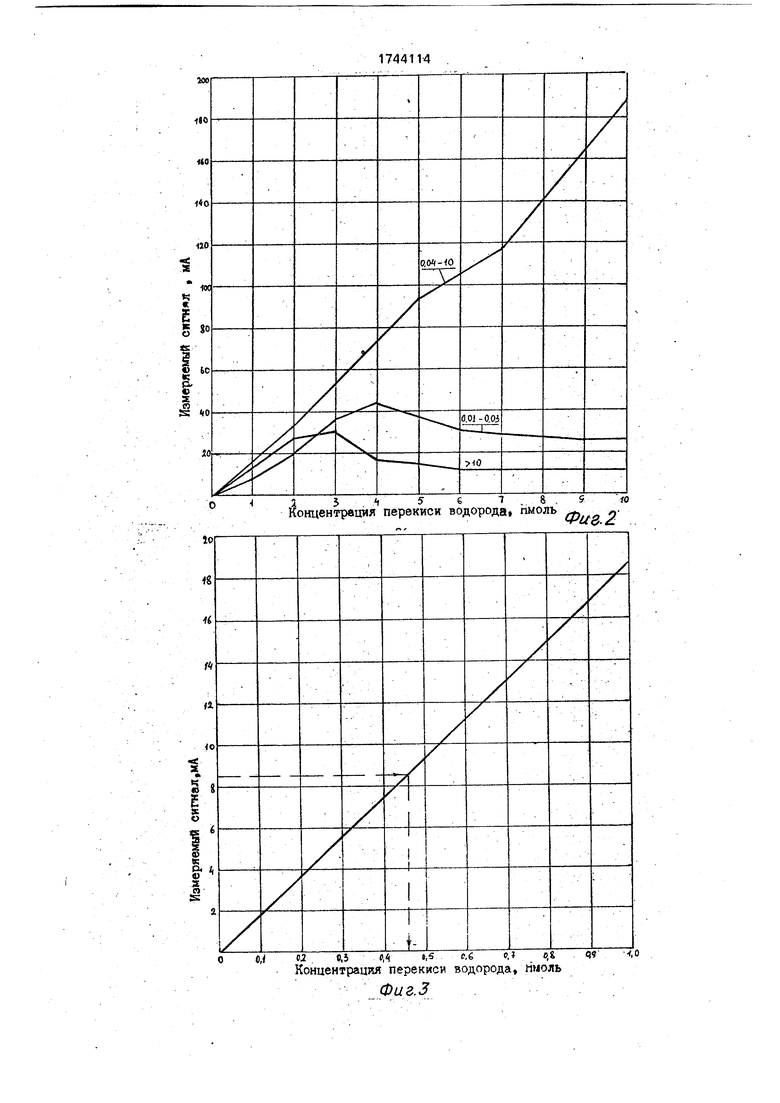
Готовили раствор люминола в щелочи (КОН) концентрацией 0,276 мг/л и на его основе готовили люминолгеминовый состав с концентрацией гемина от 0,01 до 12 мг/л в растворе люминола. Готовили растворы люминола в щелочи концентрацией 0,05- 1,0% и в каждом из них растворяли навески гемина из расчета его концентрации в растворе люминола 0,1 мг/л. Готовили разведения перекиси водорода концентрацией 1-10 нмоль и с помощью анализатора проводили их анализ, используя приготовленные люминолгеминовые составы. По результатам анализа строили графики в ко- ординатах: величина измеряемого сигнала ( концентрация перекиси водорода (нмоль).
Графики приведены на фиг.1 и 2.
Из фиг. 1 и 2 видно, что эффективными концентрациями люминола в щелочи являются концентрации 0,1-0,8%, а для гемина в растворе люминола они лежат в пределах от 0,04 до 10 мг/л.
Поскольку шкала анализатора не отградуирована в единицах концентрации перекиси водорода, то ее определяли по калибровочному графику (см.фиг.З), полученному по результатам анализа разведений перекиси водорода с помощью jrnoMHHOfl.reMHHOBoro состава, в котором концентрация люминола в щелочи составляет 0,276 мг/л, а навеска гемина растворена из расчета его концентрации в растворе люми- нола,равной 0,1 мг/л.
Пример. Определяли активность L-ли- зин-сг-оксидазы в водном растворе культуры. Брали емкость из стекла с притертой пробкой объемом 150 мл, наливали в нее 0,15%-ный щелочной (рН 12,8) раствор люминола и растворяли в нем навеску гемина массой 0,04 мг в течение 3 мин при комнатной температуре. В двух чистых колбах с притертыми пробками параллельно готовили реакционные смеси, содержащие, об.% на 1 мл фосфатный буфер (,7-5,9) 0,7-0,8, водный раствор L-лизи- на концентрацией 1,46 мг/л 0,1, водный экстракт культуры 0,2-0,1
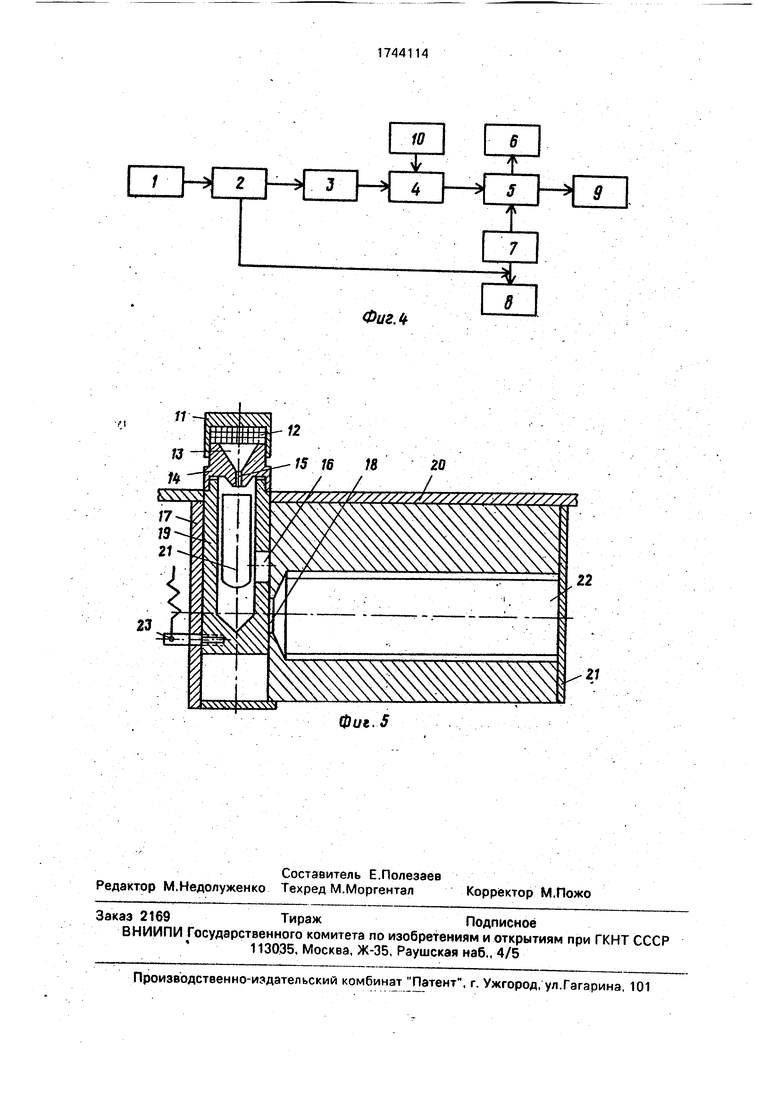
Колбы закрывали пробками и инкубировали аэробно при 37°С 20 мин, после чего в смесях колб без охлаждения и остановки реакции HCI определяли перекись водорода с помощью люминолгеминового состава на анализаторе. Для этого прибор подключали к источнику питания и оно подавалось на блок 1 питания (см.фиг.4). Далее с блока
1питания напряжение подавалось на блок
2преобразования напряжения, откуда низковольтное напряжение подается на блок 8 регистрации времени измерения и блок 7 управления. Высоковольтное напряжение подается на блок 3 отключения напряжения, блок 4 преобразования светового сигнала в электрический.
С подвижного стакана 19 (см.фиг.5) блока 4 преобразования светового сигнала в электрический снимают крышку 1Ч1, дозатор 14 и из него извлекают пробирку 17. В пробирку помещают 0,1 мл анализируемой реакционной смеси, устанавливают ее снова в подвижный стакан 19 и на него устанавливают дозатор 14. В полость 13 дозатора 14 наливают 1 мл люминолгеминового реактива, закрывают ее крышкой 11 и нажимают на нее рукой. Под действием нажатия стакан 19 перемещается до упора вниз, где он фиксируется рычагом 23. При этом отверстие 16 в стакане 19 совмещается с чувствительным элементом 18 ФЭУ. При достижении стаканом 19 упора от нажатия руки деформируется резиновая прокладка 12 в крышке 11 и через отверстие 15 в дозаторе 14 люминолгеминовая смесь вводится в пробирку 17. При взаимодействии люми- нолгеминовой смеси с перекисью водорода, образовавшейся в реакционной смеси, в пробирке 17 выделяются кванты света, которые ФЭУ преобразуются в электрический сигнал. Он поступает на аналого-цифровой преобразователь 5 (см.фиг,4), откуда поступает на блок 6 индикации и блок 9 регистрации его внешними регистрирующими уст- ройствами. Положительный эффект способа оценивали по результатам анализа перекиси водорода концентрацией 0,01 нмоль с
помощью люминолгеминовой смеси на анализаторе. По результатам анализа определяли среднеквадратическую ошибку и оценивали меру точности.
Результаты анализа приведены втаблице.
Истинное значение измеряемой величины сигнала лежит в интервале 0,1918- 0,788 с надежностью 0,99. За единицу активности фермента принято количество
фермента.катализирующего образование 1 нмоль перекиси водорода за 1 мин в стандартных условиях. Активность фермента в первой колбе составила 1,43 ед. (14,7 ед/мл экстракта), а во второй 2,74 ед. (13,7 ед/мл
экстракта). Нижняя граница чувствительности 0,01 нмоль. воспроизводимость ±0,01 нмоль.
Использование предлагаемого способа обеспечивает следующие преимущества:
исключается использование редких, дорогих и ядовитых реактивов, что делает процесс определения активности фермента безопасным для человека и дешевым по стоимости; повышена чувствительность способа в 10 раз; обеспечивается возможность контроля кинетики накопления перекиси водорода в реакционной смеси при ее инкубировании, что позволяет оценивать качество фермента; реактивы и прибор
отечественного производства и внедрить предлагаемый способ в практику не составляет труда.
Формула изобретения Способ определения активности L-лизинcr-оксидазы в водном экстракте культуры гриба рода Trichoderma, лредусматриваю- щий приготовление реакционной смеси, состоящей из фосфатного буфера, водного раствора L-лизина и водного экстракта культуры, инкубирование ее в термостате с последующей оценкой результатов, отличающийся тем, что, с целью повышения чувствительности способа, его упрощения, ускорения и безопасности, компоненты реакционной смеси берут в следующем количественном соотношении, об.%;
Фосфатный буфер 0,7-0,8
Водный раствор L-лизина с концентрацией 1,46 мг/мл 0,1
Водный экстракт культуры 0,1-0,2 после инкубирования в реакционную смесь дополнительно вводят 0,1-0.8%-ный раствор люминола с рН 10.0-13.8, содержащий гемин из расчета 0,04-10,0 мг/л раствора
яюминола, при соотношении реакционной смеси и люминолгеминового состава 1:10, а
результат оценивают люминометрическим методом.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения активности @ -лизин- @ -оксидазы | 1982 |
|
SU1047957A1 |
| Способ определения перекисных соединений | 1990 |
|
SU1749795A1 |
| ШТАММ Trichoderma harzianum Rifai - ПРОДУЦЕНТ ИНГИБИТОРА ВИРУСА КОЛЬЦЕВОЙ ПЯТНИСТОСТИ ТАБАКА (Tobacco ringspot virus) | 2011 |
|
RU2475528C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ L-ЛИЗИН-АЛЬФА-ОКСИДАЗЫ | 2011 |
|
RU2471866C1 |
| Способ определения активности оксидазы- @ -аминокислот | 1983 |
|
SU1217879A1 |
| ПРОДУЦЕНТ ИНГИБИТОРА МИКОПЛАЗМЫ (Mycoplasma hominis) | 2014 |
|
RU2569150C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРОВИНОГРАДНОЙ КИСЛОТЫ | 1994 |
|
RU2123529C1 |
| ПОЛИФУНКЦИОНАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ L-ЛИЗИН-α-ОКСИДАЗЫ ИЗ ГРИБА РОДА TRICHODERMA И СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ФЕРМЕНТА | 2002 |
|
RU2233171C2 |
| ПРОДУЦЕНТ ИНГИБИТОРА ВИРУСА НЕКРОТИЧЕСКОЙ ПЯТНИСТОСТИ БАЛЬЗАМИНА | 2010 |
|
RU2481392C2 |
| ПРОДУЦЕНТ ИНГИБИТОРА ВОЗБУДИТЕЛЯ БАКТЕРИАЛЬНОЙ ПЯТНИСТОСТИ ТЫКВЕННЫХ КУЛЬТУР (Acidovorax citrulli) | 2013 |
|
RU2535983C1 |
Использование: микробиология, фармацевтическая промышленность, медицина. Сущность изобретения: готовят реакционную смесь, содержащую, об:%: фосфатный буфер 0.7-0,8; водный раствор L-лизина с концентрацией 1,46 мг/мл 0,1; водный экстракт культуры гриба рода Trichoderma 0,1-0,2. После инкубирования смеси дополнительно вводят в нее 0,1- 0,8%-ный раствор люминола с рН 10,0-13,8, в 1 л которого растворено 0,04-10,00 мг ге- мина. Соотношение реакционной смеси и люминолгеминового состава устанавливают равным 1:10. Результат оценивают люми- нометрическим методом. 5 ил., 1 табл.
Ло
I
I
10
25 i5678
Концентрация перекиси водорода, нмоль
Фиг.1
7
А
0,1-ОД
7
VL
fo
f«0
5
«
мс
О СЕ
80
ьс
s о
и
iO
NX.
13 15678S
Концентрация перекиси водорода, пмоль
в, од с,5 с, 4 .5 f.6 с. о,& Концентрация перекиси водорода нмоль
Фиг.З
/
/
01-003
я
49-1,0
t
11
Фиг. 5
| Способ определения активности @ -лизин- @ -оксидазы | 1983 |
|
SU1163268A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Гребенчатая передача | 1916 |
|
SU1983A1 |
Авторы
Даты
1992-06-30—Публикация
1990-04-17—Подача