Изобретение относится к области биотехнологии, точнее к технике культивирования тканевых клеток животных и человека, и может найти применение в медицине, сельском хозяйстве, вирусологии, онкологии, для получения клеточной биомассы, в производстве биологически активных веществ (интерферона, гормонов, антител, ферментов и т.д.) вакцин и сывороток.
Одним из перспективных методов культивирования клеток животных и человека является культивирование на микроносителях, который обеспечивает высокое качество конечных продуктов клеточного и вирусного происхождения [1] Преимущество этого метода состоит в том, что он сочетает монослойное и суспензионное культивирования, позволяя использовать разработанные для суспензий аппаратурно-технические конструкции, и обеспечивает большую развитую поверхность (по отношению к объему) для выращивания. Метод с использованием микроносителей позволяет получать более гомогенную клеточную и вирусную продукцию.
Применение культиваторов спиннерного типа сокращает при этом количество манипуляций при работе, уменьшает риск контаминации культуры, облегчает процесс выращивания клеток и значительно экономит энергоресурсы.
Использование оборудования для суспензионного культивирования облегчает контроль за условиями выращивания клеток, обеспечивается смена питательной среды без значительных потерь микроносителя и клеток при кратковременном отстаивании и концентрировании клеточных суспензий. Важное значение имеет также возможность применять практически любые клеточные системы без предварительной адаптации.
В то же время метод имеет ряд недостатков. Так, микроносители обычно используются однократно, требуют длительной обработки, не выдерживают повторной стерилизации. Отмечается [1,2] что на некоторых из микроносителей не всегда обеспечиваются стабильные результаты, особенно это касается стадии прикрепления клеток к микрогранулам, а также представляет определенные трудности процесс субпассирования клеток.
К числу широко применяемых относятся микроносители с положительным зарядом поверхности, в частности, содержание диэтиламиноэтильные (ДЕАЕ) группы [3] Ионообменный декстран ДЕАЕ-Sephadex A-50 с размером гранул 60-100 мкм в концентрации 1 г/л был использован для культивирования перевиваемых клеточных линий, первичных клеток почек кролика и диплоидных клеток человека. Однако дальнейшее увеличение количества микроносителя в среде не обеспечивало повышения выхода клеток в связи с их токсичностью.
Прототипом изобретения является способ культивирования на микроносителе [4] представляющем собой тройной сополимер состава:
N,N'-диметиламинопропилметакриламид (20-40%) катионсодержащий мономер;
N,N'-метиленбисакриламид (3-10%) сшиватель;
акриламид (40-75%) гидрофильный мономер.
Сополимеризация мономеров проводилась в 0,1 н. водном растворе NaCl, в суспензии в хлороформе, для выделения и отмывки гранул использовался метанол. Полученные таким способом мягкие микросферические гели по свойствам аналогичны ДЕАЕ-целлюлозе фирмы BioRad (Cellex D).
Культивирование на этом микpоносителе клеток Vero (почки африканской зеленой мартышки) проводят в среде Игла с добавлением антибиотиков при концентрации микроносителя 5 г/л при посевной дозе 2 • 105 клеток/мл. Процесс проводят в две стадии: на первой осуществляется прикрепление клеток к носителю при слабом перемешивании (1-2 об/мин) в течение суток, после чего включают режим культивирования, увеличивая скорость перемешивания до 15-20 об/мин. Удвоение урожая наблюдали через 65 ч, а через 16 сут урожай клеток составил 7 • 105 клеток/мл (индекс пролиферации равен 3).
К недостаткам этого способа культивирования относятся:
низкая пролиферативная активность клеток;
длительность процесса прикрепления;
сложная технология получения микроносителя с использованием многокомпонентной системы мономеров и токсичных растворителей (хлороформ, метанол).
Целью изобретения является разработка способа культивации с повышением профилеративной активности клеток и сокращением периода прикрепления клеток к микроносителю. Указанная цель достигается использованием микроносителя, получаемого путем сополимеризации 50-60 моль. N,N'-диэтиламиноэтилметакриламида (ДЕАЕ) с 40-50 мол. N,N'-метиленбисамида (МБА), и проведением стадии прикрепления в режиме культивирования.
Существенным отличием заявляемого способа является новая структура микроносителя, позволяющая эффективно прикреплять живые клетки, причем из-за высоких скоростей посадки и повышенных сорбционных свойств прикрепление определяется возможностью контакта клетки с носителем, т.е. требует более высоких степеней перемешивания, скорость которых ограничивается на верхнем пределе отсутствием повреждающего механического действия мешалки. При более низких скоростях мешалки эффективность процесса снижается из-за большего времени, требующегося для посадки клеток.
Использование новой совокупности признаков позволяет резко снизить время культивирования клеток и повысить их пролиферативную активность.
Сопоставление методов культивирования pазличных клеток в известных условиях и при культивировании на новых сорбентах, получивших наименование "Ольвагели", приведены в примерах.
П р и м е р 1. Методика получения микроносителя "Ольвагель" (60/40).
В стеклянной емкости на 500 мл приготавливали раствор ДЕАЕ-метакриламида (26 ч) (60 мол.) в растворе хлористого натрия (360 ч). В раствор вводили N, N'-метиленбисакриламид (14 ч) (40 мол.) и инициатор персульфат аммония (0,8 ч). В термостатируемый реактор, снабженный механической мешалкой, холодильником и трубкой для барботирования аргона, помещали тридекан (600 ч), содержащий СПАН, и вводили реакционную смесь, приготовленную в стеклянной емкости при непрерывном перемешивании со скоростью 300 об/мин в течение 15 мин при комнатной температуре, далее включали обогрев реактора до 70oC. Процесс сополимеризации проводили в течение 3 ч. Гранулы отмывали от тридекана водой с детергентом, дистиллированной водой и рассеивали на ситах, выделяя фракцию 100-200 мкм.
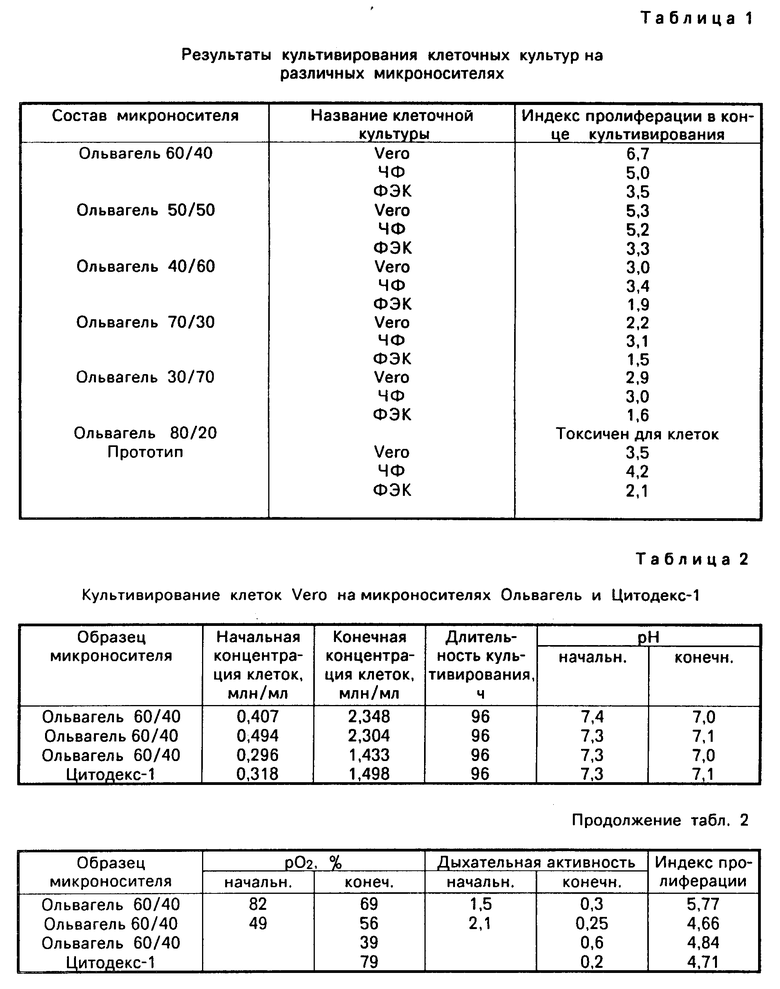
П р и м е р 2. В условиях примера 1 синтезировали микроносители с различным соотношением компонентов (в числителе ДЕАЕ, в знаменателе МБА). Результаты культивирования pазличных культур приведены в табл.1. Более подробно условия культивирования приведены в последующих примерах.
Микроноситель представляет собой сферические гранулы белого цвета, плотность гранул 1,15 г/см3, емкость по функциональным группам ДЕАЕ в пределах 1,1-1,5 мг•экв/г; имеет магистральные поры размером 500-1000  Микроносителю присвоено название Ольвагель.
Микроносителю присвоено название Ольвагель.
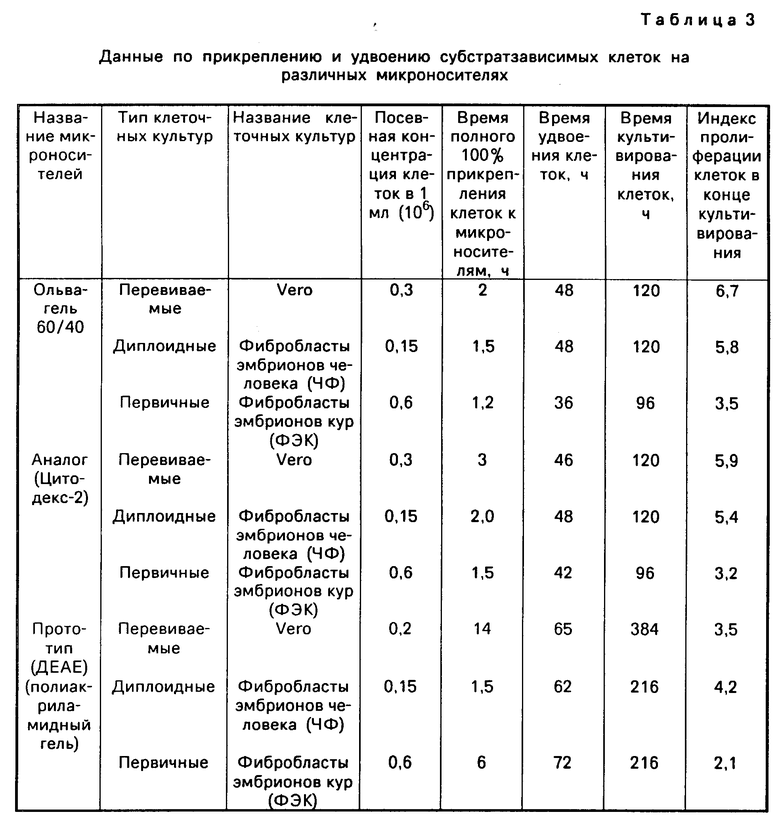
Оценку эксплуатационных характеристик микроносителей проводили на клетках линии Vеro. Культивирование велось в модифицированных ферментах F-2000 фирмы NBS. Подготовка и стерилизация микроносителей осуществлялась в соответствии с рекомендациями фирмы "Фармация" для микроносителей типа "Цитодекс". В качестве контроля при культивировании использовали микроносители Цитодекс-1.
Условия проведения экспериментов:
Объем заполнения ферментера культуральной жидкостью 1,0 л.
Концентрация микроносителя 5,0 г/л.
Посевная концентрация клеток 0,3-0,5 млн/мл.
Аэрирование поверхностное, переменное.
Состав культуральной жидкости:
среда Игла НЕМ, 90%
сыворотка КРС, 10%
глютамин, 0,6 г/л;
антибиотики.
Учет результатов проводили по максимальной концентрации клеток через 4 сут. Результаты культивирования см. в табл.2.
П р и м е р 3. Культивирование фибробластов эмбрионов кур (ФЭК) на микроносителях.
2,3 мл гидратированного осадка микроносителей Ольвагель, аналога Цитодекс-2 и прототипа ДЕАЕ-полиакриламидный гель, обеспечивающий культуральную поверхность 825 см2 для 0,6 • 106 свежеизолированных клеток куриных эмбрионов 9-дневного возраста культивируют в 50 мл питательной среды 199 без добавления глютамина, содержащей 10% сыворотки крупного рогатого скота и антибиотики.
Культивирование клеток на микроносителях Ольвагель и аналога проводили 4 сут, на прототипе 9 сут в сосуде объемом 150 см3 при перемешивании со скоростью 15-20 об/мин и ежедневной смене питательной среды на 50% начиная с вторых суток культивирования.
Количество клеток ФЭК в 1 мл в конце культивирования (урожай клеток) на микроносителях Ольвагель составляло 2,1 • 106 кл/мл (индекс пролиферации 3,5) (табл. 3)). Аналогичные результаты были получены при культивировании клеток ФЭК на микроносителе-аналоге (индекс пролиферации клеток 3,2).
При культивировании клеток на микроносителе-прототипе количество клеток в конце культивирования (96 ч) было 0,7 • 106 клеток в 1 мл (индекс пролиферации 1,2).
При более длительном культивировании клеток ФЭК (216 ч) на микроносителе-прототипе (табл. 3) не удалось достичь индекса пролиферации клеток, полученного при их культивировании на микроносителе Ольвагель в течение 96 ч (2,1 против 3,5).
Использование микроносителя Ольвагель для культивирования клеток ФЭК позволяет сократить время прикрепления клеток к микроносителю более чем в 5 раз по сравнению с прикреплением клеток на прототипе (табл.3), при использовании Ольвагеля более чем на сутки сокращается время удвоения количества клеток и увеличивается их окончательная концентрация в конце культивирования.
П р и м е р 4. Культивирование диплоидных фибробластоподобных клеток эмбриона человека.
Культивирование проводят, как в примере 3, с той разницей, что для 2,3 мл осадка микроносителей площадь их культуральной поверхности 825 см2, берут посевную концентрацию клеток 0,15 • 106 кл/мл. Урожай клеток на пятые сутки (табл. 3) в объеме культивирования составлял на микроносителе Ольвагель 0,87 • 106 клеток в 1 мл (индекс пролиферации 5,8). При культивировании на аналоге урожай был 0,8 • 106 кл/мл (индекс пролиферации 5,4), на прототипе 0,49 • 106 кл/мл (индекс пролиферации 3,3).
При культивировании клеток на Ольвагеле было показано, что по отношению к прототипу здесь на 3 ч меньше время прикрепления клеток и в 2 раза меньше время удвоения клеток при более высоком индексе пролиферации в конце культивирования.
Даже при культивировании на 5 сут дольше (216 ч) на прототипе не был получен результат, получаемый на Ольвагеле на четвертые сутки (через 96 ч). Соответственно индексы пролиферации 4,2 и 5,8.
П р и м е р 5. Культивирование перевиваемых клеточных линий на микроносителях.
Культивирование перевиваемых клеточных линий Vero проводили: как описано в примере 3, с той лишь разницей, что для 2,3 мл осадка микроносителей, обеспечивающих площадь поверхности 825 см2, брали посевную концентрацию клеток Vero 0,3 • 106 кл/мл, а Нер-2 и L-41 0,2 • 106 кл/мл.
Урожай клеток Vero в объеме культивирования на микроносителях Ольвагель на 4 сут (96 ч) составлял 2,02 • 106 кл/мл (индекс пролиферации 6,7) (табл. 3), на аналоге Цитодекс-2 1,7 • 106 кл/мл (индекс пролиферации 5,9), на прототипе 0,7 • 106 кл/мл (индекс пролиферации 3,5).
При культивировании клеток Нер-2 на микроносителях Ольвагель их урожай составлял 0,8 • 106 кл/мл (индекс пролиферации 3,9), на прототипе 0,24 • 106 кл/мл (индекс пролиферации 2,4).
Урожай клеток L-41 при культивировании их на микроносителях Ольвагель был на 4 сут культивирования 0,6 • 106 кл/мл (индекс пролиферации 3,5), на аналоге 0,58 • 106 кл/мл (индекс пролиферации 2,9), на прототипе 0,26 • 106 кл/мл (индекс пролиферации 1,3).
На пpототипе клетки Vero культивировали в течение 16 сут (384 ч), однако не были достигнуты результаты культивирования клеток в течение 5 сут (120 ч), на микроносителе Ольвагель. Соответственно индексы пролиферации 3,5 против 6,7.
Как видно из приведенных примеров, при культивировании широкого круга клеток на микроносителях Ольвагель удается при сокращении времени культивирования в 1,5-2,0 раза получить повышенный урожай биомассы. ТТТ1 ТТТ2
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВИРИОННОЙ ГЕРПЕТИЧЕСКОЙ ВАКЦИНЫ | 1991 |
|
RU2014084C1 |
| СПОСОБ СУСПЕНЗИОННОГО КУЛЬТИВИРОВАНИЯ ФИЛОВИРУСОВ В КЛЕТОЧНЫХ КУЛЬТУРАХ НА МИКРОНОСИТЕЛЯХ | 1993 |
|
RU2076905C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1993 |
|
RU2082432C1 |
| Способ определения пригодности микроносителя для культивирования клеток животных | 1988 |
|
SU1703685A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВИРУССОДЕРЖАЩЕГО МАТЕРИАЛА ДЛЯ ИЗГОТОВЛЕНИЯ АНТИРАБИЧЕСКОЙ ВАКЦИНЫ | 1994 |
|
RU2083668C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2003 |
|
RU2330885C2 |
| МИКРОНОСИТЕЛЬ ДЛЯ КУЛЬТИВИРОВАНИЯ СУБСТРАТЗАВИСИМЫХ КЛЕТОК ЖИВОТНЫХ IN VITRO | 2006 |
|
RU2328527C1 |
| СУБСТРАТ ДЛЯ КУЛЬТИВИРОВАНИЯ ФЛАВИВИРУСОВ ИЛИ АРЕНОВИРУСОВ НА ОСНОВЕ КУЛЬТУРЫ КЛЕТОК И СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНА ФЛАВИВИРУСА ИЛИ АРЕНОВИРУСА | 1990 |
|
RU2082757C1 |
| Способ получения желатиновых микроносителей для культивирования клеток животных | 1990 |
|
SU1724687A1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕРПЕТИЧЕСКОЙ ВАКЦИНЫ И ЛЕКАРСТВЕННАЯ ФОРМА НА ЕЕ ОСНОВЕ | 1997 |
|
RU2142816C1 |
Использование: медицина, сельское хозяйство, биотехнология - технология культивирования тканевых клеток животных и человека. Цель: повышение пролиферативной активности клеток и сокращение периода прикрепления к микроносителю. Сущность изобретения: микроноситель получают путем сополимеризации N, N'-диэтиламиноэтилметакриламида (50-60 мол. %) с N,N'-метиленбисакриламида (40-50 мол. %). Микроноситель представляет собой сферические гранулы белого цвета, плотность гранул 1,15 г/см3, емкость по функциональным группам ДЭАЭ в пределах 1,1-1,5 мг• экв/г, размер пор 500-1000  . Прикрепление клеток к микроносителю проводят в режиме культивирования при перемешивании со скоростью 15-20 об/мин. 3 табл.
. Прикрепление клеток к микроносителю проводят в режиме культивирования при перемешивании со скоростью 15-20 об/мин. 3 табл.
Способ культивирования опорно-зависимых клеточных культур, предусматривающий прикрепление клеток к микросферическим носителям, полученным сополимеризацией катионного мономера с акриламидным сшивателем, и выращивание при 40 60°С при перемешивании со скоростью 15 20 мин-1, отличающийся тем, что, с целью сокращения периода прикрепления клеток и повышения их пролиферативной активности, в качестве микроносителя используют сополимер с содержанием 50 60 мол. катионного мономера и 40 50 мол. акриламидного сшивателя N,N'-метиленбисакриламида, при этом в качестве катионного мономера используют N,N'-диэтиламиноэтилметакриламид, а прикрепление клеток ведут в условиях режима выращивания.
| Грудина Н.В., Сергеев В.А., Хижинская В.П | |||
| Выращивание культур клеток животных на микроносителях | |||
| - Сельскохоз | |||
| биология, N 2, c.85-91, 1985 | |||
| Van Wezel A.L.Nature, 216,64,1967 | |||
| Levine D.W., Thilly W.G.D., Pat | |||
| US N 4036693 Патент США N 4237218, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
Авторы
Даты
1996-08-20—Публикация
1990-05-14—Подача