Предлагается способ получения производных хинолина общей формулы
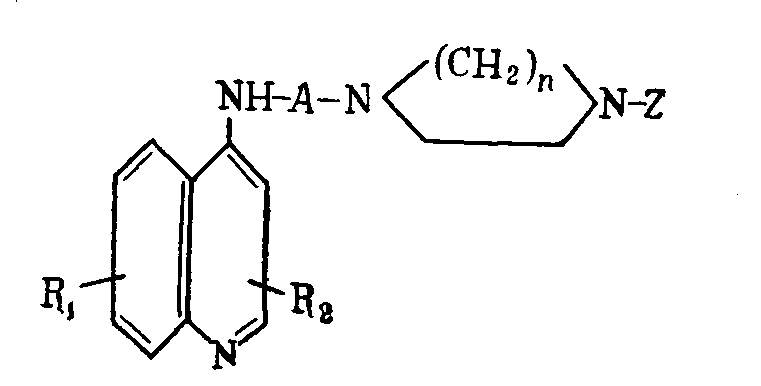
где А - alk с числом атомов С 2-6;
Z - остаток пиридина, пиримидина, 2-аминопиримидина, 2-амино-4-этил-5-хлорфенилпиримидина, 4-метил-2-хлорфениламинопиримидина, 2-метокси-6-хлоракридина, фенил-2-пиридин, хинолин, содержащий заместители: галоген, алкил, диалкилсульфамил, трифторметил, алкоксил, амин или алкиламин;
R1 - водород, галоид, алкил, алкилокси-, алкилтио-, алкансульфонил-, диалкилсульфамил-, амино-, алкиламино-, нитро-, циано- или трифторметильные группы в положении 5, 6, 7 или 8;
R2 - водород, галоид, алкил, фенил в положении 2 или 3;
n - 2 или 3,
заключается во взаимодействии хлорпроизводных, указанных [Z]-гетероциклов с пиперазин-алкилхинолинами.
Пример 1. Смесь из 20 г (пиперазин-5-пентил-2)-амин-4-хлор-7-хинолина, 5,85 г хлор 4-пиридина и 15 г фенола, перемешивая, подогревают 30 мин при 130°С. Температуру до 125°С поддерживают 20 час. Затем вещество охлаждают до 80°С и пастообразную массу выливают в смесь, состоящую из 200 см3 хлороформа, 200 см3 воды и 60 см3 10 N натрия. В течение 1 час вещество перемешивают, декантируют и экстрагируют водную фазу в два приема 100 см3 хлороформа. Хлороформные экстракты объединяют и выливают, перемешивая, в раствор 30 г чистой метансульфокислоты в 100 см3 воды. 15 мин вещество перемешивают, декантируют и экстрагируют хлороформный слой в три приема 200 см3 воды. Водные экстракты соединяют и перемешивают 15 мин с 1 г растительного угля. Затем вещество фильтруют, добавляют в фильтрат 400 см3 хлористого метилена и подщелачивают до рН 13 10 N натрием. Затем снова производят декантирование и экстрагирование водной фазы в три приема 150 см3 хлористого метилена. Органические фазы объединяют, высушивают на сульфате натрия, фильтруют и отгоняют растворитель в водяной бане. Получают 19,86 г неочищенного продукта, который растворяют в 250 см3 хлористого метилена. Раствор хроматографируют на колонне, содержащей 20 г окиси алюминия.
Извлечение адсорбированного вещества производят при помощи 1000 см3 хлористого метилена, а затем при помощи 1000 см3 хлористого метилена с 1% этанола. Растворители извлеченных адсорбированных веществ отгоняют и повторно кристаллизуют остатки (13,2 г) в 250 см3 изопропанола. Получают 9,7 г (хлор-7′′-хинолил-4′′)-амин-4′-пентил-1-(пиридил-4′′′)-1-пиперазина с т. пл. 191-192°С.
Пример 2. Действуя, как в примере 1, на основе 10 г (пиперазин-5′-пентил-2′)-амин-4-хлор-7-хинолина, 8,04 г амин-2-этил-4-хлор-фенил-5-хлор-6-пиримидина и 15,4 г фенола получают 8,6 г (хлор-7′′-хинолил-4′′)-амин-4-пентил-1-(амин-2-этил-4′′′-хлорфенил-5′′′-пи-римидин-6′′′)-4-пиперазина с т. пл. 114-117°С (исходный амин-2-этил-4-хлорфенил-5-хлор-6-пиримидин был приготовлен по методу Ф. Курд и др. I. Chem. Soc., стр. 378, 1946).
Пример 3. Действуя, как в примере 1, на основе 10 г (пиперазин-5′-пентил-2′)-амин-4-хлор-7-хинолина, 15,3 г хлорфениламин-2-хлор-4-метил-6-пиримидина (приготовленного по Ф. Курд и Ф. Роз I. Chem. Soc., стр. 349, 1946) и 17 г фенола, но хроматографируя раствор неочищенного продукта в смеси 10 см3 бензола и 40 см3 хлористого метилена и последовательно извлекая адсорбированное вещество при помощи 500 см3 смеси бензол - хлористый метилен (1:3), 4 л хлористого метилена и 750 см3 хлористого метилена с 1% этанола, после испарения растворителей получают 10,27 г масла, которое растворяют в растворе 12,4 г чистой метансульфокислоты в 500 см3 воды. Этот раствор перемешивают с 0,5 г растительного угля. После фильтрации его подщелачивают 200 см3 10 N натрия до рН 13 в холодной ванне и при постоянном перемешивании. Получают белое вещество, которое фильтруют, промывают водой и высушивают при 50°С. Таким образом получают 8,07 г (хлор-7′′-хинолил-4′′)-пентил-1-амин-4′-(хлорфенил-2′′′-метил-4′′′-пиримидил-6′′′)-4-пиперазина с т. пл. 106-110°С.
Пример 4. Смесь, содержащую 10 г (пиперазин-5′-пентил-2′)-амин-4-хлор-7-хинолина, 8,55 г метокси-2-дихлор-6,9-акридина и 30 г фенола, подогревают 30 мин при 135°С. Затем смесь охлаждают до 125°С и оставляют при этой температуре на 30 мин. Далее смесь снова охлаждают до 80°С и выливают, перемешивая реактивную среду, в смесь из 100 см3 хлороформа, 100 см3 воды и 30 см3 10 N натрия. В течение 1 час смесь перемешивают, декантируют и экстрагируют водную фазу в два приема при помощи 100 см3 хлороформа. Хлороформные экстракты соединяют и выливают в раствор из 15 г метансульфокислоты в 1 л воды. Затем смесь перемешивают 15 мин, декантируют, экстрагируют хлороформный слой в три приема 100 см3 воды, водный слой перемешивают, а водные экстракты соединяют в течение 15 мин с 0,5 г растительного угля, после чего смесь фильтруют. Вещество подщелачивают 10 N натрием и экстрагируют в три приема 200 см3 хлористого метилена. Органическую фазу высушивают на сульфате натрия, фильтруют и вводят в сухом состоянии в водяную баню. Получают 14 г масла, которое удаляют 100 см3 смеси бензол - хлористый метилен (1:1), а раствор хроматографируют на колонне, содержащей 150 г окиси алюминия. Извлечение адсорбированного вещества проводят 100 см3 хлористого метилена и 100 см3 хлористого метилена с 1% этанола. После испарения растворителей остается 5 г флюресцентного кристаллического вещества.
Это вещество подвергают вторичной кристаллизации в 250 см3 этанола. После фильтрации, отжимки и просушки получают 4,35 г (хлор-7′′-хинолил-4′′)-амин-4′-пентил-1-(метокси-2′′′-хлор-6′′′-акридил-9′′′)-4-пиперазина с т. пл. 136-138°С.
Пример 5. Смесь из 58,1 г (амин-3′-пропил)-1-(хлор-7′′-хинолил-4′′)-4-пиперазина, 37,8 г дихлор-4,7-хинолина и 36 г фенола подогревают 4 час при 180°С. Затем ее охлаждают до 125°С, после чего выливают в раствор, состоящий из 25 г едкого натра и 200 см3 дистиллированной воды и сразу же удаляют основание при 1000 см3 хлороформа. Раствор высушивают на безводном сульфате натрия и подвергают хроматографии на 600 г окиси алюминия в колонне диаметром 4,5 см и высотой 40 см. Извлечение адсорбированного вещества проводят 2 л хлороформа, после чего извлеченные адсорбированные вещества разделяют на части по 500 см3. Концентрацией до получения сухого состояния третьего и четвертого объединенных извлеченных адсорбированных веществ и двойной последовательной кристаллизацией соответственно в 80 и 60 см3 ацетонитрила получают 7,8 г (хлор-7′′-хинолил-4′′)-амин-3′-пропил-1-(хлор-7′′′-хинолил-4′′′)-4-пиперазина с т. пл. 176-177°С без понижения давления.
Амин-3′-пропил-1-(хлор-7′′-хинолил-4′′)-4-пиперазин был получен при помощи удаления фталимида из (фталимид-3′-пропил)-1-(хлор-7′′-хинолил-4′′)-4-пиперазина. Его можно получать также конденсацией дихлор-4,7-хинолина на фталимид-3′-пропилпиперазине.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-АРИЛПИПЕРАЗИНАЛКАНАМИДА | 1988 |
|
RU2014328C1 |
| ПРОИЗВОДНЫЕ 1,3-ЗАМЕЩЕННОГО ЦИКЛОАЛКЕНА И ЦИКЛОАЛКАНА В ФОРМЕ СМЕСИ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫХ ИЗОМЕРОВ, ИЛИ ИХ ГИДРАТЫ, ИЛИ СОЛИ | 1992 |
|
RU2116297C1 |
| Способ получения ароилзамещенных фенилуксусных кислот | 1973 |
|
SU719490A3 |
| Способ получения 2-(4-замещенных пиперазино-4-амино-6,7-диметокси)хинолинов или их гидрохлоридов | 1984 |
|
SU1340589A3 |
| Способ получения гетероциклических соединений | 1975 |
|
SU673173A3 |
| Способ получения амидных производных хинолина или их солей с кислотами | 1986 |
|
SU1508957A3 |
| СПОСОБ ПОЛУЧЕНИЯ\-ЗАМЕ1ЦЕННЫХ ИЛИ \,\-ДИЗАМЕЩЕННЫХ АМИНОКАРБОНИЛАЛКИЛЬНЫХ СОЕДИНЕНИЙ | 1968 |
|
SU422153A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-БЕНЗОДНАЗЕПИНОНА-2 ИЛИ ИХ СОЛЕЙ | 1970 |
|
SU417948A3 |
| ТИОКСАНТЕНОНОВЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2138495C1 |
| ДИАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ | 1992 |
|
RU2099335C1 |
Способ получения производных хинолина общей формулы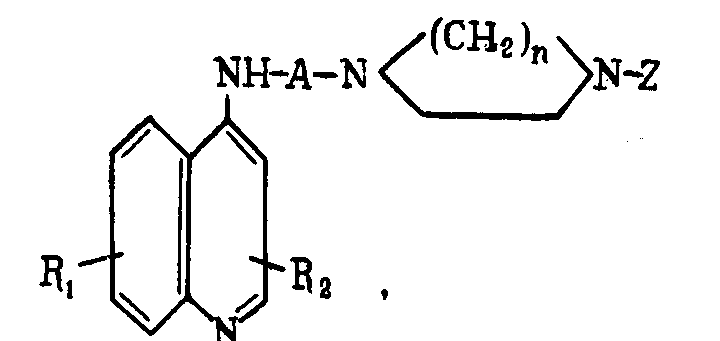
где А - alk с числом атомов С 2-6; Z - остаток пиридина, пиримидина, 2-аминопиримидина, 2-амино-4-этил-5-хлорфенилпиримидина, 4-метил-2-хлорфениламинопиримидина, 2-метокси-6-хлоракридина, фенил-2-пиридин, хинолин, содержащий заместители: галоген, алкил, диалкилсульфамил, трифторметил, алкоксил, амин или алкиламин; R1 - водород, галоид, алкил, алкилокси-, алкилтио-, алкансульфонил-, диалкилсульфамил-, амино-, алкиламино-, нитро, циано- или трифторметильные группы в положении 5, 6, 7 или 8; R2 - водород, галоид, алкил, фенил в положении 2 или 3; n - 2 или 3, отличающийся тем, что хлорпроизводные указанных [Z]-гетероциклов подвергают взаимодействию с пиперазиналкилхинолинами.
Авторы
Даты
1968-07-03—Публикация
1962-06-14—Подача