3150
Изобретение относится к способам получения новых амидных производных хинолина, которые связываются с рецепторами бензодиазепинов церебраль- ного типа и, следовательно, пригодны в качестве анксиолитических агентов.
Пример 1. В течение 8 ч 30 мин кипятят с обратным холодильником 3,5 г | 2-фенил-4-хинолил -глико- левой Лислоты и 2,8 см тионилхлори- да в 300 см хлороформа.
Растворители удаляют при пониженном давлении, полученный остаток в течение 15 мин добавляют к предвари- тельно охлажденному до 5°С раствору 13 см диэтиламина в 100 см метилен хлорида. Перемешивают в течение 1ч 30 мин при 5-10 С, органическую фазу промывают 6 раз 100 см воды, высу- шивают над сульфатом магния и выпаривают при пониженном давлении. Полученный остаток подвергают хроматографии на силикагеле, используя в качестве элюента смесь циклогексан - этилацетат (80-20).
Полученный остаток перекристалли- зовывают из смеси диизопропилового эфира с ацетонитрилом (10:1). Таким образом, выделяют 1,91 г Ы,Н-диэтил- - 2-фенил-А-хинолил-4-окси -ацетамид с т. пл. 97°С.
2-Фенил-4-хинолил -гликолевая кислота может быть приготовлена омылением соответствующего сложного эти лового эфира с помощью 1 н. раствора гидроксида натрия. Ее т.пл. 178
181°С.
Этил I L2-фeнил-4-xинoлилJ-оксиаце татА может быть приготовлен следую- щим образом.
К перемешиваемой суспензии 8,8 г 2-фенил-4-хинолинола и 11 г карбоната калия в 300 СМ метилэтилкетона
л
прикапывают 4,4 см этила бромацета- та.
Кипятят с обратным холодильником в. течение 3 ч. Затем доводят до комнатной температуры (около 20°С), отсасывают нерастворимое вещество и удаляют растворители при пониженном :давлении.
Остаток обрабатывают ТОО см 5 пет- ролейного эфира с т.кип. 40-70 С и затем фил5.труют. Таким образом вьще- ляют 11,1 г этил- 2-фенил-4-хино- лил -оксиацетата с т.пл. 96 С.
2-фенил- 2-хинолинол получают известным способом.
Пример 2. Используют методику примера 1 , но берут 3 г | 2-фенил- -4-хинолил -гликолевой кислоты, 2,35 см тионилхлорида в 50 см хлороформа, 1.,04 см пиперидина и 3 см триэтиламина в 50 см толуола. Полученный остаток в ацетоне превращают в е го хлоргидрат путем добавления раствора соляной кислоты в диэтиловом эфире. После перекристаллизации из этанола получают 0,46 г 1-|(2-фенил- -4-хинолил)-оксиацетил -пиперидин- ; -хлоргидрата, имеющего т. пл. 146 С.
Пример 3. Следуют методике примера 1, но берут 3 г 2-фенил-4- -хинолил -гликолевой кислоты, 2,35 см тионилхлорида в 80 см хлороформа, 1,18 см N-метилпиперазина и 3 см триэтиламина в 50 см толуола.
Полученный остаток обрабатывают ацетоном и после добавления раствора соляной кислоты в диэтиловом эфире выделяют 1,1 г 4-метил-1-(2-фе- нил-4-хинолил)-оксиацетилЗ -пиперазин- -дихлоргидрата с т.пл. 182°С.
Пример 4. Следуют методике примера 1, но берут 3 г |2-фенил-4- -хинолил -гликолевой кислоты,3,12 см тионилхлорида в 100 см хлороформа, 0,94 см морфолина и 3 см триэтиламина в 50 см толуола.
Полученный остаток два раза .пере- , кристаллизуют из этилацетата. Таким о&разом получают 1,43 г 4-|(2-фенил- -4-хинолил) -оксиацетил -морфолина с т. пл. 145° С. .
Пример 5. Следуют методике примера 1, но берут 3 г 2-фенил-4- -хинолил г ликолевой кислоты, 3,12 см тионилхлорида в 100 см триэтиламина, 1,39 г Н-метил-2-бутамина и 3 см триэтиламина в 50 см толуола.
Полученный остаток обрабатывают ацетоном и после, добавления раствора кислоты в диэтиловом эфире и двух рекристаллизации (первую осуществляют из смеси этанол - диэтиловый эфир, вторую - из изопропанола) выделяют 0,69 г N-MeTHH-N- 1-метилпро- пил - 2-фенил-4-хинолил -оксиацет- амид-хлоргидрата с т.пл. .
Пример 6, В течение 3 ч кипятят с обратным холодильником 1,8 г 2-фенил-4-хинолил -гликолевой кислоты и 1,41 см тионипхлорида в 54 см хлороформа. Растворитель удаляют при пониженном давлении и полу-
ченный остаток суспендируют в хлороформа.
К этой суспензии медленно при по- j мешивании добавляют 0,83 см N-ме- тилбензиламина и 2 см триэтиламина в 10 см хлороформа, поддерживая температуру 10°С. Перемешивают в течение 15 мин при комнатной температуре 10 (около 20 с), выпаривают растворитель при пониженном давлении и остаток обрабатывают 50 см этилацетата и 20 см воды (органическую фазу декантируют, промывают 2 раза 10 см воды, затем 10 см 1н. раствора соляной кислоты и, наконец, 10 см воды).
После выпаривания растворителя при пониженном давлении остаток растворяют в ацетонитриле и кристаллизуют при медленном добавлении ди- изопропилового эфира. После перекристаллизации сырого продукта из смеси ацетонитрил - диизопропиловый эфир выделяют 0,85 г Н-бензил-К-метил. - 2-фeнил-4-xинoлилJ -оксиацетамида, имеющего т, пл. 102°С.
Пример 7. Следуют методике примера 1, но берут 6 г 2-фенил-4- -хинолил -гликолевой кислоты,4,6 см тионилхлорида в 180 см хлороформа,
3,31 г этил-(1-пиперазин)-карболата и 6,5 см триэтиламина в 200 см хлороформа.
После перекристаллизации остатка из смеси этилацетат - этанол (5:1). выделяют 3 г этил-4-(2-фенил-4-хино- лил)-оксиацетил -1-пиперазин-карбоксилата, имеющего т.пл. 163°С.
Пример 8. Следуют методике примера 1 , но берут 2 г 2-фенил-4- -хинолилЗ-гликолевой кислоты, 1,5 см тионилхлорида в 70 см хлороформа, г тиоморфолина и см триэтиламина в 70 см хлороформа.
После растворения в этилацетате и кристаллизации путем добавления ди- изопропилового эфира выделяют 1,8 г 4- р2-фенил-4-хинолил)-оксиацетилЛ - -тиоморфолина, имеющего т.пл. 130 С.
Пример 9. Следуют методике примера 1, но берут 2,2 г 4-хлор- -2-фенил-4-хинолил1 -гликолевой кисЧ
лоты, 1,5 тионилхлорида в 70 см хлороформа, 0,71 г тиоморфолина и 2,1 см триэтиламина в 70 см хлороформа.
1508957
40 см После перекристаллизация из этил- ацетата выделяют 0,8 г (4-хлор- фенил-4-хинолнл)-оксиацетил -тиоморфолина с т.пл. 117°С.
4-хлор-2-фенил-4-хинолил -глико- левую кислоту получают так же, как 2-фенил-4-хинолил -гликолевую кислоту (пример 1). Ее т.пл. 230 с (с разложением).
Пример 10. Следуют методике примера 1, но берут 3 г 2-фенил-4хинолил }-гликолевой кислоты, 3,8 см тионилхлорида в 90 см хлороформа, 12,5 см ЗМ раствора диметиламина в толуоле и сокращают время приготовления хлорангидрида кислоты до 3 ч.
После перекристаллизации остатка из смеси толуол - диизопропиловый эфир выделяют 2,2 г Н,Ы-диметил- 2-(Ьенш1-4-хинолил1 -оксиацетамида с
о - т. ПЛ. 112с.
Пример 11. Следуют методике примера 1, но берут 3 г 2-фенил-4- -хинолил -гликолевой кислоты, 3,8 см тионилхлорида в 90 см хлороформа и 2,7 см N-метилизопропиламина в 90 см хлороформа и сокращают время
30 приготовления хлорангидрида кислоты до 3 ч.
После проведения хроматографии остатка на силикагеле с использованием в качестве элюанта смеси цикло35 гексан - этилацетат (50:50) и перекристаллизации из диизопропилового эфира выделяют 1,3 г N-мeтил-N-изo- пропил-Г2-фенил-4-хинолил -оксиацет- амида, имеющего т.пл. 80°С.
40 Пример 12. Следуют методике примера 1, но берут 3 г | 2-фенил-4- -хинолил -гликолевой кислоты, 3,8 см тионилхлорида в 90 см хлороформа и сокращают время приготовления хлор45 ангидрида кислоты до 3 ч.
После проведения хроматографии остатка на силикагеле с помощью смеси циклогексан - этилацетат, используемой в качестве элюанта, и пере50 кристаллизации из диизопропилов.ого эфира, вьщеляют 1,7 г 2,6-диметил- -4-(2-фeнил-4-xинoлил)-oкcиaцeтилJ -морфолина, имеющего т.пл. 117°С. Пример 13. Следуют методике
55 примера 1, но берут 3 г 2-фенил-4- -хинолилП-гликолевой кислоты,3,,8 см
тионилхлорида в 90 см и
хлороформа
1,08 г 4-оксипиперидина и 3,25 см триэтиленамина в 90 см хлороформа
тионилхлорида в 90 см и
хлороформа
1,08 г 4-оксипиперидина и 3,25 см триэтиленамина в 90 см хлороформа
и сокращают время приготовления хлорангидрида кислоты до 3ч.
Остаток обрабатывают этанолом и после добавления раствора соляной кислоты в диэтиловом эфире выделяют 3 г хлоргидрата 1-(2-фенил-4-хино- лил)-оксиацетил -4-пиперидинола с т.пл. 185° С.
Пример 14. Следуют методик примера 1 , но берут 3 г 2-фенил-4- -хинолил -гликолевой кислоты,3,8 см тионилхлорида в 90 см хлороформа,
1,34 г Ы-метш1-2-метоксиэтиламин-. а
-хлоргидрата, 4,5 см триэтиламина в 90 см хлороформа и сокращают время приготовления хлорангидрида кислоты до 3 ч.
После осуществления двух перекристаллизаций из смеси этилацетат - 20 лил)-оксиацетамида, имеющего т.пл. диизопропиловый эфир выделяют 1,6 г
189 С.
35
N-мeтил-N- 2-метоксиэтил - 2-фeнил- -4-xинoлил -oкcиaцeтaмидa, имеющего т.пл. 109°С.
Ы-метил-2-метоксиэтиламин может 25 быть приготовлен по методу Мидшояна и др.
Пример 15. Следуют методике примера 1, но берут 3 г 2-фенил-4- -хинолил -гликолевой кислоты,3,8 см зо тионилхлорида в 90 см хлороформа, 3,2 г 1-ацетил-пиперазин-паратолуол- сульфоната, 4,5 см триэтиламина в 90 см хлороформа и уменьшают время приготовления хлорангидрида кислоты до 3 ч.
После проведения хроматографии остатка на силикагеле при использовании смеси этилацетат - хлороформ - этанол (70:20:10) в качестве элюан- та и перекристаллизации из смеси этанол - диизопропиловый эфир выделяют 1 г 1-ацетил-4-(2-фенил-4-хи- нолил)-оксиацетш1 -пиперазина с
т.пл. .
I 45
1-Ацетил-пиперазин-паратолуолсуль- фонат может быть получен согласно известному способу.
Пример 16. Следуют методике примера 1, но берут 3 г 2-фенил-4- 0 -хинолил -гликолевой кислоты,3,8 см тионилхлорида в 90 см хлороформа, 1,07 г 2-пипёразинона и 3,25 см триэтиламина в 90 см хлороформа и сокращают время приготовления хлор- 55 ангидрида кислоты до 3 ч..
По окончании реакции осадок отсасывают, промывают водой, затем де- цинормальным раствором гидроксида
40
Пример 18. Следуют методик примера 1, но берут 3 г 2-фенил-4- -xинoлилJ-гликoлeвoй кислоты,3,8 см тионилхлорида в 90 см хлороформа.
Остаток хроматографируют на си- ликагеле при использовании смеси циклогексан - этилацетат (50:50) в качестве элюанта.
.Остаток обрабатывают (извлекают) ацетоном и после добавления раствора соляной кислоты в диэтиловом эфире выделяют 1,6 N-циклопропил- метил-К-метил 2-фенил-4-хинолил -ок сиацетамид-хлоргидрата, имеющего т.пл. 178°С.
Пример 19. Следуют методик примера 1 , но берут 6 г { 2-фенил-4- -хинолил -гликолевой. кислоты,4,6 см тионилхлорида в 18р см хлороформа, 2,4 г 1-формилпиперазина и 6,5 см триэтиламина в 200-см хлороформа.
После двух перекристаллизации (первая - из этилацетата, вторая - из этанола) вьщеляют 2,6. г 1-формил -4- (2-фенил-4-хинолил)-оксиацети.Г1 -пиперазина с т.пл. .
Пример 20. Следуют методик примера 1, но берут 6 г 2-фенил-4- -хинолил -глйколевой киcлoтЫj4,57 с тионилхлорида в 150 см хлороформа, 1,53 г пирролидина и 6 см диэтилам на в 150 см хлороформа и сокращают время приготовления хлорангидрида кислоты до 3 ч.
После перекристаллизации остатк из этилацетата вьщеляют 5,3 г 1- -(2-фенил-4-хинолил)-оксиацетш1 - -пироллидина, имеющего т.пл. 135°С.
натрия и еще раз водой осадок пере- кристаллизуют из уксусной кислоты.
Таким образом получают 1,9 г 4- - (2-фенил-4-хинолил)-оксиацетил -2- -пиперазинона, имеющего т.пл. 215°С.
2-Пиперазинон может быть приготовлен согласно S-.R.As-pinale, J.Am. Chem. See., 62,1202,1940. Пример 17. Следуют методике примера 1 , но берут 3 г | 2-фенил-4- -хинолил -гликолевой кислоты,3,8 см тионилхлорида .в 90 см хлороформа, 1,25 г 4-Ы-метш1аминоморфолина и 3,25 см триэтиламина в 90 см хлороформа.
После перекристалли зации остатка из ацетонитрила получают 2 г 4-N-Me- тил-Ы-морфолинил- (2-фенил-4-хинолил)-оксиацетамида, имеющего т.пл.
лил)-ок
189 С.
5
5
о
5
0 5
0
Пример 18. Следуют методике примера 1, но берут 3 г 2-фенил-4- -xинoлилJ-гликoлeвoй кислоты,3,8 см тионилхлорида в 90 см хлороформа.
Остаток хроматографируют на си- ликагеле при использовании смеси циклогексан - этилацетат (50:50) в качестве элюанта.
.Остаток обрабатывают (извлекают) ацетоном и после добавления раствора соляной кислоты в диэтиловом эфире выделяют 1,6 N-циклопропил- метил-К-метил 2-фенил-4-хинолил -ок- сиацетамид-хлоргидрата, имеющего т.пл. 178°С.
Пример 19. Следуют методике примера 1 , но берут 6 г { 2-фенил-4- -хинолил -гликолевой. кислоты,4,6 см тионилхлорида в 18р см хлороформа, 2,4 г 1-формилпиперазина и 6,5 см триэтиламина в 200-см хлороформа.
После двух перекристаллизации (первая - из этилацетата, вторая - из этанола) вьщеляют 2,6. г 1-формил-. -4- (2-фенил-4-хинолил)-оксиацети.Г1 - -пиперазина с т.пл. .
Пример 20. Следуют методике примера 1, но берут 6 г 2-фенил-4- -хинолил -глйколевой киcлoтЫj4,57 см тионилхлорида в 150 см хлороформа, 1,53 г пирролидина и 6 см диэтилами- на в 150 см хлороформа и сокращают время приготовления хлорангидрида кислоты до 3 ч.
После перекристаллизации остатка из этилацетата вьщеляют 5,3 г 1- -(2-фенил-4-хинолил)-оксиацетш1 - -пироллидина, имеющего т.пл. 135°С.
1508957
П-р и м е р 21. Следуют методике примера 1 , но берут 6 г 2-фенил- -4-хинолил -гликолевой кислоты,
10
20
4,57 см тионилхлорида в 150 см
хлороформа, 2,3 г N-метиланилина и 6 см триэтиламина в 100 см хлороформа и уменьшают время приготовления хлорангидрида кислоты до 3 ч.
После перекристаллизации остатка из этилацетата получают 5,4 г N-ме- тил-Ы-фенил- Г2-фенил-4-хинолил -ок- сиацетамида, плавящегося при 150 С.
Пример 22. Следуют методике примера 1, но берут 6 г 2-фенил-
-4-хинолил -гликолевой кислоты,
ч
4,57 см тионилхлорида в 180 см хлороформа, 2 г 3-метилпиперидина и 6,48 см триэтиламина в 200 см хлороформа и сокращают время приготовления хлорангидрида кислоты до 3 ч.
После проведения хроматографии остатка на силикагеле с использованием в качестве элюанта этилацетата выделяют 4,25 г З-метил-1-(2-фенил- -4-хинолил)-оксиацетил -пиперидина с т.пл. 96°С.
Пример 23. Следуют методике примера 1, но берут 6 г 2-фенил-4- -хинолил -гликолевой кислоты,4,57 см тионилхлорида в 180 см хлороформа 3,21 г этилизонипектотата и 6,5 см триэтиламина в 200 см хлороформа и сокращают время приготовления хлор- ангидрида кислоты до 3 ч.
После хроматографии остатка на силикагеле с использованием этил- ацетата в качестве элвданта выделяют 5,5 г этил-1-(2-фенил-4-хинолил)- -оксиацетил -4-пиперидин-карбоксила- та, имеющего т.пл. .
Пример 24. Следуют методике примера 1, но берут 19,7 г 2-фенил- -4-хинолил -гликолевой кислоты, 15,45 см тионилхлорида в 100 см толуола, 6
, W г N-метилциклобутиламина триэтиламина в 200 см тои 60 см
луола и сокращают время приготовления хлорангидрида кислоты до 2 ч. После хроматографии остатка на силикагеле с использованием в качестве элюанта смеси циклогексан - этил- ацетат (70:30) получают остаток, который обрабатывают петролейньм эфиром с пределами кипения 40-60 С. После фильтрации и сушки получают 12,65 г Ы-циклобутил-Ы-метил 2-фе- нил-4-хинолил -оксиацетамида, плавящегося при- 110° С.
п
и сл
ти
ти
-м ти
к
ни к
м -м
30 ни ко
-х к
ни к
к
-ф
фе ли
ни
25
40
50
ко
ни ко
сг -ф .ли
-ф ли
10
10
20
-
N-Метилциклобутиламин может быть получен известным способом.
Используя соответствующие амин и хлорангидриды кислот, получают следующие соединения.
П р и м е р 25. Хлоргидрат 4- (4-хлорфенил )-хинолил-4}-оксиацетил -морфолина, который плавится при 191°С.р
Пример 26. Хлоргидрат (4-метоксифенил)-хинолил-4 -оксиаце- тил -морфолина, который плавится при 215°С.
Пример 27. Хлоргидрат 4-(6- -метокси-2-фенилхинолил-4)-оксиаце- тил -морфолина, который плавится при 179°С.
П р, и м е р 28. 4-Метокси-1ти2- фенилхинолил-4) оксиацетил З-пиперидин,
который плавится при 96 С.
Пример 29. 4- 2-(4-метилфе- нил)-хинолил-4 -оксиацетил} -мррфолин, который плавится при 146 С.
П-р и м е р 30. (3-Трифтор- метилфенил)-хинолил-4 -оксиацетил - -морфолин, который плавится при 135°С. р
Пример 31. (2-Фторфе- 30 нил)-хинолил-4 -оксиацетил -морфолин, который плавится при 145 С.
Пример 32. (2-Тиенил)- -хинолил-4- -оксиацетил} морфолин, который плавится при 198 С.
Пример 33. (3-Хлорфе- нил)-хин олил-43-оксиацетил f-морфолин, который плавится при 131 С.
Пример 34. (Пиридил- 2)-хинолил-4 -оксиацетил} -морфолин, который плавится при 185 С.
Пример 35. 1-Метил-4-(2- -фенилхинолил-4)-оксиацетилЗ-пипери- зинон-2, который плавится при 140°С.
Пример 36. (4-Нитро- фенил)-хин олил-4 -ок с иацетил -морфолин, который плавится при 172 С.
Пример 37. 4-(5-Хлор-2-фе- нилхинолил-4)-оксиацетил -морфолин,
25
40
который плавится при 168°С.
Пример 38. 4-(6-Хлор-2-фе- нилхин олил-4)-ок сиаце тил -морфолин 7 который плавится при. 182°С.
П р и. м е р 39.4- (6-Метил-2- -фенилхинолил-4)-оксиацетил -морфо- .лин, который плавится при 158 С.
Пример 40. 4-(6-Амино-2-. -фенилхинолил-4)-оксиацетил -морфолин, который плавится при 194 С.
-мсЗрфолин, который плавится при 261 С
Пример 42. 4- (4-Амино фенил)-4-хинолил -оксИацетил -морфолин с т. пл. 174°С.
П р и м е р 43. (Тиенил-3)- -хинолил-4 -оксиацетил -морфолин, который плавится при 183°С.
П р и м е р 44. Н-метил-К-трет- бутил-(2-фенилхинолил-4)-оксиацет- амид, который плавится при 90 С.
Сродство новых соединений к рецепторам церебрального типа - бензоди- азепинам, установлено по известному методу на мебранах головного мозга крысы с использованием в качестве лиганда ЗН-диазепама. Это сродство составляет 0,001-0,5 мкМ.
Это сродство определено по способности соединений смещать тритирован- ный диазепам по месту его связи и выражается величиной К;, мкМ, которая рассчитывается по формуле
К.
1C
50
I +
К
D
к 1C
50
где С - концентрация использованного ЗН-диазепама;
константа сродства, характеризующая диазепам, концентрация соединения, необходимая для получения 50% ингибировани я связи ЗН-диазепама . Результаты приведены в таблице.
Соединения согласно изобретению малотоксичны - ЛД перорально для мьши вьше 200 мг/кг. ЛД определя-. ли после 3-дневного наблюдения по кумулятивному методу.
Для медицинского употребления можно использовать указанные соединения такими, какие они есть, или в виде солей с сильной кислотой, фармацевтически совместимой.
Формула изобретения Способ получения амидных производных хинолина общей формулы
CO-NC 1
0
да, алкильными или алкоксигруппами, содержащими от.1-4 атома углерода, амино- или ациламиногруппами, со- держащими 1-4 атома углерода;
Z является фещшьным, тиенильным, пиридильным радикалом или фенильным
Q радикалом, замещенным одним или двумя заместителями, выбранными из атомов галоида, алкильных или алкоксиль- ных групп, содержащих 1-4 атома углерода, трифторметильной, нитро- или
5 аминогрупп;
R означает линейную или разветвленную алкильную групау, содержащую 1-6 атомов углерода, алкоксиалкил, алкильная и алкоксильная части кото-
0 рого содержат каждая 1-4 атома угле- рода, циклоалкил, содержащий 3-6 атомов углерода, фенил, фенилапкил, алкильная часть которого содержит 1-4 атома углерода, или циклоалкилалкнл,
5 алькильная часть которого состоит из 1-3 атомов углерода, а циклоалькиль- ная часть - из 3-6 атомов углерода,
R является линейной или разветвленной апкильной группой, содержащей 1-6 атомов углерода, алкоксиалкилом, алкоксильная и алкильная части которого каждая содержат 1-4 атома углерода, циклоалкилом, содержащим 3-6 атомов углерода, фенилом, фенилалки5 лом, алкильная часть которого содержит 1-4 атома углерода, циклоалкил- алкилом, алкильная часть которого содержит 1-3 атома углерода и цикяо- алкильная часть которого содержит . .
0 3-6 атомов углерода или 4-морфолино- вым циклом; .
R и R могут также образовывать с атомом азота, к которому они
5 присоединяются, пирролидиновый цикл, пиперидиновый цикл, в известных слу чаях замещенный гидроксильной, ал- кильной группой, содержащей 1-4 атома углерода, алкоксильной группой,
0 содержащей 1-4 атома углерода, ал- коксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, морфолиновый цикл, в известных случаях замещенный одной или двумя алс кильными группами, содержащими. 1-4 атома углерода, тиоморфолиновый цикл, пиперазиновый цикл, в известных случаях замещенньй на атоме азо- ,та алкильной группой, содержащей
1
1-4 атома углерода, алкилоксикарбо- нилом, алкильная часть которого содержит 1-4 атома углерода, ацилом, содержащим 2-5 атомов углерода, фор милом, или пиперазиновый цикл, в из вестных случаях замещенный на атоме азота алкилом, -содержащим 1-4 атома углерода,
или их солей с кислотами, отличающийся тем, что вводят в реакцию амин общей формулы
HN:
ч
R.
508957
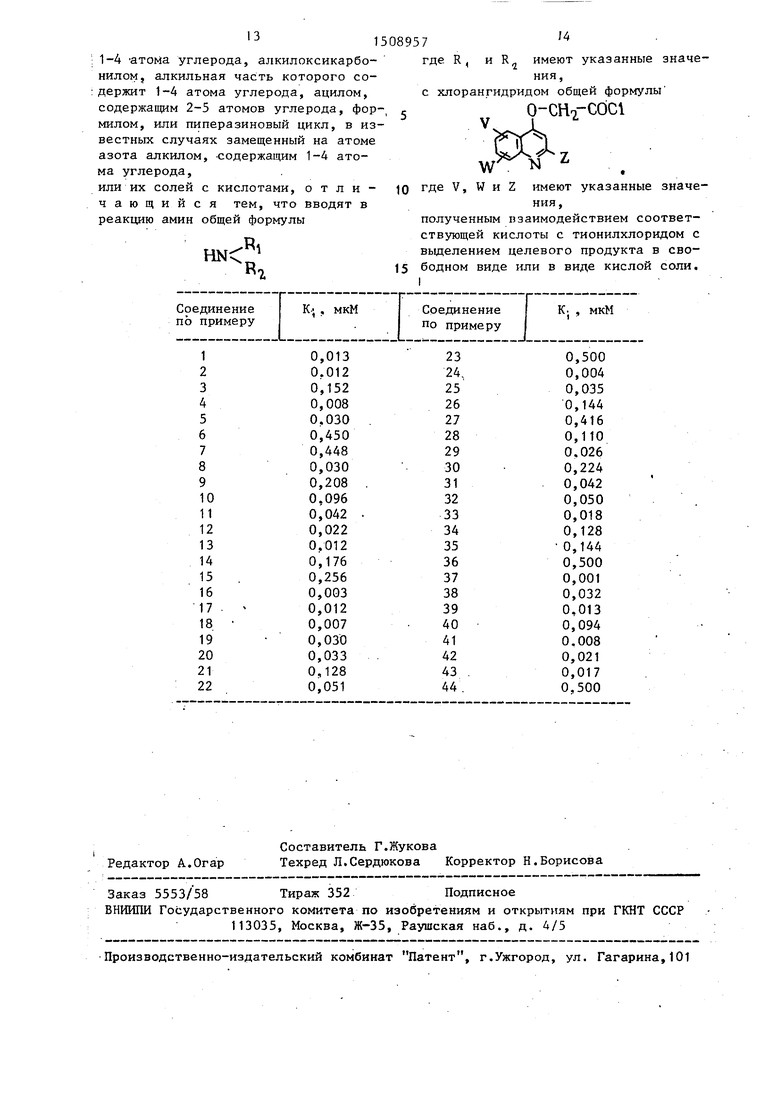
где R, и R,j имеют указанные значения, с хлорангидридом общей формулы
N
где V, W и Z имеют указанные значения,
полученным взаимодействием соответствующей кислоты с тионилхлоридом с выделением целевого продукта в свободном виде или в виде кислой соли.




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения амидов, их диастериомеров, рацематов, энантиомеров или их аддитивных солей | 1987 |
|
SU1614759A3 |
| Способ получения рацемических или стереоизомерных производных нафталин- или азанафталинкарбоксамидов | 1983 |
|
SU1255050A3 |
| Способ получения амидов | 1987 |
|
SU1544186A3 |
| Способ получения производных хинолина | 1989 |
|
SU1709911A3 |
| Способ получения амидов или их кислотноаддитивных солей | 1986 |
|
SU1440342A3 |
| Способ получения амидов хиназолина | 1987 |
|
SU1537135A3 |
| Способ получения производных 2,3,6,7-тетрагидротиазоло/3,2-а/пиримидин-5-она (его варианты) | 1981 |
|
SU1091859A3 |
| ФЕНИЛ- И АМИДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ | 1989 |
|
RU2041874C1 |
| НОВЫЕ 2-ЦИАНО-1,3-ДИОНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ ПОДАВЛЕНИЯ СОРНЯКОВ | 1994 |
|
RU2149869C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ОКСАЗОЛИДИН-5-КАРБОНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) | 1993 |
|
RU2114834C1 |
Изобретение касается гетероциклических соединений , в частности, способов получения амидных производных хинолина общей формулы X-O-CH2-C(O)- NR1R2, где X-группа формулы @ где V и W (одинаковые или разные) - H, галоид, C1-C4-алкокси, NH2 или C1-C4-ациламиногруппа
Z - тиенил, пиридил или фенил (он может быть замещен одним или двумя заместителями, выбранными из группы: галоид, C1-C4-алкил, C1-C4-алкокси, CF3, NO2 или NH2)
R1-H- или изо-C1-C6-алкил, C1-C4 - алкокси- C1-C4-алкил, C3-C6-циклоалкил, фенил, фенил-C1-C4-алкил, C3-C6-циклоалкил-C1-C3-алкил, 4-морфолиновый цикл, или NR1R2 - пирролидиновый цикл, пиперидиновый цикл (он может быть замещен гидроксилом, C1-C4-алкилом, C1-C4-алкокси, C1-C4-алкоксикарбонилом), морфолиновый цикл (он может быть замещен одной или двумя C1-C4-алкильными группами), тиоморфолиновый цикл, пиперазиновый цикл (он может быть замещен у атома азота C1-C4-алкилом, C1-C4-алкилоксикарбонилом, C2-C5-ацилом, формилом), пиперазиноновый цикл (он может быть замещен у атома азота C1-C4-алкилом), или их солей с кислотами, которые могут быть использованы в качестве анксиолитических агентов. Цель - создание соединений с активностью, не характерной для данного класса. Синтез целевых соединений ведут реакцией амина формулы HNR1R2 с хлорангидридом формулы X-O-CH2-C(O)CL, где R1, R2, X, имеют указанные значения, полученным взаимодействием соответствующей кислоты с тионилхлоридом, с выделением целевого продукта в свободном виде или в виде кислой соли. Средство новых соединений к рецепторам церебрального типа - бензодиазепинам составляет 0,001-0,5 мкМ, при токсичности ЛД50*98200 мг/кг.

| Бюлер К., Пирсон Д.Органические синтезы- , ч | |||
| II, с | |||
| Уровень с пузырьком | 1922 |
|
SU388A1 |
Авторы
Даты
1989-09-15—Публикация
1986-05-29—Подача