Изобретение относится к области получения новых производных пиррола, обладающих высокой биологической активностью, и которые могут найти применение в фармацевтической промышленности.
Описывается способ получения производных пиррола общей формулы
/R,
y -CH-C.H,-li R.
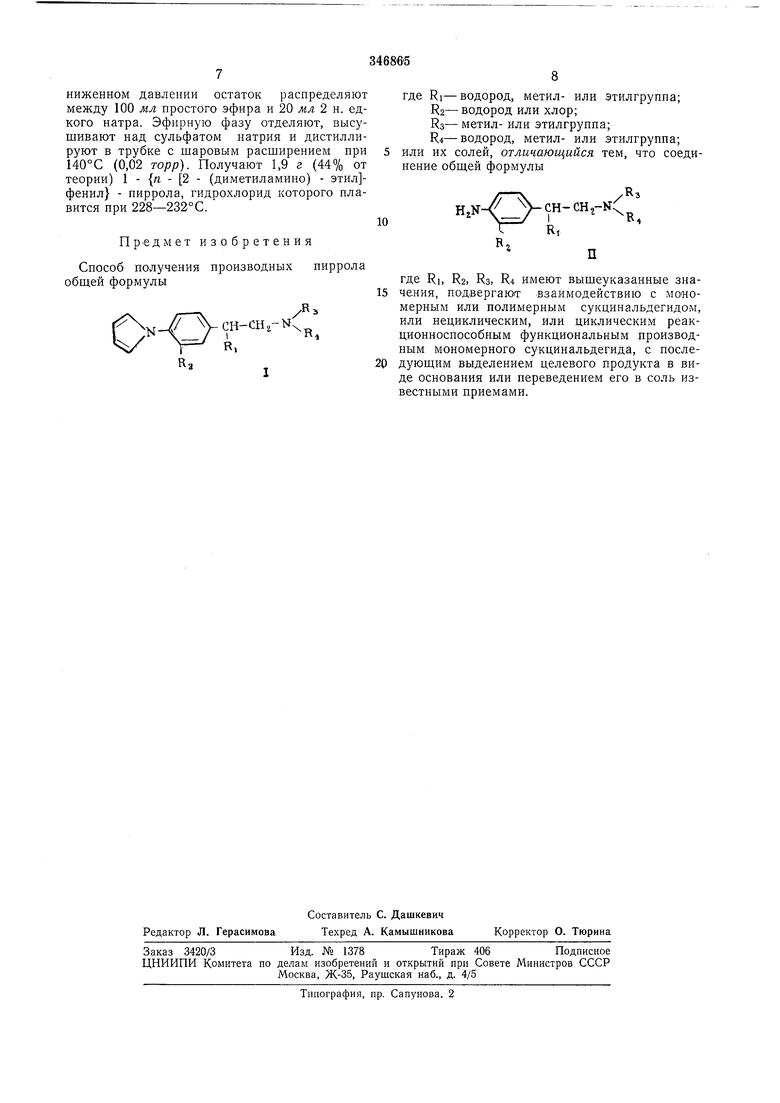
где Ri-водород, метил- или этилгруппа;
R2- водород или хлор;
iRs-метил- или этилгруппа;
R4-водород, метил- или этилгрупна. Способ заключается в том, что соединение общей формулы
лическим, или циклическим реакционноспособным функциональным производным мономерного сукцинальдегида с последующим выделением целевого продукта в виде основания или переведением его соль с помощью неорганической или органической кислоты.
Сукцинальдегид используют либо в мономеровой форме, которую освобождают непосредственно до реакции из функционального производного или получают путем дистилляции полимеровых форм, либо в виде полимерной модификации.
В качестве функциональных производных мономерового сукцинальдегида используют в особенности нециклические или циклические ацеталы, ацилалы, а-галогенные эфиры, энольпые эфиры или энольные сложные эфиры общей структурной формулы
Н Н
) Г
X- СН НС - X
R-CO-0-, R стоит вместо соответствующего галогензамещенного углеводородного остатка, затем атомы хлора или брома, или же X совместно с Y оксоостаток равны О, Y и У независимо друг от друга-остатки вышеуказанных структурных формул R-О- или R-СО-О- или оба вместе эпоксиостаток -О-, или каждое вместе с Z или Z по одной дополнительной связи соответственно пунктировапным линиям, а Z и Z- атомы водорода, если они не имеют вышеуказанного значения, в присутствии или без разбавителей и (или) конденсационных средств.
В качестве таких соединений, которые можно использовать вместо сукцинальдегида, следует указать например на нециклические производные мономерового сукцинальдегида, его ацетали, например сукцинальдегид - монодиэтилацетаталь, бисдиметилацеталь, бисдиэтилацеталь, ацилали, например сукцинальдегид - 1,1 - диацетат - (4,4 - диацетоксибутирилальдегид), энольные эфиры как 1,4 - дифеноксибутадиен, энольные сложные эфиры как 1,4 - диацетоксибутадиен. Соединения общей структурной формулы III, где Y и Y образуют совместно эпоксиостаток, формально представляют собой производные тетрагидрофурана, реагирующие в зависимости от значения X и X как ацетали или ацилали сукцинальдегида или же как а-галогенные эфиры с разомкнутой цепью.
Такими соединениями являются 2,5 - диалкокситетрагидрофураны и родственные соединения, такие как 2,5-диметокси-, 2,5-диЭТОКСИ-, 2,5-дипропокси - 2,5 - дибутокси -, 2,5 - бисаллилокси - 2,5 - бис - (2 - хлорэтокси) - 2,5 - дифенокси - и 2,5 - бис - (3,4 ксилилокси) - тетрагидрофуран, затем 2,5 диацилокситетрагидрофураны, как 2,5 - диацетокситетрагидрофурад, а также 2,5 - ди,галогентетрагидрофураны, как 2,5 - дихлортетрагидрофуран и 2,5 - дибромтетрагидрофуран, и наконец, соединения, относящиеся одновременно к двум типам, как 2-хлор - 5 (2 - хлорэтокси) - тетрагидрофуран и 2 - аллилокси - 5 - хлортетрагидрофуран.
В качестве среды для реакции согласно изобретению используют при применении свободного или освобожденного in siiu сукцинальдегида любой растворитель, в котором сукцинальдегид растворим, например метанол, содержащий воду, диоксан или уксусная кислота.
Ацетали и ацилали .сукцинальдегида, а также циклические ацеталообразные производные преимущественно вводят в реакцию в уксусной кислоте в качестве растворителя или конденсационного средства. Реакцию соединений общей структурной формулы III, где X -И (илИ X) являются атомами галоидов, осуществляют, например, в инертных органических растворителях, как хлороформ, бензол или толуол. Температура реакции - предпочтительно между комнатной и точкой кипения растворителя или разбавителя, причем нижняя область в первую очередь пригодна для последних галогенных соединений. Если rt-нитропроизводные фенэтилгалогенидов и р-алкилфенэтилгалогеиидов сначала вводить в реакцию с соединениями общей структурной формулы
/Кз
Н(
R-, IV
и только затем восстанавливать нитриловую группу, то получают исходные вещества общей структурной формулы П.
Пример 1. 6,7 г п-амино - N, N - диметилфенэтиламина растворяют в 80 мл ледяной уксусной кислоты, затем 1 час кипятят с обратным холодильником вместе с 2,5-диметокситетрагидрофурана.Реакционную
смесь выпаривают при 12 торр. Дистилляция черного остатка в трубке с щаровым расщирением при 140-150°С (0,02 торр) дает
5.4г 1 - {« - 2 - (диметиламино) - этил - фенил} - пиррола иочти в виде бесцветного масла, частично кристаллизующегося. Его растворяют в 50 мл простого эфира и с помощью
7.5мл 3,3 и. эфирного раствора хлорводорода иереводят в гидрохлорид (4,8 г; 46% от теории).
По перекристаллизации из метанола 1-{я 2 - (диметиламино) - этил - фенил}-пиррол; гидрохлорид плавится при 228-232°С.
Аналогичным путем при использовании 7,7 г п-амино - N, N - диэтилфенэтиламина получают 3,8 г (38% от теории) I - {п - 2 (диэтиламино) - этил - фенил} - ииррола, который иереводят в его фумарат; т. пл. 123-125°С.
П р и м е р 2. 3,3 г п - амине - N, р - диметилфенэтиламина, растворенного в 35 мл ледяной уксусной кислоты, 1 час кипятят с обратным холодильником при добавлении 2,7 г 2,5 - диметокситетрагидрофурана. Затем реакционную смесь выпаривают под пониженным давлением. Черный остаток распределяют между 100 мл простого эфира и 20 мл 2 н. едкого натра. Эфирный слой отделяют, промывают 10 мл воды и высушивают над сульфатом натрия. По выпаривании простого эфира остается масло, которое дистиллируют в трубке с щаровым расширением при 120°С (0,01 торр); образуется 2,4 г (55% от теории) 1 - {« - 1 - метил - 2 - (метиламино) - этил фенил} - пиррол, гидрохлорид которого плавится при 208-212°С.
Аналогичным путем ири использовании 3,5 г р-этил-п-амино - N - метилфенэтиламина получают 2,5 г (54% от теории) 1 - {« - 1(метиламинометил) - пропил - фенил} - пиррола; т. пл. гидрохлорида 182--185°С.
мощью абс. этанола; получают этиловый сложный эфир; т. кип. 110-115°С (0,01 торр). 10,0 г п - амииогидраттрОПакислотный этиловый сложный эфир и 20 г метиламина 10 час нагревают в автоклаве до 180°С. По выпаривании избыточного метиламина реакционную смесь дистиллируют в трубке с шаровым расширением, получая 7,9 г {86% от теории) п - амино - N - метилгидраттропамида.
Б. Аналогично из 10,0 е этилового сложного эфира 2 - п - аминофенилмасляной кислоты получают 7,5 г (81% от теории) 2-(/г-аминофенил) - N - метилбутирамида в виде вязкого масла.
В. В 110 мл 2,1 - молярного раствора диборана в асб. тетрагидрофуране (ТГФ) по каплям добавляют при охлаждении и размешивании 7,9 г /г-амино - N - метилгидраттропамида, растворенного в 80 мл асб. ТГФ, после чего 3 дня отстаивают при комнатной температуре без влаги. Образуется 5,0 г (6% от теории) п - амино - N, р - диметилфенэтиламина, дистиллирующегося в трубке с шаровым расширением при 120-130°С (0,1 торр).
Г. Аналогично примеру В, исходя из 7,4 г 2-(п - аминофенил) - N - метилбутирамида, получают 5,2 г (75% от теории) р - этил - п амино - N - метилфенэтиламина (т. кип. 135-140°С (0,1 торр) в трубке с шаровым расширителем.
Пример 3. Аналогично примеру 23,0 г /г-амино - N - метилфенэтиламина и 2,7 г 2,5 - диметокситетрагидрофурана в 30 мл ледяной уксусной кислоты подвергаются взаимодействию и обрабатываются. Образуется 1,7 г (41% от теории) 1 - {п - 2 - (метиламино) - этил - фенил} - пиррола, т. кип. 120- 13б°С (0,1 торр), гидрохлорид которого плавится при 254-256°С.
Исходное вещество получают следующим образом.
А, 11,5 г п - нитрофенэтилбромида растворяют в смеси из 20 мл диоксана и 100 мл а-бс. этанола, затем 6 дней отстаивают с 25мл бензилметиламина при комнатной температуре. Реакционную смесь выпаривают при давлении 20 торр, затем 0,1 торр и температуре ванны 80-100°С. Остаток распределяют между 150 мл простого эфира и 30 мл 2 и. едкого натра; эфирную фазу промывают 10 мл воды, высушивают над сульфатом натрия и выпаривают. Остаток дистиллируют при 140-150°С (0,05 торр), получая 12,9 г (95% от теории) N - бензил - N - метил - п нитрофенэтиламина.
Б. 11,7 г вышеуказанного соединения растворяют в 150 мл этанола, затем добавляют 21 мл 2 н. соляной кислоты и гидрируют при комнатной температуре и атмосферном давлении с добавлением 2 г палладия на угле (5%) до останова реакции (поглощается 4 моль эквивалента). Катализатор отфильтровывают, растворитель выпаривают, основание освобождают концентрированным едким Натром и экстрагируют простым эфиром. Сырое основание дистиллируют в трубке с шаровым расширением при 100-110°С (0,2 торр), получая 4,8 г (74% от теории) п - амино - N - метилфенэтиламина; т. пл.
о лOQ О(
о4-об С.
Пример 4. Аналогично примеру 1 из 2,3 г р - этил - я - N,N - диметилфенэтиламина, 1,6 г 2,5- диметилокситетрагидрофурана и 30 мл ледяной уксусной .кислоты получают 2,1 г (72% от теории) I - {п - I - (диметиламинометил) - пропил - фенил} - пиррола, кислый фумарат которого плавится при 137- 140°С.
Исходное вещество получают следующим образом.
А. 27,0 3 этилового сложного эфира 2 - (п аминофенил) - масляной кислоты и 80 г диметиламина дают аналогично примеру 2 Б 12,9 г (48% от теории) 2 - (п - аминофенил) N,N - диметилбутирамида; т. пл. 88-95°С.
Б, Восстанавливая 12,9 г замещенного бутирамида 100 мл 2 н. диборанового раствора и ТГФ аналогично примеру 2 В, получают 7,7 г (64% от теории) р-этил - п - амино N,N - диметилфенэтиламина; т. кип. 120 - 125С (0,1 торр) в трубке.
Пример 5. В раствор 4,9 г я-амино - N,Nдиметилфенэтиламина к 6 мл пиридина в 40 мл хлороформа при размешивании по каплям добавляют раствор 4,3 г 2,5 - дихлортетрагидрофурана в 20 мл хлороформа. Затем реакционную смесь 2-3 час отстаивают, встряхивают с 30 мл 4 н. едкого натра, а хлороформный раствор высушивают над карбонатом калия. Образующийся по выпаривании хлороформа остаток дистиллируют в трубке с шаровым расширением при 140°С (0,02 торр), получая 2,1 г (32% от теории) 1 - (rt - 2 - (диметиламино) - этил - фенил}пиррола; т. пл. гидрохлорида 228-232°С (из изопропанола).
Пример 6. 3,3 г п-амино-Ы,М-диметилфенэтиламина (см. пример 2 В), 3,8 г 2,5-диацетокситетрагидрофурана и 40 мл ледяной уксусной кислоты 1 час кипятят с обратным холодильником, затем обрабатывают аналогично примеру 2. Таким образом получают 2,1 г (48% от теории) 1-{п- 1-метил - 2 - (метиламино) - этил - фенил} - пиррола; т. пл. гидрохлорида 208-212°С (из изопропанола).
Аналогичны.м путем при использовании 3,3 г п - амино - N,N - диметилфенэтиламина получают 2,4 г (55% от теории) 1-{«- 2-(диметиламино) - этил - фенил} - пиррола; т. пл. гидрохлорида 228-232°С.
Пример 7. 3,8 г 2,5 - диацетокситетрагидрофурана 20 мин размешивают при комнатной температуре с 20 мл 0,1 н. соляной кислоты до образования гомогенного раствора сукциндиальдегида. По добавлении раствора 3,3 г п - амино - N, N - диметилфенэтиламина и 1,2 г ледяной уксусной кислоты в 10 мл диоксана и 5 мл воды реакционную смесь 1 час кипятят с обратным холодильником. Образующийся по выпаривании при пониженном давлении остаток распределяют между 100 мл простого эфира и 20 жл 2 н. едкого натра. Эфирную фазу отделяют, высушивают над сульфатом натрия и дистиллируют в трубке с шаровым расширением при 140°С (0,02 торр). Получают 1,9 г (44% от теории) I - {п - 2 - (диметиламино) - этил фенил} - пиррола, гидрохлорид которого плавится при 228-232°С. Пр-едмет изобретения Способ получения производных пиррола обшей формулы где RI-водород, метил- или этилгруппа; Кг- водород или хлор; RS- метил- или этилгруппа; R4-водород, метил- или этилгруппа; или их солей, отличающийся тем, что соединение обш,ей формулы CH-CH -N где RI, R2, Ra, R4 имеют вышеуказанные значения, подвергают взаимодействию с моиомерным или полимерным сукцинальдегидом, или нециклическим, или циклическим реакционноспособным функциональным производпым мономерного сукцинальдегида, с последуюш,им выделением целевого продукта в виде основания или переведением его в соль известными приемами.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения пирролиловых соединений или их солей | 1975 |
|
SU562194A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛА ИЛИ их СОЛЕЙ | 1972 |
|
SU349177A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛА ИЛИ их | 1973 |
|
SU374823A1 |
| ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАН- ИЛИ ЦИКЛОПЕНТЕН -β- АМИНОКИСЛОТ И ИХ СОЛИ, КОМПОЗИЦИЯ, АКТИВНАЯ В ОТНОШЕНИИ ШТАММОВ S.AUREUS CANDIDA И TRICHOPHYTON | 1993 |
|
RU2126379C1 |
| Способ получения производных норборнана | 1973 |
|
SU497764A3 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЛИПОЕВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2233840C2 |
| ЗАМЕЩЕННЫЕ 5-ЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2151143C1 |
| Способ получения производных аминопиррола или его солей | 1974 |
|
SU843738A3 |
| Способ получения производных бензилпиримидина или их солей | 1975 |
|
SU612629A3 |
| КОНДЕНСИРОВАННЫЕ 5-ЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ ИЛИ ИХ СОЛИ, ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ ПО ТОРМОЖЕНИЮ АГРЕГАЦИИ | 1992 |
|
RU2041211C1 |


Авторы
Даты
1972-01-01—Публикация