Изобретение относится к способу получения йовых ГЛЮКОЗИДОВ, обладающих высокой физиологической активностью.
Известен способ- получения алкилиденовых производных 4-деметилэпиподофиллотоксинp-D-глюкозида взаимодействием глюкозида с карбонильным соединением общей формулы Rj.RjC О, где RI - водород, R2 - низщий алкил, или с соответствующими ацеталями или кеталями в присутствии катализатора - кислот Льюиса.
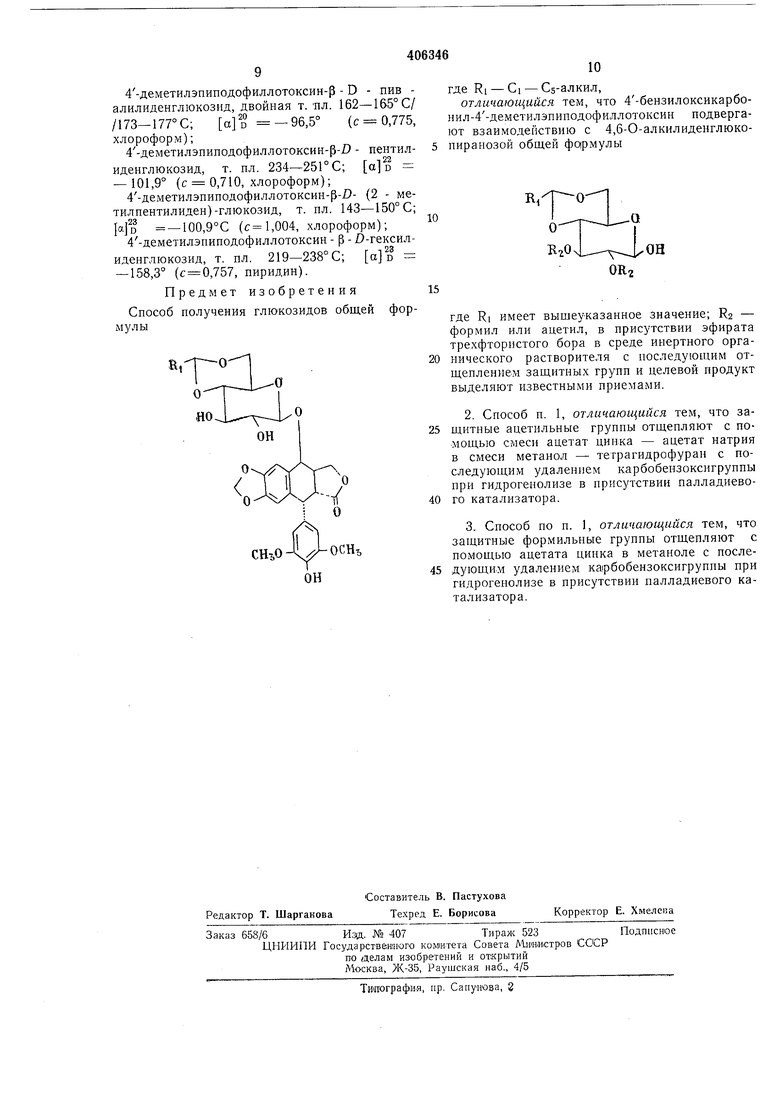
Предлагаемый способ получения глюкозидов общей формулы
... -он
где RI - GI - Сз-алкил,
состоит во взаимодействии 4-бензилоксикарбонил-4деметилэпинодофиллотоксина
15
20
с 4,6 : 0-алкилиденглюкопиранозой
общей формулы
25
С)
30
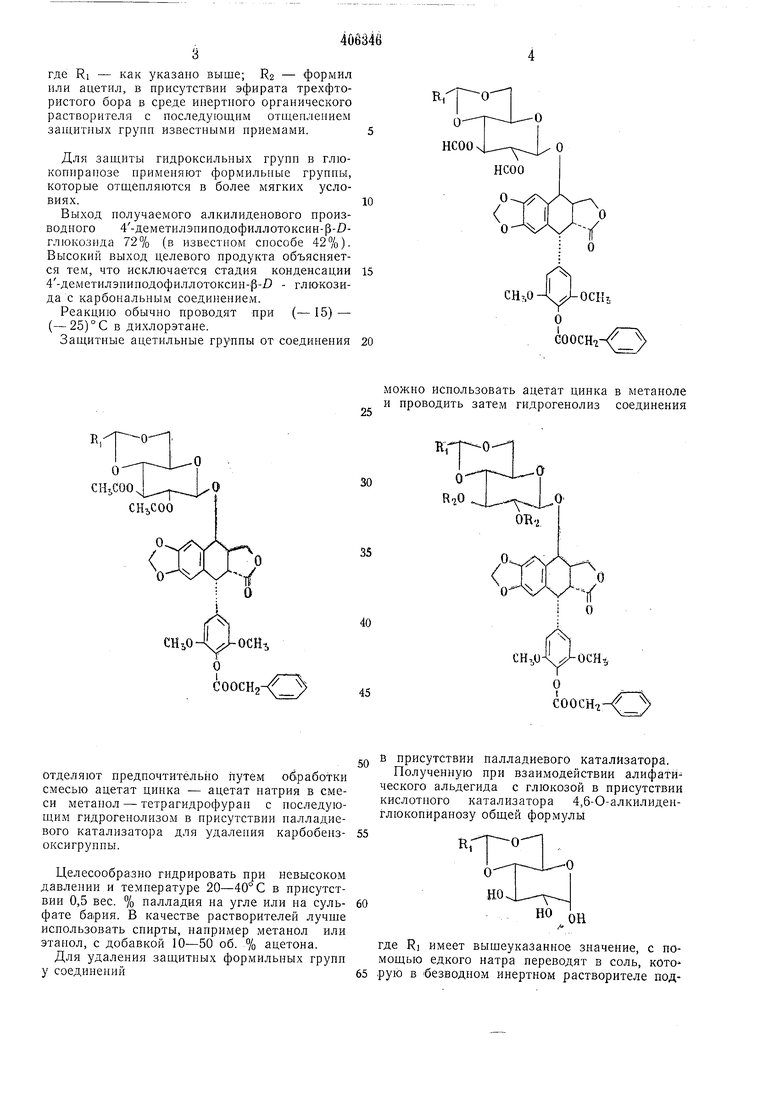
где Ri - как указано выше; R2 - формил или ацетил, в присутствии эфирата трехфтористого бора в среде инертного органического растворителя с последующим отщеплением защитных групп известными приемами.
Для защиты гидроксильных грунн в глюконнранозе применяют формильпые группы, которые отщепляются в более мягких условиях.
Выход получаемого алкилиденового производного 4-деметнлэпиподофиллотоксин-р-1глюкознда 72% (в известном способе 427о)Высокий выход целевого продукта объясняется тем, что исключается стадия конденсации 4-деметилэниподофиллотоксин- р- - глюкозида с карбональным соединением.
Реакцию обычно проводят при (- 15)- (-25)°С в дихлорэтане.
Защитные ацетильные группы от соединения
о
СООСН-г 


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения защищенной 4,6-0-алкилиден- - -глюкопиранозы | 1969 |
|
SU447886A1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ ГЛЮКОЗИДОВ | 1971 |
|
SU313351A1 |
| Способ получения 1,2-ди-0-пальмитоил- 3-0-/6-0-(1,2-ди-0-пальмитоил- - глицеро-3-0-фосфорил)- - глюкопиранозил/- -глицерина | 1978 |
|
SU787414A1 |
| Способ получения пентасахарида | 1983 |
|
SU1694065A3 |
| Способ получения 8-бензофурилметил1,3,8-триазаспиро-/4,5/-деканов | 1972 |
|
SU442597A1 |
| Способ получения производных глюкозамина или их солей | 1976 |
|
SU660589A3 |
| Способ получения N @ -арил-сульфонил- @ -аргининамидов | 1979 |
|
SU1042615A3 |
| Способ получения производных - 7- -аминодезацетоксицефалоспорановой кислоты в виде смеси цис и трансизомеров или в виде одного из них | 1972 |
|
SU466662A3 |
| СИНТЕТИЧЕСКИЕ ПОЛИСАХАРИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2167163C2 |
| Способ получения 3-(2"3"-дидезоксигликозидов)карденолида | 1970 |
|
SU473361A3 |

CHbCOO, СН,,СОО
CHsO
отделяют нредночтитёльно путем обработки смесью ацетат цинка - ацетат натрия в смеси метанол - тетрагидрофуран с последующим гидрогеполизом в присутствии налладиевого катализатора для удаления карбобензоксигруппы.
Целесообразно гидрировать при невысоком давлении и температуре 20-40°С в присутствии 0,5 вес. % палладия на угле или на сульфате ба,рия. В качестве растворителей лучще использовать спирты, например метанол или этанол, с добавкой 10-50 об. % ацетона.
Для удаления защитных формильных групп у соединений
можно использовать ацетат цинка в метаноле и проводить затем гидрогенолиз соединения
.-T-J
RoO
В присутствий палладиевого катализатора.
Полученную при взаимодействии алифатического альдегида с глюкозой в присутствии кислотного катализатора 4,6-О-алкилиденглюкопиранозу общей фор.мулы
НО
где R имеет выщеуказанное значение, с помощью едкого натра переводят в соль, кото рую в (безводном инертном растворителе подвергают реакции обмена с бензилформиатом, полученное соединение общей формулы R,-T-0-1 о-Т о. II / ноД,,(-о-сН2Л / но где RI - как указано выше, обрабатывают производными уксусной или муравьиной кислоты, например их ангидридом, в присутствии пиридина, образующиеся соединения общей формулы 0- , -r-J- 0 -20 ..О-С о- СНг-) ОЙ2 где RI и RZ имеют вышеуказанное значение, подвергают гидрогенолизу в присутствии палладиевого катализатора в сухом ацетоне. Для гидрогенолитического отщепления бензилоксикарбонилыюй группы пригоден лишь свежеприготовленный палладий, полученный при восстановлении хлористого палладия (PdCb). Пример 1. 4 - Деметилэпиподофиллотоксин-р-/)-этилиденглюкозид. 160 г 4-бензилоксикарбонил-4-деметилэпиподофиллотоксина растворяют при нагревании в 45 мл дихлорэтена, охлаждают до 20°С, прибавляют 17,5 г 4,6-О-этилиден - 2,3-ди-Оацетил-р-О-глюкопираиозы, перемешивают при 20°С до растворения, охлаждают до -18°С в отсутствие влаги, в течение 3 мин при перемешивании прикапывают в вязкий раствор 10,5 мл эфирата трехфтористого i6opa и перемешивают 40 мин при -18°С. При охлаждеНИИ и перемешивании прибавляют по каплям смесь 10,5 мл абсолютного пиридина и 100 мл этиленхлОрида, промывают 4 X 50 мл воды, высушивают органическую фазу над сульфатом натрия, выпаривают в вакууме и сушат остаток в высоком вакууме при 60° С. Сырой продукт растворяют в 60 мл горячего этанола, прикапывают раствор к 240 мл воды при перемешивании и охлаждении льдом, перемешивают 20 мин, отсасывают белый осадок, промывают его 50 мл смеси вода - этанол (4:1) и сушат в высоком вакууме при 70° С. После двухразовой перекристаллизации из метанола получают чистый 4-бензилоксикарбонил-4-деметилэпиподофиллото Ксин-|3-1) - 2,3 ди-0-ацетил-4,6-0-этилиденглюкозид, т. пл. 230°С; - 60,4° (с 1,054, хлороформ). К раствору 18,6 г 4-беизилоксикарбонил-4деметилэпиподофиллотоксин-р-Д-2,3- ди - О ацетил-4,6-0-этилиденглюкозИхЧа в смеси 120 мл метанола и 30 мл абсолютного тетрагидрофурана прибавляют 2,2 г безводного ацетата цинка и 0,8 г безводного ацетата натрия, нагревают 4 час с обратным холодильником, отгоняют 20 мл растворителя, прибавляют 10 мл абсолютного тет.рагидрофураиа и нагревают 20 час. Концентрируют до 70- 80 мл, нагревают 7 час с o6paTHFjiM холодильником, прибавляют к раствору 2 мл уксусной кислоты, выпаривают в вакууме при 40С, растворяют остаток в 150 мл хлороформа, промывают 4x20 мл воды, сушат органическую фазу над сульфатом натрия, вынаривают в вакууме и хроматографируют остаток на силикагеле, элюируя хлороформом с 2-3% метанола. Сначала выделяют неполностью деацетилированную массу, а затем фракцию, состояшую из смеси 4-бензилоксикарбонил4-деметилэниподофиллотоксин-|3-) - этилиденглюкозида и 4-деметилэпиподофиллотоксин-рД-этилиденглюкозида. Полученные фракции хроматографируют на пластинках с силикагелем, элюируя хлороформом с 3% метанола. Для проявления используют раствор 0,2% сульфата церия (IV) в 50%-ной уксусной кислоте и нагревают при ПО-130°С. Для отщепления бензилоксикарбонильной группы растворяют фракцию в 100 мл смеси ацетон - этанол (1 :1) и гидрируют в присутствии 2 г палладиевого катализатора (5% палладия на угле) при 20° С и атмосферном давлении. После гидрогенолиза отфильтровывают катализатор, промывают его смесью ацетон - этанол (1:1) и выпаривают фильтрат в вакууме. Остаток перекристаллизовывают четыре раза из этанола, прибавляя этилацетат, и получают 4-деметилэпиподофиллотоксин-р - D-этилиденглюкозид, т. пл. 253-255° С (после высушивания в высоком вакууме при 110°С). После кристаллизации из метанола т. пл. 236- 253°С; - 111,0° (с 1,046, хлороформ). Для синтеза исходной 4,6-О-этилиден-2,3-диО-ацетил-р-/3-глюкопиранозы к 102 мл 2 н. едкого натра, охлажденного до 0°С, прибавляют 41,6 г 4,6-0-этилиден-/)-глюкопиранозы, перемешивают до растворения, прибавляют 1000 мл смеси этанол - эфир (3:2), перемешивают 15 мин нри охлаждении льдом, фильтруют, промывают 200 мл этанола и 300 мл эфира, сушат в высоком вакууме при комнатной температуре и получают натриевую соль 4,6-О-этилиден-/)-глюкопиранозы. К суспензии 40 г натриевой соли 4,6-О-этилиден-)-глюкопиранозы в 750 мл абсолютного и не содержащего спирта хлороформа прибавляют 40 г 75%-ного бензилформиата, перемешивают 16 час в отсутствие влаги при 20° С, прибавляют 160 мл изопропанола, перемешивают 5 мин, прибавляют 200 мл смеси хлороформ-изопропанол (4 : 1) и промывают ЗХ X 100 мл воды. После высушивания над сульфатом натрия органическую фазу выпаривают в вакууме и экстрагируют остаток ЗХ 150 мл Эфира. Нерастворимый в эфире остаток растворяют в 900 мл горячего этилацетата, концентрируют в слабом вакууме до 300 мл, дважды перекристаллизовывают из этилацетата и получают 4,6-О-этилиден-1-О-бензилоксикарбонил-р-/)-глюкопираыозу в виде иголок, т. цл. 168-169°С; -27,7° (с 1,044, хлороформ). К смеси 50 мл абсолютного циридина и 50 мл уксусного ангидрида прибавляют 42,5 г 4,6-О-этилиде11-1-0-бензилокси«арбонил-р - D глюкопиранозы, выдерживают 15 час сначала при охла ;;дении холодной водой, а затем при 20°С. После выпаривания в вакууме растворяют остаток в трех порциях бензола по 100 мл, выпаривают бензол в вакууме и закристаллизовывают остаток в 100 мл ацетона, прибавляя 30 мл эфира. При кристаллизации из смеси ацетон-эфир-пентан получают чистую 4,6-О-этилиден-1-0-бензилоксикарбоиил-2,3-О-ацетил-р-О-глюкопиранозу, т. пл. 161°С; fccfo -46,1° (,95, хлороформ). 500 мг PdCb растворяют в 50 мл воды, прибавляют 100 мл метанола, гидрируют при 20° С и атмосферном давлении, декантируют верхний слой раствора от осажденного налладия, тщательно освобождают палладий от кислоты, удаляют ме1анол, промывая 3X150 мл сухого ацетона. Пс-лученнын палладиевый катализатор суспендируют в 250 мл сухого ацетоиа, прибавляют 25,5 г 4,6-О-этилилен-1-0бензилоксикарбонил-2,3-ди-О-ацетил - | -О-глюкопиранозы и гидрируют 1 час при 20°С и атмосферном давлении. Отфильтровав катализатор и промыв его 100 мл сухого ацетона, выпаривают фильтрат в вакууме при 35° С (температуры бани), сушат остаток 1 час при 30° С в высоком вакууме, обрабатывают 50 мл диизопропилового эфира при 30-35° С и перекристаллнзовываот из смеси ап,етон - пептан. Получают 4,6-О-этилиден-2,3-ди-О-ацетил-|3-Д - глюкопиранозу, т. пл. 109-111°С; ар -35,9°С (с-1,006, хлороформ). Пример 2. 4 - Деметилэпиподофиллотоксин-р-Л-этилиденглюкозид. 8,0 г бензилокси«арбонил-4-деметилэпиПОдофиллотоксина растворяют при нагревании в 25 мл дихлорэтана, охлаждают до 20° С, прибавляют 7,00 г 4,6-О-этилиден-2,3-ди-0формил- - -глюкопиранозы и перемешивают до растворения. В отсутствие влаги охлаждают до -15° С, при перемешивании в течение 2мин прибавляют по каплям 5,5 мл эфирата трехфтористого бора, перемешивают 45 мин при (-15) - (-18)°С и прибавляют по каплям смесь 5,5 мл абсолютного пиридина и 100 мл дихлорэтана. Промыв 4X50 мл воды, сушат органическую фазу над сульфатом натриЯ, выпаривают в вакууме, обливают остаток 200 мл горячего метанола, прибавляют 1 г безводного ацетата цинка и нагревают 3час с обратным холодильничком; наблюдая образование кристаллического осадка. Реакционный раствор выпаривают вместе с осадком в вакууме, остаток кратковременно сушат в высоком вакууме при 60°С и обрабатывают 100 мл хлороформа, 30 мл воды и 1 мл уксусной кислоты. Органическую фазу промывают 2 X 50 мл воды, высушивают над сульфатом натрия, выпаривают в вакууме, сушат остаток в высоком вакууме при 60°С и обрабатывают 60 мл теплого этанола. После отделения труднорастворимой фракции выпаривают фильтрат в вакууме, кристаллизуют остаток из этилацетата, прибавляя пентан, растворяют кристаллизат в 50 мл хлороформа, фильтруют через 5 г силикагеля, промывают адсорбент дополнительно 50 мл хлороформа и объединенные фильтраты выпаривают в вакууме. После двухразовой кристаллизации остатка из изопропилацетата получают чистый 4-бензилоксикарбонил-4деметилэпиподофиллотоксин-p-Z) - этилиденглюкозид, т. пл. 156-157°С; afo -84,6° (с 1,040, хлороформ). К раствору 5,0 г 4-бепзилоксикарбонил-4деметилэпидофиллотоксин-p-D - этилиденглюкознда в 100 мл смеси ацетон - этанол (1 : 1) прибавляют 0,5 г палладиевого катализатора (5% палладия на угле) и гидрируют при 20°С и атмосферном давлении. По окончании гидрогенолиза отделяют катализатор, промывают смесью ацетон - этанол (1:1) и выпаривают фильтрат в вакууме. После двухразовой кристаллизации остатка из смеси ацетон - этилацетат получают чистый 4-деметилэпиподофиллотоксин-р-/) - этилиденглюкозид с теми же констакгами, что и у соединения, полученного в примере 1. Для синтеза исходной 4,6-0-этилиден-2,3-диО-формил-р-)-глюкопиранозы в течение 20- 30 мин в 48 мл уксусного ангидрида при перемешивании и охлаждении льдом в отсутствии влаги прикапывают 38 мл безводной муравьиной кислоты, причем температура не должна превышать 25° С, и выдерживают 4 час при 20°С. Аналогично при гидрировании, как описано выше, 24,0 г 4,6-О-этилиден-1-О-бензилоксикарбонил-2,3-ди-О-формил-р-1 - глюкопиранозы, получают 4,6-0-этилиден-2,3-ди-0-формилр-О-глюкопиранозу, которую кристаллизуют из смеси сухой ацетон - эфир - пентан и затем два раза из смеси сухой ацетон - эфир. Двойная т. пл. 109°-114°С/135-137°С; af -37,9° (с 1,052, хлороформ). Аналогично примерам 1 и 2 получают 4-деметилэпиподофиллотоксин-р- D - пропилиденглюкозид, бесцветные кристаллы, т. пл. 178-182°С; а о - 107,2° (с--. 0,558, хлороформ); 4-деметилэпиподофиллотоксин-р - D - бути лиденглюкозид, т. пл. 170-176° С; afo - Ш0,1° (с 0,754, хлороформ); 4-деметилэпиподофиллотоксин-р- D - изобутилиденглюкозид, т. пл. 181 -185°С; - -96,9° (с 0,722, хлороформ); 4-деметилэпиподофиллотоксин-р - D - пив алилиденглюкозид, двойная т. пл. 162-165° С/ /173-177° С; - 96,5° (с 0,775, хлороформ); 4-деметилэпиподофиллотоксин-р-1) - пентилиденглюкозид, т. пл. 234-251° С; а в -101,9° (с 0,710, хлороформ); 4-деметилэпиподофиллотоксин-р-О- (2 - метилпентилиден)-глюкозид, т. пл. 143-150° С; Jaf -100,9°С (с 1,004, хлороформ); 4-деметилэпиподофиллотоксин - р - /)-гексилиденглюкозид, т. пл. 219-238°С; а D - -158,3° (,757, пиридин). Предмет изобретения Способ получения глюкозидов общей формулы20 25 40 45 где RI - GI - Cs-алкил, отличающийся тем, что 4-бензилоксикарбонил-4-деметилэпиподофиллотоксин подвергают взаимодействию с 4,6-О-алкилиденглюкопиранозой общей фчрмулы где RI имеет вышеуказапное значение; R2 - формил или ацетил, в присутствии эфирата трехфтористого бора в среде инертного органического растворителя с последующим отщепление м защитных групп и целевой продукт выделяют известными приемами. 2.Способ п. 1, отличающийся тем, что защитные ацетильные группы отщепляют с помощью смеси ацетат цинка - ацетат натрия в смеси метанол - тетрагидрофуран с последующим удалением карбобензоксигруппы при гидрогенолизе в присутствии палладиевого катализатора. 3.Способ по п. 1, отличающийся тем, что защитные формильные группы отщепляют с помощью ацетата цинка в метаноле с последующим удалением ка рбобензоксигруппы при гидрогенолизе в присутствии палладиевого катализатора.
Авторы
Даты
1973-01-01—Публикация