(54) СП(Х:ОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИПНРЛЗИНА



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,1Л-ТРИХЛОРЭТАНА | 1972 |
|
SU353412A1 |
| Способ получения производных эритромицина или их солей | 1976 |
|
SU682134A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2Г1Н)-ХИНАЗОЛИНОНА | 1973 |
|
SU366612A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1971 |
|
SU436495A3 |
| Способ получения -(1-бис-арилкиламиноалкил)-аралкоксибензиловых спиртов или их солей, рацематов или оптическиактивных антиподов | 1974 |
|
SU548204A3 |
| КОМПОЗИЦИЯ ДЛЯ ОКСИДАЦИОННОГО КРАШЕНИЯ КЕРАТИНОВЫХ ВОЛОКОН И СПОСОБ КРАШЕНИЯ С ПРИМЕНЕНИЕМ ЭТОЙ КОМПОЗИЦИИ | 1997 |
|
RU2160085C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОЦИКЛОАЛКЕНИЛДИГИДРООКСИАЛКАНОВЫХ КИСЛОТ | 1990 |
|
RU2012554C1 |
| Способ получения производных 1-полифторалкил-1,4-бензодиазепина | 1971 |
|
SU437295A1 |
| Способ получения производных уреидофеноксиалканоламина | 1971 |
|
SU510470A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2(Ш)-ХИНАЗОЛИНОНА | 1972 |
|
SU359818A1 |

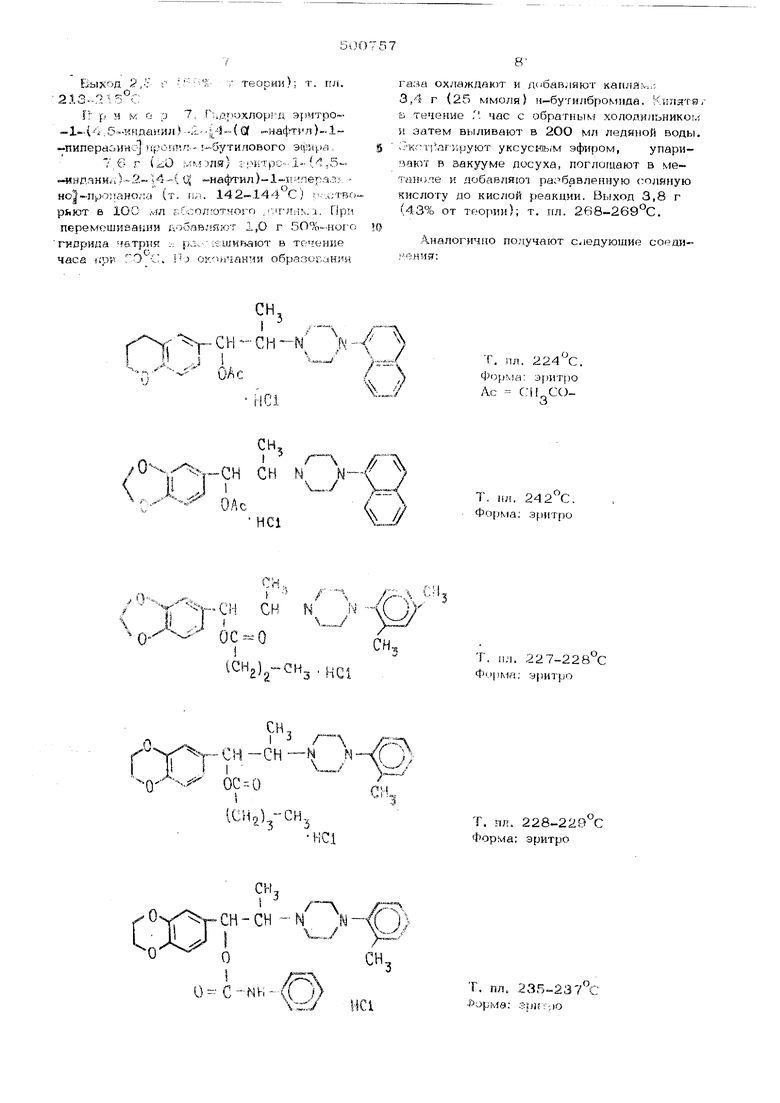
Иэоб|к:теиие относится к способу получения новых производных инпералнна, обладаю ;;.iix ионными фармако.иоги4ескими свойствам Способ получения основан на широко известной Е органической химии реакции алкилировання и аци;н1рованмя спиртов и поэво ляот получить fiOBbje соедяиггния. Описывается способ получения лроизвод- ных пипера:.нна обшей (|юрмулы Л Y YCH-CH-N N Д J V - OR, СН гце А - трмметилен- или тетраметилен трн:лети/ е-нокси-, метилендиокси- или этилендиокспгруппа и вместе с бензольным кольцом j5 -на4)тильный радикал; R - алкилрадикал с 1-4 атомами углерода, ьзиилрадикал с 2-6 атомами угле рода, алкилкарба гал с 1-4 атомами углеро (киплкарбамил; R - атом водорода, алкилрадикал с 1-4 атомами углерЬда, алкоксирадикал с 1-4 атомами углерода, атом галогена или трифторметилрадикал; - атом водорода, алкилрадикал с 1-4 атомами углерода, алкоксирадикал с 1-4 атомами углерода или «том галогена, кроме того Rg и R вместе могут означать присоединенное конденсацией бен.зольнве кольцо, или их солей. Описываемые соединения могут находиться в форме рацематов (эритро- или треоформа, или в чистой оптически активной форме. Предлагаемый способ получения соед нений обшей 4 рмулы 1 заключается в том, что спирт формулы где А, iR, имеют приведенные 2 3 значения, подвергают ацилированию или алкилиро- ванию соответствующими агентами для введения заместителя а для вве.дения карбамильных групп - взаимодействию с соответствующим изоцианатом. Для введения ацильной группы годятся ангидри ды кислоты или ацилгалогениды. Для получения простого эфира спирты формулы П могут быть обработаны соответствующи ми диазоалканами в присутствии эфирата трифторида бора или другими средствами .алкилирования, например (после переведения спирта в алкоголят с помощью гидрида натрия или амида натрия) алкилгалогенидами. Если при этих реакциях исходят из эритро- или трео формы спирта форм/лы П, то целевой продукт также получают в эритро- или треоформе. Полученные по предлагаемой реакции рацематы могут быть обычным образом ра делены путем получения диастереомероБ и оптичесж пригодной активной кислоты и выделения посредством фракционированной кристаллизации. Если сначала получают свободные основания, то из них могут быть обычными ме тодами получены соли. Если сначала получают соли, то они могут быть обычным об .разом переведены в свободные основания или в соли других кислот. Спирты формулы 11 могут быть подучен следующим образом: бромкетоны формулы СО-СН-Вг подвергают взаимодействию с пиперазн нами формулы иполучают пиперазинокетоны формулы R, I /- - СО-СН-М N 1итро-спирты формулы П (У-форма) полу ют из кетонов формулы У путем каталитического восстановления в присутствии никеля Ренея, платины или палладия.: Трео ;пирты формулы 11 (Z -форма) о разуются при восстаноачении кетонов компЬ лексными гидридами, например боргидридом лмтия, натрия или калия, алюмогидридом лития, бис {2-метоксиэтокси)-алюмогидридом натрия или при условиях по Meerwein -PonndoJf - Vef ley. Для получения чистых эритро-- или треосоединений формулы 1 исходят предпочтительно из чистых эритро- или трео-спиртов .Jш и. Пример 1, Гидрохлорид О-ацетона эритро -1-.( 1,4-бензодиоксан-6-.ил ). -(о-толил)- 1«-пиперазино -пропанола. К 7,4 г (2О ммоля) предварительно полученного производного эритропропанола добавляют 50 мл ацетавгйдрида, размеши- вают и кипятят в течение часа с обратным холодильником. Затем досуха упаривают в вакууме. Остаток растворяют в метаноле и добавляют рассчитанное количество концентрированной сеянной кислоты. Разбавляют водой в соотношении 1:1, размешивают в течение 30 мин, отсасыва1от и перекристал- лизовыЕают из спирта. Выход 75 г (84% от теории); т. пл. 232-235°С. Исходные производные эритро -пропанола получают следующим образом: а)6-(2--бромпропионил)-1,4-бензодиок- сан., 417 г (2,18 моля) 6-пропионил-1,4-бензодиоксана растворяют Е 1,5 л простого, эфира. При ЗО Смедленно добавляют 112 мл (2,18 моля) брома. Затем размешивают еще в течение ЗО мин и в вакууме отгоняют растворитель. Остаток размешивают в 1 л метанола, охлаждают, отсасывают и сушат. Выход 491 г (83% от теории); т. пл, . б)дигидрохлорид 3,4 этилендиокси-2-- 4(о толип)-1-пиперазино -пропио- j-. фенона. 9О г {О,33 моля) полученного согласно пункту а) бромкетона растворяют в 1ООО мл бензола, Сначала добавляют 1,5мл изопропиламина и затем, 116 г (0,66 мо ля) о-Толилпиперазина. Размешивают в течение 24 час при комнатной температуре, охлаждают и отсасывают от выпавшего гидpcбpo 1идa о-толилпиперазина. Бензол отгоняют в вакууме. К поглощенному в 2ОО мя метанола остатку добавляют эфирную соляную кислоту. После добавки 6ОО мл метилИчЗобутилкетона нагревают до ВО С пока не образуется прозрачный раствор {причем простой эфир отгоняют большей частью с нисходящим охладителем). После охлаждения отсасыг,в;ог и сугнат, 97 г (67% 01- теотжя), в) эритро. ( .,4.б(;;сднпкс;аи -в-ил)- -2- 4-(о...топил)- -J -ri;(ine;;flCiHV:oj нрипанол, 22,0 г (0,05 ;.лоли) ругг,л;1ро.; -иорида 3 4 -этипенягюкс й«- 2 i -1 -- т олн;i) 1 пипе разщю гфопппфэиоя;, ::;;.) в 2ОО мл водь VI vLv4i...t ,а5б(иллэцип разбавленного аммьака с.:7::;;« по/ичолачнвают. Затем SK- ipflf HjVyiOj; -H-r;;:njO :-:|п:т)ОМ, раЗ бавляют ме ifionij: ; i ijVTHOU.-bUii l.;l и гидрируют ;:: пс:/;)пал:. ub; -ЧЯ -р-гРЙ, ПОСЛ погпои;енип pQCCfir-r -::,;...; :; n/-iecTea вод рода ОТСасЬВЯ ::-;- Г 1 ;уг-; :-.,,/; r.pi, раСТВО тель ОТГОНЯЮ - i- м -..--.ггок пере- КрИПТап,пиоОВМ - К/- т; Mi 1 ,:, Выход О to V , Т. ПЛ. 127-:l.28°C; -:;Г1 О-ацета П р и ;-: :: : -, . .п,.Г;.-1тп) та трео-.1.-и . ;1--5;-:;: - 4-(о.-ТОЛил,- /,.- :П( г ;) - iM-ii-эдюла. 18,4 г {Ол,.И; л.r я я : и::ла-идрит2льно полученного тпо:; ::т;:г1У1 - ViMviTHi вместе с 100 :.гл пп ;гга1гч;;-г,м,:г у тг.ч(-;ние часа с обратным ;;,очоя::/| -- - Зо-и:м упарива ют в вакуугг:: у; ,1) в метанолг: ii ,1.о.-,:л: in,i.,i- ; .; -yi;; ашюч количество ксн.:. iVj-;:; I .; ;нi::.ii.i г .,:,;:H:iin; кислоты .1Ч:ПТ ,bO;i.:v:, у -.,. :.,ч-:1: П, до полной KpHCvijifTv .й-;-; . г ; :fb-;/;-T П пер КрИСТаЛЛИЗОВ1.Ьл11л/ - Г .Ul-iJ; , 15,. г i:-;S -. .:;УИ11); т. пл 218-2 20г, Исходам:. :-.::i-- .. /- :: лл ксаи- 6.ил)..2-I;-.-д/ -::;;. : - ,::-Ь:,У --i- -s :: -пропаноп получают г.;л;, ;Г;и:1;, ;с-разом: - - ут иленди36.,6 г 10,1 мУ,;л1/ -yiiintol . ОКСИ.-2- 4- - ( о- .топ-;VI) -- , пиофаконе :,cov;i:ac;;i: ,;:: У-;, . т. пл . , растсг;:1:л-.- i /v:.-. ;.,и: -имхта, При 1О-13С iion inyvv- 1..- ПХОб мо ля) борг-и;,рп;:г r.i;i/.:, :-.i:jr.:;iVin;ftioT в pfTiTjQi o -frC т;;, yO;.::;-V i ,-(ГУТЭаТурв йыливают в ;: УУС у; - --i-:: простым -эфиром, .c -:i-:-: .i.: , : ,,, 4vV; i; jiaKyyMe - r,.-r:- ; ;- ,;-:, И ) мета .и остаток 1. нола Выход : . 7л. 109-.111°С i П р и у, Г; г :. гv/i о.-эпантат , , : ,i 2--Й- ЭрИТрО.-.3.. ( л , ;: ;:,ъ; „(о„ТОЛЙп) - .- iTi,-p . .Ja. : 9,2 г (23 .;,.:.v.y: i {l,4-бeнэ диоксан-б-нлf-.a. -ь -1 -липорази О |,.л ацета. но .Пропане;-- У/К-.Г.О-. глмолл) хло нитрила, добаеляку у рида энактозг|( к гслоть: i):,V тг В тэчени 45 с обрГ; :Ул к: .r::v -j:;i. ,уо;-.;. После оКОНЧс:;ЛШ роя- ii:-:: -У: П. ,. v;.D; HBaroT в |воду и экстраг--iipyroT уксус);ы;л эфиром. Растворн-тел-ь ОТОняют в 8ак угчК, остаток растворяют в cniipTe, подкисляют слабой :эф1фной соляной кислотойэ охла/г-алю-г, отса сьшают и перекри.сталлизовывают из ,13опро- |панола. Выход 6,0 г (46,3% от )j г, пл. 215-.21Сгс. Пример 4. Гидрохлор;;; с-.бут-|1рата эритро -1-(3,-ь.-1 ;ет;-:пендио снфо 1Ил)--2 4™ ; - (2,4-ксилнл )( -пиле1)азинУ) -проиагюла, К 2,4 г (6,5 молола) предвартпчуаьмо ;ПОлу-чепного эртгуро. , -™мет,1л:л1;1иокси фени.л)(2,4-1лс11лил)™1 1-1иъе :к1ино -. j-пропанола (т. ri.ij. .1.32.-132 С) ц-глпЗавля-, лот ЗО мл а:Г1ШрИ; с1 маслянойкислоты -ц размешйкак) п течение часа при J.40 .150 С. Затех-; растворитель от1Онягот в ввк.ууыа, cic/raToK рйстроряьп- - cii-iipi-e н добавляют разба1 ле шую ,ую кпслоту йо слабокисло) пеакиии., От1::асы.:-аго- и пере- кристауллизов-ывают пз спир-:--а. Выход 2,0 г (65% от теор-ци); т, пл, 227-2.28V;:. Исходиь)й ..--П|Юаа1 Ол получа- т по примеру la-s ил 3,4-мети,-1ендио1и;)и1рогиО фенона. При м .; ; Г;, Гидрох.г;О|-:ил :.р;п-ро.„ N „. П-буП -{ i ,4.-бонао.-.;- ; К:--М - в.-Ил).-2--. {4,,( V/ ))-l- lЛUHn.Л:ni,;.;|-ПpOПИЛ Уp- т, 1:5 Г (0,37 :.f:.fn Ki 1 эритро- -. i. . -i блн:5ОД1кжсан -о- Л--2.-| 4-( Q -нафтя }.-1---1И1Г1ералипо.-.1 ро1-:;-11 ола (т. пл. 132---J -чз-(-:) растворяют г ЗО ;.л бензола и 1.,ба1),1Яю1 0,4- г н-бч-тил.изоцканата., --азук мппзают в то,чо;пгр часа при 70 С 11 riacTDop-;iTe.iib отгоня ст в ва-кууме.Остаток растворяют Р сггирте и слабо подклсляют 2 н. соляной кислотой. Отсасывают и лорйкристаллязояьизпют кз :изолропапола, 2ыхоц 1,0 г- (5С% от теорггаУ; -т. пл. 137-183с;, При м е р 6. Гидрохлорид эритро-J.--. (хромаИ.)--2-14( Q -.нафтл5л)--1-пи-пе.jpaaHHO -nponii.- Мет-плового эф-ира. 4,О ,г (IJ му;оля) эр1ггрс-4 - Ьсрок ан-6-кл )2- 4 -1 U - нафтил) - 1-п;;1:сразчно| Про-панола -растворяют в 1ОО мл ггрост- го . эфира, За-тем при ;ампературе не въшю 20 С добаБллк Т 1,4 г (Ю ;.гктоля) эфирата триф:торл.да бора и модлеиио. ОД и, раствора эфт1р; ого днсзометана до образования неменяющегося: яселтого окр)а1лнвлн11я. С став- ляют стоять Б то--/.енив растворитель отгоняют Е F;,:ii-ry-y)x;:, поглощают в мчутаноле и добавляют разбавлен} ую соляную клас.иот-у до кислой peaiuuiH. Вынавшие к|1иста- лы отсасывают и перкзк-ристаллизовывают из метанола при робаоке угля для обп ппечи ваг1ИЯ.
Выход 2, г ,-- i теории); т. пл. . т -. ,. -.- ; -
fr р и ivv о р 7, Г;.дрохлор1 д эритро-l-4-i ,5-HHflaHHJi -- | -l -(Qf -нафтил)- -пиперазин : i iporsTi/; - -бутилового эшира ,
7,6 г (й;0 глмэля) :;:ритрс-1.-( .5-инпанил)( 1| -.нафтип)1-1 Пбраз; но|-прог анола (т. и;. 142-144 С) P-.UTBOрьют 6 1ОО ЛШ йОсолютного ,-.1глг.. :i. При перемошиэации )бав.шют 1,0 г УО%-ного гиорийа чатрия ,-: ра- ;€:шква от в теч.ение часа s;nvv С. ij око 1чании обрагзоБан; н
сн,
i .
. ../ V-CH--CH-N
ОАс
HCi
СН,
. ....r-CH СН N
v.y
ОА(
HCi
8
газа охлаждают и дибавляют капляк;,; 3,4 г (25 ммоля) и-бутилброкиша. Кипятя;в течение Г час с обратным холодильником и затем выливают в 2ОО мл ледяной воды, .:ч-;-Г1агкруют уксус-иьгм эфиром, упаризают в вакууме досуха, поглощают в метаноле и добавляют ра; бавленную соляную кислоту до кислой реакции. Выход 3,8 г (43% от трюрии); т. пл. 268-.269°С.
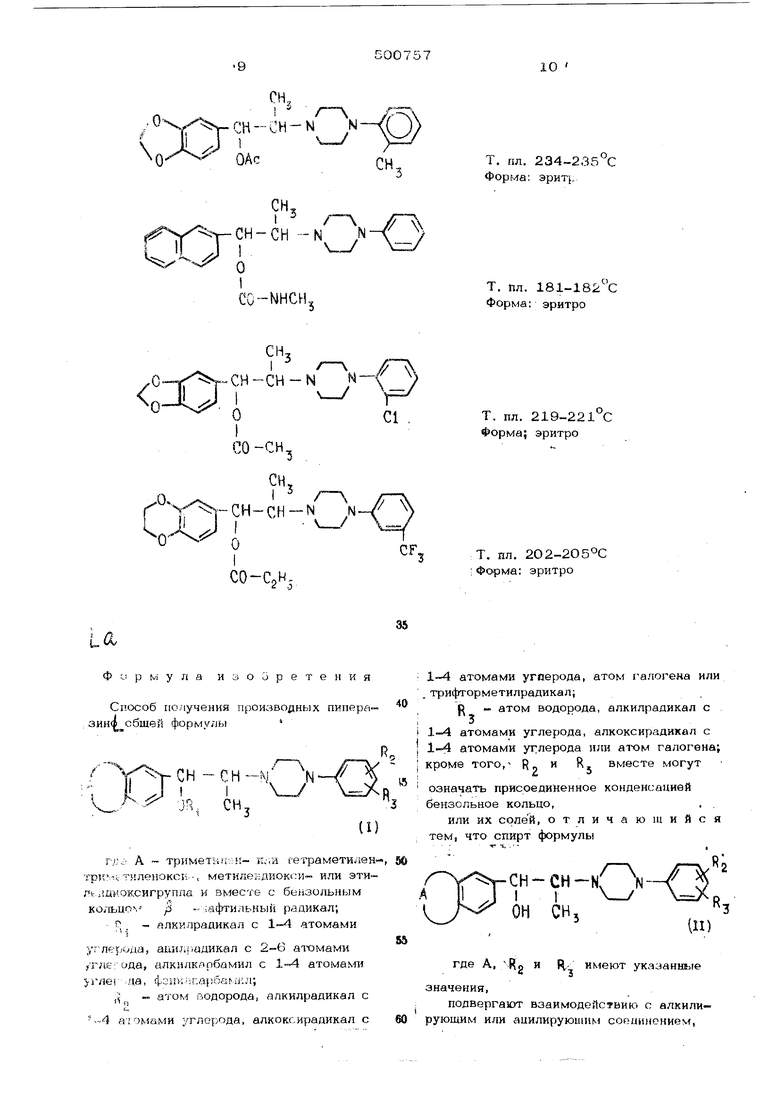
Аналогично получают с-юдующие соеди-
ненгт ;
т. пл. 224 с. 3- орма; эрнтро Ас Cii СОС5
т. ил. . Форма: эритро
СН.. 1
/
СИ о
(СН2).-сн.,,ис1
т. пл. 227-228 0 Фи1)ма: э|)итро
СН,
t 3 ™ /яCH-CH-N N-XT );
) I
(еиг,) СН,,
МС1
СИ,
т. шь 228-229°С Форма; эритро
СИ, 1
/-
СН-СН -N
.У
О
ц , ;//,
-.- --мь-л( J.
т. пл. 235-237 С
ормв: зр)г;чю
сн.
/ rVcH---CH- Ti г
ттгг
оЛ
ОАс
сн.
. 5
СН-СН -N. ,N v Xzii/
о
со-мнси
т. гш. 234-235°С Форма: эрит,.
нП
Т. пл. 181-182 с Форма: эритро
сн,
I„гщцпиа
N
т. пл. 219-221 С Форма; эритро
Т. пл. 202-205°С Форма: эритро
d
U Ф L р rvj у л а изобретения Способ получения производных пипера- зиж сбщей формуль, CH-N: N-/ ™/ rvjc: А тримет;и ;;п- к:.и гетраметилен трк1ктиленокс1 -. метилекдиокси- или этил г шиоксигрупла и вместе с бе 13ольным кольцо, р «- афтильный радикал; Р . йлкилрадикал с 1-4 атомами углерода, ашиц-.адикал с 2--6 атомами «тлег ода, алкилк.рбамил с 1-4 aTOMasra гле :Да, фoiJV;i пo-pбa iил; ,, - атом водорода, алкилрадикал с .-4 а г омами углерода, алкоксирадикал с 1-4 атомами угоерода, атом галогена или трифторметилрадикал; f - атом водорода, алкилрадикал с атомами углерода, алкоксирадикал с 1-4 атомами углерода или атом галогена; R вместе могут кроме того, R,, и означать присоединенное конденсацией бензольное кольцо,. . или их солей, отличающийся тем, что спирт формулы I у ОН СН,3 (И) где А, ;Rg и Ц,. имеют указанш 1е начения, подвергают взаимодействию с алкили ующим или ацилируюшим соецинонием,
1112 (;
содержйшкл ,;ахяикал R , полученныещ выделением целевого прод;;:-- в
при этом рацематы обычным образом раз-свободном состоянии или в . к.чде oni
лагэют.к.:; енттшоды с последую- известными приемами,
500757
Авторы
Даты
1976-01-25—Публикация
1974-05-16—Подача