Ацип может представлять собой ацил органической карбоновой кислоты, содержащий до 18 атомов уа лерода, в частности ацил незамещенной или замещенной алифатической, циклоалифатической, циклоалифатически-алифатической, ароматической, ара лифатической, гетероциклической или гетероциклически-алифатической карбоновой кис лоты (включая муравьиную кислоту), а так же ацил полупроизводного угольной кислоты. Rj обычно содержит до 7, предпочтительно до 4, атомов углерода. Для синтеза солей, например солей щелочных и щелочноземельных металлов, солей аммония и аминов, применяют щелочи, аммиак, алифатические, циклоалифатические циклоалифатически-алифатические и арали- фатические первичные, вторичные или третичные МОНО-, ди или полиамины, оксиалкиламины, алкиленамины, циклоалкиламины гетероциклические основания, например тр этиламин, 2-оксиэтиламин, бис-(2-оксиэтил)-амин, три-(2-оксиэтил)-амин, 1-эти пиперидин, бициклогексиламин, N, N дибензилэтилендиамин, пиридин, коллидин, хино- Целевые соединения, содержащие основную группу, могут образовывать кислотно-аддитивные соли с неорганическими, например соляной, серной или фосфорной, и с органическими, например трифторуксус- ной или 4-метилсульфоновой кислотами. Изомеризацию 2-цефемсоединения в 3- -цефемсоединение проводят в присутствии слабоосновных третичных аминов, таких, как низщие алкиламины, третичные гетероциклические основания ароматического характера, в первую очередь третичные алифатические, азациклоалифатические или ара лифатические основания, например N, N,N-триметиламин, N, N -димети; - N -этиламин, N, NJ N -триэтиламин, N, N «ди изопропип- N -зтиламин, N -метилпипери дин, N -бензил- N, N -диметиламин, а также их смеси, например смесь пиридина и триэтиламина. Изомеризацию можно осуществлять в присутствии производного карбоновой кислоты, подходящего для образования смешанного ангидрида или галоидангидрида карбоновой кислоты, например в пиридине в присутствии ангидрида уксусной кислоты Обычно работают в свободной от воды сре де, иногда в присутствии растворителя, (гапример хлорированного, алифатического, циклоалифатического или ароматического углеводорода. Используемые слабоосновны третичные амины, жидкие в условиях реак ции, также могут служить растворителем. Реакцию проводят при (-30) - 100°С в атмосфере инертного газа, например азота, и/или в закрытом сосуде. Получаемые 3-цефемсоединения известным способом, например путем адсорбции и/или кристаллизации, отделяют от примесей 2-цефемсо единений. Во всех примерах, кроме специально оговоренных случаев, УФ-спектр снимают в 95%-ном этаноле, а ИК-спектр в метиленхлориде, для тонкослойной хроматографии используют силикагель и Г о(.3,. определяют в хлороформе. Пример 1. 50 мг дифенилметило- Бого эфира З-метокси-7- Р -фенилацетиламино-2-цефем-4- cL -карбоновой кислоты в 0,5 мл диметилсульфоксида и 5 мл этилдиизопропиламина выдерживают 17 час при комнатной температуре, разбавляют толуолом, промывают водой, 2 н.соляной кислотой и насыщенным водным раствором хлористого натрия, высушивают над сульфатом натрия, выпаривают и получают смесь (6: : 4) дифенилметиловых эфиров 3-метокси-7- Р -фенилацетиламино-2-цефем-4- сС -карбоновой и 3-метокси-7- р -фенилапе- тиламино-3 цефем-4-карбоновой кислоты, которую хроматографируют на 5О г сили- кагеля. Исходный дифенилметиловый эфир элюируют смесью толуол-этилацетат (4:1). Выход 27 мг, т.пл. 174-177 С (метилен- хлорид пентан). Выход целевого дифенилметйлового эфира 18 мг, R,. 0,37 (толуол-этилацетат, 1:1). УФ спектр, Л д, 258(6340), 264 (6350), 281 (5600), плечо. ИК-спектр, мк: 2,94, 3,О2, 5,62, 5,83, 5,93, 6,26 и 6,70. Для синтеза исходного вещества раствор 11,82 г натриевой соли 3-метокс -7- р -фенилацетиламино-3-цефем-4-карбоновойкислоты (получена при энзиматическом дезацетилировании натриевой соли 3-ацетил- оксиметил-7- р фенилацетиламино-3-цефем- -4-карбоновой кислоты в присутствии очищенного экстракта энзима из Baci6&u6 subti is штамм АТСС 6633 с последующей лиофилизацией реакционного раствора) в 2ОО мл воды наслаивают 4ОО мл этилаце- тата, подкисляют концентрированной фосфорной кислотой до рН 2, отделяют водную фазу, экстрагируют этилацетатом (2x150 мл), промывают экстракты водой (4 х 50 мл), сушат над сульфатом магния, концентрируют до 4ОО мл, прибавляют избыток дифенил- диазометана, выдерживают 3 час при комнатной температуре и отфильтровывают зернистый кристаллический осадок. Фильтрат концентрируют до 20О мл, при нагревании добавляют циклогексан, охлаждают до комнатной температуры, выдерживают при , отфильтровывают осадок, перекристаллизовывают его из смеси ацетон-циклогексан и получают дифенилметиловый эфир 3-метокси-7- р -фенилацетиламино-3-це- фем-4-карбоноБой кислоты, т.пл. 176 176,5°C;i:oC3 ° -6 + 1° (,231), при проявлении в парах йода или в УФ-све те при 254 ммк RP 0,42 (хлороформ-ацетон, 4:1), Рг 0,43 (толуол-ацетон, 2:1) и R. 0,41 (метиленхлорид-ацетон, 6:1). 1,03 г дифенилметилового эфира 3-метокси-7- р -фенилацетиламино-3-цефем-4- -карбоновой кислоты и 1,05 г йодида N -метил- N,N -дициклогексилкарбодиимидия в атмосфере азота растворяют в 25 мл абсолютного ТГФ, нагревают 1 час до 35ЯЗ добавляют еще 1,05 г йодида N -метил- N, N -дициклогексилкарбодиимидия в 15 мл абсолютного ТГФ и выдерживают 17 час при комнатной температуре в атмосфере азота. Затем упаривают в вакууме, растворяют остаток в метиленхлориде, пропускают через колонну с 50 г силикагеля, дезактивированного 10% дистиплированной воды, и элюируют метиленхлоридом (4 X 100 мл). Концентрируют элюат и хро матографируют на колонне с 90 г силикагелн, дезактивированного 10% дистиллированной воды. Используя 900 мл смеси то- луол-метиленхлорид (3:7), удаляют неполярные загрязнения. При элюировании ме- тиленхлоридом (2 х 20О мл) и лиофилизации из бензола получают дифенилметиловый эфир 3-йодметил-7- fb -фенилацетипамино- -З-цефем-4-карбоновой кислоты.
ИК-спектр, мк: 3,00, 5,62, 5,82, 5,95, 6,70, 7,32 и 8,16.
Для синтеза агента йодирования в круглодонной колбе на 250 мл с магнитной мещалкой, обратным холодильником и баллоном для азота растворяют 42 г свежеперегнанного N, N -дициклогексилкарбо- диимида в 9О мл метилйодида в атмосфе- ре азота при комнатной температуре, перемешивают 72 час при 70°С, из красно-бурого раствора отгоняют избыток метилйодида в вакууме, вязкий красно-бурый остаток растворяют в 15О мл абсолютного толуола при 40°С, выдерживают несколько часов, отделяют кристаллы на стеклянном нутч-фильтре, снабженном баллоном для азота, промывают фильтрат ледяным толу- алом (3 X 25 мл) и этим же толуолом промывают слабо-желтоватую кристалли-
руя метиленхлоридом и метиленхлоридом, содержащим 2% метилацетата, выделяют дифенилметиловый эфир З-метилен-6- В -фенилацетиламиноцефам-4- сС -карбоновой кислоты, т. пл. 144-147°С (метиленхлорид-гексан); ЕоС J |° .«18 + 1° (,715). УФ-спектр - МАКС () ммк: 254
(1540) и 260 (155О).
ИК-спектр, мк: 2,94, 5,65, 5,74, 6,94, 6,26 и 6,67.
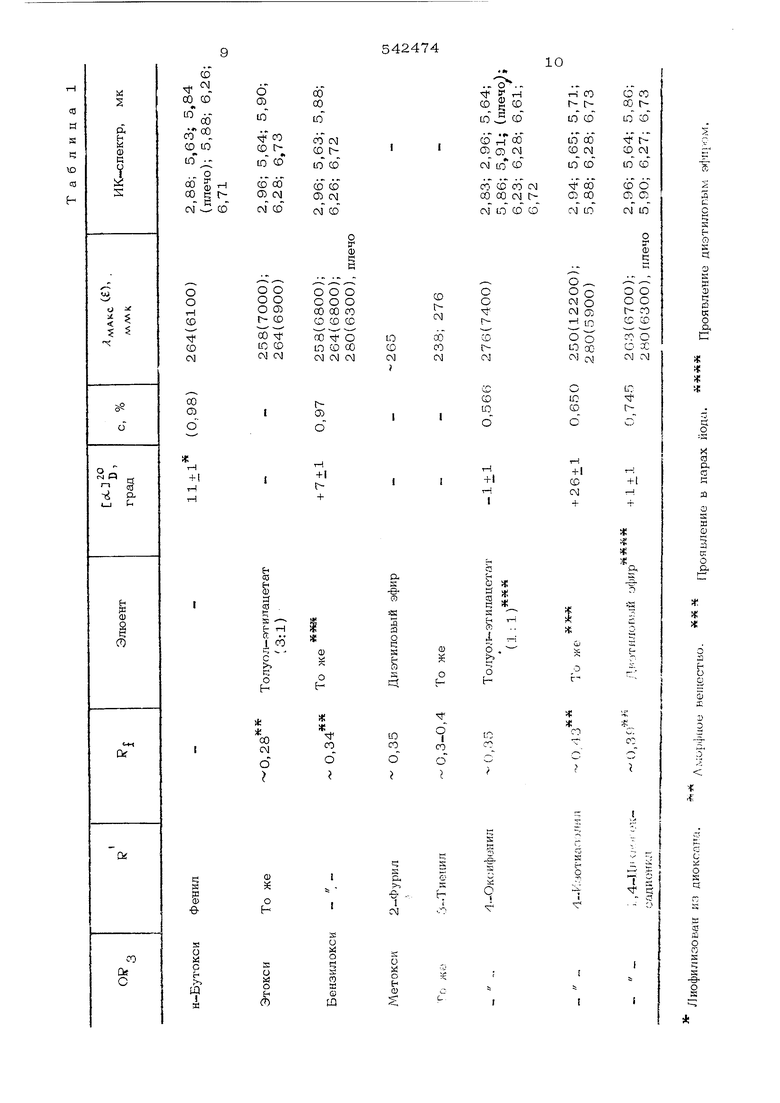
Раствор 1,0 г дифенилметилового эфира . З-метилен-7- р -фенилацетиламиноцефам-4 oi-карбоновой кислоты в 250 мл метиленхлорида обрабатывают в течение 8,5 мин при -7О°С смесью кислорода п озона (0,265 ммоль/мин озона), прибавческую массу на нутч-фильтре до обесцвечивания. После высушивания в течение 2О час при ОД мм рт.ст. и комнатной температуре получают йодид N -метил- N,N-дициклогексилкарбодиимидия в виде бесцветных кристаллов, т. пл. 111-113°С. ИК-сцектр (хлороформ), мк: 4,72 и 6,ОО. Раствор 0,400 г дифенилметилового эфира З-йодметил-7- -фенилацетиламино-3-цефем-4-карбоновой кислоты в 15 мл 90%-ной уксусной кислоты охлая дают в ледяной бане до О С и цри интенсивном перемешивании прибавляют порциями 2,0 г порошкообразного цинка, выдерживают 30 мин при О С, отфильтровывают непрореагировавшийся цинк на нутч-фильтре со слоем кизельгура, остаток на фильтре несколько раз взмучивают в свежем метиленхлориде и фильтруют. Объединенные фильтраты концентрируют в вакууме, прибавляют абсолютный толуол и упаривают досуха в вакууме. Остаток растворяют при перемешивании в 50 мл метиленхлорида и 30 мл 0,5 М раствора ., водные фазы экстрагируют метиленхлоридом (2 х 30 мл), органический слой и экстракты промывают повторно насыщенным водным раствором хлористого натрия, высушивают над суль фатом магния и упариварт в . Остаток хроматографируют на 22 г силикагеля, дезактивироватгного 1;0% воды. Злюиляют 1 мл диметилсуяьфида, перемешивают 30 мин при -70 С и 1,5 час при комнатной температуре и упаривакэт досуха в вакууме. Остаток, содержащий смесь дифенилметилового эфира 7- |i -фенилацетиламиноцефам-З-он-4- -карбонэвой кислоты и 1-оксидифенилметилового эфира 7- |i -фенилацетиламиноцефам-З-он-4-. -карбоновой кислоты, растворяют в 5О г метанола и при О С прибавляют избыток диазометана (раствор в диэтиловом эфире), перемешивают 15 мин при , выпаривают в в кууме и хроматографируют остаток на50 сипикагеля. Дифенилметиловый эфир 3-ме токси-7- |} -фенилацетиламино-2-цефем-4 - cL -карбоновой кислоты элюируют смесь толуол-этилацетат (4:1), I г 0,57 (толуол-этилацетат, 1:1), т. пл. 174-177°С (метиленхлорид-пентан). УФ-спектр, ,с ммк: 258 (4000). ИК-спектр, мк: 2,96, 5,63, 5,74, 5,92, 6,15 и 6,66. Пример 2 . Как в примере 1, получакуг 0,3 г аморфного дифенилметило вого эфира З-метокси-7-. /i -( D - oi -трет-бутилоксикарбониламино- оС -фенил- аяетиламино )-3-цефем-4-карбоновой кислоты, который лиофилизуют из диоксана, TJ - J. т J. (с 0,98); при прояв 1 + 1 лении в парах йода Р, -0,33 (диэтиловы эфир). УФ-спектр, Л..,.,,, ( , ммк: 264 ,. Д 14 С(63ОО), ИК-спектр, мк: 2,94, 5,62, 5,84, 5,88 (плечо), 6,25 и 6,71. Для синтеза используют 2 г соответст вующих дифенилметиловых эфиров 3-меток си-7- / - ( D - ci -трет-бутилоксикарбони амино- d- -фенилацетиламино)-2-цефем-4- ot-карбоновой кислоты, т. пл. 166 168°С (метиленхлорид-пентан); с(. ,х + 178 + 1° (с 0,771); при проявлении 4 8 0,61 (диэтиловый эфир). в парах йода 1 УФ-спектр (этанол), (, (f) ммк: 257 (3550). ИК-спектр, мк: 2,96, 5,63, 5,74, 5,85 (плечо), 5,92, 6,16, 6,64 (плечо) и 6,74. После хроматографирования (элюирование диэтиловым эфиром) выделяют 1,49 г непрореагировавшего продукта. Пример 3 . Aнaлoгич iым образом получают дифенилметиловые эфиры З-н-бутокси-7- |i -фенилацетиламино-3-цефем-4-карбоновой кислоты, беспветные пластинки, т. пл. 168-170°С (метиленхлорид-диэтиловый эфир);Гс131° + 55 + 1 (с 0,38); Д 264 ммк ( 7300); полосы поглощения в ИК-спектре при 2,96; 5,62; 5,81; 5,92; 6,26 и 6,62 мк, и Дифенилметиловый эфир 3-метокси-7- /3 -(5-бензоиламино-5-дифенилметокс икарб онилвалер иламино) -З-цефем-4-карбоновой кислоты, аморфное вещество, Rr 0,45 (толуол-этилацетат, 1:1); Я 258 ( 7450), плечо; 264 ( 7050) и 268 ммк ( 670О); полосы поглощения в ИК-спектре при 5,65, 5,78, 6,03 и 6,64 мк. Подобным образом синтезируют дифенилметиловые эфиры 3-OR -7- |i - Г D - о(-- -трет-бутилоксикарбЬниламино- d-(R )-ацетиламиноТ -З-цефем-4-карбоновой кислоты, перечисленные в табл. 1. Пример 4 . Смесь О,20О г ди- фенипметилового эфира З-метокси-7- В -f D - d -трет- бутилоксикарбонипамино-ci--(1,4-циклогексадиенил)--ацетипамино -З-цефем-4-карбоновой кислоты, 0,5 мл анизола и 10 мл охлажденной трифторуксу ной кислоты перемешивают 15 мин при ОЧ добавляют 50 мл холодного толуола и упа ривают в вакууме. Остаток размешивают с циэтиловым эфиром, отфильтровывают осадок, сушат, растворяют в 6 мл воды, добавляют 2 н. соляную кислоту до рН 1,5 промывают раствор 20 мл этилацетата, до бавляют по каплям 20%-ный раствор три- этиламина в метаноле до рН 5,0, разбавл ют 20 мл ацетона и 10 мл диэтилового эфира и выдерживают 16 час при О°С. Ос док отфильтровывают, промывают апетоном и диэтиловым эфиром, сушат и получают 3-.метокси-7- ji D - J -амино- Л -(1,4-циклогексадиенил)-ацетиламино -3-цефем-4-карбоновую кислоту, внутренняя соль; т. пл. 170 С (разл.); при проявлении в парах йода ,26 (н-бутано -уксусная кислота - вода, 67 : 1О : 23) и RI 0,58 (изопропанол - муравьиная кислота - вода, 77:4:19). УФ-спектр (О,1 н. соляная кислота), - ллАкс : 267 ммк (6100). УФ-спектр (0,1 н.бикарбонат натрия), ллАкс (О : 268 ммк (66ОО). Пример 5 . Смесь 0,095 г дифенилметилового эфира 3-метокси-7- р - D - о1 -трет-бутилоксикарбониламино- -о1 -(4-оксифенил)-ацетиламино 3-цефем -4-карбоновой кислоты, 0,25 мл анизола и 5 мл охлажденной трифторуксусной кислоты перемешивают 15 мин при , прибавляют 50 мл холодного толуола, упаривают, в вакууме, размешивают остаток с диэтиловым эфиром, фильтруют, сушат. растворяют в 5 мл воды, добавляют 2 н. соляную кислоту до рН 1,5, промывают раствор 20 мл этилацетата, добавляют по каплям 20%-ный раствор триэтиламина в метаноле до рН 5,0, наблюдая образование бесцветного осадка. Разбавляют 8 мл ацетона, выдерживают 16 час при 0°С, отфильтровывают осадок, промывают его ацетоном и диэтилоБым эфиром, сушат в вакууме и получают З-метокси-7- |Ь - D - (Г -амино- оС -(4 оксифенил)-ацетиламино) - -З-цефем-4-карбоновую кислоту, внутренняя соль; т. пл. 180°С (разл.); при проявлении в парах йода F, 0,24 (н-бутанол: -уксусная кислота: вода, 67:10:23) и 0,57 (изопропанол: муравьиная кислота: вода 77:4:19). УФ-спектр (0,1 н. соляная кислота), - ллАкс () : 228 (120ОО), 271 (6800). уф спектр (0,1 н.бикарбонат натрия), ЯМАКС t) : 227 (10500), 262 (8000), плечо. Используя подходящие реагенты, получают 3-н-бутокси-, т. пл. 141-142°С; R.J - 0,21; 267 ммк ( е 7300), 3 этокси-, аморфное вещество, RI О,17; i МАКС 263 мм ( 550), и 3-бепзилокси-7- р) - ( D ( -Фенилглициламино)-З-цефем-4-карбоновую кислоту, R| О,17; 266 ( . 6500) ммк, в виде внутренней соли. Для элюирования перечисленных кислот применяют систему этилацетат -пиридин - уксусная кислота - вода, 62:21:6:11, а УФ спектр снимают в 0,1 н. бикарбоната натрия. Кроме того, синтезируют 3-метокси-7- „ -(R )-3 цефем-4-карбоновые кислоты, указанные в табл. 2.
МетоксикарбонилацетилaMirao0,5 -0,6
0,25 -0,35 н-Бутано; -уксусная
0,3 -0,4 То же (2-Тиепил)ацетиламино0,5 -0,6
( cL -Карбокси- ci- -фенил- ацетиламино)
-0,4 н-Бутанол-уксусная
Ацетоацетиламино 0,35 -0,45 Цианоацетиламино
o L-Цианопропиониламино 0.4 -0,5То же
d. -Циано- ot -фенилацетиламино0,3 -0,4
2 Хлорэтиламинокарбонип
амино0,3 -0,4
0,40
Дихлорацетиламино
d-Сульфо- d. -фениладетиламино 0,10 -0,20
о,Фениламинокарбониладетиламино0,30
Этилацетат-уксусная
2655,66 кислота (9:1) кислота-вода (75 :
264 :7,5:21)
2665,66
235; 264
н-Бу1 ано л-пиридин уксусная кислота - вода (4О:24:6:30)
238; кислота-вода 265 (75:7,5:21)
2654,44; 5,66
н-Бутанол-уксусная кислота-вода
2674,42; 5,65 (75:7,5:21)
к«
266
То же
5,67
264
к«««
241
5,65 266 -н-Бутанол-пиридинуксусная кислота - вода (38:24:8:30) н-Бутанол-пиридинуксусная кислота-вода. оо R «R (38:24:8:30)2644,32;5,6о
15
524474
16 Продолжение таблицы 2





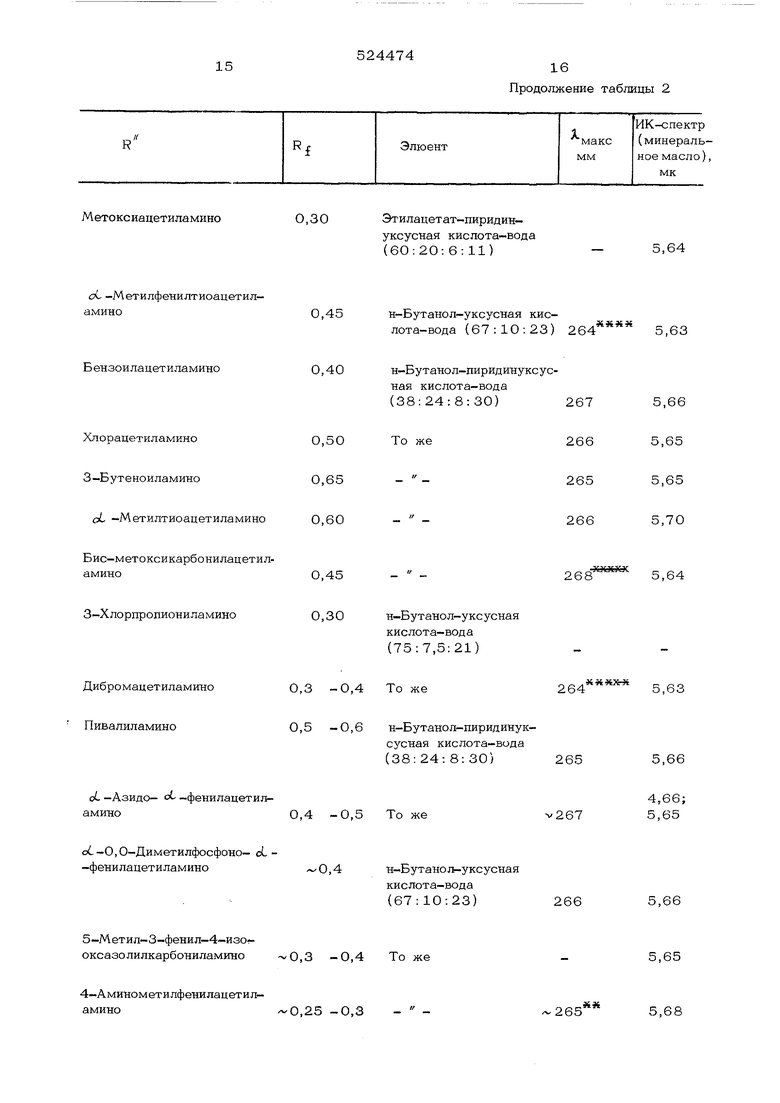



Метоксиацетиламино
0,30Этилацетат-пиридина -Метилфенилтиоацетил- амино0,45
Бензоилацетиламино
0,40
Хпорацетиламино
0,50
3-Бутеноиламино
0,65
oL -Метилтиоацетиламино0,60
Бис-метоксикарбонилацетиламино0,45
3-Хлорпропиониламино
0,30н-Бутанол-уксусная
Дибро мацетиламино
О,3 -0,4 То же Пивалиламино 0,5 -0,6
oi. -Азидо- о -фенилацетиламино0,4 -0,5 То же
oL 0,4н-Бутанол-уксусная
5-Метил-3-фенил-4-изо-
0,3 -0,4 То же оксазо лилкарбониламино
4-Аминометилфенилацетил-
-0,25 -0,3
амино
уксусная кислота-вода
5,64 (60:20:6:11)
н-Бутанол-уксусная кислота-вода (67 : 10 : 23) 264 5,63
уксус267
5,66 5,65
266 5,65
265 5,70
266
ggXlOtMC
кислота-вода (75:7,5:21)
264 5,63
5,66
4,66; 5,65
v267
кислота-вода (67:10:23)
5,66
266
5,65
,68 н-Бутанол-пиридинук;сусная кислота-вода (38:24:8:30)265
17
2,6-Диметоксибензоиламино 0,5О
ГБ- ot-амино- (3-тие- нил)-ацетиламино -ч. 0,2 -0,3
Г D - сС-амино- d - (2-фу рил)-ацетиламино J
0,25
С D - ot -о кои- сзС-фенилаце-ЛЙЙЙЙК.- г г
тиламинд 0,35
1-Аминоциклогексилкарбонил0,2 -0,25 н-Бут ано л-у КС усная кис4-Пиридилтиоацетиламиноv 0,25 -0,3 „ j -4-АминопиридинииацетилjiiKKK M
0,20 -0,30 То же
амино
0,35 -0,45 - 1-Тетразолилацетиламино
1-Метил-2-имидазолилтио-
ацетиламино0,3 -0,4
1,2,4-Триазол-З-илтиоацеО,3 -0,4 - тиламино
0,40
Азидоацетиламшю
«Снят в метаноле.
KSСнят в 0,1 н.соляной кислоте.
« Получена в виде динатриевой соли.
JtxKKСнят в этаноле.
JCKXKXСнят в О,1 М бикарбонате натрия.
юскххкЛиофилизован из диоксана.
яюшхккАморфное вещество в виде внутренней соли.
542474
18
Продолжение таблицы 2
265
5,64
н-Бутанол-у кс усная кислота- вода (67:10:23)
То же
5,66
-265 лота-вода (67 : 10 : 23)
5,65 5,15
5,66
хжкк
4,65;
264 5,64 -264 н-Бутанол-пиридин-уксусная кислота - вода (42:24:4:30)
Авторы
Даты
1977-01-05—Публикация
1973-06-27—Подача