(54) СПОСОБ ОЧИСТКИ ФЕРМЕНТН ЫХ ПРЕПАРАТОВ


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ очистки протеолитических ферментов | 1978 |
|
SU942427A1 |
| Способ очистки протеолитических ферментов | 1976 |
|
SU644796A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА КОЛЛАГЕНАЗЫ С ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ ИЗ ГЕПАТОПАНКРЕАСА КАМЧАТСКОГО КРАБА | 2009 |
|
RU2412995C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАРИНОВ С НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ | 2005 |
|
RU2295538C2 |
| Способ очистки @ -глюканазы | 1985 |
|
SU1353807A1 |
| Способ очистки микробной трипсино-пОдОбНОй пРОТЕиНАзы | 1978 |
|
SU819167A1 |
| Биоспецифический полимерный адсорбент для выделения протеиназ (его варианты) | 1982 |
|
SU1137388A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-МАКРОГЛОБУЛИНА | 1990 |
|
RU2049470C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНГИБИТОРА СЕРИНОВЫХ ПРОТЕИНАЗ КАМЧАТСКОГО КРАБА | 2014 |
|
RU2560264C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ | 1991 |
|
RU2008353C1 |

Изббретенне относится к способу получения; высокоочищенных ферментных препаратов, которые могут найти применение в пищевой, медицинской и микробиологической промышленности, а также в лабораторной и медицинской практике. Эти ферментные препараты могут быть использованы, в частности, в таким процессах, как производство сыров, соков, вин или медицинских сывороток.
В литературе описано большое количество способов очистки ферментов 1. Наиболее распространенным и удобным методом очистки ферментов является метод жидкостной хроматографии, заключающийся в адсорйдии растворенных ферментов на носителе, отделения от носителя с применением солевых буферных растворов, с последующим обессоливанием раствора очищенного фермента, например, диализом. При этом в общем случае прочность связывания фермента с носителем определяется многими физико-химическими особенностями фермента, характером и расположением заряженных групп, степенью диссоциации при данных условиях, размером молекул и т.д. и степень очистки фермента зависит не только от условий разделения, но и от типа применяемого носителя - адсорбента.
Наиболее широко при таком способе очистки ферментов используются ионнообменные носители на основе целлюлозы, такие, как диэтиламиноэтилцеллюлоза (ДЭАЭ-Ц) и карбоксиметилцеллюлоза (КМ-Ц). Известны и другие ионнообменные материалы такие, как, например, ионнообменные смолы типа Абмерлит, Дауэкс, применяемые для очистки некоторых белков, однако, менее эффективные для большинства белков, чем производные целлюлозы.
Известен, в частности, способ очистки ферментов с применением в качестве носителя ДЭАЭ-Ц 2 2. Однако этот способ обладает рядом существенных недостатков. Во-первьк, материал носителя часто оказьшается нестоек к отдельным компонентам исходного ферментного препарата и загрязняет очищенный фермент прюдуктами распада. Во-вторых, материал носителя легко подвергается действию микроорганизмов. В-третьих, все известные материалы на основе целлюлозы при работе в колоночном варианте обладают высоким гидродинамическим сопротивлением. Это обстоятельсрзс приводит к длительным операциям с растворами ферментов, снижая выход активного фермента.
Предиагается способ очистки ферментных пре паратов путем ионообменной хроматографии на широкопористых адсорбентах на основе двуокиси кремния, например силохромах, которые дан избирательного действия на ферменты и сопутствующие им примеси и белки модифицируют разлитаыми реагентами, содержащими ионогенные группы.
В случае способ осуществляют следующим образом.
Раствор неочищенного фермента вводят в кон такт с адсорбентом на основе двуокиси кремния, которому шриданы необходимые свойства путем обработки его химическими реагентами. Выбор реагентов для модификащш адсорбентов на основе двуокиси кремния проводят, исходя из известных или предполагаемых физико-химических свойств биологического объекта, подлежащего выделению, и сопутствующих ему примесей (изоэлектрическая точка, полярность и т.п.).
Установлено, что модифицированный силохром, содержащий анионогенную аминогруппу (аминосилохром), способен избирательно связывать кислые протеиназы такие, как пепсины и химозш1ы, причем оптимальное связывание указанных ферментов проявляется при рН исходной среде выще изоточки фермента, например для пепсина при рН 2,4-6,0, для химозина при 4,6-6,0.
Модифидированньш силохром, имеющий катионогенную сульфогруппу алкил/арил/ сульфокислоты, обладают избирательным дествием на нейтральные и щелевые протеиназы, оптимум действия при рН 6,0-8,0.
Таким образом, используя избирательность взаимодействия модифшшрованного силохрома на билологически активные вещества, можно производить разделение ферментов и их отделение от примесей.
В качестве злюентов используют растворы солей, кислот и т.д., в воде или органических растворителях.
Установлено, что оптимальные условия для элюции кислых протеиназ создаются при применении буферов с рН ниже изозлектрической точки ферментов - для пепсина с рН 1,5-2,4 и для химозина с рН 2,0-4,5.
Используя буферы с различным рН в пределах 1,5-6,0, можно произвести разделение различных видов кислых протеиназ. Данный способ позволяет
не только очищать ферменты от сопутствующих им примесей, но и в ряде случаев позволяет разделять родственные ферменты, например пепсины и химозины субтилизины.
Пепсины и химозины относятся к кислым протеиназам, поэтому при обработке их смеси аминосилохромом адсорбируются оба фермента. Для их разделения применяют последователыю элюзию 5 мм (рИ2,4) и 50мм (рН 1,5) растворами соляной кислоты. Первая фракция злюата (рН 2,4-4,5) содержит фермент химозин; вторая фракция злюата (рН 1,5-2,4) - фермент пепсин.
Для разделения таких протеиназ, как трипсин и субтилизины, их сорбируют iia сульфосилохроме при рН 6,0-8,0, а элюцию ведут, используя буферы: для трипсина с рН 3,0-5,0; суЬтилизина - с рН 8,0-12.
Таким образом, создавая оптимальные условия для адсорбирования и злюции того или иного фермента, можно обеспечить высокий выход продукта высокой степени чистоты при сохранении его высокой активности.
Очищенный фермент можно использовать в виде раствора или высущенным. Высущивают фермент лиофильно. Для сохранения активности фермента при лиофильной сушке раствор очищенного фермента обрабатьшают анионитом для удале1тя из раствора кислоты.
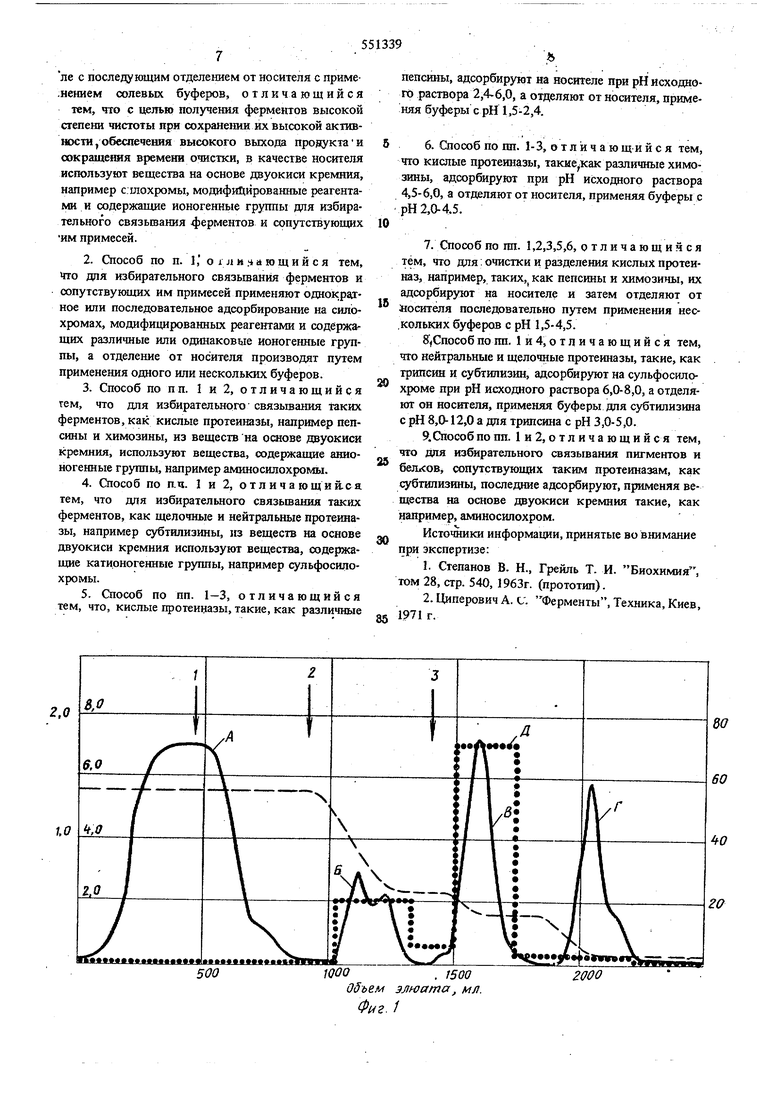
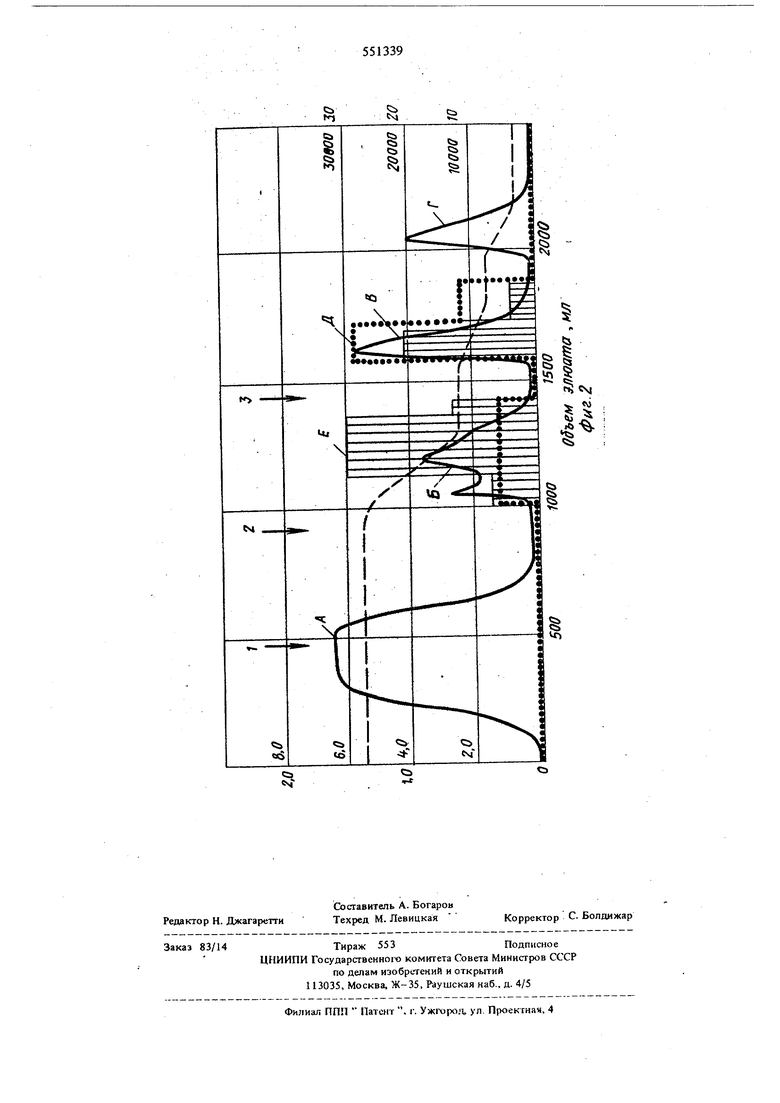
На фиг. 1 и 2 приведены хроматограммы двух процессов - очистки коммерческого препарата свиного пепсина на ами.носш1охроме и очистки и разделения на аминосилохроме пепсина и химозина из коммерческого препарата, полученного из желудков телят (сплощная линия - оптическая плотность элюата с хроматографической колонки с аминосилохромом, измеренная детектирующим устройством при длине волны света 280 нм; пунктирная линия - изменение рН элюата; точки - измерение удельной активности, измеренной по скорости гидролиза гемоглобина в фракциях элюата; стрелки последовательность смены элюентов: 1 - промьтка колонки с адсорбированными на ней ферментами исходным буфером, 2 и 3 - начало пропускания через колонку 5 мм и 50 мм соответственно растворов кислот. Максимумы оптической плотности на фиг. 1, обозначенные буквами, соответствуют: А примесям, не адсорбированным колонкой и смытым исходным буфером; Б - примесным пигментам и белкам, десорбируемым;. с колонки буфером 2 и В - ферменту пепсину, десорбируемому с колонки буфером 3 и обладающему высокой протеолитической активностью (Д). Максиму мы оптической плотности на фиг.2 соответствуют:А - примесным белкам и пигментам, не адсорбированным на колонке и смытым исходным буфером; Б ферменту химозину, десорбируемому с колонки буфером 2, и В - ферменту пепсину, десорбируемому с колонки буфером 3. Максимумы плотности Г соответствуют примесям, которые десорбируются с колонки при ее регенерации 1 М раствором соляной кислоты. Участки хроматограммы на фиг. 2, выделенные вертикальной штриховкой, показывают удельную активность фракций :шюата, определенную по створаживанию молока, и соответствуют максимумам оптической плотности. Наибольшая удельная активность (Е) соответствует максимуму (Б), т.е. фракции, содержащей фермент химозин. В указанных условиях достигается высокая очистка и четкое разделение ферментов, обладающих соответствующими нм высокими активностями (Д и Е).
В примере 1 приведен способ очистки свиного оепсынь на немо шфицировашюм си юкроме марки
С-80. Из сравнения удеяыжж актяввосга фермен тов, ошщенных по способам, яряаеашным в иримерах 1 и 2 (примере 2 для очистки свиного пепсина использован аминосилохроа модафицированньш силохром, содержапдай ио геиные аминогруппы), видно, что модификация приводит
к избирательному действию носителя на очищаемый фермент (см. фиг. 1).
Пример. Очистка пепсина на силохроме. Буферный раствор с рН 3,0-6,0 (целесообразно 3,5-5 5)j со держащий неочищенный свиной пепсин с удельной активностью около 19. единиц активности .(оптическую единицу (е.а./о.е.) пропускают через роматографическую колонку, заполненную силохромом марки С-80. Затем адсорбент промьшают последовательно исходным буфером 5мм и 50 мм растворами соляной кислоты (НС1). Собирают фракцию элюата с колонки с рН 1,. Удельная активность пепсина в указанной фракции составляет 25-30 е.а./о.е.
П р и м е р 2. Очистка пепсина на аминосилохроме. Хроматограмма процесса очистки представлена на фиг. 1.
Буферньш раствор с рН 3,0-6,0 (целесообразно 5,4), содержащий неочищенный свиной пепсин с удельной активностью около 15-30 е.а./о.е. пропускают через хроматографическую колонку, заполненную аминосилохромом (модифицированным силохромом, имеющим анионогенную аминогруппу). Затем адсорбент промьшают последовательно исходным буфером (1) 5 мМ (2) и 50 мМ (З) растворами НС 1. Собирают фракцию элюата с колонки с рН 1,5-2,4. Удельная активность пепсина в указанной фракции, определенная по методу Ансона, составляет 60-75 е.а./о.е. Перед лиофилизадаей раствор фермента обрабатывают ионитом марки АВ 17-8/АВ 16 ГС, Дауэкс 1 х 16 и т.п./ в ОН - или СНзСОО-форме, увеличивая рН раствора до 2,5-5,0, целесообразно 3,5-5,5. Выход фермента по активности после лиофилизации составляет около 70-80%.
Примерз. Очистка и разделение пепсина и химозина.
Хроматограмма процесса представлена на 1ФИГ.2.
Буферный раствор с рН 4,5-6,0 (целесообразно 5,4), содержащий ферментный препарат, полученный из желудков телят, пропуска ют через хроматографическую колонку, заполненную аминосилохромом. Затем адсорбент промывают последовательно исходным буфером (1) 5 мМ (2) и 50 мМ (3) растворами ПС. Собирают фракции элюата с рН 2,4- 4,5 и 1,5 - 2,4. |1ервая фракция содержит фермент химозин (молокоствораживающий фермент) с удельной актииностью, определяемой по створаживанию молока, равной 30000 ед. активности на миллиграмм фермента (е.а./мг). Вторая фракция содержит пепсин желудка телят и обладает претеолитической активностью, определяемой по расщеп лению гемоглобина (метод Лнсона), равной 20-30
а.е./о.е. 11роф шь кривой зтскзкк с колонки приведен на фиг. 3. Перед лиофилизацней указанные фракции обрабатывают ионитами марки АВ 17 -8/АВ 16 ГС, Дауэкс х 16 и т.п./ в ОН- или
СНзСХЭО-форме. Выход химозина по активности составляет около 80%.
П р и м е р 4. Очистка субтилизина на аминосило хроме.
Буферный раствор, рН 6,0 - 11,0, целесообразно 6,0 - 8,0, содержащий фермент субтилизин,пропускают через колонку, заполненную аминосилохромом. Элюат с колонки содержит свободный от сопутствующих пигментов и других примесей субтилиз1Ш с активностью в 8-15 раз выше исходной,
определяемой по расщеплению синтетического Субстрата п-т1троа1шлида карбобензоксиглищш - глицил - л - лейцина.
П р и м е р 5. Очистка и.разделение субтилизинов на сульфосилохроме.
Буферный раствор с рН 6,0 - 1 ,0, целесообразно 6,0 - 8,0, содержащий субтилизин, пропускают через хроматографическую колонку, заполненную сульфосилохромом - модифицированным силохромом, имеющим катионогенную сульфогрутшу алкил (арют сульфокислоты. Затем адсорбент промывают последовательно исходным буфером с рН 6,0-8,0 и буферами с рН 8,1 - 9,0 и 0- 1. Собирают фракции элюата с колонки с рН в пределах 8,0 - 11,0, содержащие практически чистый субтилиЗИН, свободньш от примесных белков и пигментов. П р и м е р 6. Очистка трипсина на сульфосилохроме.
Буферный раствор с рН 6,0-8,0, содержащий трипсин, пропускают через хроматографическую
колонку, заполненную сульфосилохромом. Затем адсорбент промывают последовательно исходным буфером и 1 мМ раствором НС срН 3,0. Собирают фракции элюата с колонки с рН 3,0 - 5,0, содержащие высокоактивный трипсин, по данным злектрофореза, свободный от сопутствующих примесей и белков. Примеси элюируются с колонки при последующей ее промывке 10 мМ раствором шелочи И-пи 1,0 М раствором НС1.
П р и м е р 7, Очистка иммуноглобулинов.
Буферный раствор, рН 6,0-9,С целесообразно,
0,05 М фосфатный буфер с рН 7,0-8,0, содержащий препарат ачацентарного человеческого иммуноглобулина, пропускают через колонку, заполненную аминосилохромом. Элюат с колонки при промывке
ее исходным буфером содержит практически чистый плацентарный иммуноглобулин. Примеси элюируются с колонки при последующей ее промывке 10мМ раствором щелочи или 1,0 М раствором . соляной кислоты.
Формула изобретения
ле с последующим отделением от носителя с приме.нением солевых буферов, отличающийся тем, что с целью получения ферментов высокой степени чистоты при сохранении их высокой активности, обеспечения высокого выхода продуктаИ сокращения в жмени очистки, в качестве носителя используют вещества на основе двуокиси кремния, например с.шохромы, модифиДйрованные реагентами и содержащие ионогенные группы для избирательного связывания ферментов и сопутствующих им примесей.
пепсины, адсорбируют на носителе при рН исходного раствора 2,4-6,0, а отделяют от носителя, применяя буферы с рН 1,5-2,4.
SfCnoco6 по пп. 1и 4, отличающийся тем, что нейтральные и щелочные протеиназы, такие, как трипсин и субтилизин, адсорбир)тот на сульфосилохроме при рН исходного раствора 6,0-8,0, а отделяют он носителя, применяя буферы для субтилизина с рН 8,0-12,0 а для трипсина с рН 3,0- 5,0.
Источники информации, принятые во внимание при экспертизе:

Авторы
Даты
1977-03-25—Публикация
1975-09-29—Подача