(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦИКЛОПЕНТАНА






















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных циклопентана | 1971 |
|
SU473356A3 |
| Способ получения циклопентановых производных или их солей | 1973 |
|
SU574149A3 |
| Способ получения производных циклопентана | 1975 |
|
SU624569A3 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО ЦИАНОЕНОНА КАК МОДУЛЯТОРЫ KEAP1 | 2021 |
|
RU2822828C1 |
| Способ получения производных 3-метокси-4-оксатрицикло(5,2,1, 02,6)-дец-8-ен-5-спиро-2"-тетрагидрофурана | 1975 |
|
SU527428A1 |
| Способ получения 13,14-дегидро-11-дЕзОКСипРОСТАглАНдиНОВ | 1976 |
|
SU845774A3 |
| СПОСОБ ЛЕЧЕНИЯ ШИЗОФРЕНИИ | 2012 |
|
RU2648474C2 |
| Способ получения полифункциональных серусодержащих спироциклических лактонов | 1986 |
|
SU1351933A1 |
| Способ получения производных катехина | 1984 |
|
SU1424729A3 |
| Способ получения производных 8,12-диизопростановой кислоты | 1975 |
|
SU626692A3 |

1
Данное изобретение относится к способу получения новых производных циклопентана общей формулы
(CHalnRj
Х- cm, I
OR а
где R,- аг:кил Cj - C,g с нормальной или разветвленной цепью, который может быть алкоксилом, или представляет циклоалкил Сд -С , адамантил, Rj- водород, алкил, ацил Rj- карбоксил, алкоксикарбонил С- -Cjj с нормальной или разветвленной цепью, карбомоил, незаметенный или
замещенный одним или двумя алкилами карбазоил,
Кд- кислород, рксиимино, алкоксиимино, гидразоногруппа, замещенная или незамещенная двумя алкилами RS - алкил, водород X - транс -виниленовая или этиленовая группа;
Л - 5, 6, 7 или 8,
которые обладают ценными медикобиологическими свойствами и могут найти применение как фармакологические препараты.
Известен 1 способ получения - (3-оксиокта-1-енил-2-оксициклопентил - энантовой кислоты из 7-i6poMгептаноата и калиевого енолята 2-этоксикарбоциклопентанона, включающий последовательность из i одиннадцати стадий
Вг(СН.)бСООС.1Н5 +
К-Сопь
HgC.OOC (Ш)дСООС,Н5
20%H,S04
( COOHЖ ° (СН2)бСООН
HCN 0 0
HOOC (СН2)бСООН HOOC (СН,)бСООНз 8 УоУоОН ГЛ СНзОн н W
ClOC (сН2)(П1з SOCU V4 CHjOH OH- (Ш2)б 100СНз
о
.-
ZH.HoS04 I г
11
Ч (ОТа)бСООСНз
но
-(СНг)4СНз
Y((Hj)eCOOCH3 OH
HO
Br
A1C13 ОСНз ОСНз NOBN KB
он
CsHtiTigBr ОСНз (СН1)бСООСНз С целью синтеза новых производных циклопентана общей формулы J предложен -ьКбО(1)яСч - A: E нами И R.
о
-J-HCIi
КБ-Ч
jQniMi/
-ТЕ
--Kj
HgOUHi
НТА
ГУ /
QjF-CHCORi
- sHf
{СН,)пСООН
вТИ -К5-/
R у-/
(СН,)„СООИ
3lX-«54X
- указанные выше энагде и,,и, ,п чения; н
(СЯ2)пСН,011
IV
(СН2)лСНгОН
С№
(сНг)пСНгОН
0 -CfVI
Н
(CHjjnCHiOH
fi
Tin
В
(CHjjnCOOH
li
ои М способ, включающий последовательность, состоящую из восьми стадий. (CHt)rtCHiOH VJ Я - водород или группа, отщеплявмая при гидролизе; A-R-,0 OR, / XII где йч одинаковые алкилы или оба вместе замещенная, или незамещенная этиленовая группа RII - алкил. Предлагаемые соединения формулы J имеют такую конфигурацию, в которгч Соковые цепи, присоединенные к атома углерода кольца в 1 и 2-положениях, имеют троне-расположение. Изомерные форкы соединений изобре тения, воэникаюшие из центров изомери зации,можно разделять известными спо собами, например, диастереоизомерные ф мы можно разделять хроматографией с применением избирательной ашсорбции из pacT BOpeti или из паровой фазы на подходящие адсорбенты. Энантиомерные формы кислотных соединений с формулой , где RJ - карбоксильная группа можно разделять путем образования солей с оптически активным основанием и последующим разделением получен ных пар диастереоизомеров, например фракционированной кристаллизацией из подходящей системы растворителей с последующей регенерацией энантиомерных кислот формулы. Для осуществления предлагаемого способа применяют альдегиды формулы К80()„СНО и где Нс водород или группа, легк отщепляемая при гидролизе, например 2-тетрагидропиранил, незамещенный или замещенный алкилом; л- вьаиеуказанное значение. Реакцию альдегида с формулойg и енамина (например, морфолиненамина) цйкЛопентанона до получения 2-оксиалкилциклопент-2-ен-1-онов Rj проводят в инертном органическом раствор теле, например ароматическом углево дороде (бензол) при непрерывном уда лении волы при 60-120°С с последующим гидролизом в водной кислоте (например, соляной кислоте) при комнатной температуре. Затем реакци онную смесь нагревают с кислотой, например концентрированной до в таком инертном растворителе, например бутаноле, до перем щения двойной связи из экэоцикличес го в эндоциклическое положение. Полученные оксиалкилциклопент-2ген- 1-оны(пО гидроцианируют, например ацетонциангидридом, в присутствии основания, например карбоната натри в водном органическом растворителе, например в водном метаноле, при температуре 50-1Юс или кипении растворителя с обратным холодильником до образования кетонитриловО)Кетонитрилы(1У) превращают в кеталиСУ) взаимодействием соединения с формулой IV и соответствующего спирта в присутствии кислого катализатора, например я -толуолсульфокислоты с одновременной отгонкой воды.Этот процесс ведут в среде инертного огранического растворителя, например бензола при температуре кипения. Кроме того, кeтoнитpилыJV могут быть превращены в оксимы взаимодействием с соответствующими алкоксиаминами в присутствии основания. Далее, нитрилы IV восстанавливают в инертном органическом растворителе, например низшем диалкиловом эфире (диэтиловом эфире), предпочтительно при температуре от -86 до до соединений (VI), с помощью известных комплексных металлических восстановителей, предпочтительно раствора гидрида диизобутилалюминия, в инертном органическом растворителе, например ароматическом углеводороде (бензол). Получаемые 2- (оксиалкил) -циклопентанкарбальдегиды1у являются новыми соединениями и основными промежуточными продуктами прюцесса, предусмотренного изобретением. При реакции альдегида(УОи фосфорана обшей формулы Q jP CH-GO-R, X11I где Qj - фенил, алкфенил, алкил, например бутил; Н,- вышеуказанное значение, в инертном органнческом растворителе, например тетрагидрофуране, при температуре кипения реакционной смеси с обратным холодильником, получают непредельные KeTOKcj(vil). Далее, кетоныУГ| окисляют в органическом растворителе, например, трехокисью хрома в диметилформамиде, предпочтительно при температуре от -Ь до -t-lU C до образования циклопентанал-. кановых кислот(У1иЬ Циклопентаналкановые кислоты(у111)в инертном органическом растворителе, например этаноле, восстанавливают боргидридом металла, например боргидридом натрия, желательно в присутствии основания, например гидроокиси щелочного металла (гидроокиси натрия) до получения (оксиалкенил) циклопентилалкановых кислот (IK.). Затем кетали1Х , где А группа формулы , подвергают кислотному гидролизу, например, в разбавленной водной соляной кислоте при 45-70°С до получения 5- (3-оксиалкенил)-2-оксоциклопентилалкановых кислот 2Этот гидролиз выгодно проводить совместно с превращением соединеннйУ в соединения IX с изменением условий для протекания гидролиза кеталя до кетона . За счет этого уменьшается количество стадий реакции до семи.
Он СИМЫ с общей формулы g, .где д группа, имеющая формулуХП , являются новыми соединениями, из входящих в ряд соединений формулы J . Их можно превращать в соединения формулы известными способами превращения оксимов в кетоны, например обработкой водного Органического раствора оксима с формулой §, предпочтительно смесью водной уксусной кислоты и диоксана, водным раствором треххлористого титана и атмосфере инертного газа, например азота.
Производные соединений общей формулы Т , где RJ- алкоксикарбо, можно получить при реакции соответствункцей карбоновой кислоты с общей где R. - карбоксил, со спиртом, имеющим общую формулу
RgOH
гдейд- алкил, , , избыток которого можно использовать в качестве растворителя, в присутствии неорганической кислоты, например соляной или чзерной, предпочтительно при температуре кипения реакционной смеси.
В случае, когдай представляет формулу СНЯ,
где R ti Rj - водород или низший алкил, с диазоалканом общей формулы
RioR,.
XIV
где Нд, U Н, вышеуказанные значения, в среде инертного органического растворителя, предпочтительно диалкилового эфира, например диэтилового эфира. С другой стороны, можно проводить реакцию серебряной соли карбоновых кислот с формулой I с галоидалкилом RgZj , где 2 галоген и вьюеуказанное значение,
в присутствии органического растворителя, например ароматического углеводорода (бензол) при температутре кипеиня реакционной смеси.
Амиды.с формулой Bj-карбамоил, незамещенный или замещенный одним или двумя алкилами, можно получить:
1Г Йри реакции соединеиия, име&цего общую формулу
ННВцКц ХГГО
где RJJ ft и - водород или алкил, с соединением, имекжцим общую формулу
(т)„соок14
XV
X-CH-RJ
ORj
где R.Rj.R ,R5 , n и X - вышеуказанные .значения,
R|4 - алкил, (Tjj , в инертном органическом растворителе, например низшем алканоле (этаноле) или бензоле при температуре кипения реакционной смеси желательно в присутствии основного катализатора, например алкоголята щелочного Металла, в низшем алканоле, например этилате натри я в этаноле;
2)приреакции соединения, имеющего формулу 0 , с формамидом или сшкилированным формамидом в присутствии основного катализатора, например метилата натрия;
3)или амиды с общей формулойJ , эа исключением тех, у которых водор
можно получить при реакции соответствующего галоидангидрида, имеющего общую
R4
(CHa)nCOZ,
..-гг
ХП
Х CliR J
он;
где Rj, R , R g , л , X - вышеуказан- л ные значения и 2 или ациЛ и например алканоил, или бензоил, Zg- хлор, бром,
с соединением, имеющим формулуXJV , предпочтительно при комнатной температуре, и иногда в инертном органическом растворителе,, например диалкиловом эфире.
.Тидразогидразиды с формулой I , где Hj карбазоил, незамещенный или замещенный одним или двумя алкилами,
RJ , R Н 5 , п и X вышеуказаннь е
значения, получают, например,при
замене соединений с формулой XW соединениями, имеющими общую формулу
Н БНцКй XVn
RJJ к - вышеуказ.нн значегде
ния, при процессах проведения по пунктам 1) и 3), описанных вьше для приготовления гилидов с формулой I . Гидразиды с формулой J , где Яц представляет карбазоил, незамешенный или замещенный одним или двумя алкилами, д - кислород и Rj, Hg s ПиХ |- вышеуказанные значения, мож но получать при реакции соединений, имеюших формулу XVll , с соединениями общих формул R70 ОН (СН5)пСОЩн X-CHR, 1 OR, . ,(CH2)nCOZ2 х-снн, где а, , HI , Я , 85, RT, Rjt , вышеуказанные значения,в условиях,описанных для пр готовления амидов при реакции соеди нений с формулой ЗС& с соединениями формул 35У U )1 в процессах 1) и 3), с последующей конверсией соответству щих кетонов в условиях, похожих на описанные выше, для конверсии соеди ний с формулой S , где А представляе группу, имеющую формулу Xt в .соедине нии с формулой X ; Соединения формул XV,XVI,XVII, Ш можно получа ть из соединений формулы Иi известными способами, Соединения формулы J, где Я предста ляет ацильную группу, можно получит из соответствующих спиртов формулыJ где Я,- водород, например, при реак Очсоответствующи ангидридом кислот предпочтительно в присутствии основания, например пиридина, и при окр жающей температуре иногда в присутствии такого инертного органическог растворителя, как ароматический угл род 1вензол). Соединения формулы , где Rj - алки иЛ, алкоксикарбо, у которого алкиль часть соответствует Н j , можно получать при реакции соединений, имеющи формулу)Х ,где А имеет формулу§ , с соединениями, имегацими общую формул RttT Х)С алкил,Cj- , Y - кислотный остаток, например а брома, хлорида или иода, сульфонатн или сульфатная группа, TAnvi С соединением, имеющим формулу ХД1 и кислотой Льюиса, например трехфтористым бором, в инертном растворителе предпочтительно диалкиловом эфире, например диэтиловом эфире предпочтительно при температуре от -50 до +20°С до получения соединений, у которых RJ имеет формулу CHR jjPjj , U RJJ - вышеуказанные значения, с последующим превращением в соответствующие кетоны в условиях, аналогичных описанным выше, для превращения сЪединений А в соединенияХ. Кетоны с формулой Г , где R. - кислород, можно превращать в такие их производные как оксимы, алкоксиимины и гидразоны, которые могут быть замещенными одним или двумя алкилами, известными способами, например, при реакции с соответствующими гидроксиламином, алкоксиамином или гидразином или с алкилйрованными производными их . Соединения с формулой 1,где X представляет этиленовую группу Rj-Rj и п- вышеуказанные значения, можно получать, например, при восстановлении соответствующих соединений формулы I , где X представляет виниленовую группу, известными способами, например при лгидрогенизации, в присутствии катализатора гидрогенизации, например палла дня на древесном угле, иногда при повышенном давлении. Соединения формулы i, где Rj орбоксил, можно получать при щелочном гидролизе соответствующих соединений формулы, где RJ -карбоалкокси. . Согласно изобретению получают следующие новые соединения: 7-{5-(З-оксигекс-1-енил)-2-оксоциклопентил}-энантовая кислота; 7-{4-(З-оксигепт-1-енил)-2-оксоциклопентил1-энантовая кислота 7-{5-(з-оксинон-1-энил)-2-оксоциклопентил}-энантовая кислота; 7- 13-оксидец-1-енил) -2-оксоциклопентил -знантовая кислота; 2-(oL - (Ь-карбоксигексил)-3- fi (Zftоксиокт-J -еннл У-ииклопентанон; 7- {5-(3-окси-5-метилгекс-1-енил)-2оксоциклопентил}-энантовая кислота; 7- {в-(З-циклопентил-З-оксипроп-1л нил) -2-оксоциклопентил -энантовая кислота 7-(5-(3-оксидодец-1-енил)-2-оксоциклопентил -энантовая кнслота; (3-окси-5-метилокт-1-енил)-2оксоциклопентил}- энантовая кислота; 7- 5- I З-окси-Ь-метилокт-1-енил)-2чэксои,иклопентил1 - энантовая кислота; 7- (5-(3-окси-/-метилокт-1-енил)2-оксоциклопентил| -энантовая кислота; 7- {5-(З-циклогексил-З-оксипроп-1енил)-2-оксоциклопентил}-энантовая кислота;
7- (5-(3-окси-8-метоксиокт-1-енил)2-оксоциклопентил}-энантовая кислота;
(3-адамантил- -оксипрюп-1-енил) -оксоциклопентил}-энантовая кислота;
7-(5-(3-циклопентил- -оксипроп-1- § ил)-2-оксоциклопентил| -энантовая кислота;
7-{5-(З-оксиокт-1-енил)-J-метил- оксоциклопентил -энантовая кислота;
7-2- метоксиимино-: -оксиокт-1-енил) - ... циклопентил}-энантовая кислота;г7-(5-(3-ацетокси-4-метилокт-1«нил)2-оксоциклопентил -энантовая кислота;
метил-7- (5-(3-цнклогексил-З-оксипроп-1-енил)-2-оксоциклопентил -этантоат,
метил-7-(5-(J-циклопентил-З-оксипроп-1-енил) -2-оксоциклопентил} - энантоат,
метил-7- 5-(З-оксидодец-1-енил)-2оксоциклопентил -энантоат,
N -метил-7-{ 5- (З-оксидодец-1-енил) 2-оксоциклопентил}-энантоат;
гептил-7- 5- (3-циклс -ексил-З-оксипроп1-енил)-2-оксоциклопентил -энантоат. Следующие примеры поясняют изобретение ,
Пример 1. (З-окси-4метилокт-1-енил)-2-рксоцикпопентил|энантовая кислота.
I.Получение 2-(7-оксигептил)-циклопент-2-ен-1-она,30
Смесь 7-.(2-тетрагидропиранилокси)« гептаналя {22 г) и 1-морфолинциклопентена (21,4 г) в бензоле (25 мл) нагревают с обратным холодильником в течение 12 час в атмосфере азота и 35 вьщелякедуюся воду непрерывно удаляют прибором Дина - Старка. Затем добавляют бензол {10 мл) и по каплям пркбавляют 18%-ную соляную кислоту (28 мл) и смесь перемешивают 2 час. Органический слой отделяют и вьшаривают. К остатку добавляют кони, соляную кислоту (72 мл), и бутанол {300 мл). Смесь нагревают при температуре в течение 1 час и после концентрирования раствора получают масло. К маслу добавляют диэтиловый эфир, эфирный раствор промывают водным раствором бикарбоната натрия, .а затем водой и сушат сульфатом натрия. После упари- - вания растворителя получают 2-{7оксигептил)-циклопент-2-ен-1-он (11,7 г) т. кип. 125-170с (0,15 мм рт.ст.) ; п 1,4-90.
Смесь 2-(7-оксигептил).-циклопент-2ен-1-она (17 г), циангидрида ацетона f3, ) 6%-ного водного раствора карбоната натрия (8 мл) и метанола вО (50 мл) нагревают с обратным холодильником в течение 4 час при перекешивании. После удаления метанола в вакууме добавляют воду (100 мл) и смесь экстрагируют диэтиловым эфирюм, затем 65
сушат сульфатом магния. После испарения растворителя остаток перегоняют в вакууме, получают 2-О-оксигептил)-3-оксоциклопентанкарбонитрил (11,3 г) {т.пл. 144-182°С.О,15 мм рт.ст)5п ljt.4795.
Ш.Получение 7-циан-б-(7-оксигептил) , 4- ДиоксаспирЬ- 4 , 47 -нонана ,
Смесь 2- (Токсигептил) -3-оксоциклопентанкарбонитрила 20 г, этиленгиколя (5,6 г), паратолуолсульфокислоты (1 г и бензола (160 мл) нагревают собратным холодильником в течение 3,5 час при непрерывном удалении воды. После охлаждения смеси добавляют безводный карбонат натрия, фильтруют через слом карбоната натрия и удаляют растворите при пониженном давлении. Остаток переняют в вакууме и получают 7-циан-6(7-оксигептил)-1,4-диоксаспиро 4,4 нонан (19,3 г); т.кип. 166-182°С (0,1 мм рт.ст.). Этот продукт используют в качестве исходного для следующей стадии; аликвотную часть его перегоняют при 177-179°С (0,1 мм рт.с Найдено,%: с 67,1; Н 9,2; К 4,89. C,j Hj5 OjN .
Вычислено,%: С 67,37; Н 9,42; W5,24.
1У.Получение 7-формил-6-(7-оксигептил) -1,4-диоксаспиро 4,4}нонана.
Раствор гидрида диизопропилалюминия (53 г) в безводном бензоле (145 мл) добавляют при быстром перемешивании к раствору 7-циан-6-(7-оксигептил)-1, 4-диоксаспиро- 4 , 4|-нонана (43,2 г) в абс. диэтиловом эфире (432 мл) при lO-lS C. Перемешивание при комнатной тег« пературе продолжают 1,5 час и смес добавляют к 2 Н. уксусной кислоте (1 л) при температуре ниже 15°С. Органический слой отделяют и водный слой экстрагируют диэтиловым эфиром. Объединенные органические слои промывают водным раствором бикарбоната натрия, сушат сульфатом натрия, удаляют растворитель в вакууме и остаток перегоняют при пониженном давлении; получают 7-формил-6-(7-оксигептил)- , 1, 4-диоксаспиро- 4 , 4 -нонан (25,3 г); т.кип. 164-200с (0,04 мм рт.ст).
Смесь 7-ФОРМИЛ-7-(7-оксигептил)-1,4,-диоксаспиро- 4,4}-нонана (3,88 г) и 2-метилгексаноилметилентрифенилфосфорана (6,0 г) в безводном тетрагидрофурйне (30 мл) нагревают с обратным холодильником в токе азота в течение 18 час.
После .удаления растворителя в вакууме остаток растирают-, с петролейным эфиром (т.кип. б6-80 С), выдерживает . при и отфильтровывают от трифенилфосфиноксида. Фильтрат выпаривают И
получают 6-(7-оксигептил)-1,4-диокса-7-(3-оксо-4-метилокт-1-енил)спиро-14,41-нонан (5,56 г); QKC Этот продукт используют на следующей стадии для приготовления ,4-диокса-7-(З-оксо-4-метилокт-1-енил)-спиро4,4 -нон-б-ил - энантовой кислоты без дополнительной очистки.
Vj. Получение ,4-диокса-7-(3-оксо-4-метилокт- 1-енил) -спиро 4 , 4j НОН-6-ИЛ -энантовой кислоты.
Трехокись хрома (6,0 г), высушенную над пягйокисью фосфора, добавляют порциями при перемешивании к раствору 1-г (7-оксигептил) -1,6-диокса-7- (З-оксо -4-метилокт-1-енил) -спиро 4 , 4 нонана (5,56 г) в безводном диметилформамиде (70 мл) при температуре ниже 0°С. Затем добавляют концентрированную серную кислоту (2 мл) в диметилформамиде (70 мл) и смесь перемешивают при температуре ниже 10°С в течение 1 час, дбавляют диэтиловый эфир и минимальное количество воды для получения двух отдельных слоев. Эфирный слой отделяют и промывают 2 и. раствором карбоната натрия. Водный слой отделяют, экстрагируют эфиром, покрывают слоем диэтилового эфира и подкисляют до рН 4 при добавлении по каплям концентрированной соляной кислоты. Эфирный слой отделяют, а водный слой снова экстрагируют диэтиловым эфиром. Объединенны эфирные слои сушат сульфатом натрия и выпаривают до получения сырой ,6-диокса-7-(З-оксо-4-метилокт-1-енил)-апиро 4 , 4 нон-6-ит -энантовой кислоты |(1, 6 г) ;
накс .1620, 1660, 1700 см Этот продукт используют для получения 7-{5-(3-окси-4-метилокт-1-енил)-2-оксоциклопентил -энантовой кислоты без дополнительной очистки.
щ. Приготовление 7- 5-(3-окси-4-метилокт-1-енил)-2-оксоциклопентил -энантовой кислоты.
Раствор борогидрида нат{5ия (0,07 г в 0,2 и. водном растворе гидроокиси натрия (0,7 мл) по каплям добавляют к раствору 7-{1,4-диокса-7-(3-oкco-4-мeтилoкт-l-eнил):пиpo 4,4 нон-6-ил -энантовой кислоты (0,7 г) в смеси этанола (10 мл) и 1 н. раствора гидроокиси натрия (0,65 мл). Полученный раствор перемешивают 4,5 час, затем в вакууме удаляютэтанол. Добавляют 10 мл воды, раствор промывают диэтиловым эфиром, водный слой под слоем эфира подкисляют до рН 1, добавляя по каплям концентрированную соляную кислоту. Эфирньлй слой отделяют, водный слой дважды экстрагируют эфиром. О6ъе дииенные эфирные экстракты сушат сульфатом магния и испаряют растворитель. Остаток смешивают с 2 н. соляной кислотой (10 мл), нагревают при перемешивании в течение 1,2 час при 65-75с
После охлаждения смесь дважды экстрагируют диэтиловым эфиром, объединенные экстракты сушат сульфатом магния и выпаривают. Остаток хроматографируют в тонком слое на силикагеле,применяя в качестве элюента смесь бензола,диоксана и уксусной кислоты (65:15:1), получают (3-окси-4-метйлокт-1-енил)-2-оксоциклопентил -энантовую кислоту (0,33 г). . Найдено,%: С - 71,8; н - 10,2; CitHjfiOt
Вычислено, %: с - 71,6; Н - 10,3. Пример 2. (3-оксиокт-1-енил)-2-оксоциклопентил}-энантовая кислота.
Х.Получение 6-(7-оксигептил)-1,4-диокса-7- (3-оксоокт-1-енил -спироС4, 4 нонана.
Смесь 7-формил-б-(7-оксигептил)-1, 4-диоксаспиро f4 , 4 нонана (6 г), приготовленного, как описано в примере 1, и гексаноилметилентрифенилфосфорана (8,5 г) в безводном тетрагидрофуране (50 мл) нагревают с обратным холодильником в течение 16час в токе азот:а. После удаления рас творителя в вакууме остаток растирают с петролейным эфиром (т.кип. 60-80с),
охлаждают до . течение дня, отфильтровывают от трифенилфосфиноксида и фильтрат выпаривают. Остаток снова растирают в петролейном эфире (т.кип. 60-80с) для удаления остатка трифенилфосфиноксида, отфильтровывают и выпаривают;
получают 6-(7-оксигептил)-1,4-диокса-7- (З-оксоокт-1-бнил)-спироГ4,41нонан (7,5 г);
Неполучение 7- {I,4-диокса-7-(3-.оксоокт-1-енил)-спиро.4 , 4 нон-6-ил -энантовой кислоты.
J Трехокись хрома (2,80 г), высушеннуЮ; пятиоксисью фосфора, добавляют порциями при перемешивании к раствору 6- (7-оксигептил)-1,4-диокса-7-(3-оксоокт-1-енил)-спиро , 4 нонана (2,5 г) в безводном диметилформамиде (40 мл) при температуре ниже Ос. После добавления концентрированной серной кислоты (1 мл) в диметилформамиде (30 мл) смесь перемешивают при температуре ниже в течение 15 мин. Затем добавляют диэтиловый эфир (50 мл) и минимальное количество воды, необходимое для образования двух легко разде 1яющихся слоев. Эфирный слой отделяют, сушат сульфатом магния и выпаривают, получают 7-{l ,,4 -диокса-7- (3-оксоокт-1-енил)-спиро 4,4} нон-6-ил}-энантовую кислоту (2,23 г). Продукт используют для получения 7-{5-(З-оксиокт-1-енил)-2-оксоциклопентил -энантовой кислоты без дополнительной очистки.
Ш.Получение 7-(5-(З-оксиокт-1-енил) -2-оксоциклопентилj-энантовой кислоты. Раствор борогидрида натрия (0,54 г) в 0,2 н, растворе гидроокиси натрия (5,4 мл) по каплям добавляют к раство ру 7- 1,4-диокса-7-(З-оксоокт-1-енил спиро 4,4 НОН-6-ИЛ -энантовой кислоты (2,23 г) в смеси этанола (54 мл) и 1н. раствора гидроокиси иатрия (-&-, (5,4 мл). Получеиный раствор перемеишватат в течение 1 дня, а затем в вакууме удаляют этанол. Водный слой под слоем диэтилового эфи подкисля от до рН 1, добавляя по каплям концентрированную серную кислоту. Эфирный слой отделяют, а водный слой дважды экстрагируют диэтиловым эфиром Объединенные эфирные экстракты сушат сульфатом магния и испаряют растворитель. Остаток (1,09 г), смешивают с водой (5 мл) и 2 н. соляной кислотой (10 мл перемешивают при 50с в течение 3 час Охлаждают, дважды экстрагируют диэтиловым эфиром, объединенные экстрактысушат сульфатом магния и выпаривают. Остаток (0,89 г) хроматографируют в тонком слое на силикагеле, применяя в качестве элюента смесь бензола, диоксана и уксусной кислоты (65:15:1), получают (З-оксиокт-1-енил)-2-оксоциклопентил),-энантовую кислоту (0,7 г). Найдено,%s С 70,7; Н 10,0. Сго м04Вычислено,%: С 70,96; Н 10,12. 980, 1700, 1720 см . П р и м е р 3. (З-окси-5-метил гекс-Л-енил)-2-оксо-циклопентил -эиантовая кислота. I Получают 6-(7-оксигептил)-7-(5-метил-З-оксогекс-1-енил)-1,4-диоксаспиро 4,4 нокана. Так же,как описано выше в примере 2 I,для приготовления 6-(7-оксигептил)1,4-диокса-7-(З-оксоокт-1-енил)-спиро 4,4 нона, но заменив тексаноигметиле трифенилфосфоран соответствующим коли чеством 3-метилбутирилметилентрифенил фосфорана, получают сырой 6-(7-оксиге тил)-7-(5-метил-3-оксогекс-1-енил)-1, -диоксаспиро 4,4) нонан. Продукт исполь зуют для получения (5-метил-З-оксоокт-1-енил)-1,4-диоксаспиро 4,4 нoи-6-илV-энантовой кислоты без дополнительной очистки. Д. Получение 7 -{7-(5-метил-З-оксо гекс-1-енил)-1,4-диоксаспиро 4, -б-ил}-энантовой кислоты. Как описано выше в примере 2, Г, для приготовления 7- , 4-диокса-7-(З-оксоокт-1-енил)спиро(4,4 -нон-бил энантс1вой кислоты, но при замене б- (7-6кс6гептил) -1,4-диокса-7-( 3-оксоокт-1-енил) -сп-иро 4 ,4 нонана соответствующим количеством ,4-диокса-7- (З-оксоокт-1-енил)-спиро 4 ,4 нон-6-ил -энантовой кислоты, получают 7-{7-(5-метил-3-оксогекс-1-нил)1,4-диоксаспиро 4,4 нон-6-ил энантовую кислоту. Ш.Получение 7- {5-(З-окси-5-метилгекс-1-енил)-2-оксоциклопентил)-энантовой кислоты , как описано выше в примере 2 , Ш для приготовления (3оксиокт-1-енил)-2-оксоциклопентил)энантовой кислоты, но при замене 7- {l , 4-диокса-7- ( З-оксоокт-1-енил)спиро 4,4 -нон-6-ил}-энантовой кислоты соответствующим количеством 7- (7-(5-метил-3-оксогекс-1-енил)1,4-диоксаспиро 4,4 нон-6-ил -энантовой кислоты получают 7-(S-( 3-окси 5-мeти;JгeJ c-l-eнил) -2-оксоциклопентил -энантовую кислоту. Найдено,%: С 69,9; Н 9,7. С1, И О . Вычислено,%: С 70,3; Н 9,9. Строение полученного продукта подтверждено ИК и ПМР спектрами. Пример 4. 7-{5-(3-циклопентил-З-оксипроп-1-енил)-2-оксоциклопентил -энантовая кислота. Г.Получение 7- (3-циклопентил-Зоксопроп-1-енил)-б-(7-оксигептил)1, 4-диоксаспи-ро 4,4 нонана. Так же, как описано выше в примере 2,1 для приготовления 6-(7-оксигептил) -1,4-диокса-7-(З-оксоокт-1енил)-спиро 4,4 нокана, но при замене гексаноилметилентрифенилфосфорана соответствующим количеством циклопентилкарбониЛметилентрифенилфосфорана, получают сырой 7-(3-циклопентил-3-оксопроп-1-енил)-б-(7оксигептил)-1,4-диоксаспиро 4,4|нонан. Этот продукт использовали ,для получения 7- (7- ( З-циклопентил-Зоксопроп-1-енил)-1,4 диоксаспиро 4 , 4 нон-6-ил}- энантовой кислЪты без допо лнительной очистки. S-Получение 7- 7-(3-циклопентил-З-оксопроп-1-енил) -1, 4-диоксаспиро 4 , 4 нон-6-ил}-энантовой кислоты. Так же, как описано вьше в примере 2,П для приготовленйя ,4диокса-7- ( З-оксоокт-1 -енил)спирю 4 , нон-6-ил -энантовой кислоты, но при замене 6-(7-оксигептил)-1,4Диокса-7-(3-оксоокт-1-енил )пиро 4 , 4 нонана соответствующим количеством 7-(З-циклопентил-З-оксопроп-1-енил)-6-(7-оксагептил-1,4-диоксаспиро . 4, 4 нонана, получают 7--(7-(3-циклопенТил-З-оксопроп-1-енил)-1,4-диоксаспиро4,4-нон-б-ил}-энантовую кислоту. Этот продукт использовали для получения 75-(З-циклопентил-З-оксипроп-1-енил)-2 оксациклопентил -энантовой кислоты без дополнительной очистки. ц Получение ( 3-циклопентил-J- OKипроп-1-енил)-2-оксациклопентил| -энановой кислоты.
19
Так же, как описано выше в примере 2, Щ для приготовления 7-J5-23-оксиокт1-енил)-2-оксоЦиклопентилр-энантовой кислоты, но при замене 7-{1,4-диокса7-( 3-оксоокт-1-енил)-спиро 4,4 нон-6- g ил.-энантовой кислоты соответствующим количеством ,7- (3-циклопентил-З-оксопроп-1-енил)-1,4-диоксаспиро 4,4 нон6-ил1-энантовой кислоты получают 7(5-(З-циклопентил-З-оксипроп-1-енил)2- .Q оксоциклопентилУ-.энантовую кислоту. Найдено,,%: С 71,1; Н 9,4.
20 i2 °4
Вычис71ено, %: С 71,4; Н 9,5.
Пример 5, (З-окси-4-ме- .тилокт-1-енил) -2-оксоциклопентил|..энантовую кислоту (0,30 г), приготовленную, как описано в примере 1, дополнительно очищают; и разделяют на два диастероизомера хроматографией в тон- -. ком слоена силик геле, применяя для элюирования смесь этилацетата, цикло-. гексана и муравьиной кислоты (40:40:1 по объему). Хроматограмму элюируют четыре раза смесью растворителей, высушивая при комнатной, температуре после каждого элюирования. Положения двуц полос Обнаруживают при опрыскивании небольшой полоски хроматограммы раствором ФосфомолибденовоП кислоты в зта-i ноле (10 вес.%). Каждую полосу снимают 30 с опорной стеклянной пластинки и экстрагируют диэтиловым эфиром в аппарате Сокслета.После испарения эфира получают два диастереоизомера 7-{5-(3окси-4-метилокт-1-енил) -2-оксоциклопен- 35 тил1-э(нантовой кислоты, структура которых подтверждена ПНР-спектрами.
Пример 6. Аналогично опиианному в примере 5 и при применении такой же смеси растворителей для элюирования |0 7-(5-(3-оксиокт-1-енил)-2-оксоциклопенTHJT энантовую кислоту, полученную, как описана в примере 2, разделяют на .два компонента (вероятно, диастереоизомерные пары энантиомеров) хроматографией в 45 тонком слое на силикагеле.
Один из изомеров представляет со- бой новый диастереоизомер, 2-о.-(6 карбоксигексил) -3 Jb - (3- оксиокт-1-енил)-циклопентанон,а другой являет- gj ся известным диастереоизомером - 2-flL-(б-карбоксигексил)-3 -(3- -окси-окт-1-енил)-циклопентаноном. -f
Tl мер 7. 7-{5-(З-оксинон-1-енил)-2-оксоциклопентил энантовая g кислота.
I Получение 6- (7-оксигептил)-1, 4-диокса-7-(3-оксонон-1-енил)-спиро 4,4 нонана.
Аналогично описанному в примере 1,5 для приготовления 6-(7-оксигептил)1,4диокса-7-(3-оксо-4-метилокт-1-енил спиро 4, 4 нонана, применя я в качестве исходного продукта соответствующие количества гептаноилметилентрифенил- 66
20
|фосфорана, получают сырой 6-(7-оксигептил)-1,4-диокса-7-(З-оксонон-2енил) -спиро 4 , 4 нонан, достаточно истый для применения в качестве исхоного продукта для получения 7-(l,4диокса-7- (3-оксонон-1-енил) спиро 4 , 4 нон-6-ил}-знантовой кислоты, описанной ниже.
IT.Получение 7-{1, 4-диокса-7-(3-оксонон-1-енил) -спиро 4 , 4j нон-6-ил . -энантовой кислоты.
Аналогично описанному в примере 1 ,ы из соответствующего количества 6-(7-оксигептил)-1,4-диокса-7-(3-оксонон-1-енил)«спиро f4, 4 нонана получают 7- (1,4 -диокса-7-(З-оксонон-1-енилУчзпиро 4, 4 нон-6-ил} -энантовую кисло1620, 1660, 1700 СМ-
ту.
макс
Ш.Получение (З-оксинои-1-енил)-2-оксоциклопентил|-энантовой кислоты.
Аналогично описанному в примере 1 из соответствующего количества 7-/1,4-диокса-7-(3-оксо-4-метйлокт-1-енил) спиро .4 ,4 нон -б-ил -энантовой кислоты, получают (З-оксинон-1-енил)-2-оксоциклопентил}-энантовую кислоту. Найдено,%: С 71,3;И 10,3.
21 % ОВычислено,%: С 71,6; Н 10,3.
Строение продукта.потверждено ИК-и ПМР-спектрами.
Пример 8 .Аналогично описанному в примере 2,Ш для получения 7- (З-оксиокт-1-енил) -2-оксоциклопентил -энантовой кислоты из соответствующих количеств: ,
а)7- 1,4-диокса-7-(З-окродец-1енил)-спирю 4, 4j нон-6-ил1. энантовой кислоты.
б)7- {1, 4-диокса-7- (j-оксодец-1-ени спиро 4, 4J нон-6-ил} - энантрв зй кислоты
в)7-{l, 4-диокса-7-(З-оксогепс-1,-енилКзпиро 4, 4J-нoн-6-и -энaнтofeoй кисты,
г)7- 1,4-диокса-7-(З-оксогекс-1-енил):пиро 4, 4 нон-6-ил}-энантовой килоты,
д)7 (7- (5-метил-3-оксоокт-1-енил)«диоксаспиро 4,4 нон-6-илJ энантовой
кислоты,
е)7- 7-(6-метил-3-оксоокт-1-енил)i , 4-диоксаспиро 4,4 нон-6-ил1- энантовой кислоты,
ж)7- i7- (7-метил-3-оксоокт::-1-енил) -1, 4-диоксаспиро 4,4 нон-б-ил| энантовой кислоты,
з)7- (7-(3-циклoгeкcил-3-oкcoпpoп-l eнил)-1, 4-диоксаспиро 4,4 нон-6-ил энантовой кислоты, i- и) (3-мeтoкcи-3-oкc6 Л{т-l-eнил) -1,4-диоксаспиро 4,4 нон-6-ил1 -энантовой кислоты
получают соответственно
а) 7-(5- (З-оксидец-1-ёнил)-2-оксоциклопентил -энантовую кислоту.
Найдено,%: С 72,4; Н 10,4
21 iJ je °4 BfcJ4HCjieHO,%; С 72,2; H 10,4. б),(З-оксидодец-1-енил)-2-оксоциклопентил -энантовую кислоту. Найдено,%: С 73,0i Н 10,6. l Вычислено,%: С 73,1,Н 10,7. в)7- (3-oкcиFeпт- -eнил)-2-oкcoциклoпeнти A-энaнтoвyи) кислоту. Найдено,%. с 71,0, Н 9,5. . Вычислено,%: С 70,5 Н 9,9. г)7-{5- (З-оксигекс-1-енил) -2-fORc циклопентил -энантовую кислоту. Найдено,% С 69,4 Н 9,8. Ct8«lo04Вычислено,%: С 69, 9,7. д)(3-окси-5-метилокт-1-енил -2-окроциклопентил}-эмантовую кислоту. Найдено,%: С 71,6; Г 10,4. М 56 И Вычислено,%: С 71,6; Н 10,3; е)7-{5-(3-окси-6-метилокт-1-енил -2-оксоциклопенти7 «энантовую кислоту Найдено,: С 71,2; Н 10,6. « CaiHjgO. §Йчислено,% С 71,6j Н 10,,3. ж)7- {5-(3-окси-7-метилокт-1-внип -оксоциклопенти Д -энантовую кислоту. Найдено,: С 71,2 Н 10,1. 21 56° Вычислено,% С 71,6 Н 10,3. з)7- 5-(3-циклогексил-3-оксипроп -енил) --2-оксоциклопентих -энантовую кислоту, Найдено,%j С 71,2; Н 10,3. -1/ Вычислено,%; С 71,1; Н9,7а и) 7- {5-(3-окси-8-метоксиокт-1-:ен -2-оксоциклопентил -энантовую кислоту. Найдено,%: С 68,5; Н 10,2. С Н. О. В№1ислено,%: С 68,5; Н 9,8. Пример 9. 7-{5-(3-адамантял -З-оксипроп-1-енил) -2-оксоциклопенти внантовая кислота. i Получение 7- (3-адамантил-З-окс.опр - 1-енил)-6-(7-оксигептил)-144-диокса С4,4 нонана. СмесЪ 7-формил-6-(7-оксигептил-З-оксопроп-1-енил)-1,4-диоксаспиро 4,4 нонана (2,7 г), полученного, как описано в примере 1, Cf , и адамант карбонилметилентрифенилфос рсфоран (4,38 г) в ;гексаметилфосфорТтриам де (60 мл) нагревают на пароЪой ба в течение четырех дней. К охлакдён (НОй реакционной смеси добавляют Ди тиловый эфир и выделившееся твердо вещество отфильтровывают. Фильтрат промывают дважды водой, сушат безво ным сульфатом натрия и выпаривают. Получают 7-(З-адамантил-З-оксопроп-енил)-6-(7-оксигептил)-1,4-диоксасп ({4,4унон ан. Этот 1родукт используют
22 для 7- (7-(3,-aдaмaнтил-з-oкcoпpoп-leнил) -1,4-диоксаспиро(4,4 нон-6-ил энантовой кислоты без дополнительной очистки. Й,Получение7- (7-(3-адамантил-З-оксрtfpon-1-енил) -1, 4 -диокс&спиро 4 ,4 нон -6-ил}-энантовой кислоты. Аналогично описанному в примере 2,iT для 7- (1,4-диокса-7-(3-оксоокт-1-енил)спиро{,4 ,4 нон-6-ил}. -энантовой кислоты, из сооТв§.тствующегокбличества 7-(3-адамантил-3 оксопроп-1-енил)-67-оксигептил) -1, 4-диоксаспиро 4 , 4 нонана, получают 7- {7-(3-адамантилЗ-оксопроп-1-енил) -1,4-диоксаспиро 4 , 4J но г6-ил} - энантовую кислоту. Ш.Получение 7-,{5-( 3-адамантил-ЗоксипрЬп-1-енил)-2-oкcoциклoпeнtил энaнтoвoй кислоты. Аналогично описанному в примере 2 ,Ul получению 7- (5-(З-оксиокт-1-енил)2-оксоциклопентил -энантовой кислоты из соответствующего количества (З-адамантил-З-оксопроп-1-енил)-1,4циоксаспиро , 4 нон-6-ил энантовой кислоты получают 7- {5-(3-aдaмaнтил-3oкcoпpoп-l-eнил) -2-оксоциклопентил}энантовую кислоту. Строение которой подтверждено ИК-и ПИР-спек трами. Пример 10. 7- |5(3-циклопентил 3-оксипроп-1-енил)-2-оксоциклопентилI -энантовая кислота. Раствор 7- {5-(3-циклопентил-Зоксипроп-1-енил)-2-оксициклопентил энантовой кислоты (1,0 г), приготовленной, как описано в примере 4, в этаноле (50 мл) каталитически восстанавливают водородом при давлении 7 кг/см и присутствии в качестве катализатора 5% палладия на угле при комнаТ Ой температуре в течение 3 час. Затем катализатор отфильтровывают, испаряют этанол; получают 7- 5-(3-циклопентил-Зоксипроп-1-енил)-2-оксадиклопентил энантовую кислоту (0,8 г) . Чистыйобразец этой кислоты, получают хроматографированием в тонком слое на силикагеле, применяя для элюирования смесь (Этилацетйта, циклогексана и муравьиной кислоты (40:40:1 по объему). Найдено,%: С 70,7 Н 10,0. 2о м°4Вычислено,%: С 71,0; Н 10,0 ИК-и ПМР-спектры соответствуют полученному соединению. Пример 11. 7- {5-(З-оксиокт1-енил) -3- метил-2-оксоциклопентил}энантовая кислота. . Т.Получени е -оксо-2- (7- (2-тетрагидропиранилоксйТ-гептил.циклопентанкарбонитрила. 3,4-дигидро-2Н-пиран (7,3 г) по каплям добавляют при перемешивании и температуре .к смеси 2-(7-оксигептил)-3-оксоциклопентанкарбонитри23
ла (10 г), приготовленного, как описано в примере 1, 51 и концентрированной соляной кислоты (4 капли). Перемешивают при в течение 1 час. Охлаждают, к раствору добавляют бензол (50 мл), промьгеают водным раствором бикарбсЛата натрия, а затем водой и сушат сульфатом натрия. Растворитель удаляют в вакууме и получают З-оксо-2- {7-(2-тетрагидропиранилокси)
гептил -циклопентанкарбонитрил (15 г) Этот продукт используют для получения 4-этоксалил-3-оксо-2- 1-(2-тетрагидропиранилокси-гептил -циклопентанкарбонитрила, без дополнительной счист кн.
.Получение 4-этоксалил-3-оксо-2{7-(2-тетрагидрОпиранилокси)-гептил|циклопентанкарбонитрила.
Охлажденный льдом раствор 3-оксо2- 7- (2-тетрагидропиранилокси)-гептил X-циклопентанкарбонитрила (15 г) и диэтилоксалата (15,9 г) в безводном бензоле {110 мл) добавляют к безводному метилату натрия (5,9 г). Смесь выдерживают при комнатной температуре в течение 24 час, добавляют ледяной воды до образования двух слоев. Водный слой промывают бензолом, бензольные растворы объединяют и добавляют к 30%-ному водному раствору кислого фосфата натрия (150 мл) при , Слои разделяют, бензольный слой экстрагируют четыре раза охлажденным льдом 4%-ным водным раствором гидроокиси натрИ|Я, объединенные щелочные экстракты добавляют к водному раствору кислого фосфата натрия, перемешивают при в течение 15 мин, а затем экстрагируют диэтиловым эфиром. Эфирные экстракты промывают водой,J сушат сульфатом натрия, удаляют растворитель в вакууме и получают сырой 4-этоксалил-3-оксо-2- (1-(2-тетрагидропиранилокси) -гептилI -циклопентанкарбонитрил (11,2 г). ij Получение 4-метил-3-оксо-2--{7-(2тетрагидропиранилокси)-гептил -циклопентанкарбонитрила.
Смесь 4-этоксалил-3-оксо-2- {7-(2тетрагидропиранилокси)-гептил -циклопентанкарбонитрила (11,2 г) безводного карбоната калия (22 г), йодистого метила (67 мл) и ацетона (450 мл) перемешивают и нагревают с обратным холодильником в течение 22 час, смесь охлаждают, фильтруют и .фильтрат коицентрируют в вакууме. К остатку добавляют воду и экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты ;промывают последовательно 2 н. вод-иым раствором гидроокиси натрия и одой, а затем сушат сульфатом натрия, иэтиловый эфир удаляют в вакууме иолучают сырой 4-метил-3- оксо-2- { 7(2-тeтpaгидpoпиpaнилokcиГ гептил;}
24
циклопентанкарбонитрил (8,3 г);
1730 смГ
паке
Этот продукт использовали для получения 2- (7-оксигептил)-4-метил-З-оксоциклопентанкарбонитрила, без допол нитвльной очистки.
ty Получение 2-(7-оксигептил,-4метил-3-оксоциклопейтанкарбонитрила.
60%-ный водный раствор соляной кислоты (6 капель) добавляют к раствору
0 4-метил-3-6ксо-2- (7-(2-тетрагидропиранилокси)-гептил циклопентанкарбонитрила (8,3 г) в безводном этаноле (35 мл). Через 24 час добавляют хлороформ и раствор промывают последователь5но 2н. водным раствором карбоната натрия и насыщенным раствором хлористого натрия, сушат сульфатом натрйя, раство ри ель удаляют в вакууме и остаток перегоняют при пониженном давлении. Получают 2- |f 7-оксигептил)-4-метил-Зоксоциклопентанкарбонитрил (3,5 г); т,кип. 140-200с (0,16 мм рт. ст.).
Найдено,%: С 70,2; Н 10,0; К 5,4.
Сх.Н,, О, N.
Вычислено,%: С 70,8; Н 9,8;К 5,9.
5
V Получение 7- 5-(З-оксиокт-1-енил)З-метил-2-оксоциклопентил} -энантовой кислоты
Аналогично описанному в примерах l,inirVn из 2- (7- оксигептилТ Зоксоциклопентанкарбонитрила, но применив в качестве исходного продукта 2-(7-оксигептил)-4-метил-З-оксоциклопентанкарбонитрил, получают 7-(5-(3S-оксиокт-1-енил)-3-метил-2-оксоциклоп нтил1 - энантовую кислоту..
найдено, % г С 71,0; Н 10,6.
C.IJ Нjg Oj.
вычислено,%: С 71,6; Н 10,3.
Строение полученного продукта подтверждено ИК-и ПМР-спектодми.
Пример 12. 7- (2-метоксиимин-5-(З-оксиокт-1-енил)-циклопентилУ йнантовая кислота. ,
J Получение 2-(7-оксигептил)-3-метоксииминоциклопентанкарбонитрила.
Смесь 2-(7-оксигептил)-3-рксоциклопентанкарбонитрила(5,0 г), полученного, как описанов примере 1,й , хлоргидрата метоксиламина (2 г) и пиридина (6,1 мл) выдерживают при комнатной температуре в течение 24 час.
Удаляют пиридин в вакууме, добавляют воду (20 мл). Смесь экстрагируют диэтиловши эфиром и экстракт сушат сульфатом магни;;. Растворитель удаляют, а остаток перегоняют в вакууме и получают 2- (7-оксигептил) --3-мвтоксииминцйклопентанкарбонитрила (4,33 г); т.кип. 150-190 С (0,07 км рт.ст.);
о 1050, 2250 см
Аналогично описанному в примере 1, из 2-{7-оксигептил)-3-метокси25иминциклопентанкарбонитрила получают З-формил-2-{7-оксигептил)-метоксиимин циклопентан. Ш.Получение 2-{7-оксигептил)-3(3-оксоокт-1-енил)-метоксииминциклопентана. Аналогично описанному в примере 2,1 получению 6-(7-оксигептил)-1,4-диокса-7-(З-оксоокт-1-енил)-спиро 4,4 -нонана при применении в качестве исходного продукта, З-формил-2-(7-оксигептил)-метоксйиминциклопентака, получают 2- (7-оксигептил)-3--(3-оксоокт-1-енил)-метоксииминциклопентан. j. Получение 7-(2-метоксиимиио-5-. - (З-оксиокт-1) -циклопентил|-эна.нтовой кислоты. Аналогично описанному в примере 1, Y1 получению 7- {1,4-диокса-7-(3-оксо-4-метилокт-1-енил)1-епиро Г4,4 нон-6-ил -энантовой кислоты из 2- -(7-оксигептил) -3- (3-оксоскт-1--енил) -метоксииминциклопентана получают 7- {2-метоксиимин-5-/3-оксоскт-1-енил)-циклопентил| -энантовую кислоту. V.Получение 7- 2-метоксиимин-5-{3-оксиокт-1-енил)-циклопентил1 -энантовой кислоты. Раствор борогидрата натрия (0,222 г) в 0,2 и, водном растворе гидцроокиси натрия (2 мл) по каплям добавляют к раствору 7-{2-метоксиимин -5-(3-рк5рокт-1-евил)-циклогептил зна ТОБОЙ кислоты (0,84 г) в смеси этанол (50 мл} и 1 н. pacfBOpa гидроокиси натрия (2 мл). Полученньй раствор перемешив ают в течение 20 час,удаляют iBaxyyMe. этанол, добавляют воду и эк pal-HpyioT диэтиловым эфиром. Водный слой под слоем диэтилового эфира подкисляют до рН 1 при добавлении по каплям концентрированной соляной кислоты. Эфирный слой отделяют, водный слой дважды экстрагируют диэтиловым эфиром, рбъединенные эфирные экстракты сушат сульфатоммагния, и после испарения растворителя в вакууме полу чают 7- |2-метоксиимино-5-(3-оксиокт-1-енил)-циклопентил} -энантовую кислоту в виде полугидратао Найдено,%: С 67,0; Н 9,,31. С,, Н„ О. N. -1/2 И.О. Вычислено,%: С 67,3; Н 10,2} М 3,7 Строение полученного продукта подтвер ждено ИК и ПМР спектрами. Пример 13. Получение 7-{5-(3-аЦ|етокси-4-метилокт-1-енил) -2-оксоцик лопентил1 -I энтановой кислоты. Раствор 7- (5-(З-окси-4-метилокт-1 -енил)-2-оксоциклопентил -энантовой кислоты (0,34 г), полученный как опи сано в примере 1,YU t в безводном пиридине (10 мл) обрабатывают уксуснь ангидридом (10 мл), выдерживают при комнатрй температуре в течение трех дней, разбавляют водой при охлаждени на ледяной бане. Водный раствор дваж
26 ды экстрагируют диэтиловым эфиром, , объединенные экстракты промывают разбавленной соляной кислотой и водой, и сушат сульфатом магния Растворитель испа-ряют в вакууме и получают 7-{5-(3-ацетокси 4-метилокт-1-енил)2-оксоциклопентил} -энантовую кислоту (0,37 г), которую очищают хроматографированием в тонком слое силикагеля с применением смесиэтилацетата, циклогексана и муравьиной кислоты (40s40 si по объему) для элюирования. Найдено,%s с 10,1; Н . Hjo DS . Вь:числено,%г С 70,0 Н 9,7. макс 975, 1240. 1700, 1715, 1725 См Пример 14. Метил -7-{5-(3циклогексил-3-оксипроп 1-енил)-2оксоциклопентил } -энантоат, Раствор диазометака в диэтиловом эфире (100 мл) добавляют к 7-{5-(3циклогексил-3-оксипроп-1-енил) -2оксоцкалопентилJ - знантовой кислоте, полученной, как описано в примере 8, и реакционную смесь выдерживг т в течение одного дня при комнатной тем.пературё. Полиметилены -образовавшие ся в качестве побочных продуктов реакции, отфильтровывают, фильтрат промывают paэбaвлeнньпv1) водным раствором карбоната натрия, эфир испаряют, получают сырой метил-7-|5-(3-цкклoгeкcил(3-oкcипpoп-l-eнил) -2-оксоциклопенти/ -энантоат, который идентифицирован по Ж-и ПМР-спектрам. При р 15. Аналогично описан-; ному выше 3 примере 14 получению метил7-(5-(3-циклогексил-3-оксипроп-1-ени/ 2oкcoциклoпeнти -.энaнтoaтa из 7- {5(З-циклопентил-З-оксипроп-1-енил)-2-.оксоциклопенти; -энантовой кислоты и 7- (5-(З-оксидодец-1-енил)-2-оксоциклопентил -энантовой кислоты получают метил -7- (5-(3-циклопентил-З-оксипроп 1-енил) -2-оксоциклопенти7 -энантоат и метил-7- (З-оксидодец-1-енил) -2 оксоциклапенти/ знантоат. найдено,%: С 73,1; Н 10,8 Cjj К.. О. Вычислено,%t С 73,4; н 10,9. Пример ..16.N -метил-7- {5-(3оксидодец-1-енил)-2-оксоциклопентил энантоат. Смесь метил-7- 5-(З-оксидодец-1енил)-2-оксоциклопентил -энантоат (0,30 г), полученного как описано в примере 15, К -метилформамида (1,9 г) и безводного метилата натрия (0,06 г) нагревают при в течение одного дня. Охлаждают, к смеси добавляют охлажденную льдом 5%-ную соляную кислоту и экстрагируют iхлороформом. Хлороформенный экстракт промывают водой и сушат сульфатом яатрия, хлороформ удаляют в вакууме, остаток хроматографируют в тонком слое сили кагёля с применением для элюирования смеси бензола и диоксана (5:3 по объему), получают-Н -метил- 7-| 5-{3-оксидодец-1-енил)-2-оксоциклопентйл энантоат. Строение которого подтвертдёно ИК- и ПМР-спектрами. Пример 17. Аналогично описанному в примере 14 получению метил-7 -fs- (З-циклогексил-З-оксипроп-1-енил) - -оксоциклопенти7 -энантоата из диазогептана получают гептил-7- -{3-цикло гёксилгЗ-оксипроп-1-енил}-2- оксоцйкло пентил энантоат. Строение полученного продукта подтверждено ИК и ПМР-спектрами 4 , Пример 18. 7- |5-(З-гидроксибут-1-еНИЛ)-2-oкooциклoпeнти й гeптaновая кислота. ; i Получение 6-(7-гидроксигептил)-1,4-диокса-7-(3-оксобут-1-енил)-спиро 4,4 нонана. Смесь 7- формил-6-(7-гидроксигептил -1,4-диоксаспиро 4 , 41нонана (8,4 г; получен ПОметодике примера 1) и ацетилметилентрифенил$осфора|1а (12,0 г; в осушенном тетрагидрофуране (70 мл) нагревают при температуре кипения под азотом в течение 18 час. Растворитель отгоняют ;ГГодвакуумом и остаток расти рают в порошок в смеси петролейного . эфира (т.кип. 60-80 С) и этилацетата, выдерживают при , фильтруют досуха с получением 6-(7-гидроксигептил)-1,4 диокса-7-(З-оксобут-1-енил)-спиро 4,4 нонана (10,2 г) , (5мак.с. 1620, 166q см , Й.Полу 1еиие 7- ,4-диокса-7-(3-рксобут-1-енил)-спиро,4,43нон-б-ил « -гептановой кислоты. К раствору б-П-гидроксигептил)-1,4-диокса-7-(З-оксобут-1-енил)-спир(э|4,4|нонана (5,70 г) в осушенном диметилформамйдё (100 мл) добавляют при перемешивании триокись хлора (7,70 г) To ViiTe HHOroj над пятиокисью фосфора) при температуре ниже . Добавляют концентрированную серную ки лоту (2,75 мл) в диметилформамйдё (100 мл) и смесь перемешивают при тем пературе ниже в течение 1 час. Затем добавляют диэтиловый эфир и минимальное количество воды для обраэования легко разделяющих слоев. Эфирны слой отделяют и перемешивают с водным 2 и. раствором карбоната натрия. Водный слой отделяют-, промывают диэтилов эфиром затем покрыли слоем диэтиловог эфира и подкисляют до рН 5 20%-ным во ным раствором дигидрофосфата натрия. Эфирный.слой отделяют, а водный слой опять подвергают экстрагированию диэ. тиловым эфиром. Эфирные слои объединя ют, над сульфатом натрия и выпаривают до образования 7-(l,4 -диокса - 7 - (З-оксобут-1-енил) -спиро f 4,4 нон-6-ил -гептановой кислоты .(1,60 г). Это продукт использован для следующей ста дии получения 7-{5-(3-гидроксибут-:1-енил)-2-оксоциклопентил}- гептановой кислоты без предварительной очистки. Щ.Получение 7-{5-(З-гидроксибут-1енил)-2-оксоциклопентил1-гептановой кислоты. Раствор 7- 1,4-диокса-7-(3-оксобут-i-енил) -спиро 4 ,4 нон-б-ил -гептановой кислоты (0,55 г) в метаноле (9мл) добавляют к 2%-ному водному раствору цитрата натрия (138 мл) и охлаждают до . Затем добавляют боргидрид Kaiлия (2,35 г) при перемешивании в течение 1 час при температуре . Раствор переметивaipT 2 час, добавляют ацетон (20 мл), затем 10 %-ный водный раствор лимонной кислоты для получения рН 4. Раствор насыщают хлористым натрием и экстрагируют диэтиловым эфиром. Эфирные вытяжки промывают солевым раствором и выпаривают. Маслянистый оста-, ток перемешивали с 2 н. соляной кислотой (15 мл) при в течение 2 час, охлаждают и экстрагируют диэтиловым ; эфиром. Эфирные вытяжки cytaat над сульфатом натрия и выпаривают. Остаток очищают с помощью препаративной тонкослойной Хромотографии на силикагеле с использованием в качестве элюента смеси бензола, диоксана и уксусной кислоты (65:15:1 по объему). Получают 7-(5-(З-гидроксибут-1-енил)-2оксоциклопентил -гептановую кислоту (0,13 г). Найдено,%: С 67,9 Н 9,5. Cji HAjO. . Вычислено,%: С 68,0 89,3. яакс. 980, 1700, 1720 см В спектре ядерного магнитного резонанса (ЯМР) 10%-ного растовора в дейте рохлоро форме содержатся следующие пикиг дублет при 1,30 fl (У -6 цикл (вторичный), мультиплеты при 1,1-2,7 S 4,0-4,6 & i 5,45-5,7 бсинглет при 7,16-). Пример 19. 7-{5-(3-гидрокси4,4-диметилпент-1-енил)-2-оксоциклопентилгептановая кислота. I. Получение 6-(7-гидроксигептил)7-(4,4-диметил-3-оксопент-1-енил)-1,4диоксайпироJ4,41нонана. Смесь 7-формил-б-(7-гидрокСигептил)1,4-диоксаспиро 4,4 нонана (5,2 г получен по методике примера 1), трнметилацетилметилентрифенилфосфорана(6,5 г) и гексаметилфосфортриамида (42 мл) нагревают на паровой бане под аз.отом в течение 7 дней. К охлажленной реакционной смеси добавляют воду и хлороформ, затем разделяют слои. Водный слой дважды экстрагируют хлороформом. Слои хлорофориа объединяют, сушат над сульфатом натрия и выпаривают. Остаток растирают в порошок в смеси петролейного эфира (т.кип.6080 0 и этилацетата, выдерживают при , отфильтровывают для удаления окиси трифенилфосфина и фильтрат выпари29вают до образования б- (7-гидроксигёп тил)-7-(4,4-диметил-3-оксопент-1-енил)-1,4-диоксаспиро 4 ,4jHQHaHa 1620, 1660 см. (8 г); -; II Получение 7-(7-{4 ,4-диметил-З-оксопент-1-енил) -1,4-дйоксаспиро f4,4J нон-6-ил -гептановой кислоты. По методике получения 7--{4,4-диокса-7- (З-оксобут-1-енил) -спиро 4 , 4, нон-6-ил -гептановой кислоты примера 18, И при замене исходного 6- (7-гидроксигептил)-1,4-диокса-7-(3-оксобут-1-енил)-спиро 4,4 нонана соответствующим количеством 6-(7-гидроксигеп тил) -7- (4,4-диметил-3-оксрпент-1-енил)-1,4-диоксаспиро 4,4 нонана получают 7-|7-(4,4-диметил-З-оксопет1-енил) -1, 4-диоксаспиро 1:4,4 нон-б-ил -гептановую кислоту. Ш. Получение 7-{5-(З-гидрокси-4,4диметилпент-1-енил)-2-оксоциклопентил гептановой кислоты. По методике получения 7-{5-:(3-гидpo кcибyт-l-eнил)-2-oкcoциклoпe тилJгeптaнoвoй кислоты примера 1§, П1 при замене исходной 7-|l ,4-диокса-7-(3-оксобут-1-енил) -спиро 4,4 нон-б-ил1- -гептановой кислоты соответствующим количеством 7-{7-i 4,4-диметил-3-рксопент-1-енил) -1,4 диoкcacпиpoJ4, 4jHOH «6-ил -гептановой кислоты получают 7- (З-гидрокси-4 ,4-диметилпент-1енил) -2-оксоциклопенти1 -.гепта новую кислоту. Найдено,%: С 68,5,Н 9,7|Н О 1,0| О. 1/4Н20. Вычислено,%: С б9,з;н 10,p;Hj,O 1,4. П р и м е р 20. 7-(5-{3-гидрокси-4,4-диметилгепт-1-енил)-2-оксоциклопентил}-гептановая .кислота, I.Получение 6-(7-гидроксигептил)-7-(4,4-диметил-3-окс1рге0у-1-енил) -1,4-диоксаспиро{4,41 нонана. По методике получения б-(7-гидроксигептил)- 7- (4,4-димети/1-3-оксопент -1-енил) -1, 4-диоксаспиро К 1 нонана, описанной в примере 19, iпри замене тр иметилацетилметилентрифенилфрсфорана соответствующим количеством 2,2-диметилвалерилметилентрифенилфосфорана получают 6-(7-гидроксигептил)-7-(4,4-диметил-3-оксогепт-1-енил)-1,4-диоксаспиро 4,4 нонан.Эт.от продукт использован на следующей стадии получения 7- (4,4-диметил-3-оксогепт-1-ени -1,4-диоксаспиро 4,4 нон-б-ил|-гептан вой кислоты без предварительной очист ки.2,2-диметилвалерилметилентрифенилфосфоран,примененный в выше названной реакции (т.пл. 94-96 с) . Найдено,%: С 80,9 Н 7,б ч CjgH,gOP. Вычислено,%: С 80,4; ,Н 7,5ч . Получен иэ 1-бролю-зуз-диметилгекса З-она 3, З-диметил-2-оксогексилхрифенилфосфониевый бромид {т. пл., 21 ).
30 П.Получение 7-(7-(4,4-диметил-3-оксогепт-1-еиил)-1,4-диоксаспиро 4,4 но н-6-ил f-гептановой кислоты. По методике получения ,4-диокса7- (З-Ьксобут-1-енил)-спиро 4,4 нон-6ил -гептановой кислоты, описанной в примере 18, jj при замене исходного 6( 7-гидроксигептил)-1,4-диокса-7-(3-оксобут-1-енил)-спиро J4,4 нонана соответствующим количеством б-(7-гидроксигептил) -7- (4, 4-диметил-3-оксогепт--1-енил) 1,4-диоксаспиро , 4 нонана синтезирована 7- (7-(4,4-диметил-3-оксогепт-1енил) -1,4-диоксаспиро; 4 ,4 нон-б-ил| гептановая кислота. §vПолучение 7- 5-(З-гидрокси-4,4-ди.метилгепт-1-енил)-2-oкcoциклoпeнтилJ-гептановой кислоты. По методике,получения 7- 5-(3-гидроксибут-1-енил)-2-оксоциклопентил}гептановой кислоты, описанной в примера 18, 25 при замене исходной 7-{l,4диокса-7-(З-оксобут-1-енил)-спиро 4,4|нон-б-ил -гептановой кислоты соответствующим количеством 7- {7-(4,4диметил-З-оксогепт-1-енил)-1 ,Д-диоксаспиро 4,4 нон-6-ил|- гептановой кислоТЫ синтезирована 7- | 5-(3-гидрокси-4,4-диметилгепт-1-енил)-2-оксоциклопентил -гептановая кислота. Найдено,: С 70,3;н 10,4. Cjj Hjg Од. 1/4Н5О . Вычислено,%: С 70,7;Н 10,3, 980, 1700, 1720 Пример 21. 7-(5-(3-гидрокси4-пропилокт-1-енил)-2-оксациклопентил - гептановая кислота. I.Получение 6-(7-гидроксигептил)-7-(4-пропил-3-оксоокт-1-енил)-1,4-диоксаспиро 4 , 4 нонана, По методике получения .л&ыактил-3- оксопроп-1-енил)-б- (7-гидрок сигептил)-1,4-диоксаспиро 4,4 нонана, описанной в примере 9, при замене исходного адамантилкарбо йлметилентрифенилфосфорана соответствующим количеством :27попилгексаноилметилентрифенилфосфорана синтезирован б-(7гидроксигептил)-7-(4-пропил-З-оксоокт1-енил)-1,4-диоксаспиро 4,4 нонан. 2-пропилгексаноилметилентрифенилфосфоран, использованный в вьшеназванной реакции (т.пл. 100-102 С) : Найдено,%: С 80,9J Н 7,6. Сге з ОРВычислено,%: С 80,7; Н 8,0. макс. 1435, 1475, 1535 получен из 2-пропилгексаноилхлорида через 2-хлор-3-пропилгептан-2-он (т.кип. 102-110 С мм рт.ст.): Найдено, %: С 63,6, Н 10,5, Сад Н его. Вычислено,%; С 63,0;н 10,0; и |3 -пропил-2-оксогептилтрифенилфосфониевый хлорид (т.пл.150-153 0) по. методике примера. 1.
31 Н.Получение 7- (7-(4-пpoпия-3-oкcooк -l-eнил) -1,4-диоксаспиро 4,4|нон-6-ил гептановой кислоты. По методике примера 18,11 при замене исходного 6-(7-гидроксигептил)-1,4-диокса-7-(З-оксобут-1-енил)-спир -4,4-нонана соответствующим количест вом 6-(7-гидроксигептил)-7-(4-пропил -З-оксоокт-1-енил)-1,4-диоксаспиро Т4,4 нояана получена 7 - -(4-пpoпил-3 -oкcooкт-l-eнил) -1,4-дирксаспиро l4,4| нон-6-и/ -гёптансшая кислота. §; Получение 7--(5-(3-Yидpoкcи-4-пpo пипoкт-l-eнил) -2-оксоциклопентил}гептановой кислоты. По методике получения 7-{5-(3 гидDO lccибyт-l-eнил) -2-оксоциклопентил}гептановой кислоты, описанной в примере 18,W«npH замене исходной JTj(i, 4-Дйокса-7- 3 6ксобут-1-енил) -спиро нон-6-ил -гептановой кислоты соответствующим количеством 7- (4Пропил-З-оксоокт-1-енил)-1,4-дйоксаспиро 4,4 нон-6-ил1- гептановой кисло|5-f 3-гидрокситы синтезирована 7- -оксоциклопентил4-пропилокт-1-енил) -гексанб вая кислота. Найдено,% С 72,4iH 11,0, С «40 °4 Вычислено,%: С 72,6; Н 10,6. ткс 30 В спектре ядерного магнитного резонанса (ЯМР) 10%-ного раствора; в дейтерохлороформе обнаружены следующи пики: триплет пои 0,88(5, мультиплеты при 1,05-1, Эб, 1,9-2, 7д , триплет при 2, Зоб, мультиплеты при 4,12 и 5,55,76, синглет при 6,49. Пример 22. 7- 5-(3-гидроксй -4,4-диметилокт-1-енил) -2-сксоцик71Опентил -гептановая кислота. Т.Получение 6-(7-гидроксипентил)-7-(4,4-диметил-3-оксоокт-1-енил) -1,4-диоксаспиро 4,4 нонана . По методике получения 7-(3-адаманти З-оксопроп-1-енил)-6-(7-гидроксигепти -1,4-диоксаспиро 4,4 нонана, описанной в примере 9, при замене исходного адёи11антилкарбонилметилентрифенилфосфо рана ,соответствующим количеством 2,2-диме лгексаноилмётилентрифенилфосфорана синтезирован 6-(7-гидроксигептил -7- (4,4-Д21метил-3-оксоокт-1-енил) -1,4-диоксаспиро 4 ,4 нонан; ткс 1680,. 1620, 1390, 1370, 990 см . 2,2-Диметилгексаноилметилентрифен фосфоран реакции; т.пл. 83-85 С Найдено,%: С 80,5; Н 7,8;р7,6. С„Н, ОР.. Вычислено,%1 С 80,6; н 7,8; Р 7,7; получен по методике примера 1 из 2 ,2-диметиленгексаноил5 лорида через Д-хлор-З,З-диметилгептан-2-он; т.кип 105-107 С/ 10 мм рт.ст: Найдено,%: С 19,9 . Сд HI ceo.
32 Вычислено,%: С 20,1; и 3,З-диметил-2-оксогептилтрифенилДюсфониевый хлорид; т.пл. 172-114°С. Получение 7-|7- (4,4-диметил-ЗоксоОкт-1-енил)-1,4-диоксаспиро 4,4 нон-6-ил -гептановой кислоты. По методике примера 18,2 при замене исходного 6-(7-гидроксигеПтил)-1,4диокса-7-(З-оксобут-1-енил)-спиро 4,4 нонана соответствукицим количеством 6-(7-гидроксигептил)-7-(4,4-диметил-З-оксоокт-1-енил)-1,4-диоксаспиро 4 , 4 -нонана синтезирована 7- 17(4,4-диметил-3-оксоокт-1-енил)-1,4диоксаспиро 4 ,4 нон-6-ил|-гептановая кислота ; tl( Получение 7- 5-( З-гидрокси-4 , 4диметилокст-1-енил)-2-оксоциклопентиг гептановой кислоты. По методике получена 7- 5-(3-гидрсзксибут-1-енил) -2-оксоциклопенти1 гептановой кислоты, описанной в примере 18,Ш при замене исходной 7- (1,4Диокса-7- (З-оксобут-1-енил) -спиро (4, 4 нон-6-ил - гептановой кислоты соответствующим количеством 7- (7(4 ,4-диметил-3-оксоокт-1-енил) -1,4диоксаспиро 4,4 нон-6-ил -гептановой кислоты синтезирована 7- -5(3гидрокси-4,4-диметилокт-1-енил)-2оксоциклопёнтил -гептановая кислота. Найдено,%: С 71,6;: Н 10,5. С22 Hjg Од , Вычислено,%: С 72,1; И 10,5. нсжс.975, 1370,1390, 1725 см-Ч Пример 23. 7- (5-(3-гидрокси-4-пропоксибут-1-енил)-(2-оксоциклопентилЗ -гептановая кислота. Т Получение 6-(7-гидроксигептил)-7 (3-оксо-4-пропоксибут-1-енил)-1,4диоксаспиро 4 ,4 нонана. По методике получения 6-{7-гидроксигептил) -1,4-диокса-7-(3-оксобут-1енил)ч:пиро 4 , 4 нонана, описанной в примере 18, J, при замене ацетилметилентрифенилфосфорана соответствующим количеством пропоксиацетилметилентрифенилфосфорана синтезирован 6-{7гидроксигептил)-7-(3-оксо-4-пропок7сибут-1-енил)-1,4-диоксаспирор ,4J/ нонан. Этот продукт использовали на следующей стадии, стгщии получения7- {l,4-диокса-7-(З-оксо-4-пропоксибут-1-енил)-спиро 4 ,4J нон-6-ил1-гептановой кислоты без предварительной очистки. Исходный пропокскаиетилметилентрифенилфосфоран получен следующим образом. Раствор 1-хлор-З-пропоксиацетона (8,5 г) и трифенилфосфина (15,6 г) в хлороформе (20 мл) насыщают азотом и нагревают при температуре кипения под азотом в течение ночи. Затем добавляют в избытке сухой диэтиловый эфир, растворители декантируют из
33 выделившейся смолы. Оставшийся растворитель удаляют в вакууме и получаю 2-оксс-З-пропоксипропилтрифенилфосфо ниевый хлорид (14,9 г). Его интенсив но перемешивают с раствором карбоната натрия (14,6 г) в воде (146 мл) в течение 24 час. Раствор экстрагируют диэтиловым эфиром, эфирные вытяжки сушат над сульфатом натрия. Выпариванием удаляют растворитель, а остато растирают в порошок в петролейном эфире, получают пропоксиацетилметилен трифенилфосфоран (6,3 г), представляющий собой твёрдое вещество. Исходный 1-хлор-З-пропоксиацетон получают следующим образом. К перемешиваемому раствору 1-хлор-2-гидрокси-З-пропоксипропана (9,1 г) в ацетоне (30 мл) прикапывают 8 н. реактив Зопез (30 мл) в течение 30 мин температуру реакции поддерживают Затем реакционную смесь перемешивают в течение 4 час, потом добавляют воду в количестве, достаточном лпя растворения выпавших в осадок хромовых солей. Смесь трижды экстрагируют диэт ловым эфиром, эфирные вытяжки сушат над сульфатом натрия, концентрируют при пониженном давлении, вновь сушат и концентрируют с получением 1-хлор-; -3-пропоксиацетона (8,5 г). Н.Получение 7- (1,4-диокса-7-(3-оксо-4-пропоксибут)-1-енил) -спиро , 4 нон-€-ил -гептановой кислоты. По методике получения 7- {1,4-диокса-7-(3-оксобут-1-енил)-спиро 4,4 нои-6-илХ-гептановой кислоты, описанной в примере 18, 5 , при замене исходного 6-(7-гидроксигептил)-1,4-диокса-7-(З-оксобут-1-енил)-спиро 4,4 нонана соответствующим количеством б-(7-гидроксигептил)-7-(З-оксо-4-пропоксибут-1-енил) -1,4-диоксаспиро 4 , 4 нонана синтезирована 7- , 4-диокса-7-(3-оксо-4-пропоксибут-1-енил) -спиро ;4 ,4 нон-6-ил |-гептановая кислота. Получение 7- { 5-(3-гидpoкcи-4-пpoпoкcибyт-l-eнил) -2-оксоциклопентил гептановой кислоты. По методике получения 7-{5-(3ч:идроксибут-1-енил)-2-оксициклопентил чгептановой кислоты, описанной в примере 18,Щлри замене исходной 7- {1,4 диокса-7-(З-оксобут-1-енил)-спиро (.4 ,41 НОН-6-ИЛ гептановой кислоты соответствующим количеством 7- {1,4диокса-7-(3-оксо-4-пропок сибут-1енил) -спиро 4 , 4 нон-6-ил} - гептановой кислоты синтезирована 7- {5-(3-гидрокси-4-пропоксибут-17енилУ-2-оксоциклопентил}-гептановая кислота. Найдено,%: С 66,5; Н 9,6i CjgH OsВычислено, %: С 67,0; Н 9,5. .980, 1700, 1720 см, ЯМР (приблизительно 10%-ный раство в дейтерохлороформе): триплет при
34 0,92 ( Э-7,25 цикл, вторичный), мультиплеты при 1,1-2,, триплет при 2,31 (5 ( J-7 цикл, вторннный) мультиплет при 3 , 5 (У , дублет при 3,28 (38,10, цикл, вторичный), триплет при 3,46 5, (3-7 цикл, вторичный), ,мультиплет при 4 ,1-4 , 5 в дублет при 5,78 . (3 -6, 15,5 цикл, вторичный), дублет при 5,455P f-5, 15,5 цикл, вторичный синглет при 6,27 . Пример 24. 7- (-5 3-гидрокси4-{1-метилпропокси)-бут-1-еНил -2-оксоциклопентил -гептановая кислота. Т,Получение 6-(7-гидроксигептил)-7-4- (1-метилпропокси)-З-оксобут-1енил -1, 4-диоксаспиро А , 4Знонана. По методике получения 6-(7-гидроксигептил) -1, 4-диокса-7-(3-оксобут1-енил)-спиро 4,4 нонана, описанной JB примере 18, J. при замене ацетилметилентрифенилфосфорана соответствующим количеством Ч- метилпропоксиацетилметилентрифенилфосфорана синтезирован 6-(7-гидроксигептил) - (4-метилпропокси) -З-оксобут-1-енил -1,4. диоксаспиро 4 , 4 нонан. Исходный 1-метилпропоксиацетилметилентрифенилфосфоран, т.пл. 84-89 С получен по методике примера 1, через 3-(1-метилпропокси)-2-оксопропилтрифенилфосфониевый хлорид, т.пл. 68-71 С, из 1-хлор-З-(1)-метилпропокси)ацетона, т.кип. 89-90с/9 мм рт.ст. синтезированный по методике примера 23. Неполучение 7-{1,4-диокса-7- з-оксо.-4-(1-метилпропокси)-бут-1-енилЗспиро , -6-ил| - гептановой кислоты. По методике получения 7- {1,4-диокса7-(З-оксобут-1-енил)-спиро 4,4 нон-бил}-гептановой кислоты, описанной в примере 18,п при замене исходного 6(7-гидроксигептил)-1,4-диокса-7- ( 3оксобут-1-енил)-спиро 4,4 нонана соответствующим количеством 6-(7-гидроксигептил) -7- 1.4- (1-метилпропокси) - 3-оксобут-1-енил -1, 4-диоксаспиро 4,4 нонана синтезирована 7- |l, 4-диокса-7- .3-оксо4- (1-метилпропокси)-бут-1-енил - спиро 4 , 4 нон-6-ил гептановая кислота . Щ/1олучение 7- {5- 3-гидрокси-4-(1метилпропокси)-бут-1-енил -2-оксоциклопентил -гептановой кислоты. По методике получения 7- { 5-(3-гидроксибут-1-енил)-2-оксоциклопентил Гептановой кислоты, описанной в примере 18,Щ, при замене исходной 7- {1,4диокса-7-(З-оксобут-1-енил)-спиро 4,4 нон-6-ил - гептановой кислоты соответствующим количеством 7- { 1,4-диокса-7 з-оксо-4- (1-метилпропокси-бут- 1-енил спиро (4 , 4 нон-6-ил -гептановой кислоты синтезирована 7- (5-р-гидрокси-4-(1метилпропокси) -бут-1-енил -2-о ссоциклопентил1 -гептановая кислота. Найдено,%: С 67,6; Н 9,6. CioKj Os35
Вычислено,%: С 67,8; Н 9,7. макс. 990, 1710, 1730 смЧ ЯМР (приблизительно 10%-ный раствор в дейтерохлороформе) : триплет при О , 9iiy, дублет при 1 ,1 75,мультиплет при 1,1 - 2,68, мультиплеты при 3,25-3,75 4,15- 4,455, 5,3 - 6,о5синглет при б,7&,
Пример 25. 7- {5-(З-гидрокси-изопропоксибут-1-еиил)-2-окссциклоПентил}-гептановая кислота. Х.Получение 6-(7-гидроксипентил)-7-(3-оксо-4-изопропоксибут-1-енил)-1,4-диоксаспиро ( нонана.
По методике получения б-(7-гидроксигептил)-1,4-диокса-7-(З-оксобут-1енил)-спироJ4,4 нонана, описанной в примере 18, д., при замене ацетилметилентрифенилфосфорана соответствующим количеством изопропоксиацетилметилен трифенилфосфорана был синтезирован 6-(7-гидроксигептил)-7-{З-оксо-4-изопропоксибут-1-енил)-1,4-диоксаспиро 4, 47нонан
. 990, 1610, 1685 см-. Исходный изопропоксиацетилметилентрифенилфосфоран (т.пл. 109-110 0 получен по методике, описанной в примере 1, через З-изопропркси-2-оксопропилтрифенилфосфониевый хлорид (т.пл. 78-82®С) из 1-хлор-З-изопРОКсиацетона (т.кип. 78-80 0/8 мм рт.ст,), синтезированный по методике примера 23.
fl.Получение 7- U.4-диокса-7(3-окс 4-иэопропоксибут-1-енил)-спиро 4, 4 нон-брил}-гептановой кислоты.
По методике получения 7-{l,4-диокса 7- (З-оксобут-1-енил)-спир® 4,4 нон-б-ил. гептановой кислоты, описанной в примере 18,и,при замене исходного 6-(7-гидроксигептил)-1,4-диокса-7-(3-оксобут-1-енил) -спиро 4, 4 нонана соответствующим количеством 6-(7-гидрокснгептил)-7-(З-оксо-4-изопропоксибут-1-енил)-1,4-диоксаспиро 44 нонана синтезирована 7- 1, 4-диокса-7-(3-оксо-4-изопроп®ксибут-1-енилЬспиро 4,4 нон-6-ил -гептановая кислота.
Ш Получение 7- {5-(З-гидрокси-4-изопропоксибут-1-енил)-2-оксоциклопентилj -гептановой кислоты.
По методике получения 7- {5-(3-гидроксибут-1-енил)-2-оксоциклопентил - гептановой kиcлoты, описанной в примере 18, Ш , при замене исходной 7- {1,4-диокса-7-{З-оксобут-1-енил)-спиро нон-6-ил -гептановой кислоты, соответствующим кЪличеством 7- 1,4-диокса-7-(З-оксо-4-изопропоксиРут-1-енил)-спиро 4,4 нон-6-ил}-гептановой кислоты синтезирована 7- 5-(З-гидрокси-4-изопропоксибут-1-енил)-2-оксоциклопентил гептановая кислота.
Найдено,%: С67,4;Н9,0.
Cjg Hjo DS .
36
Вычислено,%: С 67,4; Н 8,9
990, 1630, 171Р, 1735 см .
макс
ЯМР (приблизительно 10%-ный раствор в дейтрехлороформе), дублеты при 1,2$ ,6,45 «У синглеты при 4,18 S, 9,8, мультиплеты при 1,1-2,76, триплет при 2,325, септет при 3,695; дублет при 7,05 .
Пример 26. К раствору 7- (5-(3-гидрокси-4-метилокт-1-енил)-2-оксоциклопентил} - гептановой кислоты (0,704 г) в сухом дихлорметане (10 мл) прикапывают триэтиламин (0,222 г) в сухом дихлорметане (5 мл), затем пивалоиловый хлорид (0,264 г) в сухом дихлорметане (5 мл), затем пивалоиловый хлорид (0,264 г) в сухом дихлорметане (5 мл). Реакционную смесь перемешивают 15 мин, при перемешивании добавляют раствор ундеканола (4 мл) в сухом пиридине (2 мл) при температуре окружающей среды в течение 90 мин. Прибавляют дополнительной количество дихлорметана (30 мл) и промывают реакционную смесь 2 н. соляной кислотой. Органический слой промывают водным бикарбонатом натрия и водой, осушают над сульфатом магния и выпаривают досуха. При хроматографировании остатка на колонке, заполненноЙ силикагелем,
0 и элюировании сначала циклогексаном для удаления избытка ундеканола, а затем смесью циклогексана и этилацетата (10:1 по объему) получают ундецил-7{5-(3-гидрокси-4-метилокт-1-енил)325 . оксоциклопентил -гептаноат (0,15 г).
макс. 3400, 1730, 1380, 980 см
Найдено, %: С 76,3; Н 11,1..
Cjji Н58 04 .
Вычислено,%: С 76,8; Н 11,4.
0
ЯМР (приблизительно 10%-ный раствор в дейтерохлороформе): мультиплет при 5,2 - 5,78, широкий мультиплет при 3,7 - 4,3, перекрываемый триплетом при 4,08 (3-6,25 цикл/вторич5ный ) .
По этой же методике при замене 7- {5-(3-гидрокси-4-метилокт-1-енил)-2-оксоциклопентил| -гептановой кислоты соответствующим количеством 7- (5-(3-гидрокси-7-метилокт-1-енил)-2-оксоциклопентил}-гептановой кислоты синтезирован ундецил 7-(-5(3-гидpoкcи-7-мeтилoкт-l-eнил) -2-оксоциклопентил -гептаноат., 3450, 1725, 980 см
ЯМР (10-ный раствор вдейтерохлороформе) : дублет при 0,906 (3-цикл, вторичный), триплет при 0,9Й, мультиплеты при 1,05 - 2 , 7 , 4 , О - 4,35, 5,5 - 5,75.
Пример 27. 7- (5-(3-гидрокси-4-пропоксибутил)-2-оксоциклопентил -гептановая кислота.
Раствор (З-гидрокси-4-пропоксибут-1-енил)-2-оксоциклопентил 5
37 -гептановой кислоты {U,&5 г); получена по методике, описанной в примере 23) в этаноле (50 мл) восстанав ливают каталитически водородом при давлении 5 кг/сьгв присутствии 5%-но го палладия на древесном угле (0,23 при комнатной температуре 3 час. Кат лиэатор отфильтровывают, этанол выпаривают, получают 7- {5-(3-гидpoкcи -4-пpoпoкcибyт-l-ил) -2-оксоциклопенти -гептановую кислоту (0,39 г). Кислоту очищают с помощью препаратной тонкослойной хроматографии на силикагеле, в качестве элюента используют смесь этилацетата, циклогексана и муравьиной кислоты (40:40:1 по объему). ЯМР (приблизительно 10%-ный раствор в дейтерхлороформе): триплет при 1,08 (J-7 цикл, вторичный); мультиплет при 1,1 - 2,off,2,0 - 2,755 3,2 - 4,1 широкий синглет при 6,06-, Найдено,%: С 67,0; Н 10,1, СII Hj Oj . Вычислено,: С 66,6; Н 10,0Пример 28. 7- (3-гидpoкcи-4-пpoпилгeпт-l-elJИл) -2-оксоциклопентил -гептановая кислота. |) .Получение 6- (7-гидроксигептил) -7 -(3-оксо-4-пропйлгепт-1-енил)-1,4-дйоксаспиро 4,4 нонана. .По методике получения 6-(7-гидрок сйгептил)-7-(4,4-диметил-3-оксопент-енил)-1,4-диоксаспиро |4,4 нонана, описанной в примере 19, при замене исходного тримётилацетилметилентрифе нилфосфорана соответств ующим количес вом 2-пропилпентаноилметилентрифенил фосфорана синтезирован 6-(7-гидрокси гептил) -7-(3-оксо-4-пропилгепт-1-ени -1,4-диоксаспиро-4,4-нонан. ивкс. 955, 990, 1620, 1655 см , достаточно чистый для использования на следующей, стадии без предваритель Ной очистки. 2-Пропилпентаноилметилентрифенилфосфоран (т.пл. 138-143°С): Найдено,%: С 80,6; Н 7,7; Р 7,7. Сг7Нм°РВычислено,%; С 80,6; Н 7,8; Р л)макс 111° 154 получен через 2-пропилпентаноилметил трифенилфосфониевый хлорид (т-пл. 172-175С) : Найдено,%: С 73,9; Н 7,2; С 8,2, С 27 HjjCeOP. Вычислено,%: С 73,9; Н 7,4; СС 8,1 Mottc. 1110/ 1695 см i и 4-хлорацетилгептан (т. кип. 98-102 /8 мм рт.ст.): Найдено,%: С 61,6; Н 10,2. С 5 . Вычислено,%: С 61,2; Н 9,7; макс . 1465, 1715 см; из 2-пропилпентаноилхлорида.
38 Л Получение 7- { 7-(З-оксо-4 ч-пропилипт1-енил)-1,4-диоксаспиро 4,4 нон-бил -гептановой кислоты. По методике примера 18, при замене исходного 6- (7-гидроксигептил)1,4-диокса-7-(З-оксо-бут-1-енил)спиро 4,4 нонана соответствующим с количеством 6-(7-гидроксигептил)-7-(3-оксо-4-пропилгепт-1-енил)-1,4-диоксаспиро 4,4 нонана синтезирована 7-(3-оксо-4-пропилгепт-1-енил)-1, 4-диоксаспиро , 4 j нон-6-Ил j -гептановая кислота. .. 955,.990, 1625 см . 1И,Получение 7- ( 5-(З-гидрокси-4-пропилгепт-1-енил)-2-оксо-циклопентил -гептановой кислоты. По методике получения 7- {5-(3гилроксибут-1-енил)-2-оксациклопентил - гептановой кислоты примера 18,Ш, при замене 7- {1,4-диокси-7-(3-оксобут1-енил)-спиро 4,4 нон-6-ил -гептановой кислоты соответствующим количеством 7- {7-(3-оксо-4-пропилгепт-1-енил)1,4-диоксаспиро 4,4 нон-6-ил - гептановой кислоты синтезирована 7-i(5-(3гидрокси-4-пропилгепт-1-енил)-2-оксоциклопентил -гептановая кислота. Найдено,%: С 72,1; Н 10,5. Сг JS О, . Вычислено,: С 72,1; Н 10,5. иакс. 980, 1705, 1730 см В спектре ЯМР (приблизительно 10%ный раствор дейтерохлороформе) . обнаружены следующие пики: широкий синглет при 6,5 мультиплеты при 5,5 - 5,7S , 4,22 и 1,0 - 2,78, триплет при 0,898. Пример 29. 7- (5-этокси-Зидроксипент-1-енил)-2-оксоциклопентил1 гептановая кислота. С Получение 6- (7-гидроксигептил)-7-(5-этокси-3-оксопентил-1-еиил)-1,4-диоксаспиро 4 ,4 нонана. По методике примера 18, 1 при замене исходного ацетилметилентрифенилосфорана соответствующим количеством 3-этоксипропионилметилентрифенилфосфосинтезирован 6-(7-гидроксигептил)-7-(5-этокси-3-оксопент-1-енил)-1,4диоксаспиро 4,4 нонан, достаточно чистый для применения на следующей стадии без предварительной очистки. Исходный 3-этоксипропионилметилентрифенилфосфоран, т.пл. 63-65 С, получен по методике примера 1, через 4-этокси-2-оксобутилтрифенилфосфонйе вый хлорид (т.пл. 157-160°С) из 1-хлор-4-этоксибутан-2-она, синтезированного из 3-этоксипропионил хлорида . 11 Получение 7- ( 7-(5-этокси-З-оксопент-1-енил)-1,4-диоксаспиро 4,4}нон-6-ил } -гептановой кислоты.
39 По методике примера 18,Дпри заме исходного 6- (7-гидроксигептил)-1,4 диокса- - (З-оксобут-1-енил) -спиро , 4 5 нонана соответствующим количе вом 6-(7-гидроксигептил)-7-(5-этокс -3-оксопент-1-енил)-1,4-диоксоспиро 4,4 нонана синтезирована 7- {7-(5 --этокси-З-оксопент-1-енил) - 1, 4-диок пиро 4,4 нон-6-ил1-гептановая кис лота , Получение J- (5-{5-этокси-З-ги роксипент-1-енил)-2-оксоциклопентил -гептановой кислоты. По методике получения 7- (3-гидроксибут-1-енил)-2-oкcoциклoпeнт -гептановой кислоты, описанной в при мере 18( замене ;исх6дной 7- (1,4-диокса-7-{З-оксабут-1-енил)-спиро 4,4 нон-6-ил -гептановой ки лоты соответствующим количеством 7- {7- (5-этокси-3-оксопент-1-енил)-1,4-диоксаспиро 4,4 нон-6-ил - -гептановой кислоты синтезирована 7-{5-(5-этокси-3-гидроксипент-1-енил -2-оксоциклопентил - гептановая кисло та . Найдено,%: С 67,2; Н 9,8. CiqHjjOs. Вычислено,%: С 67,0; Н 9,5. макс. 970, 1710, 1730 см- . ЯМР (приблизительно 10-ный раствор 1В дейтерохлороформе: триплет при 1, ( Э - f цикл, вторичный) .мультиплеты при 1,0 - 2,, 3/3 - 3,77, 4,36 5,5 - 5,74ej синглет при 6,826, же образом можно получить следующие соединения формулы I. 7- {5-(3-гидрокси-4-этилгекс-1-енил) -2-оксоциклопентил гептановую кислоту. Найдено,%s С 70,6; н 1 Q , i Вычислено,%: С 71,0; Н 10,1. мак-с. 970, 1720 см .. ЯМР (приблизительно 10%-ный раство в дейтерохлороформе); мультиплеты при 0,65 - 1,05, 1,05 - 2,7, 4,116 4,3 - 5,7д-, синглет при 6,13} ч 1- {5-(4-этил-3-гидроксиокт-1-енил 2-оксоциклопентилJ - гептановую кис лоту. Найдено,%: С 71,8; Н 10,7, гг se °4 Вычислено,%: С 72,1; Н 10,5. , 980, 1700. 1730 см 7- 5-(3-гидрокси-4-метилпент-1-енил)-2-оксоцкклопектилi -гептанов кислоту. Найдено,% С 69,8; Н 9,8. С.д Н О Вычислено,% С 69,7) Н 9,7. ЯМР (приблиэительно 10%-ный раст вор в дейтерохлороформе): широкий синглет при 6,06, мультиплеты при 5,55 - 5,75в, 3,9, 2 - 2,8 в, 1,1 -2,03, ЯУблет при 0,92(Si
40 7- 5-(З-гидроксиундец-1-енил)-2оксоциклопентил - гептановая кислота. Пример 30. По методике примера. 5 j используя в качестве элюента Иидентичную смесь растворителей, 7| 5- (3-гидрокси-7-метилокт-1-енил) 2-оксоциклопентилI - гептановую кислоту (440 мг; получена по примеру 8) разделяют на два диастереоизомера 7- 5-(3-гидрокси-7-метилокт-1-енил)2-бксоциклопептил - гептановой кислоты с помощью препаративной тонкослойной хроматографии на сЗиликагеле. Изомеры обозначены как компонент ЗОа (ближе от начала Х{:)омотограммы; 70 мг) и компонент 30 в (дальше от начала хроматограммыу 50 мг) соответственно . Компонент ЗОа перекристаллизовывают из смеси диэтилового эфира и гексана и получают белые кристаллы (50 мг) , т.пл. 62-63 с. ЯМР для компонента 30 а (приблизительно 10%-ный раствор в .дейтерохлороформе): дублет при 0,9 С -6цикл, вторичный), мультиплеты при 1,1 - 2,05, 5,5 - 5,IS и синглет при 6, 7S. Спектр ЯМР компонента 30 индентичен спектру компонента 30 а, за исключением синглета при 7,2 который в спектра компонента 30 а неблюдался при 6,75 (эти сигналы принадлежат водородным атомам гидроокиси и карбо,ксигрупп) . Пример 31. 7- (5-(3-ацетокс-4-пропилгепт-1-енил)-2-оксоциклопенти/ гептановая кислота. 7- (3-гидрокси-4-прсП1Илгепт-1енил-2-оксоциклопентил1-« гептановую кислоту (0,08 г, получена как описано в примере 28) растворяют в смеси уксусного ангидрида (3 мл) и безводного пиридина (3 мл). Полученный раствор выдерживают, прц, комнатной температуре три дня, затем добавляют к смеси льда и воды (30 мл). Смесь экстрагируют диэтиловым эфиром, эфирные вытяжки промывают 2 н. соляной кислотой, затем водой и сушат над безводным сульфатом магния. Раствор выпаривают досуха, остаток /Очищгиот при помсяди препаративной тонкослойной хроматоргафии на силикагеле с использованием в качестве элюента смеси этилацетата циклогексана и 90%-ной муравьиной кислоты (200:200:5 по объему). Получают 7- {5-(3-aцeтoкcи4-пpoпилгeпт-l-eнил) -2-оксоциклопентил|гептановую кислоту (39 мг). Найдено,%: С 70,8; Н 10,0 - sВычислено,%: С IQ.j Н 9,9. В спектре (прийлизнтельно 10-ный аствор в дейтерохлороформе) бнаружены следующие пики/ широкий инглет при 9,Iff, мультиплеты при 5,2 - 5,85, 1,0 - 2,65, синглет при ,1Ь - триплет при Q,9QS,
41 Пример 32. Раствор 7- (5-этокс::-3-гидроксипентг1-енил) -2-оксоциклопентил - гептановой кислоты (0,27 г, получена как описано в примере 29,|Г1 в сухом пиридине (8 мл обрабатывают уксусным ангидридом (8 Полученный раствор выдерживают при температуре окружающей среды в течение трех дней, затем разбавляют водо охлаждая н ледяной бане. Полученный водный раствор трижды экстрагируют хлороформом, вытяжки сушат над сульф том натрия. После отгонки в вакууме применена тонкослойная хроматография иа силикагеле с использованием в качестве элюента смеси (40:40:1 по объему) этилацетата, циклогексана и 90%-ной муравьиной кислоты для выделения 7- f5-(З-ацетокси-5-этоксипент 1-енил)-2-оксоциклопентил - гептанов кислоты (0,1 г). Найдено,%: С 66,1; Н 9,1, Cj. . Вычислено,%: С 65,9; Н 9,6. . 1240, 1700, 1730 , ЯМР (приблизительно 10%-ный раст вор в дейтерохлороформе): триплет при 1,206 (3-7ЦИКЛ, вторичный) мультиплет при 1,1 - 2,66, синглет при 2,05ff , мультиплеты при 3,55, 5,2 - 5,8 , синглет при 9 ,0 в. По аналогичной методике при заме не исходных уксусного ангидрида и 7- t 5- (5-этокси-3-гидроксипент-1-енил) -2-оксоциклопентил --гептановой кислоты соответствующими количествами маеляного ангидрида и 7- (5-(3-гидpoкcи-7-мeтилoкт-l-eнил) -2-оксоциклопентил гептановой кислоты (получена как описано в пример 8) синтезирована 7- Ь (3-бутирилокси-7-метилокт-1-енил)-2чэксоциклопентил - гептановая кислота Найдено,%: С 71,0; Н 10,4. 2S 42°S Вычислено,%: С 71,1; Н 10,0 мо«. 975, 1700, 1725 см ЯМР (приблизительно 10%-ный раствор в дейтерохлороформе) : триплет при О , 9 & (3 -7цикл, вторичный) дублет при 0,88 5 (Э -6 цикл, втори ныР), мультиплеты при 1,0 - 2,68, 4,9 - 5,78-, По ЭТОЙ же методике при замене исходной 7- 5-(5-этокси-З-гидроксипент-1- енил)-2- оксоциклопентил гептановой кислоты соответствующим количеством компонента 5а 7- {5-(3гидрокси-4-метилокт-1-енил)-2-оксоциклопентил - гептановой кислоты ( получена как описано в примерю 5) синтезирован компонент 32а. 7-{5-(3-ацетокси-4-метилокт-1-енил)-2оксоциклопентил}- гептановой кислоты - tViKC. 975, 1240, 1700, 1715, 1725 см Из компонента 5 7- {5-(3-гидрокси-4-метилокт-1 -енил)-2-оксоциклопентил гептановой кислоты получен компонент
42 32/в 7- {5-(3-ацетокси-4-метилокт-1енил)-2-оксоциклопентил}-гептановой кислоты. Найдено,%: С 69,9; Н 10,1 i CjjHjjOj . Вычислено,% С 70,0 Н 9,7, 975, 1240, 1700, 1725 см . ПримерЗЗ. По методике примера 5 7- {5-(З-гидрокси-4,4-диметилгепт 1-енил)-2-оксоциклопентил|-гептановую кислоту очищают и разделяют .на два компонента ( представляющие собой, по-видимому, две диастереоизомерных пары знантиомеров) компонент ЗЗа, Сближе к старту) и компонент ЗЗв (дальше от старта). В ЯМР - Спектре компонента ЗЗа (приблизительно 10%-ныР раствор в дейтерохлороформе) наблюдались сигналы: мультиплеты при 0,7 - 1,056, 1,05 2,, 3,75- 3,96 и 5,5 - 5, и, синглет при 6,15 , ЯМР-спектр компонента ЗЗв пра ктически аналогичным. П р и м е р 34. По методике примера 5, 7- {jj-( З-гидроксигепт-1-енил)-2 - -оксоциклопен тил -гептановую кислоту (получена по примеру 8) очищают и разделяют на два компонента (по-видимому, две диастереоизомерных пары энантеомеров) компонент 34а (ближе к старту) и компонент 34в (дальше от старта). Компонент 34а перекристаллийовывают из смеси петролейного эфира (т.кип. 40-60С) и диэтилового эфира с образованием белых кристаллов, т.пл. 6870 0. Найдено,% С 70,4; Н 10,0. C HjjOeВычислено,%: С 70,3; Ч 9,9. ., 1685, 1705, 3475 см . ЯМР : синглет при 6,156, мультиплеты при 5,55 - 5,706-, 4,13,(S, 2,05 - 2,65-, и 1,08 - 2,056 и триплет при 0,91 в, Компонент 34в перекристаллизовывают из смеси петролейного эфира (т.кип. 40-60 С) и диэтилового эфира с образованием белых кристаллов, т.пл. 61-63 С Найдено,%: С 70,3; Н 10,4. макс 980, 1720, 3450 см-. ЯМР данные практически идентичны данным ЯМР компонента 34а. Пример 35. По методике примера 5 7- (5-(3-циклoлeнтил-3-гидpoкcипpoп-l-eнил)-2-оксоциклопентил} - гептановую кислоту (получена как описано в примере 4) очищают и разделяют на два компонента (представляющие собой, по-видимому, две диастереоизомерных пары энантиомеров). компонент 35а (ближе к старту) и компонент 35в (дальше от старта). Компонент 35а перекристаллизовывают из смеси диэтилового эфира и гексана с образованием белых кристаллов, т.пл. 67-69 С. Найдено,%: С 71,3; Н 9,9.
43 CjpHjjO . Вычислено,%: С 71,5; Н 9,83. ЯМР : широкий синглет при 6,065, мультиплеты при 5,5 - 5,7, 3,906 2 - 2,75 , 1,566- и 1 - 2fi. Пример 36. По методике , описанной впримере 5, 7- (5-(3-гидроксидец-1-енил)-2-оксоциклопентил1гептановую кислоту (получена как опи сано в примере 8) очищают и разделяют на два компонента (по-видимому, две диастереоизомерных пары энантиомеров) компонент Зба (ближе к старту) и компонент Збв (дальше от старта) . Компонент Зба перекристаллизойыва ют из смеси диэтилового эфира и гексана с образованием белых кристаллов т.пл. 83-85 С. Найдено,%; С 72,1; И 10,6; Сга з9 4 Вычислено, %: С 72,1; II 10,4. . 970, 1680, 1730, 3400 см ЯМР : широкий сигнент при 6,l5ff, мультиплеты при 5,5 - 5,73, 4,125 2- 2,78- и 1,05 -2(3, триплет при 0,89S. Компонент Збв выделили в виде мас ла. п р и м е р 37. По методике приме ра 5 7- (3-гидрокси-4-метилокт-1-енил-2-оксоциклопентил} - гептановую кислоту (получена по примеру 1) очищают и разделяют на два диастереоизо мерных компонента - компонент 37а (ближ к старту) и компонент 37в (дальше от старта). Компонент З а : Найдено,%: С 71,4; Н 10,6. С21 Hjg О. Вычислено,: С 71,6; Н 10,2. VMQKC , 975, 1380, 1700, 1730 см. Компонент 37в: Найдено,%: С 71,7; Н 10,6. макс. 975, 1380, 1700, 1730 c Вьделяют в виде масла. ПЕ1Имер 38. С помощью -тонкослойноП хроматографии на силикагеле, используя в качестве элюэпта смесь этилацетата, циклогексана и 90%-ной муравьиной кислоты (40:40:1 по объему), устанавливают, что 7- {5-(3-гид роксинон-1-енил) -2-оксоциклопентил1.. -гептановая кислота (получена как описано в примере-7) представляет собой смесь двух компонентов (очевидно диастереоизмерние пары энантиомеров) Компонент ближе к старту на хроматог рамме, компонент 38а выделен из смес при обработке гексаном, содержащим.н большое количество Диэтилового эфира полученное твердое вещество перекрис таллизовали из смеси диэтилового эфи ра и г.ексана с образованием белых кристаллов, т.пл. 93-95,. ЯМР (приблизительно 10%-ный раствор в- дейтерохлороформе) : триплет при
44 0,90, мультиплеты при 1,0 - 2,08, 2,0 - 2,85, 4,126-, 5,55 - 5,76-, синглет при 5,4(5, Пример 39. 7- {5-(3-гидроксидец-1-енил)-2-оксоциклопентил1- гептановую кислоту (получена как описано в примере 8) разделяют на два диастереоизомерных компонента с помощью хроматографии на колонке, заполненной силикагелем (100 г) в качест е элюента используют смесь этилацетата и толуола (20:80. по объёму). Контроль за фракциями осуществляют с помоц ью аналитической тонкослойной хроматографии, соответствующие фракции объединяют, выделяют первый компонент (имеющий большее Rf ) - компонент 39в, идентичный -по всем данным компонентуЗбв. Второй компонент (имеющий меньшее Sf ) -компонент 39а перекристаллизовывают из смеси диэтилового эфира и гексана с образованием твердого вещества, т.пл, 83-85 С, идентичного по всем данным компоненту Зба. Получена также смесь компонентов 39а и 39в. Пример 40. По методике примера 5, используя ту же смесь растворителей в качестве элюента, 7- {5-(3-гидроксиундец-1-енил)-2-оксоциклопентил)- гептановую кислоту (представляющую собой две диастереоизомерных пары энантиомеров) разделяют на два компонента - компонент 40а ( ближе к старту на хроматограмме) и компонент 40в (дальше от старта на хроматограмме) . Компонент 40а перекристаллизовывают из смеси дизтилового эфира и гексана с образованием белых кристаллов, т.пл. 56-58 С. Найдено,: С 73,0; Н 10,6. . Вьгчислено,%: С 72,6; Н 10,6. маКС . 970, 1690, 1730, 3400 Компонент 40в получен в виде масла. Пример 41. Раствор 7- {5-(3гидрокси-4, 4-диметилгепт-1-енил) -2оксоциклопентил - гептановой кислоты (0,82 г), получена примеру 20, Ш « S сухом циридине (15 мл) обрабатывают уксусным ангидридом (15 мл), полученный раствор выдерживают при температуре окружающей среды в течение трех дней, затем разбавляют водой при охлаждении на ледяной бане. Полученн1Лй водный раствор экстрагируют трижды хлороформом, объединенные вытяжки сушат над сульфатом натрия. После отгонки в вакууме получают 7- 5(З-ацетокси-4,4-диметилгепт-1-енил)-2оксоциклопентил - гептановую кислоту (0,57 г), из которой с помощью препаративной тонкослойной хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата, циклогексана и 90%-ной муравьиной кислоты (40:40:
45 1 по объему) выделяют некоторхэе коли чество (280 мг) более чистой 7- (5-(З-ацетокси-4,4-диметилгепт-1-енил) 2-оксоциклопентилI - гептановой кисло ты. Найдено,%: С 70,4; Н 10,2. CjjHjgOg. Вычислено,%: С 70,0; Н 9,7 «axt . 975, 1240, 1700, 1725 см ЯМР (приблизительно 10%-ный раствор в дейтерохлороформе); триплет при 0,92(9, мультиплет при 1,9 - 2,65, Shoes, 5,25 - 5,8 и синглеты при 2,08 в , 9,185. По аналогичной методике при замене исходной 7- 1 5-( З-гидЕЮКси-4 , 4-диметилгёпт-1-енил-2-оксоциклопентил -гептановой кислоты соответствующим количеством компонента 35а 7- 5-(З-циклопентил-З-гидроксипроп-1-енил 2-оксоциклопентил - гептановой кис лоты, полученного, как описан в при мере 35, синтезирована 7- ( 5-(3 ацетокси-З-циклопентилпроп-1-енил)-2-оксоциклопентил - гептановая кислота (0,110 г), иэ этой кислоты препаративной хроматографией на сили кагёле, используя в качестве элюента смесь диэтилового эфира, л -гексана и этилацетата (2:1:1 по объему), выделяют некоторое количество (0,063 г еолее чистой 7- { 5-(3-aцeтoкcи-3циклoпeнтилпpoп-l-eнил) -2-оксоциклопентил - гептановой кислоты. Найдено,%: С 70,1; Н 9,1. C22Hj405 . Вычислено,%: С 69,7; Н 8,9 , 900, 950, 975, 1240, П75, 170 1730 см . Пример 42. Компонент 37 7-|5 -(З-гидроксинон-1-енил)-2-оксоциклопеитил гептаиовой кислоты (62 мг получен как описано в примере 38) разбавляют гексаметилфосфорамидом (0,45 wi) и обрабатывают водным раст вором гидроокиси натрия (0,05 мл , 25%-ной)- После перемешивания в тече ние 2 час при комнатной температу-у ре добавляют уидецилбромид (0,159 мл и перемешивание продолжают в течение 24 час. Затем реакционную смесь дваж ды экстрагируют диэтиловым эфиром, объединенные эфирные вытяжки дважды промывают водой и сушат над безводнам сульфатом натрия. После отгонки в высоком вакууме избытка алкилгалог нида получают ундецил 7- { 5-(3 гидiюкcинoи-l-eнил)-2-oкcoциклoпeнти гептаноат (66 мл). Это вещество очищают с покющью препаративной тонкослойной хроматографии на силикагеле, испол ьзуя в качестве элюента смесь диэтилового эфира, и -гексана и этилацетата (2: 1:1 по объему), полу чают уидецил 7- { 5-(3-гидроксионон-1-енил)-2-рксоциклопентил - гептаноат (16 мг).
46 Найдено,%: С 75,9; Н 11,7. Cjj , Вычислено,% С 75,8; Н 11,53. По аналогичной методике при замене исходной 7- 5-(З-гидроксинон-1енил)-2-оксоциклопентил -гептановой кислоты соответствующими количествами 7- 5-(3-гидроксидец-1-енил)-2оксоциклопентилI - гептановой кислоты (компонент Зба) и 7-(5-( 3-гидрокси-4-метилокт-1-енил)-2-оксоциклопентил| гептановой кислоты (компоненты 37а и 37в) получены; Ундецил 7- {5-(З-гидроксидец-1-енил) 2- оксоциклопентил -гептаноат. На(дено,% С 75,9 Н ll,7i СЗЗ ко «4 ВьЛислено,%: С 76,1;н 11,6. JMOKC 975, 1170, 1730, 3450 см Компонент 42а-ундецил 7- {5-(3гидрокси-4-метилокт-1-енил)-2-оксоциклопентил - гептаноата. Найдено,%: С 75,6; Н 11,3. С« «М °4 Вычислено,%: С 75,8; Н 11,4. Компонент 42в - ундецил17- (5-(3гидрокси-4-метилокт-1-енил)-2-оксоциклопентил j - гептаноата. Найдено,%: С 75,7; Н 11,4. Компонент 42а и компонент 42в имеют разные Bi , что указывает на их различие в строении. По этой же методике при замене исходного ундецилбромида соотве ствующим количеством гексилбромида получки гёксил-7- 5-(З-гидроксинон-1-енил)2-оксоциклопентил}- гептаноат; Найдено,% С 74,1; Н 11,0. Вычислено,: С 74,3; Н 11,1 . По аналогичной методике при замене сходных ундецилбромида и (гидроксинон-1-енил)-2- оксициклопени/ гептановой кислоты соответствующии количествами гексилбромида и компоента Зба (З-гидроксидец-1-енил)-оксоциклопентил - гептановой кислоы синтезирован гексил 7- {5-(3-гидоксидец-1-енил)-2-оксоциклопентил -ептаноат. Найдено,%: С 74,8; Н 11,2 С28 50°4 . Вычислено,%: С 76,4; Н 11,19. Формула изобретения. Способ получения производных циклопентана общей формулы I - /пи, , 41 1-СИВ
47 где fif алкил с нормальной или разветвленной 1цепью, который может быть замещен алкоксилом, или представляет циклоалкил . , адамантил; водород, алкил, ацил; Rj- карбоксил, алкоксй арбонил Cj-Cjj. с нор 4альной или разветвленн цепью, карбомоил, незамещенный или замещенный одним или двумя алкилами карбазоил; И4 кислород, ОКСИИМИНО-, алкок с ними , гидра зоно группа, незамеще ная или замещенная двумя алкилами; RS - алкил, водород; X -щране-виниленовая или этиленовая группа; Л - целое число 5-8, о т л и чающийся тем, что ёнамин . цик пентанона общей формулы Д Л где RS вьшеук азанные значе ния, конденсируют с альдегидомобще формулы iTl КбО{ш)„С где п - вышесказанные значения Rg- водород или группа, отщеп ляемая при гидролизе, в среде инертного растворителя, например аромати ческого углеводорода, при 60-120с и непрерывном удалении образующейся воды, полученный при этом продукт гидролизуют в кислой среде, например соляной кислотой, изомеризуют нагреванием до под воздействием кис лоты, например соляной, в среде инер тного органического растворителя до образования соответствую1аего цикли ческого енона общей формулы 1 (СНа) г - выиеуказанные значения, который далее подвергают гидроциан рованию, например ацетонциангидрином в присутствии основания, например карбоната щелочного металла, в среде водного органического растворителя,
48 например метанола, при 50-1Ю С, полученный при этом кетонитрил общей формулы 5 (СН)пШ20Н CN где U п - вышеуказанные значения, этерифицируют затем спиртом или диолом в присутствии кислого катализатора, например п -толуолсульфокислоты, с непрерывной отгонкой воды, или кетонитрил подвергают взаимодействию с алкоксиамнном в присутствии основания до образования соответствующего ,кеталя или оксима, которые восстанавливают в низшем диалкиловом эфире при температуре от-80 до раствором гидрида металла, например диалкилалюминия, в ароматическом углеводороде до 2-(оксиалкил)-циклопентанальдегида общей формулы 1 -(CHalnCHgOH 0 где RS п - вышеуказанные ачения; А -«70 OR WORo Н С или С / где Я-у - одинаковые алкилы или оба есте замещенная или незамещенная иленовая группа; RB - алкил, подвергаемого далее взаимодействию фосфораном общей формулы /Т| ОзР СНСОК где QJ - фенил, алкилфенил, алкил, Sj - вышеуказанное значение, среде интертного органического растрителя, например тетрагидрофурана, и 20-100с окислению полученного предельного кетона общей формулы VIK -(СН2)„СН20Н где RJ , , А , п - вышеуказанные ачения, например трехокнсью хрои серной кислотой в среде диметил49
формамида, при температуре, например от -5 до , до циклопе таналкановой кислоты формулы ji
-(СН,)яСООК
..
R
о
где j , «5 I - п - вышеуказанные значения,
восстановлению оксогруппы соединения Д до гидроксила боргидридом металла в присутствии оспвКання, например
50
водной гидроокиси щелочного металла, и гидролизу кетальной группы оксиалкенилциклопентилалкановой кислоты, например разбавленной соляной кислотой, или обработке оксима кислоты ij .водноорганичёским раствором кислоты, .например уксусной кислоты и диоксана, и водным раствором треххлористого
титана в атмосфере инертного газа с JQ последукяцим выделением целевого продукта в виде спирта- или его простого или сложного эфира.
Источники информации, принятые во внимание при экспертизе:
к 1. Патент Великобритании 1163762 кл. с 2 С, 1969.
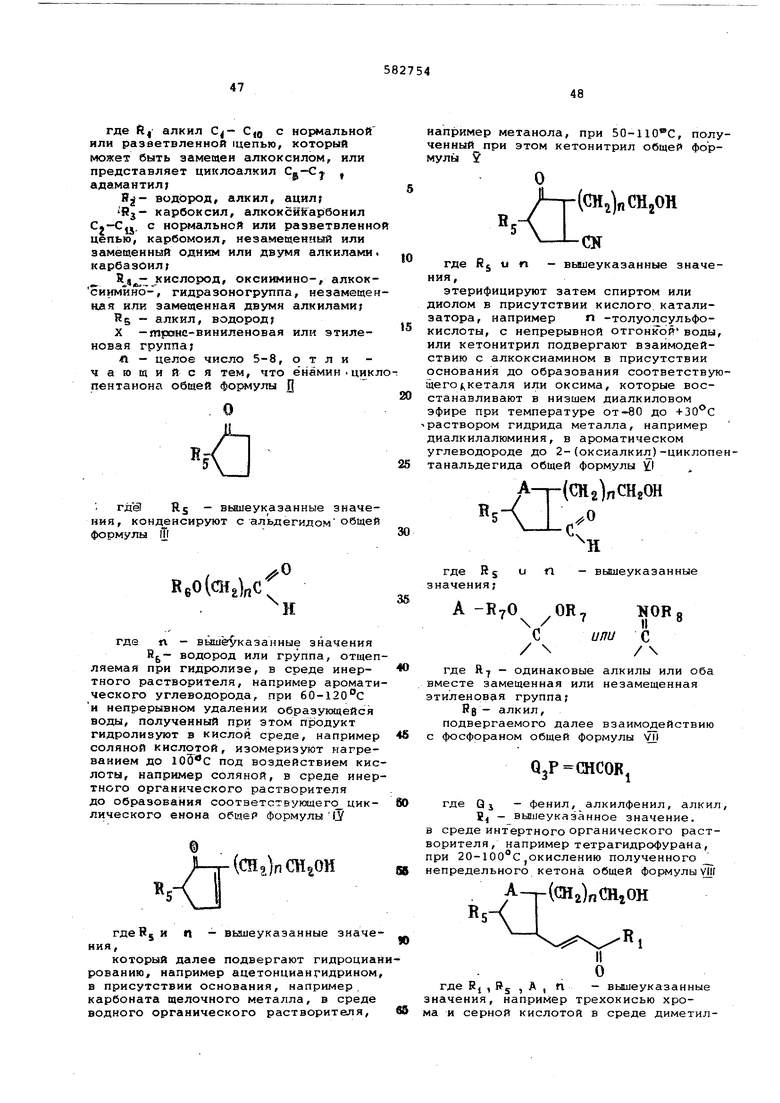
Авторы
Даты
1977-11-30—Публикация
1972-06-13—Подача