Соединения формулы 1 могут быть также получены взаимодействием 1,2-галоидкетонов с антибекзальдоксимом с последующим гидролизом промежуточно образующихся Н-(2-кетозамещенных)-ict-фенилнитронов по схеме ° О CHj
R-C-C-CH HON--CHC H5-.R-c-c-N CHC,H. 5
I СН; СНнее «з
R-C-C -NHOH-HC
i.H3
1,2-Галоидкетоны легко получают путем галоидирования соответствующих кетонов, синтезированных взаимодействием замещенных бензоловi с хлоангидридом изомасляной кислоты по Фриделю-Крафтсу.
Пример 1. N-(3-Оксо 2-метил-З-п-метилфенилпропил-2)-гидроксиламия гидрохлорид {Га}.
Сливают охлажденные растворы 31 (0,45 моль) солянокислого гидроксиламина в 75 мл воды с раствором 85 г (2,06 моль) NaOH в 150 мл воды ,Разбавляют полученный раствор 1 л мтанола, отфильтровывают осадок хлоритого натрия.К фильтрату при перемешвании добавляют в течение 1,5 ч (О,-6 моль) П метил-сС-бромизобутирофенона в 200 мл метанола, смесь кипятят 6 Реакционную массу упаривают, выпавший осадок oL-гидроксиламинооксима отфильтровывают,
Неочищен-ный оС-гидроксиламиноок сим Па смешивают с 60 мл концентрированной ЯС1 и кипятят 30 мин. Раствор охлаждают и отфильтровывают вы павший осадок гидрохлорида сб-гидроксиламинокетона 1а. Выход 89%, т.пл 137-139°С (из ацетонитрила), Ш спектр З(КВГ-): 1 675 см ( ) с Спектр ПМР (fljO): 1,97 (6Я, гем.-СЯ 2,43(ЗН CHjароматического кольца), 7,55 (4Н, сложный сигнал ароматических протонов).
Найдено, %: С 57,52; Я 7Д1; N5,83j се 15,38,
с H gNOgce.
Вычислено, %: С 57,30; Н 7,02; N6,10; се Д5,44.
Пример 2. М-(3-Оксо-2 метил-3-П-хлорфенилпропил-2)-гидроксиламин гидрохлорид (16).
В условиях примера 1 йз п-хлор-dL-бромизобутирофенона получают гкдрохлорид 172-гидроксиламинокетона 16 с выходом 75%, т.пл. 126127 С (из смеси этанола и эфира). ИК-спектр (KBr)s 1680 (0-С) . Спектр ПМР ()I 1,97 (6Я, гем. CHi), 7,58 (4Н, сложный сигнал ароматических протонов).
Найдено, %: С 48,03; Н 5,33, . N5,89; се 28,08,
.Вычислено, %: С 48,01; Н 5,24 г N5,60 се 28,35.
Пример 3. N-(2-Оксо-2-метил-З-П-фторфенилпропил-2) гидроксиламин гидрохлоркд (1в).
В условиях примера i из п-фтор-oL-бромизобутирофенона с вьлходрм 48% получают гидрохлорид 1,2-гидрок5 силаминокетона 1в, т.пл. 123-125°С (из смеси этанола и бензола). ИКспектр (КВГ ) : 1670 см () . Спектр ПМР (Д20) : 1,95 (6Я, гем.-СНэ) , 7,48 (4Я, сложный сигнал ароматиO ческих протонов).
Яайдено, %: С 51,12; Н 5,72; 5,71; се 14,88; F8,60.
13. f OgPce.
Вычислено, %: С 51,40; Н 5,57; 5 N5,99; се 15,18; F98,10.
Пример 4. Н-(3-Оксо-2-метил-3-п-метоксифенилпропил 2)-гидроксиламйн гидрохлорид (1г).
В условиях примера 1 из П-метокси-с6-бромизобутирофенона с выходом 60% получают гидрохлорид 1,2-гидроксиламинокетона 1 г, т.пл. 136-138°С (из смеси этанола и эфира). ИК- . спектр (КВг): () .Спектр ПМР (ДгО): 2,07 (6Н, гем.-СНд), 5 3,73 (ЗН, CHjO-), 7,68, (4Я, сложный сигнал ароматических протонов).
Яайдено, %: С 53,74; Я 6,48; N5,66; се 14,15-.
С Н- бМОзСе.
0Вычислено, %: С 53,76; Н 5,56;
N5,70: се 14,43. .
Пример 5. N-(З-Оксо-2-метил-З-п-оксифенилпропил-2) -гвдроксиламин гидрохлорид (1д).
5в условиях примера 1 из п-окси-сЛ-бромизобутирофенона с выходом 51% получают г щрохлорид 1, 2-гидроксиламинокетона 1д, т.пл. 172174°С (из смеси этанола и эфира).
40 ИК-спектр (KBh) |1675 () .Спектр ПМР (СДэ)2СО: 1,75 (6Я, гем.-СНд), 7,37 (4Я, ароматические протоны).
Найдено, %: с 52,61; Н 6,05; N5,68; се 14,99.
45 NOj
BfcI«иcлeнOf % С 52,31, Н 6,09; .N6,05; се 15,31.
П р и м е р 6. -(З-Оксо-2-метил-3 П-метилфенйлпропил-2)-гиарок50 силамин гвдрохлорид (1а),
В условиях примера 1 из п-метил. -оС-бромизобутирофенона с выходом 76% получают 1,2-гилроксиламинооксим 1 а, т.пл, 146-148С (из этанола). ИК-спектр (КВг): 1620 ).
.Спектр-ПМР() 1,23 (6Н, гем.СНд), 2,38 (ЗЯ, CHj ароматические колЬ|Ца) , 7,16 (4Я, сложный сигнал ароматических протонов .
Найдено, %:.С 63,40; Н 7,61; N13,50.
С
Вычислено, % С 63,50; Н 7,69 Nl3,50o
Гидролиз 1,2-гидроксила1 ноокси65 ма 1а. Смешивают 2 г 1,2-гидрокси5ламинооксима Па с 20 мл.концентрироданной НСе и кипятят 30 мин. По охлаждении отфильтровывают вьтавший осадок. По температуре плавления, спектральным характеристикам и данным элементного анализа полученное соединение идентично гидрохлориду 1,2-гидроксиламинокетона 1а Пример 7. N-(З-Оксо-2-метил-3-п-хлорфенилпропил-2)-гидроксиламин гидрохлорид (16), В условиях примера 1, из п-хлор-а1-бромизобутирофенона получают 1,2-гидроксиламинооксим Пб с выходом 69%, т.пл. 146-148°С (из этилацетата). ИК-спектр (КВг): 1610 см ().Спектр ПМР ():1,28 (бН, гем. -Са , 7,22(4Н, сложный сигнал ароматических протонов). Гидролиз 1,2-гидроксиламиноокси ма П 6 в условиях примера 6 дает с выходом 96% продукт, по температуре плавления, спектральным характеристикам и данным элементного ана лиза идентичный гидрохлориду 1,2гидроксиламинокетона 1 б. Пример 8. N-/3-OKCo-2-Meтил-3-п фторфенилпропил-2)-гидроксиламин гидрохлорид (1в). В. условиях примера 1 из п-фтор о(гбромизобутирофенона с выходом 70% получают 1,2-гидроксиламинооксим Ц в, т.пл..142-144°С (из этилацетата), ИК-спектр (KBV): 1605 см (С-Н) . Спектр ПНР (): 1,25 (6Н .гем. -CHj) , 7,22 (4Н, сложный сигнал ароматических протонов). Найдено, %: С 57,14; Н 6,24-; N13,34; F8,95 C-io Чь 2 2 Вычислено, %: С 56,78; Н 6,14; N13,21; F8,96. Гидролиз 1, 2-гидроксиламиноокси Ив в условиях примера 6 дает с вы ходом 98% продукт идентичный гидро хлориду 1,2-гидроксиламинокетона 1 Пример 9. N-(З-Оксо-2-метил-З-П-метилфенилпропил-2)-гидрок силамин гидрохлорид (1а). К охлажденному раствору этилата натрия из 1,15 г (0,05 моль) натри в 100 мл безводного спирта добавляют 6,05 г (0,05 моль) антибензальдоксима и перемешивают до полного растворения. К полученному раствор в течение 30 мин добавляют 12,9 г ;(0,05 моль) П-метил-оЬ-бромизобутирофенона. Смесь перемешивают 3 ч; при комнатной температуре, отделяют осадок NaBf и фильтрат полностью уп ривают. Получаютс -фенилнитрон (Па в виде кристаллизующегося масла. К 2 г неочищенного oL-фенилнитрона 1 а прибавляют 2 мл концентрирова ной НС6. При стйянии из раствора выпадает осадок, который отфильтровывают, сушат, растворяют в безводн спирте с кипятят в течение 2-3 мин Раствор в случае необходимости филь руют и поспе охлаждения разбавляют сухим эфиром,содержащим ЛС .Выпавший садок гидроллорида 1,2-гидроксиламинокетона 1а отфильтровывают. Вес Продукта 0,85 г,. (52%) т.пл. 137-1 (из ацетони рила). ИК-спектр (КБ ): 1675 (О-С) .Спектр ПМР (fljO) s 1,97 (6Н, гем.-СЯ,), 2,43, (ЗН,-СН, ароматические кольца), 7,55 (4Н, сложный сигнал ароматических протонов). Найдено, %: С 57,52; Н 7,11; N5,83; ее 15,83. С.Н Н вЫОгСЕ. Вычислено:,%: С 57,50; Н 7,02; N6,10; се 15,44. Пример 10. N-(3-OKCo-2-Meтил-3-П-хлорфенилпропил-2)-гидроксиламин гидрохлорид (16) . В условиях примера 1 из п-хлорбромизобутирофенона получают гидрохлорид 1 ,2-гидроксиламинокетона If с выходом 54%, т.пл. 126-127с (из смеси этанола и эфира). ИК-спектр (КВг): 1680 (0-С ). Спектр ПМР (ДгО): 1,97 (6Н, гем.-СИз), 7Г58 (4Н, сложный сигнал ароматических протонов). Найдено, %: С 48,03; Н 5,33; N5,89; Сг 28,08. Сю H,,,N02Ce. Вычислено, %: С 48,01; Н 5,24; М5,60; се 28,35. Пример 11. N-(3-Oкco-2-мeтил-3-П-фтopфeнилпpoпил-2) -гидрокеиламин гидрохлорид (1в). В условиях примера 1 из п-фтор-ct-бромизобутирофенбна получают гидрохлорид 1,2-гидрокеиламинокетона, 1в. Выход 49%, т.пл. 123-125°С (из меси этанола и бензола) . ИК-спектр (КВг ): 1670см ( ) . Спектр .ПМР (Д2О) : 1,95, (6Н, гем.СН-,,) , 7,48 (4Н, сложный сигнал ароматического протона). Найдено, %: С 51,12; Н 5,72; Ы 5,71; Сг 14,88; F 8,60. H,,N02CE F. Вычислено, %: С 51,40; Н 5,57; N 5,99; се 15,18; F 8,10. Пример 12. N-(3-Oкco-2-мeтил-3-п-мeтoкcифeнилпpoпил-2) -гидроксиламин гидрохлорид (1г). В условиях примера 1 из п-метокси-Л.-бромизобутирофенона получают гидрохлоркд 1, 2-г.-удроксиламинокетона (1г). Выход 60%, т.пл. 136-138°С (из смеси этанола и эфира) . ИК-спектр (KBt-) : 1680 см (О С ). Спектр ПМР (ДгО): 2,07 (6Н, гем.-СИд), 3,73 (3H,-OCHJ, 7,68 (4Н, сложный сигнал ароматических протонов). Найдено, %: с 53,74; Н 6,43; N5,66; се 14,15. С H gNOgCE . Вычислено, %: С 53,76; Н 6,56; N5,70; се 14,43. П р И м е р 13. М-(3-Оксо-2-метил-З-П-оксифенилпропил-2) -riuipoксиламин гидрохлорид (1д). В условиях примера 1 из п-окси-сС-бромизобутирофенона получают гид рохлорид 1,2-гидроксиламинокетона 1д. Выход 51%, т.пл. 172-174°С) (из смеси этанола и эфира). ИК-спектр (KBt-) : 1675 ( ). Спектр ПМР (Cfl,)j,CO: 1,75 (бН, гем.-Ciy, 7,37 (4Н сложный сигнал ароматических протонов). Найдено, %: С 52,61; Н 6,05 N5,68; се 14,99. C oH NOjCe. Вычислено, %: С 52,31; Н 6,09; N 6,05; се 15,31. При мер 14. N-(З-Оксо-2-метил г-3- -тиенилпропил-2- (гидроксиламин гидрохлорид (1ж)., В усло,виях примера 1 из с -тиенил -cJL-бромизобутилокетона получают гид рохлорид 1,2-гидроксиламинокетона 1ж. Выход 48%, т.пл. 142-144С (изсмеси этанола и эфира). ИК-спектр (КВг ) : 1660 (О-С) , Спектр ПМР () : 1,77 (6Н, гем.-СН), 7,40 (ЗН, сложный сигнал тиенительного остатка) . Найдено, %: С 43,21; Ц 5,37; N 6,12; се 16,01 ; S 14,43.. NOaCeS. Вычислено, %; С 43,34; Н 5,49; N6,32; се 15,99; 514,43. Приме р -15. М-(3-Оксо-2-ме тил-3- (3, 4 -диметоксифенил) -пропил-2)-гццроксиламин гидрохлорид (1е) . В условиях примера 1 из (,4-диметокси-сХ--бромизобутирофенона п лучают N-(1-кето-1-(З, 4-диметокс фенил) -2-метилпропил-2) -оС-фенилнит рон Пе. Выход 49%, т.пл. 153-155°С (этанол). . Найдено, %: С 69,59; Н 6,31; N4,16. «2-1 . . Вычислено, %: С 69,70; Н 6,47; N 4 , 28 . Гидролиз с -фенилнитрона Па. Встр хивают 1 г сС-фенилнитрона Йе 5 мл концентрированной нсе и 10 мл этило го эфира в течение 5 мин. К смеси добавляют 15 мл воды. Эфирный слой отделяют, кислотный слой экстрагируют еще раз. Кислый слой .нейтрализуют содой до рН 7-8. Выпавший осадок растворяют в 15 мл сухого эфира, в полученный раствор пропускают сухой хлористый водород. Выпавший осадок гидрохлорида 1,2-гидроксиламинокетона 1е отфильтровывают. Выхо 98%, т.пл. 151-153°С (из этанола). Найдено, %: С 52,54; Н 6,86; N5,06; се 13,05. С(2 се . Вычислено, %; С 52,30; Н 6,57; КБ,07; се 12,85. Результаты биологических испытаний свидетельствуют о том, что внов синтезированные соединения обладаю выраженной нейротропной активностью стимулирующего типа. Эти соединени вызывают выраженное возбуждение животных, усиливают двигательную ориентировочную активность, повышают интенсивность, скорость выполнения рабочей нагрузки с последующим периодом истощения и сравнительно бьлстрым восстановлением работоспособности. Токсичность предлагаемых соединений приведена в табл.1. Таблица Влияние на поведение животных. Все синтезированные вещества .обладают свойствами психостимуляторов. Уже в небольших дозах (0,5-2 мг/кг) они вызывают возбуждение животных, усиление их двигательной активности, реакций на раздражители. С повышением доз до 10-50 мг/кг признаки стимуляции центральной нервной системы усиливаются, присоединяется стериотипий, гипергидроз, саливация, экзофтальм, учащение дыхания. В дозах выше 100 мг/кг иногда отмечаются судорожные подергивания. При введении животным токсических доз гибель наступает при явлениях резкого возбуждения ЦНС и судорогах. Наиболее выраженными психостимулирующими свойствами обладают вещества 1, 1в, 1д, 1г, 1ж. . Длительность стимул.ирующего действия зависит от дозы препарата. Малые дозы (0,5-2 мг/кг) вызывают заметное возбуждение животных на 30-40 мин, при повышении доз возбуждагадее действие длится 1,5-3 ч. По сравнению с фенамином возбуждающий эффект гидроксиламинокетонов развивается быстрее и оказывается менее длительным. BJ ияниe на ориентировочную двигательную активность. Исследуют действие всехсинтезированных веществ на двигательную ориентировочную активность. Измерения проводят дважды: через 20 и 60 мин после введения вещества. Мышей на 10 мин помещают в регистратор двигательной активности ДАЭР-20. Исследованные вещества
стимулируют двигательную ориентировочную активность, но через 1 ч после введения их стимулирующая .активность заметно снижается (табл.2.). Т а- б л и ц а 2



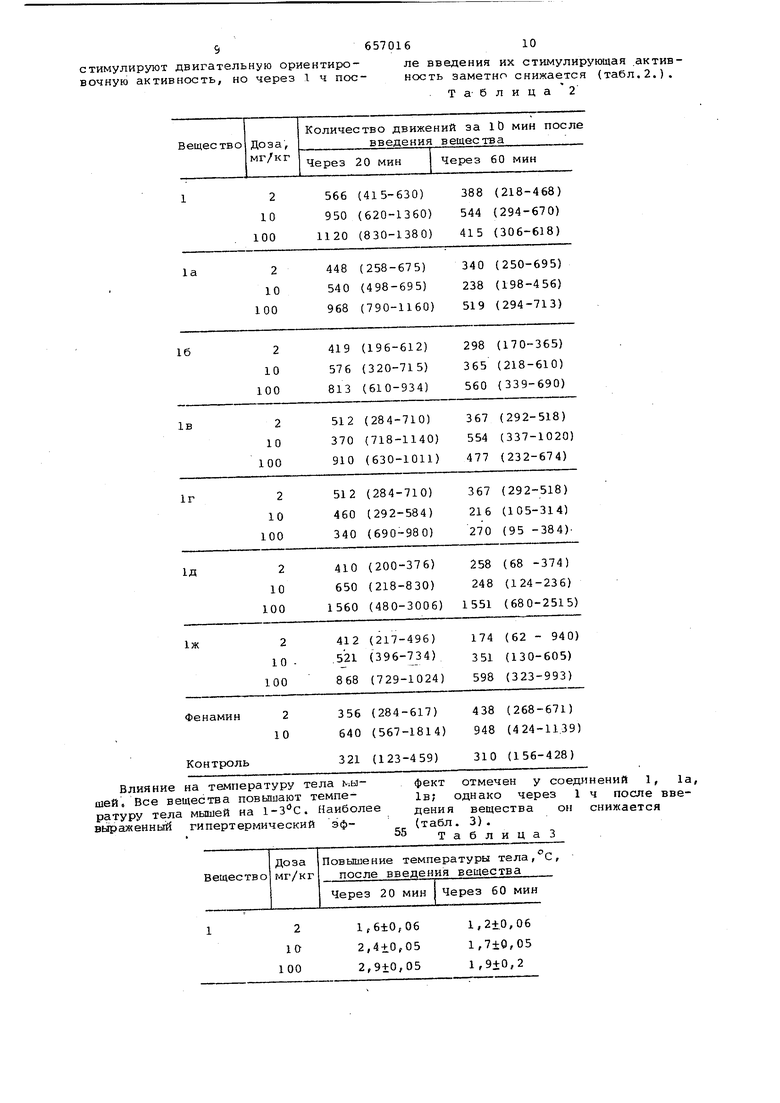
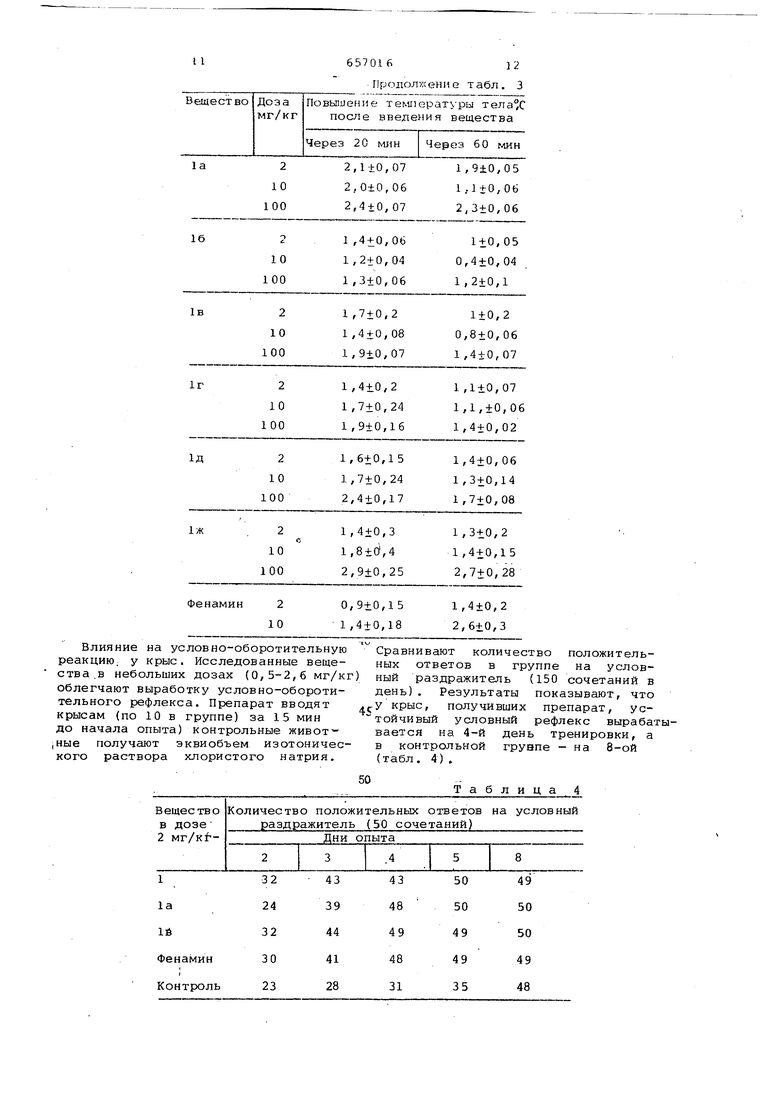




Влияние на температуру тела i-.aшей. Все вещества повьпцают температуру тела мышей на l-Зс. Наиболее выраженный гипертермичеокий эффект отмечен у соед 1нений 1, la, IB; однако через 1 ч после введения вещества он снижается (табл. 3) .
55
ТаблицаЗ
Влияние на условно-оборотительнуюСравнивают количество положительреакцию. у крыс. Исследованные веще-них ответов в группе на условства.в небольших дозах (0,5-2,6 мг/кг)ный раздражитель (150 сочетаний в
облегчают выработку условно-обороти-день). Результаты показывают, что тельного рефлекса. Препарат вводят крысам (по 10 в группе) за 15 мин
до начала опыта) контрольные живот вается на. 4-й день тренировки, а
,ные получают эквиобъем изотоничес-в контрольной грувпе - на 8-ой
кого раствора хлористого натрия.(табл. 4).
-У крыс, получивших препарат, ус тойчивый условный рефлекс вырабатыТ а б л и ц а
KfftJcaM с выработанным условно-оборонительным рефлексом вводят испытуемые вещества и через 30 мин определяют длительность латентного периоца реакции. Вещества приводят к укоКонтрольВлияние на количество потребляемой пищи. Используют вещества 1, 1а, 1в, фенамин. Все препараты существенно уменьшают количество потребляе мой пищи. При этом крыс-самцов предварительно {7 дней) обучают употреблять подслащенное молоко из граДуированного сосуда. Затем устанавливают режим: ежедневно с 12 до 16 чаФенс1мин
Контроль
рочению латентного периода в малых дозах; высокие дозы затрудянют выполнение .условной реакции в силу выраженного возбуждения,двигательного беспокойства,стереотипии (табл.5).
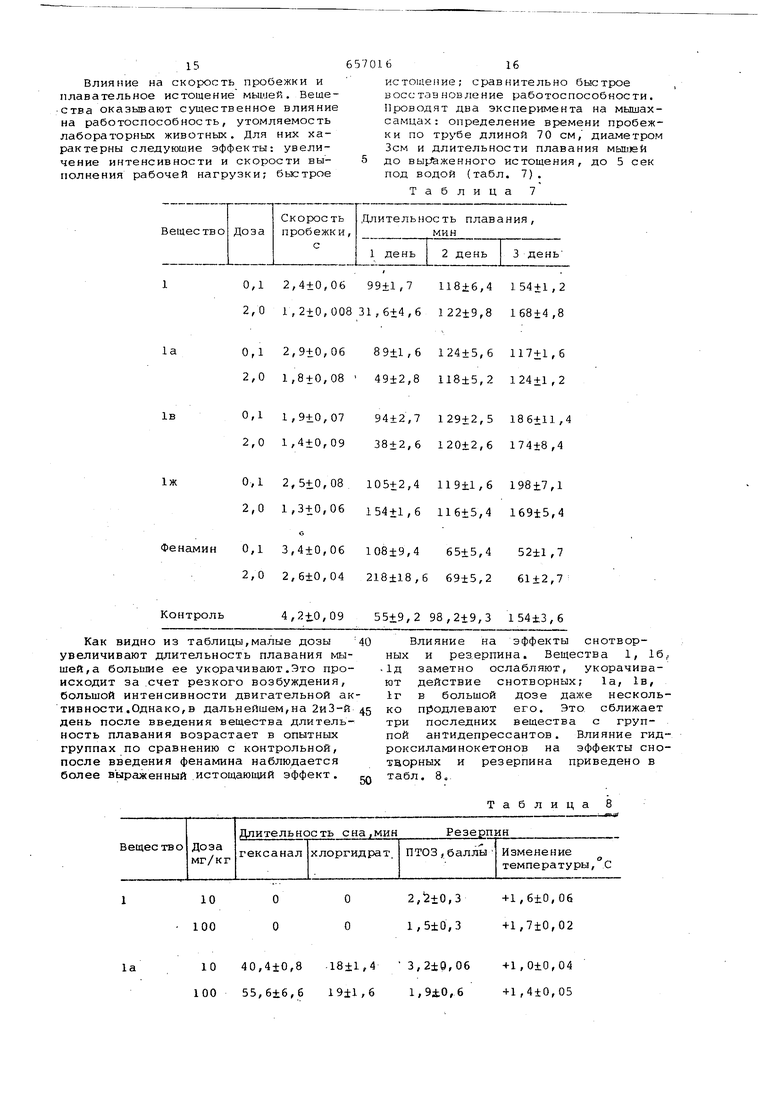
Таблица 5 0,04 сов на 4 ч обычную кормушку заменяют градуированным сосудом с молоком. В течение 4 дней ежедневно отмечают количество потребляемого молока. На 5 день за 20 мин до замены ко ллушки опытные группы получают испытуемое вещество, контрольные - физиологический раствор.Определяют количество потребляемого молока в мл/кг (табл.6X (Таблица 6 15 Влияние на скорость пробежки и плавательное истощение мышей. Вешества оказьшают существенное влияние на работоспособность, утомляемость лабораторных животных. Для них характерны следуюш.ие эффекты: увеличение интенсивности и скорости выполнения рабочей нагрузки; быстрое
0,1 2,4±0,06 99+1,7 118±6,4 154±1,2 2,0 1,2±0,008 31,6+4,6 122±9,8 168+4,8
0,12,9+0,06 89+1,6124±5,6117+1,6
2,01,8+0,08 49±2,8118±5,2124±1,2
0,11,9+0,07 94+2,7129+2,5186+11,4
2,01,4+0,09 38±2,6120±2,6174±8,4
0,12,5+0,08105+2,4119+1,6198±7,1
2,01,3+0,06154+1,6116+5,4169±5,4
О
амин
0,13,4±0,06108±9,465+5,452±1,7
2,02,6+0,04218±18,669±5,261+2,7
Контроль
4,2+0,09 55+9,2 98,2+9,3 154±3,6 Как видно из таблицы,малые дозы увеличивают длительность плавания мышей,а большие ее укорачивают.Это происходит за счет резкого возбуждения, большой интенсивности двигательной ак тивности .Однако, в дальнейшем,на 2иЗ-й день после введения вещества длительность плавания возрастает в опытных группах по сравнению с контрольной, после введения фенамина наблюдается более выраженный истощающий эффект.
о о
о о
10 100
10 40,4±0,8 18±1,4 3,2±0,06+1,0±0,04
1а
100 55,6+6,6 19±1,61,9±0,6+1,4±0,05
2,2+0,3
+1,6±D,06 +1,7±0,02 1,5±0,3 6 истощение; сравнительно быстрое восстав новление работоспособности. Проводят два эксперимента на мышахсамцах: определение времени пробежки по трубе длиной 70 см, диаметром 3см и длительности плавания мыикй до высиженного истощения, до 5 сек под водой (табл. 7). Таблица 7 Влияние на эффекты снотворных и реаерпина. Вещества 1, 16, 1д заметно ослабляют, укорачивают действие снотворных; 1а, 1в, 1г в больщой дозе даже несколько продлевают его. Это сближает три последних вещества с группой антидепрессантов. Влияние гидроксиламинокетонов на эффекты снотворных и резерпина приведено в табл. 8«Таблица 8
1035±7,5 11±G,8
IB
10060, 5±1 ,2 16±. , б
1041,5+6,4 15+42,6+0,09-0,9-1 + 0,12
Ir
10061,5i-i2,4 19 + 2,61,6+0,07--0,35+0,06
1031+6,4 12+1,51,9+0,12
1Д
10020,1+2,801,6+0,09
1019,4+1,7 6+0,41,4+0/07-0,9+0,12
1Ж
100-001,0+0,07+0,8+0,04
Фенамин
iU
40,7 + 2,9 1 ,.7±2, 5
Контроль Вещества 1, la, 16, Ir, 1ж усилрюают эффект апоморфика, ареколина - стимуляторов дофамин н линергических структур мозга, Все синтезированные вещества не влияют или усиливают действие судорожных агентов-коразола и максимального элек трошока Влияние на севдечно-сосудистую систему, периферические редепторные CHCTefviKi изучают на крысах, наркотизированных уретаном (50 MF/КГ). Артериальное давление измеряют в течение 2,5 ч . В дозах до 2 мг/кг вещестЕа, вызьлвают непостоянные изменения АД и частоты сердечных сокращен1 И. Все же имеется тенденция к дв осфазному эффекту; вначале депрессорная реакция (на 8-15 №.1 рт.ст.), затем повгл1 ение АД до исходного уровня и более, высоких цифр (на 10-15 рт Доза 5 мг/кг приводит к четкому двухфазному эффекту, депрессорная реакция длительностью 82+3,8 с сме ется npeccopHoli реакцией 394±24 с ,после чего АД возращается к норме. Отмечается учащение серп.ие6иения и дьжания, Б дозе 10 мг/кг и выше преобладает депрессорная реакция. Наиболее вь фажен указанный эффект у препаратов 1, 1а, 1в, 1д, 1
2,0±0,06
+1,4±0f02
-0,9±0,06 -0,4x0,04
1,2+0,07
-1,9+0,2 Изучено влияние на сокращение изолированных органов (матки и vas 4е егет15) 7 веществ 1 и IB. ВконueiiTpaunH 10 , они угнетают спонтаг ную активность миометрия на 30%f снижают ответ миометрия на ацетилхолино Оба эффекта быстро исчезают после отмывки. Таким образом предлагаемые гидроксиламинокетонЕл являются биологически активными веществами, обладаюЩИГ.1И выраженной нейротропной психотропной активностью. Формула изобретения Производные 1,2-гидроксиламинокетонов общей формулы 1 О сн. « 1 i R-C-C -ННОН HCt, i-cio), се где R ; СНар .а/ . jLan HO-/O -n v, cH, , s V yСНо О -обладакхдие нейротропноР активностью. 19 Источники информации, принятые во внимание при экспертизе 1. Авторское свидетельство СССР 333159,кл. С 07 С 49/00, 1972, 65701620 2. М.В.Рубцов, Л,Г.Байчиков. Сиктетические химико-фармацевтические препараты, 1971, Н., с, 38. 3, Л,Б, Володарский и др. ЖОРХ, 2,114 (1966).
Авторы
Даты
1979-04-15—Публикация
1976-11-15—Подача