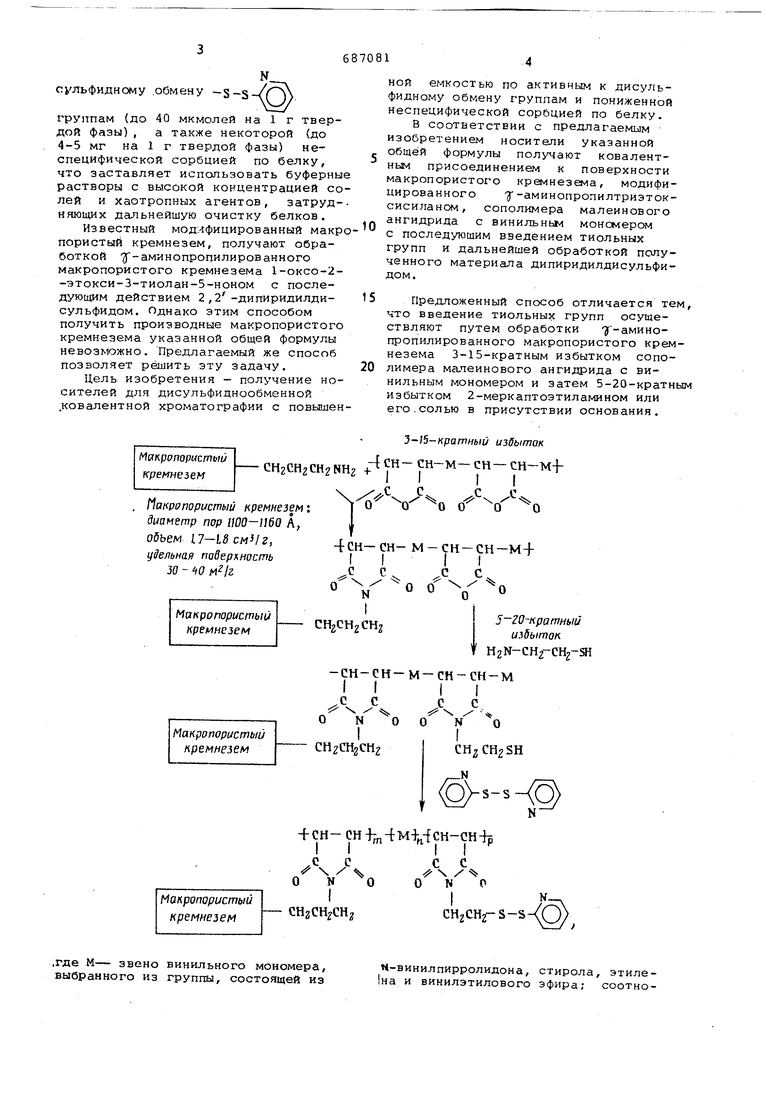
-макропористый кремнезем с диаметром пор 1100-1160 А, объемом пор 1,71,8 см/г, удельной поверхностью 30-40 м2/г,
где М - звено винильного мономера, выбранного из группы, состоящей из N-винилпирролидона, стирола, этилена и винилэтилового эфира,
и способу получения такого носителя.
Дисульфиднообменная ковалентная хроматография - недавно разработанный метод для тонкой очистки белков и иммобилизации ферментов.
Известен модифицированный макропористый кремнезем, имеющий на поверности группы
N
-(сн2)з-NHCO - смг - S - S-/QV-,
и способ его получения 1.
Известный носитель для дисульфиднообменной ковалентной хроматографии на основе модифицированного химически макропористого кремнезема .обладает недостаточно высокой эффективной емкостью по активнь к дисульфидному .обмену -S-S-/(j группам (до 40 мкмолей на 1 г твердой фазы), а также некоторой (до 4-5 мг на 1 г твердой фазы) неспецифической сорбцией по белку, что заставляет использовать буферны растворы с высокой концентрацией со лей и хаотропных агентов, затрудняющих дальнейшую очистку белков. Известный модифицированный макр пористый кремнезем, получают обработкой ЗГ-аминопропилированного макропористого кремнезема 1-оксо-2-этокси-З-тиолан-5-ноном с последующим действием 2,2-дипиридилдисульфидом. Однако этим способом получить производные макропористого кремнезема указанной общей формулы невозможно. Предлагаемый же способ позволяет решить эту задачу. Цель изобретения - получение носителей для дисульфиднообмснной ковалентной хроматографии с повыше
акропористый
снгснгснгннг + кремнезем
Макропористый кремнезем; диаметр пор UOO-U60 А, объем l7-LScM4z,
4СН-СН- М-СН-СН-М + уЗельная поверхность 30 4(7
Макропористый
СН2СН2СН2 кремнезем
-сн-сн-м-сн-сн-м
. с
- / ч
о N 00 ко
акропористый
снгшгснг кремнезем
-f-CH- CHiTn-t-M n-fCH-CH-Jp
,с с X ч о N о
Макропористый
- CHzCH CHg кремнезем
.где М- звено винильного мономера, выбранного из группы, состоящей из
З-15-кратныи избыток А СН- СН-М- СН- СН-M-f
I
.С.
I I I I
с рее
5-20-кратный
избыток. H2N-CH2-CH2-ai
II II
CH2CH2SH
,. -ч
N-,
--€,
s
К-винилпирролидона, стирола, этиле1на и винилэтилового эфира; соотноной емкостью по активным к дисульфидному обмену группам и пониженной неспецифической сорбцией по белку. В соответствии с предлагаемым изобретением носители указанной общей формулы получают ковалентным присоединением к поверхности макропористого краинезема, модифицированного -аминопропилтриэтоксисилансм, сополимера малеинового ангидрида с винильньм мономером с последующим введением тиольных групп и дальнейшей обработкой полученного материала дипиридилдисульфидом. Предложенный способ отличается тем, что введение тиольных групп осуществляют путам обработки минопропилированного макропористого кремнезема 3-15-кратным избытком сополимера малеинового ангидрида с винильным мономером и затем 5-20-кратным избытком 2-меркаптоэтиламином или его.солью в присутствии основания. Ье-ние in :n:p- 1:2-10:1. Продукт используют в качестве носителя днсульфиднообменной ковалентной хроматографии белков . В примерах описывается получение и использование новых носителей для дисульфиднообменной ковалентной хроматографии белков. Пример 1. Получение носител модификацией макропористого кремнезе сополимером малеинового ангидрида и Н-винилпирролидона (соотношение анги ридных звеньев полимера и ак.;.ногруп носителя 3:1). 3,0 г (1,23 ммоля аминогрупп) аминОсШкилированного макропористого кремнезема прибавляют , к раствору Q ,11 г (3,69 ммоля ангидридных звеньев) сополимера малеинового ангидрида и винилпирролидона (соотношение мономеров 1:1; мол.вес. 6000 7000) в 6 мл сухого диметилформамид и перемешивают реакционную массу 3 ч при 50-60°С.. Жидкую фазу отделяют декантацией и промывают носитель диметилформамидом до тех пор, пока показатели преломления чистого раств рителя и промывок не станут одинаковы ми. Затем носитель промывают ацетон (3x20 мл), эфиром (3x20 мл) и сушат вакууме: над с, в вакууме: над Р О . Кислотно-основно титрование ангидридных звеньев, привитых к твердой фазе, дает 0,14 г/пио ля на 1 г твердой фазы. ИК-спектр модифицированного носителя (таблетка измельченного в порошок вещества в КВч) показывает появление по сравнени с аминоалкилированным кремнеземом полос при i860 и 1780 см , свойственных насыщеннЕлм ангидридам с пятичленным циклом. 3,0 г полученного материала суспендируют в 8 мл раствора 2,8 г гидротартрата 2-меркаптоэтиламина в пир дине и перемешивают 3 ч при комнатн температуре. Далее носитель промываю пиридином (3x20 мл), 0,1 н. НСе (3x20 мл), дистиллированной водой (4x50 мл), ацетом (4x30 мл), диметилформамидом (3x20 мл) и суспендируют в 5 мл раствора 0,8 г 2,2-дипиридилдисульфида в диметилформам де. Перемешивают 6 ч при комнатной температуре. Жидкую фазу отделяют декантацией, а носитель промывают диметилформамидом (5x20 мл), абсолютн спиртом (5x20 мл) и сушат в вакуумоксикаторе над NaOrf. Количество активных к дисульфидному обмену групп, определенное спектрофотометрированием выделившегося при исчерпывающем восстановлении навески носителя 2-тиопиридона, составляет 80 мкмолей N групп на 1 г твердой фазы .Пример 2. Получение носител модификацией макропористого кремнезе ма сополимероги малеиьгового ан r-nj::iiH;.:i и Ь-Бинилкирролидона (соотношение ангидридных звеньев полимера и аминогрупп носителя 15:1), 3,0 г (1,23 MMOJ:R аминогрупп) а№1ноалкилированного макропористого кремнезема прибавляют к раствору 3,85 г (18,45 М74оля ангидридных звеньев) сополимера малеинового ангидрида и N-винилпирролидона (соотношение мономеров 1:1; -л-юл.вес, 8000-10000) в 15 мл сухого диметилформамида и перемешивают реак1 монную массу 3 ч при 50-бОс. Далее носитель промывают так же, как в тгримере 1, и сушат в вакууме над к, Кислотно-основное титрование ангидридных звеньев, привиты;; к твердой фазе, дает 0,16 ммоля на 1 г твердой фазы, ИК-спектр полученного продукта содержит полосы при 1860 и 1790 , свойственные насыщенным ангидридам с пятичленным циклом. Затем 3,0 г полученного вещества обрабатывают как в примере 1, но гидротартрат 2-меркаптозтиламина вводят в реакцию в количестве 14,0г а 2 , 2-дипир}удилдисульфид в количестве 3,0 г. Емкость полученного носителя ПО ккмолей г твердой фазы. Примерз, Получение носителя модификацией макропористого кремнезема сополимером малеинового ангидрида и стирола. 3,0 г (1,23 ммоля аминогрупп) аминоалкилированного макропористого кремнезема прибавляют к раствору 0,75 г (3,69 ангидридных звеньев) сополимера малеикового ангидрида со стиролом ( соотношение мономеров 1:1,5; мол,вес. 700011000) в диметилформа-.щде и перемешивают 3 ч при 60-70 0; Далее носитель промывают как в примере 1 и сушат над Кислотно-основное титрование ангидридных звеньев, привитых к твердой фазе, дает 0,21 ммоля на 1 г твердой фазы, Ж-спектр полученного продукта содержит полосы -- - iпри i860 и 1790 см , свойственные насыщенным ангидридам с пятнчленным цикле.-.;. Далее 3,0 г полученного вещества суспендируют в 8 мл раствора 1,0 г 2-меркаптоэтиламина в диметилотэмамиде и перегг1б511ивают 3 ч при комнатной температуре. Затем носитель ромывают диг-ктилформамидом (3x20 мл), пиртом (3x20 мл), листиллированной одой (3x20 мл), буферяь раствором; 0,1 М Трис/НСе - 1 ммоль ЭЛТА, Н 8,0 (3x10 мл) и суспендируют в мл указанного буфера, К суспензии обавляют 5 мл раствора 1,2 г 2,2дипиридилдисульфида в диметилформ/иде и перемешивают реакционную
массу 6 ч при комнатной температуре Жидкую фазу отделяют декантацией, а носитель промывают реакционным растворителем (100 мл), водой (200 ,мл) спиртом (100 мл) и сушат целевой продукт в вакуум-эксикаторе нзд NaOH. Емкость полученного ноN s-s
сителя 150 г мoлeй
групп на 1 г твердой фазы.
П р и м а р 4. Получение носите ля модификацией макропористого кремнезема сополимером малеинового ангидрида с винилэтиловым эфиром, 3,0 г (1,23 ммоля аминогрупп) аминоалкилированного макропористого кремнезема суспендируют в 6 мл раствора 2,8 г сополимера малеинового ангидрида (6,15 г-фюлей ангидриных звеньев) с винилэтиловым эфиром (соотношение мономеров 1:5; мол.вес, 8000-12000) в диметилформамде и перемешивают 3 ч при БО-бО С Далее носитель прогнивают как в 1 и сушат над- Р о , Кислотноосновное титрование ангидридных эвеньев, привитых к твердой фазе, дает 0,19 ммолей на 1 г Т1 ердой фазы. ИК-спектр полученного продукта додержит полосы при 1860 и 1790 см свойственные насыщенным ангидридам с пятичленным циклом. Далее носитель обрабатывают как в примере 1, НОгидротартрат 2 меркаптоэтиламина вводят в реакцию в количестве 4,67 г,а 2,2-дипиридилдисульфид в количестве 1,0 г. Емкость полученного носителя 120 мкмолей
N
-S-§-/()) групп на 1 г твердой
У
фазы.
Пример 5, Получение носителя модификацией макропористого кремнезема сополимером малеинового- ангидрида с этиленом
3,0 г (1,23 ммоля аминогрупп) аминоалкилированного макропористого кремнезема суспендируют в 10 мл раствора , 1,24 г (12,3 ммоля ангидридных звеньев) сополимера малеинового ангидрида с этилене (соотношение мономеров 1:3; мол, вес. 1600-20000) в диметилформамид и перемешивают 4 ч пии 60-7О С. Далее носитель промывают как в примере 1 и сушат в вакууме над Pj -sКислотно-основное титрование ангидридных звеньев, привитых к твердой фазе, дает 0,24 ммоля на 1 г твердой фазы, ИК-спектр полученного продукта содержит полосы при 1860 и 1790 см-., свойственные насыщенны ангидридам с пятичленным циклом, Затем носитель обрабатывают как в
примере 1, но гидротартрат 2 меркаптоэтиламина вводят в реакцию в количестве 9,34 г, а 2,2-дипиридилдисульфид в количестве 2,0 г. Емкость полученного носителя 190 мкмолей
N
- групп на 1 г твердой фазы.
П р и м е р 6, Выделение меркаптоальбумина из препарата бычьего сывороточного альбумина -дисульфиднообменной ковалентной хроматографии,
200 мг бычьего сывороточного альбумина (Calbiochem США; 5Я-титр 0,59 + 0,02 моля SH-групп
на 1 моль препарата белка) растворяют в 10 мл буфера 0,1 М Трис/riCf 0,3 КСЕ - 1 ммоль ЭДТА, рН 7,9 и вводят в контакт с носителем для дисульфиднообменной ковалентной хроматографии, получение которого описане в примере 1, причем носитель берут в количестве, соответствующем не менее чем 100-кратному избытку М.„
-S-3групп носителя к числу
SH-ГРУПП белка. Суспензию перемешивают 6 ч при комнатной температуре, твердую фазу отделяют декантацией и промывают последовательно тем же
уфером (3x30 мл) , 1, 5М КСЕ (3x30 мл деионизованной водой (3x30 мл), и окончательно исходным буферам (50 мл) . Далее носитель с иммобилизованным меркаптоальбумином пееносят в хрсматографическую колонку и смывают белок элюцией линейным градиентам от О до 0,1М концентрации цистеина в исходном буфере. Фракции, содержащие белок,
объединяют и подвергают обессолйванию на колонке, с сефадекссм Г-25,. а затем высушивают целевой продукт лиофильно. ЗН-титр полученного белка: 1,00 + 0,02 5Л-групп на
1 моль альбумина, Изоэлектрофокусирование этого продукта1 на колонке в градиенте плотности сахарозы в борно-боратном буфере с линейным градиентом концентрации маннита показывает наличие одной фракции с изоэлектрической точкой 5,30, в то время .как исходный препарат белка содержит 4 фракции с изоэлектрическими точками: 4,86; 4,98;
5,14; 5,30,
Результаты экслег ментов по выделению меркаптодльбумина из препарата бычьего сывороточного альбумина с помощью носителей для дисульфиднообменной ковалентной хроматографии, получение которых описано в примерах 2-5, приведены в таблице.
По номеру примера, где описано
получение соответствующего носителя;БСА -бычий сывороточный альбумин
Пример 7, Выделение суммарного белка пекарских дрожжей дисульфиднообменной ковалентной хроматографией.
Пекарские дрожжи замораживают в дистиллированной воде и дезинтегрируют в процессе Хьюса, Дезинтеграт оттаивают, суспензию центрифугируют при 5000 об/мин, суперматант отбирают и лиофилизуют.
1,0 г лиофилизованного суспернатата (содержание общего белка по данньм биуретовой реакции 0,404 г) растворяют в 30 мл рабочего буфера: 0,1 М Ыа-фосфат - 0,15 М 4а-додецилсульфат - 1 ммоль ЭДТА, рН 7,8. Раствор 15 мин продувают аргонсм,добавля для гашения пены 3-5 капель этанола затем вносят 1,0 мл 2-меркаптоэтанола и инкубируют смесь 2 ч при комнатной телшературе. Далее отделяют низкомолекулярные вещества на колонке с сефадексом Г-25, уравновешенным рабочим буфером, а фракцию элюата, содержащую высокомолекулярные вещества-, вводят в контакт с носителем для дисульфиднообменной ковалентной хроматографии, получение которого описано в примере 1, причем носитель берут в количестве
N
из расчета 1 мкмоль (
W/
групп твердой фазы на 1 мг белка в исходном дезинтеграте. Суспензию перемешивают при комнатной температуре б ч, затем отделяют твердую фазу, промывгиот ее рабочим буфером UOO мл) и суспендируют в гсм еже
буфере (20 мл), содержатем 1 .vi 2-меркаптоэтакола . nepeMciansaijT 4 ч при комнатной температуре, твердую фазу декактадией, прог.с эают ее рабочим буфером (100 мл), а фильтрат и объединяют и подвергают обессоливанию электродиализом. Выход суммарных белковых веществ пекарских дрожжей 0,3 г (79%).
10
При использовании для выделения по описанной методике су;-1марных белковых веществ пекарских дрожжей с помощью носителей, получение которых описано в примерах 2-5, полу15чают аналогичные результаты. Неспецифической : сорбции белков не наблюдается, так как применяют буферный раствор, содержавши детергент Na-додецилсульфат.
0
П р и М е р 8. Регенерация носителей после использования в процессах дисульфиднообменной ковалентной хроматографии.
3,0 г носителя (любого из описанных в примерах 1-5) после ис5пользования в хроматографическом процессе суспендируют в 20 мл буфера: 0,1 М Трис/лсе - 0,2 М Na-додецилсульфат - 1 ммоль ЭДТА, рИ 7,8. Добавляют 2 мл 2-меркаптоэтано0ла и перемешивают 6 ч при комнатной температуре. Твердую фазу отделяют декантацией, пpo ывaIOт буфером (4x50 мл), деионизованной водой (4x50 мл), спиртом (3x20 мл),
5 диметилформамидом (3x20 мл), а затем обрабатывают 2,2-дипиридилдисульфидом согласно методике примера 1.
Пример 9. Регенерация избытка 2,2-Дипиридилдисульфида после
0 активации . Srf-носителей.
раствор, содержащ51й избыточный 2, . 2,2-дипиридилдисульфид и выделившийся в результате реакции активадации ЗН-групп носителя (см. примеры 1-5
5 и 8) 2-тиопиридон, отделяют от твердой фазы и упаривают в вакууме досуха. Остаток растворяют в 15 ivin метанола, охлаждают до Ос и при перемешивании прибавляют по
0 каплям 30%-ный водный раствор перекиси водорода до полного обесцвечивания реакционной массы. Переманивание продолжают на холоду еще 30 мин, а затем выливают раствор в 300 мл
5 ледяной воды, при этом выпадает белый осадок, который отфильтровывают, промывают на фильтре 100 мл ледяной воды и сущат в вакуум-эксикаторе над ttaOH. Продукт перекристаллизовывают из гексана; т,пл. 57-58 С (лит.т.пл. 58С).
Полученные согласно предлагаемому изобретению носители сохраняют все положительные свойства носителей на неорганической основе , включая меxaHifjecKyro прочность, устойчивость к воздействию г шкроорганизмов, постоянство объема в различных жидких средах, и, кроме того, обладают повышенной емкостью по активным к дисульфидному обмену группам, которая достигает 150-190 мкмолей на 1 г твердой фазы, что в раз превышает максимальную емкость прототипа. Предложенные носители имеют в 2-3 раза меньшую по сравнению с . прототипом неспецифическую сорбцию по белку в процессе дисульфиднообменной ковалентной хроматографии
к-снг-Шг-снг
О N
о - С о 4СН- CHi--iMfe где № :П:р- 1:2 -10:1; R - макропористый кремнезем с диаметром пор 1100-1160 & , объемом пор 1,7-1,8 , удельно поверхностью 30-40 MVr; остаток мономера - N-винилпирролидона, стирола, этилена, винилэтилового эфира, в качестве носителя для дисульфиднообменной ковалентной хроматографии белков. 2. Способ получения соединения по П.1, путем введения на у-аминопропилированный макропористый кремнезем тиольных групп и дальнейшей активации этих групп дипиридилдисульфидом, отличающийся
Тменее мг на 1 г твердой Фазы) . Это дает возможность использовать полученные носители длявыделения и очистки индивидуальных б€шков, ферментов и белковых комплексов с большей по сравнению с прототипом эффективностью.
Формула изобретения
1. Модифицированный полимерами макропористый кремнезем общей формулы
N.
CHz-CHz-S-S-H
о N о
х #
С С -CHb, тем, что, с целью повышения емкости носителя по активным к дисульфидному обмену группам и снижения неспецифической сорбции белков, введение тиольных групп осуществляют, путем обработки .Т-аминопропилированного макропористого кремнезема 3-15-кратным избытком сополимера малеинолого ангидрида с винильным мойомером, а затем 5-20-кратным избытком 2-меркаптоэтиламином или его солью в присутствии основания. Источники информации, принятые во внимание при экспертизе 1. Авторское свидетельство СССР 540870, кл, С 07 F 7/18, 1975 (прототип) .




| название | год | авторы | номер документа |
|---|---|---|---|
| Модифицированный макропористый кремнезем в качестве носителя для дисульфидно-обменной ковалентной хроматографии белков и способ его получения | 1975 |
|
SU540870A1 |
| Способ получения тиолсодержащих сорбентов | 1978 |
|
SU771106A1 |
| Способ получения водонерастворимых биологически активных соединений | 1977 |
|
SU689200A1 |
| Способ получения модифицированного кремнеземного носителя для иммобилизации биоспецифических лигандов | 1987 |
|
SU1477439A1 |
| Способ получения производных 7-амино3-цефем-4-карбоновой кислоты | 1974 |
|
SU622408A3 |
| НАНОСОЕДИНЕНИЯ ПЛАТИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2538199C2 |
| ПОЛИМЕРНЫЕ МОДИФИКАТОРЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2323227C2 |
| Способ получения сорбента для хроматографического разделения биополимеров | 1983 |
|
SU1166751A1 |
| Способ получения водонерастворимых протеиновых препаратов | 1973 |
|
SU576959A3 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПОЛИМЕРНОГО КОМПЛЕКСА, ОБЛАДАЮЩЕГО АНТИСЕПТИЧЕСКИМИ СВОЙСТВАМИ, И АНТИСЕПТИЧЕСКОГО ПОКРЫТИЯ НА ЕГО ОСНОВЕ | 2010 |
|
RU2445980C1 |


Авторы
Даты
1979-09-25—Публикация
1977-01-24—Подача