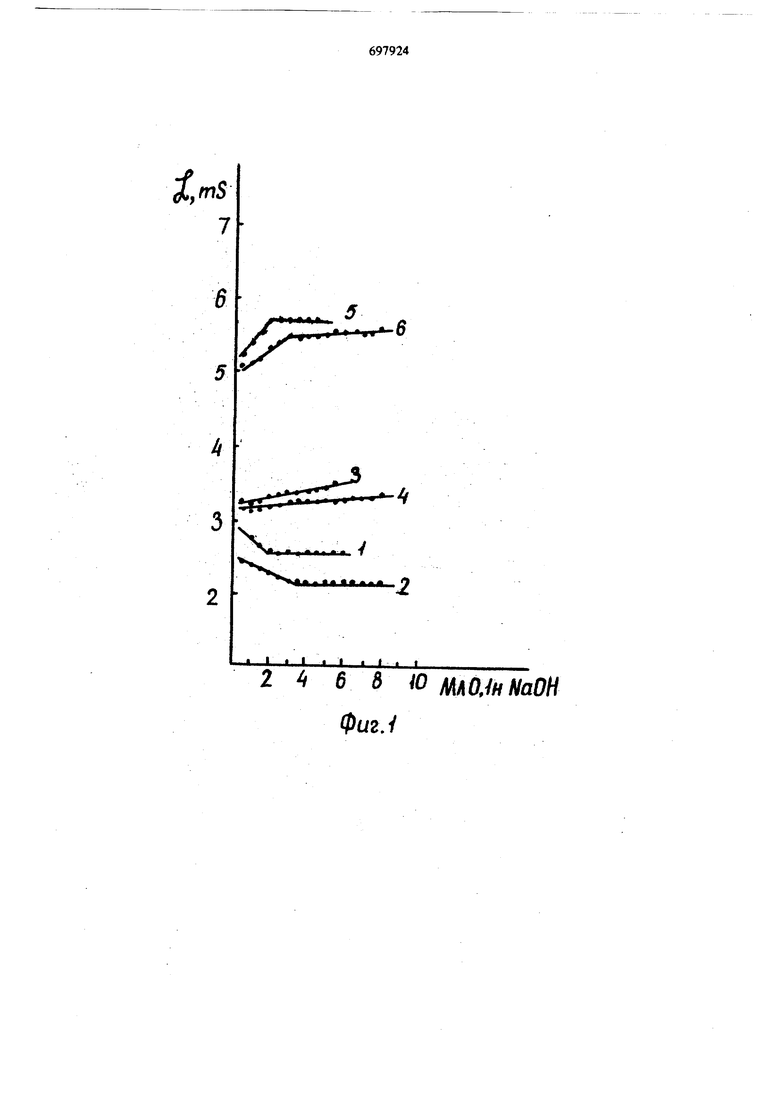
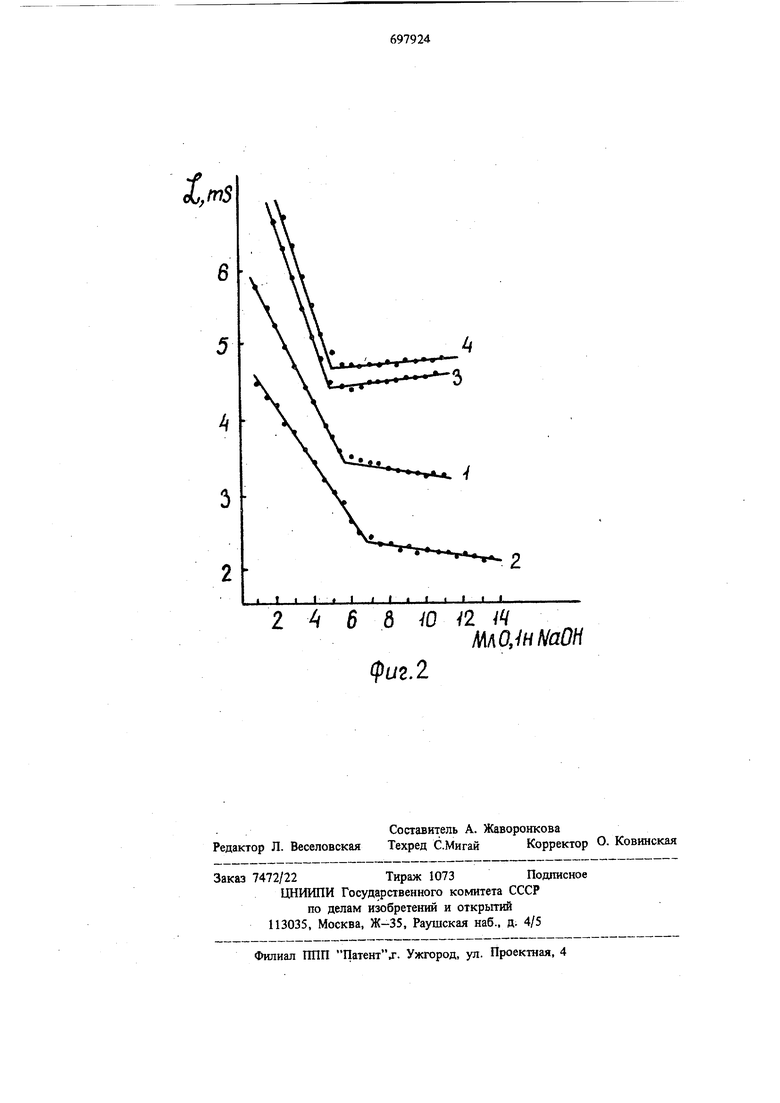
Изобретение относится к области аналитической и препаративной химии. Известен способ определения примеси кислоты (или основной соли) в хлорном хроме (III) рН-метрическим титрованием после связы вания хрома (III) в устойчивый оксалатгага комплекс, образующийся при кипячении в течение 20 мин в присутствии известного количества соляной кислоты 1. В случае присутствия примеси основных солей типа (CrOH)Cl гидроксильная группа вытесняется оксалат - ионом и взаимодействует с избытком кислоты, который затем с удовлетворительной точностью титруют раствором щелочи. Недостатком способа является то, что он позволяет установить лишь разницу между концентрацией свободной кислоты и гидрокси ных групп, находящихся как примесь в виде комплексного катиона типа (СгОН). Известен также способ .определения концент рации .ионов водорода в растворах с постоянной ионной силой, создаваемой избытком электролита с использованием солей типа NaCIO4, KNOs и т.п. 2. По этому методу ионная сила (/tl 1-5) создается фоновым электролитом и не изменяется в процессе титрования. Однако метод не пригоден для систем, в которых высокая ионная сила обусловлена не фоновым электролитом, а самими гидролизующимися солями. Использование способа затруднено, так как требуется предварительное определение аналитических концентраций всех компонентов смеси и |3нание констант их депротонизации. Наиболее близким.по технической сущности и достигаемому результату является способ определения свободной кислоты в растворах сульфатов хрома (IIf) прямым кондуктометрическим титрованием раствором щелочи 3. Недостатком способа является несовпадение экспериментальной кривой титрования с теоретической, т.е. низкая точность результатов. Цель изобретения - повышение точности определения свободной кислоты в нейтральных и основных солях хрома (III) с анионами сильных кислот, не образующими инертных комплексов. Поставленная цель достигается тем, что в раствор нейтральной или основной соли хрома (III) 3 10 - 1,2-10 моль/л перед титрованием вводят сульфат щелочного металла, например сульфат натрия 1, моль/л, а затем титруют раствором щелочи с кондуктометрической индикацией конечной точки титро вания. На фиг. 1 показано влияние сульфата натрия на форму кривой кондуктометрического титрования щелочью раствором нитра тов хрома (III), не содержащих свободной кислоты (V ЗОмл).. На фиг. 2 изображены кривые титрования добавки 5 мл 0,1 и НМОз к растворами CrOH(N03)i и Cr(N03)3 без введения (кривые 1, 2) и с введением NsjSO (3.4). На кривых титрования растворов как основ ного, так и нейтрального нитрата хрома (III) (фиг. 1, кривые 1, 2) в отсутствие свободной кислоты и сульфата натрия появляется нисходящая ветвь. Реакция, обуславливающая появление ее, протекает и в процессе нейтрализации свободной кислоты, в результате чего добавки кислоты определяются с больщим завыщением (фиг. 2, кривые 1, 2). Введение сульфата натрия 3« моль/л приводит к исчезновению нисходящей ветви кривой титрования как в растворах нейтрального, так и основного нитрата хрома (HI) (фиг. 1.-, кривые 3, 4). При концентрации сул фата натрия более, чем 6 «10 моль/л появляется восходящая начальная ветвь, которая при содержаний N82804 1,2-Ю моль/л (фиг.1 кривые 5, 6) является, зеркальным отражением нисходящей ветви, полученной в отсутствие сульфата натрия. Нисходящая ветвь исчезает, а восходящая еще не появляется в области концентраций
Т абл ица 1 сульфата натрия 1, - 6, и хрома (III) 3,0-10- - 1,. Появление нисходящей ветви кривой титрования в отсутствие свободной кислоты и завышение результатов определения свободной кислоты, по-видимому, связано с тем, что взаимодействие хрома (III) с ОН-группами в отсутствие лигандов, образующих инертные комплексы с Сг (111) Д1ротекает через стадию образования внещнесферных (лабильных) комплексов типа Cr(Hi О) Cr(H2O)sOH10H С введением сульфат-ионов быстро образуются внецшесфернью сульфатные комплексы хрома (III) типа Сг(Н20)б18О4 или iCr (Нг О) 5 ОН SO и при титровании раствором NaOH реакция идет между гидроксилом и комплексными частицами с заменой в них so; на ОН-. Увеличение злектропроводности в начальной стадии титрования, когда концентрация сульфата выше оптимальной (фиг.1, кривые 5,6), по-видимому, связано с некоторым накоплением гидроксильных групп, не взаимодействующих с Сг (III) из-за конкуренции . Добавки растворбв HNOj и НСЮ4 к растворам нейтрального и основного нитрата хрома (HI) с концентрацией хрома и сульфата натрия в оптимальной области были определены с удовлетворительной точностыб (фиг. 2, кривые 3, 4). Гидроксильные группы 1/3 - основного нитрата хрома (III) не реагировали со свободной кислотой в течение 5 ч при комнатной температ5фе. Это открывает возможность количественного определения свободной кислоты не только в нейтральном нитрате хрома (III), но и содержащем примесь основного нитрата хрома (111). Результаты определения свободной кислоты в модельных смесях приведено в табл. 1 (нав. 0,24 г в 50 мл).


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения фтора | 1978 |
|
SU828077A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МАССОВОЙ ДОЛИ ФУНКЦИОНАЛЬНЫХ ГРУПП ПОЛИУРОНИДОВ | 2001 |
|
RU2206089C1 |
| Способ количественного определения концевых групп полиамидов | 1978 |
|
SU777571A1 |
| Способ определения фтора | 1977 |
|
SU732205A1 |
| Способ комплексонометрическогоОпРЕдЕлЕНия жЕлЕзА (111) | 1979 |
|
SU836587A1 |
| Способ количественного определения концевых групп полиамидов | 1978 |
|
SU763789A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОИЗВЕДЕНИЙ РАСТВОРИМОСТИ И ИОННЫХ ПРОИЗВЕДЕНИЙ МАЛОРАСТВОРИМЫХ СОЛЕЙ И КОМПЛЕКСНЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2240555C2 |
| Способ определения никеля | 1983 |
|
SU1153286A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СВИНЦА | 2012 |
|
RU2505809C1 |
| Способ извлечения скандия(III) для его последующего определения в системе, содержащей антипирин и сульфосалициловую кислоту | 2015 |
|
RU2645068C2 |

1,6 1,6
0.5 1,0 3,0 0,5
0,75
0,48 1,30 1,03 0,65 0,47
П р и м е p. 1,2 г Сг(ЫОз)з-9Н10 растворяют в воде и переводят в мерную колбу емкостью 100 мл, доводят до метки водой, 10 мл пол)енного раствора помещают в ячейку, добавляют 5 мл 0,40%-ного раствора N32804, 35 мл воды и титруют 0,05 н раствором NaOH nopipuMH по 0,2 мл. После добавления каждой порции титранта раствор перемешивают и измеряют электропроводность.
Строят кривую титрования в координатах электропроводность - объем 0,05 н раствора NaOH. Появление начальной нисходяп ей ветви кривой титрования указьтает на присутствие в растворе свободной кислоты. По точке перегиба кривой определяют количество щелочи, затраченное на нейтрализацию свободной кислоты. Результаты реализации примера приведены в табл. 2.
Таблица 2
Найдено, HNOs, %
Предлагаемый способ позволяет, количественно определять содержание свободлой кислоты в нейтральных, основных или содержащих основную соль как примесь нитратах и перхлоратах хрома (III).
Формула нзобретения
Способ определения свободной кислоты в растворах солей хрома (III) с анионами сильных кислот, не образующими инертных комплексов, путем титрования растворами щелочей с кондуктометрической индикацией конца титрования, отличающийся тем, что с целью повыщения точности определения кислоты в нейтральных и основных солях хрома (1И). перед титрованием в анализируемый раствор вводят сульфат щелочного
металла с концентрацией 1,5-10 -6-10 моль/л.
информации, принятые во внимание при экспертизе
/,m5
X
-иУ
. I «
2 б e Ю MtOjHNaOH 0u2.y
t t 1 It I I ii I I I I
2 4 б S Ю У2
MAQVHAtoO/f
фаг. 2
Авторы
Даты
1979-11-15—Публикация
1977-04-05—Подача