(54) СПОСОБ ПОЛУЧЕНИЯ АРИЛЕНБИССУЛЬФОПИЛМОЧЕВИП
взаимодействию с амидом сульфокислоты общей формулы III
R-SO,-iNH,,III
где -R имеет вышеуказанное значение, при температуре 10-60°С в смеси диметилформамида и воды в присутствии гидроокиси щелочного металла.
Предлагаемый способ осуществляют при относительно мягких условиях при температурах в области 10-60°С. Более высоких реакционных температур нужно избегать, чтобы предотвратить образование нежелательных побочных продуктов.
Время реакции зависит от рода используемого N,N-диxлopaмидa и сульфонамида, оно составляет от 10 мин до 25 ч.
В качестве гидроокисей щелочных металлов из экономических соображений предпочтительно применяют гидроокись натрия. Также пригодны остальные гидроокиси щелочных металлов. Гидроокись щелочного металла нужно применять по меньщей мере в стехиометрических количествах. На моль Ы,Ы-дихлорамида дикарбоновой кислоты необходимо 4 моль гидроокиси, так как сульфонамид реагирует в жедательном направлении только в своей анионной форме как щелочная соль. Предпочтительно используют избыток до 2 моль гидроокиси щелочного металла на моль .Ы,-дихлорамида дикарбоновой кислоты.
Н,Й-дихлорамид дикарбоновой кислоты и сульфонамид могут быть применены в стехиометрических количествах, т. е. в мольном соотношении 1 : 2. Целесообразио применять сульфонамнд в избытке максимально 2 моль.
Пример 1.32г (0,80 моль) гидроокиси натрия растворяют в 40 г воды и смещивают при 25°С с 550 мл диметилформамида (ДМФ). В прозрачный раствор при интенсивном перемещивании быстро вносят 68,5 г (0,40 моль) тонко измельченного до порошка п-толуолсульфонамида. При этом самопроизвольно осаждается в виде белого осадка натриевая соль тозиламида. Суспензию охлаждают до 5-10°С и в течение 5 мин порциями смешивают с 46,6 г (0,20 моль) дихлорамида Н,Ы-терефталевой кислоты. Несмотря на Ьолее сильное наружное охлаждение температура реакционной смеси повыщается до 44°С. Суспензия постепенно становится жидкотекучей, спустя 7 мин практически все растворяется, спустя 8 мин уже осаждается натриевая соль я-фениленбис- (/г-толуилсульфонилмочевины) в виде белого осадка. Устанавливают охлаждение и реакционную смесь выдерживают еще примерно 45 мин нри 40- 45°С. Для полного протекания реакции нагревают еще 30 мин при 60°С, затем охлаждают и фильтруют при комнатной температуре через стеклянный фильтр. Содержащий соль, увлажненный диметилформамидом, светло-коричневый осадок на фильтре растворяют в 1,6 л воды. После отфильтровываиия небольшого количества нерастворимой части прозрачиый раствор смещивают с таким количеством соляной кислоты, пока не установится рН 2. При этом осаждается тонко дисперсный бесцветный осадок. Чтобы поддерживать суспензию способной перемешиваться, ее разбавляют
500 мл воды. Затем осадок белого цвета отсасывают с помощью стеклянного фильтра, промывают водой до нейтральной реакции промывной воды, затем суспендируют в метаноле, снова отсасывают, еще три раза
промывают метанолом и высущивают в вакууме при до постоянного веса. Получают /5,3 г (74,9% от теории) /г-фениленбис- (я-толуилсульфонилмочевины).
Из водной и метанольной фазы после
концентрирования и подкисления получают 9,02 г сульфонилмочевины. Из диметилформамидной фазы получают обратно 1,67 г ненрореагировавщего дихлорамида N,N-Teрефталевои кислоты. Таким образом получают общую степень превращения 95%, общий выход л-фениленбис-(п-толуилсульфоиилмочевины) 84%. Селективность составляет таким образом 88,4%.
Вычислено, %: С 52,57; П 4,41; N 11,15;
S 12,76.
Найдено, %: С 52,3; Н 4,0; N 11,0; S 12,4.
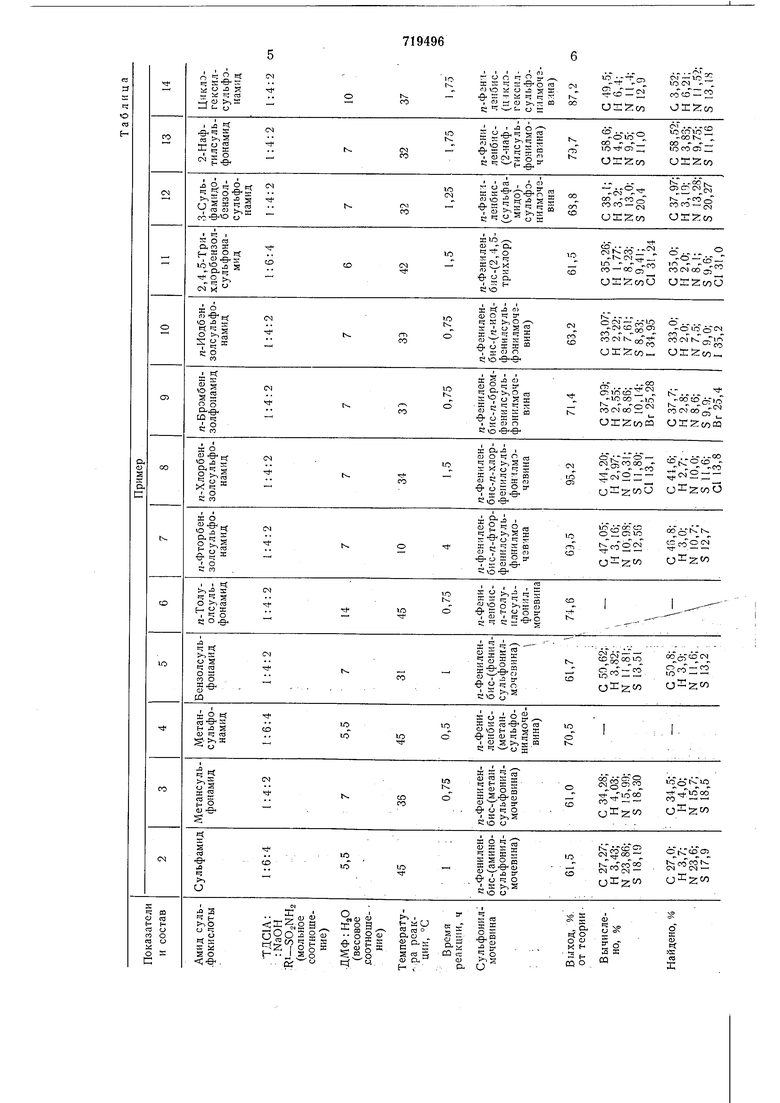
Примеры 2-14.ДихлорамидN,N-Tepeфталевой кислоты, описанный в примере 1,
вводят во взаимодействие с миогочисленными амидами кислот. Сульфонамиды вводят во взаимодействие в виде 5-15%-ных растворов в смеси ДМФ-вода. В таблице указаны используемый амид сульфокислоты, мольное соотнощение дихлорамид N,Nтерефталевой кислоты, гидроокись натрия, амида сульфокислоты, весовое соотиощение диметилформамид-вода, температура реакции, время реакции, ариленбиссульфонилмочевины, а также относящиеся к ним выходы без учета частей, содержащихся в фильтратах.
Пример 15. 32 г (0,80 моль) гидроокиси натрия растворяют в 80 мл воды, охлаждают до 20°С и разбавляют 550 мл ДМФ. В прозрачный раствор при интенсивном перемешивании порциями вносят 68,5 г (0,40 моль) я-тозиламида, причем тотчас выпадает осадок белого цвета (натриевая
соль тозиламида). Суспензию затем охлаждают до 5°С и в течение 10 мин добавляют порциями 46,6 г (0,20 моль) бис-Н-хлорамида изофталевой кислоты. Несмотря на интенсивное перемешивание и охлажденне
смесью лед - поваренная соль, температура при этом повыщается до 40°С. Сильно окисляющая суспеизия в течение 4 мин становится жидкотекучей и принимает желтооранжевое окрашивание. Спустя 15 мин
экзотермическая реакция заканчивается.
Затем выдерживают 30 мин при 35°С и для полного протекания реакции нагревают еще 60 мин нри 65°С. После охлаждения отсасывают взвесь белого цвета, 3 раза промывают но 25 мл ДМФ, растворяют примерно в 1,5 л воды (прозрачный раствор с рН 8) н подкнсляют разбавленной НС1, отсасывают п промывают до нейтральной реакции. После высушнвання получают 65,2 г желательной сульфоннлмочевины. Из окрашенного в желтый цвет фильтрата ДМФ после концентрнрования примерно до Vio объема п o лaждeния выделяют 67,5 г крнсталлнче| коч массы коричневого цвета, нз которой уже описанным образом путем растворения в воде н осаждення разбавленной НС1 получают дальнейшие 31 г сульфоннлмочевн1ТЫ.Х. Выход,/и-фениленбис-3,3-п-толунлсульсЬон лмочевины составляет таким образом 95.7% от теорнн.
Вычнслено, %: С 52,57; Н 4,41; N 11,15; S 12,76.
Найдено, %: С 52,4; Н 4,2; N 10,9; S 12,5.
Пример 16. Из 3,2 г (80 ммоль) гндроокисп натрия, 8 мл воды, 55 мл ДМФ и 6,85 г (40 ммоль) тозиламида, онисанным в примере 15 образом, приготовляют суспензию натриевой соли «-тозиламида. В эту суспензию затем в течение 1 мин вносят 5,66 г (20 ммоль) бис-Н-хлорамида 2,6-нафталиндикарбоновой кислоты. При этом, несмотря на охлаждение льдом, температура новышается до 25°С н образуется прозрачный желтый раствор. дальнейшие 2 мин начннается выпадение тонкодиснерсного осадка. Продолжают перемешивать в течение 5 ч ири комнатной температуре, прн этом количество осадка увеличивается и раствор окрашивается в светло-коричневый цвет. Так как раствор обладает еше умеренно окисляющим действием, перемешивают в теченне ночи при 20°С.
Осадок выделяют из смеси ДМФ вода н описанным в примере 15 образом растворяют в воде н осаждают. Выделяют таким образом 5,53 г белого порошка. Из фильтрата ДМФ выделяют еще, аналогично нрнмепу 5, дальнейшие 4,0 г вещества.
Выход 2,6-нафталинобнс-3,3-п - толунлсульфоннлмочевины составляет в целом 9,53 г (86,2% от теории).
Вычислено, %: С 56,51; Н 4,38; N 10,14; S 11,60.
Найдено, %: С 56.2; Н 4,3; N 10,0; S 11,2.
П р н м е р 17. Из 3,96 г гидроокиси калия (86%-ной) (60 ммоль), 3 мл воды, 55 мл ДМФ и 6,85 г (40 ммоль) л-тозиламида описанным в примере 15 образом готовят суспензию калиевой соли п-то иламида. В эту суснензию затем в течение 2 мин при 10°С вносят 3,37 г (10 ммоль бис-К-хлорамида 4,4-дифенилэтандикарбоновой кислоты при интенсивном перемешивании. Спустя следуюшие 5 мин при 10°С образуется прозрачный желтый раствор, из которого
через 10 мин при 20°С начинает осаждаться мелкий тонкодисперсный белый осадок. Затем перемешивают при комнатной темнературе 10 ч и нагревают 30 мин при 50°С.
Появляется слабое коричневое окрашивание и количество осадка увеличивается. По окончании реакции фильтруют н из фильтрата ДМФ после удаления растворителя, растворения в воде и подкисления разбавленной водной соляной кислотой нолучают 5,71 г я-дифенилэтанбис-3,3-п-толуилсульфонилмочевииы. Выход 5,71 г (94% от теории) .
Вычислено, %: С 59,39; Н 4,98; N 9,24;
S 10,57; О 15,82.
Найдено, %: С 59,1; Н 4,7; N 9,0; S 10,2.
Пример 18. К раствору нз калиевой солн п-тоэнламида. который получен аналогнчно примеру 17, из 13,6 г (79,6 ммоль)
п-тозиламида и 9,3 г гидроокиси калия 86%-ной (159,2 ммоль) в смеси нз 40 мл воды и 280 мл ДМФ нри 15-20°С в течение 10 мин добавляют 12 г (39 ммоль) бнс-М-хлорамида 4,4-дифенилового эфира
ликарбоновой кислоты при охлаждении. Прозрачный желтый раствор затем 3 ч интенсивно перемешивают прн 25°С.и 5 ч нри 40°С, пока не исчезнут окисляющие свойства. Потом отфильтровывают от выделившегося в виде осадка хлористого калия. Из фильтрата носле удаления смеси растворителей в вакууме, растворения в воде и подкисления разбавленной минеральной кислотой осаждают 17,3 г (29 ммоль. 75% от
теории) п-дифенилового эфира бис-3,3-га-толуилсульфоннлмочевнны в виде белого поротпка.
Вычнслено, %: С 56,55; Н 4,41; N 9,42; S 10,78.
Найдено, %: С 56,2; Н 4,2; N 9,2; S 10,5.
Формула изобретения
Способ получения ариленбнс-сульфонилмочевнны общей формулы
R-SO,-NH-CO-NH-Ar-NH-CO-NH-R,
где R - аминогрунна, алкил Ci-С, циклоалкил Св-Сд, арил, незамещенный или
замещенный алкилом Ci-Сз, галогеном или сульфамидогруппой;
Аг - арил, незамещенный нли замещенный алкнлом Ci-Сз, галогеном или сульфамидогруппой,
отличающийся тем, что дихлорамид дикарбоновой кислоты общей формулы
Cl-NH-CO-Ar-Co-NH-CI,
где Аг имеет вышеуказанное значение, подвергают взаимодействию с амидом сульфокислоты общей формулы
R - SO.-NHj,
где R имеет вышеуказанное значение, при 10-60°С в смеси диметилформамида
910
и воды в присутствии гидроокиси щелочно-1. Выложенная заявка ФРГ № 2225365,
го металла.кл. 12022, опублик. 1973.
Источники информации,2. Патент США № 2962530, кл. 260-553,
нринятые во внимание при экспертизеопублик. 1960.
719496



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения гликлазида | 2021 |
|
RU2754708C1 |
| Способ получения транс-циклогексан- 1,4-диАМиНА | 1979 |
|
SU841579A3 |
| СЕЛЕКТИВНЫЕ ЦИКЛОПЕПТИДЫ | 2001 |
|
RU2239642C1 |
| Способ получения флороглюцина | 1976 |
|
SU617004A3 |
| Способ получения бис- -хлорамидов дикарбоновых кислот | 1976 |
|
SU694068A3 |
| Способ получения бис- хлорамидов этилен-1,2-дифенил-4,4дикарбоновой или нафталин-2,6дикарбоновой кислоты | 1976 |
|
SU639447A3 |
| Способ получения производных тетрапептидов или их солей | 1978 |
|
SU908246A3 |
| СПОСОБ СИНТЕЗА С-2, С-3-ЗАМЕЩЕННЫХ N-АЛКИЛИРОВАННЫХ ИНДОЛОВ, ИСПОЛЬЗУЕМЫХ В КАЧЕСТВЕ ИНГИБИТОРОВ CPLA | 2005 |
|
RU2401829C2 |
| ЦИКЛИЧЕСКИЕ МОЧЕВИНЫ, СПОСОБ ИНГИБИРОВАНИЯ РОСТА РЕТРОВИРУСОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2131420C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ СОВМЕСТИМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО ДЛЯ СНИЖЕНИЯ ВЫСОКОГО ДАВЛЕНИЯ КРОВИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ СНИЖЕНИЯ КРОВЯНОГО ДАВЛЕНИЯ | 1993 |
|
RU2116300C1 |


Авторы
Даты
1980-02-29—Публикация
1976-01-21—Подача