Изобретение относится к химическим средствам борьбы с грнбковвлми заболеваниями растений, а именно к фунгицидной КОМПОЗИЦИИ на основе пр изводных 1,3,4-оксадиазола. Известна фунгицидная композиция, содержащая 2-тиоцианоэтилтио-5-фенил-1,3,4-оксадиазол и обычные добавки 1 . Однако она недостаточно эффективна. Целью изобретения является изыскание новой фунгицидной композиции на основе производных 1,3,4-оксадиа зола; обладающей усиленным фунгицид ным действием. Цель достигается использованием в качестве производного 1,3,4-оксадиазол а соединения общей формулы I R-C -C-CN Li где R - фенил; фенил, замещенный 1одинаковыми или разными заместителя ми выбранными из группы галоген,нит ро, циано, метил, алкокси , ал .лилокси, метилтио, димётиламино; .3,4-метилендиоксифенил, нафтил, пир мидинил, замещенный двукратно хлором, метокси, в количестве вес,%: Формы применения препаратов обычные .. Соединения общей формулы I можно получать дегидратацией соединения II f f Y-™ N--N It VУ I Реакцию проводят в среде инертного безводного растворителя при 060°С в. присутствии агента дегидратации, например РОСЦ , Р, QS SOCIj, или трифторуксусного ангидрида. В качестве используемых растворителей можно указать органические растворители, например, четыреххлористый углерод, пёрхлорэтилен, толуол, пиридин.Можно также использовать в качестве растворителя хлорокись фосфора, не применяя органического растворителя. Соединения общей формулы I I получают путем аммонолиза соединений общей формулы I I известным способом согласно реакционной схеме ipcj-oa ч R,OH Реакцию проводят при с по мощью в присутствии низшего алканола, например этанола, индиви дуально иди в смеси с инертным орга ническим растворителем, например с толуолом. Соединения общей-формулы I1I пол чают циклизацией соединений общей формулы IV известнЕлм способомпо реакционной схеме. в-гГ -, .R - с-Кй-НН-с - с - О.В 1 - Р Ifj+ 1 IIII II Циклизация осуществляется при. на гревании от комнатной до температур около 140°С в среде безводного орга нического растворителя, в присутствии агента дегидратации, например P2L,S или SOCIj. Практически работают при кипячений с обратным холодильником в органическом раство рителе , который может быть ароматическим углеводородом как толуол,кси ЛОЛ, бензол, хлорбензол, или алифатическим галоидированным углеводоро дом как четыреххлористый углерод, перхлорэтилен (тетрахлорэтилен). В качестве растворителя можно также использовать хлорокись фосфора, не применяя органического растворителя Соединения общей формулы IV полу .чают конденсацией алкоксиалилгалоге нйда с ацилгидразидом по реакционно схеме B-c-WH-MH, + x-d-c-oR,- иII II о00 R - с --NH-TOI- tf-C-ORj+XH II11 /I О00 Эту реакцию проводят в среде инертного безводного органического растворителя в присутствии акцептор кислоты (как третичный амин) , напри мер пиридин или триэтиламин, при температуре О-30°с. Соединения общей формулы IV такж могут быть получены воздействием галоидангидрида кислоты на алкил-ги разинооксалат по реакционной схеме .00 в- с -Tt+HjW-KH- С-С- OR,- О 00 я II fl «-c-TOi-TOi-c-coBj-f хн Ацил-гидразид получается по известному способу воздействием гидр
745349 эингидрата на сложный эфир общей фор в-с-о-снз о в кипящем с обратным холодильником этаноле, В приведенных выше формулах II-IV И схемах R имеет то же значение, что и в формуле I , R-, означает алкил X - атом галогена. , Пр и м е р 1. Получение 2-циано-5-(3,5-диметилфенил)-1,3,4-оксадиазрла (соединение 1). К суспензии 189,5 г 2-карбамоил-5-(3,5-диметилфенил)-1,3,4-оксадиазола -в 873 см безводного пиридина в течение 1 ч добавляют 200 г хлорокиси фосфора при перемешивании. В процессе зтого добавления температура реакционной среды повышается от 20 до . Продолжают перемешивание в течение 4 ч с понижением температуры до . Затем реакционную смесь вылйванрт в 8,7 л воды и выпадающий осадок отфильтро,вывают, промывают два раза 500 см воды, затем сушат на воздухе. После перекристаллизации из изопропанола получают 163 г твердого 2-циано-5-(3,5-диметилфенил) 1,3,4-оксадиазола, плавящегося при 127°С. Выход 93,7%. Вычислено N 21,09%, Найдено N 21,6%. Структура этого соединения подтверждена ИК-спектроскопией. 2-КарбамсЗИл-5- (3 , 5-диметилфенил) -1,3,4-оксадиазол получается по следующему способу. В раствор 260 г 2-этоксикарбонил-5- (3,5-диметилфенил) -1 ,.3 ,4-оксадиазола в 520 см этанола и 2600 смтолуола,поддерживаемый при 5С, пропускают путем барботирования ток ам-. миака в течение примерно 2 ч. Продолжают перемешивание еще в течение 2 ч, позволяя температуре реакционной смеси подняться до 20°С.-.Появляющийся объемный осадок отфильтровывают, промывают три раза по 150 см этанола, затем сушат при,пониженном давлении (0,5 мм рт.ст.) при 20°С. Таким образом получают 211,5 г 2-карбамоил-5-(3,5-диметилфенил)-1,3, 4-оксадиазола,. плавящегося при 230°С. Структура подтверждена ИК-спектроскопией. 2-Этоксикарбонил-5-(З/5-диметилфенил) -1,3, 4-оксадиазол получают .следующим способом. Кипятят с обратным холодильником , в течение 1 ч при интенсивном перемешивании смесь 178,5 г 1-этоксалил-2-(3.,5-диметилбензоил)-гидразина и 589 г фосфорного ангидрида в 2,7 л безводного толуола. После охлаждения до комнатной температуры к реакционной смеси при охлаждении на ледяной бане добавляют 1,6л воды.Органическую фазу декантируют, промывают последовательно два раза 1 л воды, два раза 0,5 л водного 10%-ного раствора KHCUj, затем 1л. воды и сушат над сульфатом натрия. Объединяпот с толуольной фазой такого же соединения, полученной из второго опыта,, осуществленного в тех же условиях и с такими же количествами исходных соединений. После 6тгонки растворителя при пониженном давлении (20 мм рт.ст.) при 40-50С остаточное твердое вещество перекристаллизуют из 1,4 л циклогексана. Получают таким образом 260 г твердого 2-этоксикарбонил-5-(3,5-диметилфенил)-1,3,4-оксадиазола, т.пл. . Структура подтверждена ИК-спектроскопией.
1-Этоксалил-2-(3,5-диметилбензоил)-гидразин получается следующим способом.
К 316 г 3,5-диметилбензгидразида и 195 г триэтиламина в 1,58 л безводного диоксана в течение 1 ч,при ПОД.держивании температуры реакционной смеси около 10-12°С, добавляют 265 г этоксалилхлорида. Продолжают перемешивание в течение примерно 2 ч, позволяя температуре подняться до комнатной. Затем реакционную смесь выливают в 7 л воды при переМ1аШива1нии. Образовавшийся осадок отф йяьт овывают, промывают три раза 1 л воды, затем сушат лри под давлением 1 мм. рт.ст. Получают 357г 1-этоксалил-2-(3,5-диметилбензоил)-гидразина, плавящегося при .
Плавящийся при 3,5-диметилбензгидразид может быть.получен дей5ствием гидразингидрата на метил-3,5-диметилбензоат в этаноле при кипячении с обратным холодильником.
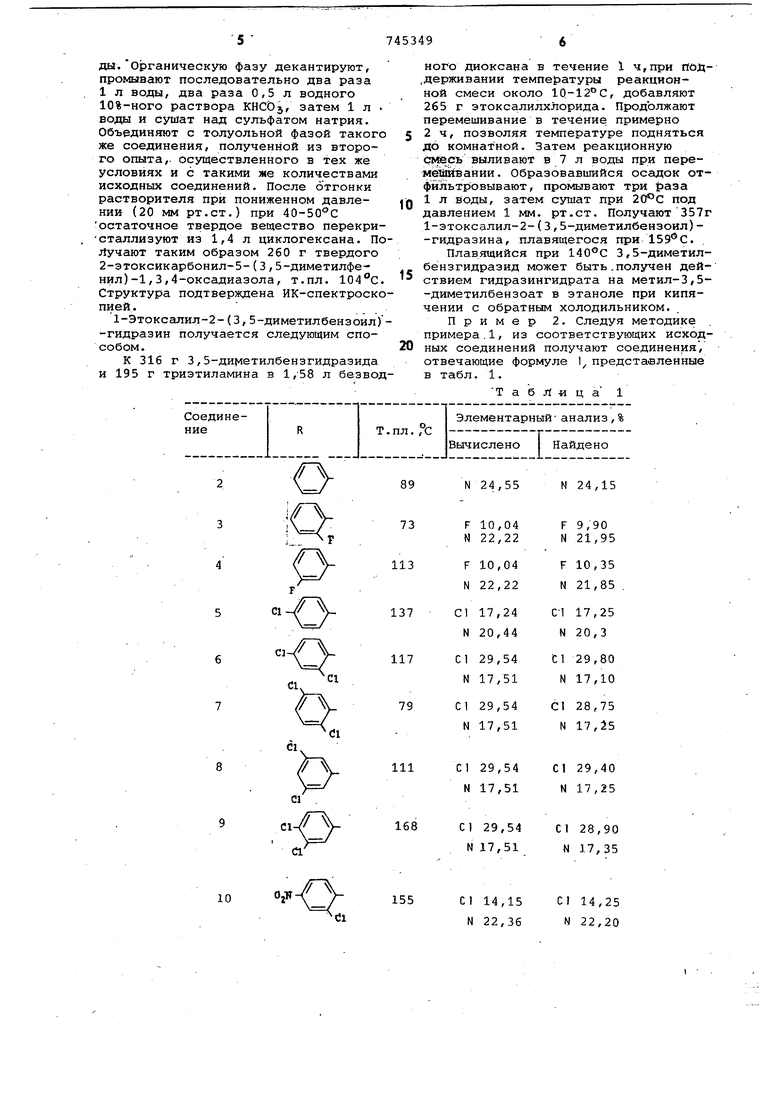
Пример 2. Следуя методике примера.1, из соответствующих исход0ных соединений получают соединения , отвечающие формуле 1 представленные в табл. 1.
Т а б Л и ц а 1







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридазина | 1980 |
|
SU984408A3 |
| 2-Алкилтио-5-(1,2,4-триазол-1-илметил)-1,3,4-оксадиазолы, способ их получения и фунгицидные композиции на их основе | 2022 |
|
RU2794339C1 |
| ПРОИЗВОДНЫЕ ФЕНИЛБЕНЗАМИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ И СПОСОБ БОРЬБЫ С ФУНГИЦИДНЫМИ ЗАБОЛЕВАНИЯМИ | 1993 |
|
RU2090552C1 |
| ПРОИЗВОДНЫЕ БЕТА-ФЕНОКСИНИТРИЛОВ И СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ КУЛЬТУР | 1989 |
|
RU2094431C1 |
| ФУНГИЦИДНАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНЫЕ ТРИАЗОЛОПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ БОРЬБЫ С ГРИБКАМИ | 1994 |
|
RU2130459C1 |
| ФУНГИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ БОРЬБЫ С ГРИБАМИ, ПРОИЗВОДНЫЕ ПИПЕРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2097375C1 |
| Фунгицидное средство | 1975 |
|
SU587840A3 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 1992 |
|
RU2014326C1 |
| Способ получения производных 1,3,4-тиадиазол-2-карбоновой кислоты | 1979 |
|
SU886745A3 |
| Фунгицидное средство | 1976 |
|
SU667107A3 |

N24,55 N 24,15
89
73
113
117
79
CI 29,40
С1 29,54 N 17,25 N 17,51
С1С1 29,54
С1 28,90 N 17,51 N 17,35
10
CI 14,25
С) 14,15 N 22,20 N 22,36
СНз
з
СЯзО
CHjO
CHjO Cl
СНзО С
Структура этих соединений подтверждена ИК-спектроскопией. .
В табл. 2 указываются точки плавления соединений формулы II.
Таблица 2
о i к-л VC-таг
t Г
NV
745349
Продолжение
N 19,71N 19,45
N 16,08 N 15,70
Cl 26,25 C. 26,25 N 15,36 N 15,35
Продолжение табл, 2
Л
СНз
/ V - 185
СН,
СЯз
снзЧ
СйзО
246
СНзО С1
сИзо
244
С1
I В табл. 3 указываются точки плавления соединений формулы III, используемых соответственно для получения соединений 11-2, 11-3, и т.д.
Таблица 3
. «
fir
C-OR,
-г 5
11
-сн.
9745349
Продолжение табл. 3
10
Продолжение табл. 4
120 86
77 98
167
148
141
152
165-169
В табл. 4 указываются точки плави J.c4v-frfi« - jf ,ivi А .ЧП.П llJiaa ления соединений формулы IV, исполь- 40 3VK«iHxcff соотя тптярнно ппя nonvtr - эующихся соответственно для получё НИН соединений III-2, III-3 и т.д. Таблица R-C-NH-NH-C-C-0-R 139-148
125
11 СИ,
12СЯзО160
-S«5
13 cwjO
,
107 55 60 65 Пример 3. Получение 2-циано-5-(4-этоксифенил)-1,3,4-оксадиазола /1 yl °единение 14;. , к суспензии 14,7 г 2-карбамоил-5-(этоксифенил)-1,3,4-оксадиазола в 126 мл безводного пиридина в течение 10 мин добавляют 8,7 мл (14,6 г) хлорокиси фосфора при перемешиваний. В процессе этого, добавления температура реакционной среды повышается от 20 до . Продолжают перемешивать в течение 24. с понижением температуры среды до . Затем реакционную смесь выливают в 1260 мл воды и образующийся осадок отфильтровывают, промывают два раза 50 мл воды,за,тем сушат при 50С под давлением 1 1 мм рт.ст. Получают 13 г сырого продукта, плавящегося при 110°С. Сырой продукт растворяют в 2.60 мл хлористого метилена и полученный окрашенный раствор перемешивают в течение 10 мин в присутствии силикагеля. Фильтруют, затем силикагель промывают хлористым метиленом. После этой обработки раствор обесцвечивается.Его концентрируют при под давлением 20 мм рт.ст и твердый остаток перекристаллизуют из изопропанола. Таким образом получают 12,3 г 2-циано-5-И-эт6ксифенил)-1,3,4-эксадиазола, плавящегося при .
Вычислено, N 19,45%.
Найдено, N 19,35%.
Получение 2-карбамоил-5-(4-этоксифенил)-1,3,4-оксадйазола, используемого в качестве исходного соединения для получения соединения 14.
В раствор 17,1 г 2 этоксикарбонил-5-(4-этоксифенил)-1,3,4-оксадиазола в 171 мл толуола и 34 мл этанола, поддерживаемый при , пропускают путем барботирования ток аммиака в течение 1 ч. Продолжают перемешивать еще в течение 2 ч- позволяя температуре реакционной среды подниматься до 20с. Появившийся объемный осадок отфильтровывают,промывают три раза по 20 мл этанола,затем сушат при 20°С под давлением 1мм рт.ст. Таким образом получают 14,8 г 2-карбамоил-5-(4-этоксифенил) -1,3,4-оксадиазола, плавящегося при ISS-C, с выходом 97,4%. Структура подтверждена ИК-спектроскопией.
Получение 2-этоксиКарбонил-5-(4-этоксифенил)-1,3,4-оксадиазола.
Кипятят с обратным холодильником вплоть до прекращения выделения газов (около 4 ч) при интенсивном перемешивании раствор 22 г 1-этоксалил-2-(4-этоксибензоил)-гидразина и 28 г тионилхлорида в 157 мл безводного 1,2-дихлорэтана. Удаляют под вакуумом (, 20 мм рт.ст.) растворитель, и избыток хлористого тионИла. Остаток растворяют в 150 мл хлористого метилена и метиленхлоридный раствор промывают последовательно 2x30 мл воды, затем 30 мл 20%-ного
15
CHjO
16
- са,
17
раствора бикарбоната калия, затем 2 .30 мл воды. Сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении (20 мм рт I ст. , 50°С) . Тверды остаток затем перекристаллизуют из изопропанола. Получают 15,9 г 2-этоксикарбонил-5-(4-этоксифенил)-1,3,4-оксадиазола, плавящегося при . Структура подтверждена ИК-спектроскопией .
Получение 1-этоксалил-2-(4-этоксибензоил) -гидразида.
К 36 г 4-эт6ксибензгидразида и 21,3 г триэтиламина в 360 мл безводного диоксана в течение 30 мин добавляют 29 г этоксалилхлорида, при поддержании температуры реакционной среды . Продолжают перемешивание в течение 2 ч с повышением температуры до комнатной. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении (20 мм рт.ст., 50°С) и остаток перемешивают:в присутствии 20 мл диизопрпилового эфирй,, затем отделяют фильтрованием. После высушивания (, 1 мм рт.ст.) получают 50,8 г 1-этоксибензоил)-гидразина, плавящегося при (после первого плавления при 120°С). Выход 90,7%.
4-Этоксибензгидразид, плавящийся при , может быть получен воздействием гидразингидрата на метил-4-этоксибензоат в этаноле -при кипении с обратным холодильником.
Пример 4. Следуя методике предьщущего примера, из соответствующих исходных соединений получают соединения, данные.в табл, 5.
Таблица 5
к- -j,-
NУ
124 CI 15,05 С1 14,95 N 17,83 N 17,55
85 N 21,09 N 20,30
N 21,09
N 20,5
13
CHgO
Gtf)
«JHjO
74534914
Продолжение табл. 5
N 20,89N 20,65
N 23,56N 28,5
N 22,69N 21,90
F 10,04F 9,75
N 22,22N 21,80
N 18,18N 17,9
N 21,09N 20,5
N 19,53N 19,50
Cl 29,42 Cl 29,45 N 23,24 N 23,4
S 14,76 N 14,43
{СНз)2 СНО CR3{CHi)iO
CHjO
CjHsO A. Тест ИН витро на фунгицидную активность. Для этого опыта используют серию пробирок, содержащих каждая по 4 мл искусственной питательной среды {агар sabourand). После стерилизации в автоклаве , в каждую пробирку добавляют по 2 мл водной суспензии испытуемого действующего начала с различными концентрациями действующего начала. v-jv.....-.... „„-r---f . Суспензия содержит, кроме того. 0,02 вес.% конденсата моноолеата сор- 60 битола с 10 моль окиси этилена. Для различных видов грибов при- готовляют суспензий спор и стерильной дистиллированной воды примерно по 4 10 спор/мл. Засевают каждую 65
Продолжение табл.5
N 20,89
N 20,30
Br 31,95
Br 32,35 N 16,80 N 16,80
Cl 16,14
Cl 16,10 N 19,13 N 18,90
N 19,52
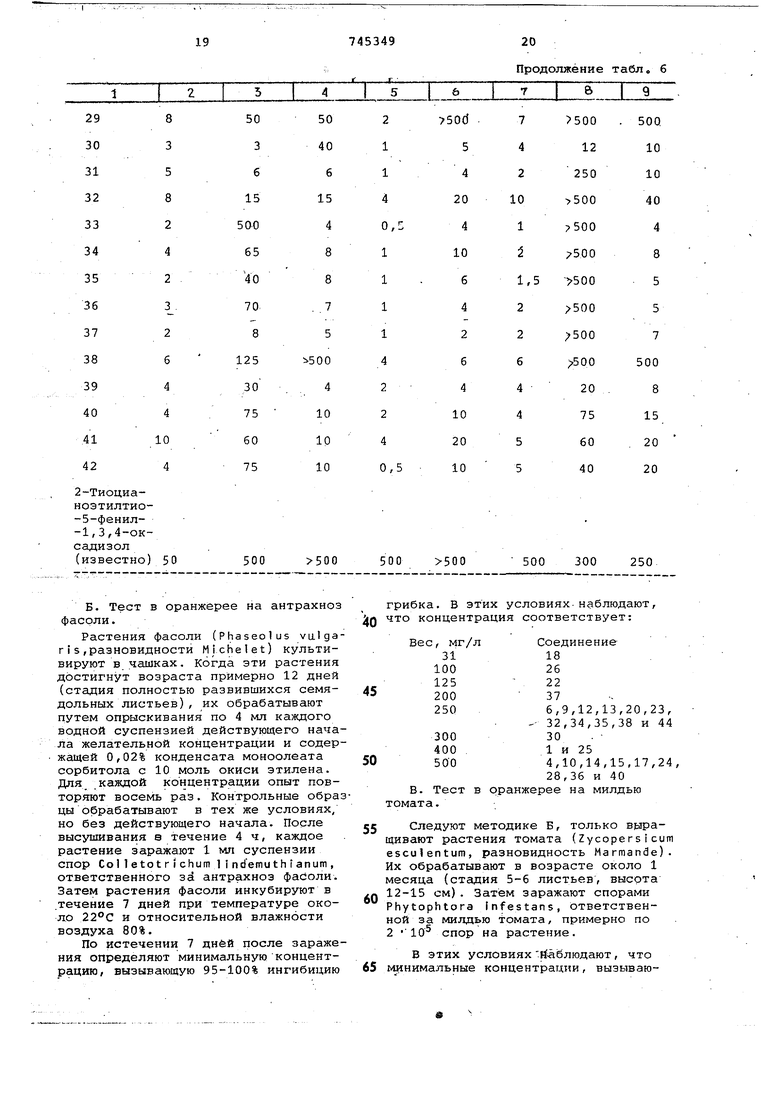
N 19,30 55 пробирку 0,25 мл этой суспензии. После посева пробирки выдерживают в течение 9 дней в сушильном шкафу при 25°С. На девятый день выращивания оценивают процент ингибирования роста каждого вида гриба для различных, концентраций действующего начйла.Иэ этих результатов определяют для каждого вида гриба минимальную концентрацию продукта, которая вызывает 95100% ингибирования роста грибов, называемую минимальной ингибирующей концентрацией. Концентрация выражается в мг действующего начала на 1 л суспензии. Результаты, относяПродолжение табл, б
21
щие 95-100% ингибицию грибка, соответственно следующие
Вес, мг/л Соединение
62 8 и 18 10031
1251,5,14,23,25,27,
28,32,35,40,41, и 42
15026
2006
25015,16,19,22,29,
33,34 и 39
350 , 17 и 37 5007,20 и 30 .
Следуют методике Б, но выращивают растения табака (Nicotina tabacum разновидность samson). В возрасте около месяца (стадия 5-6 листьев, высота 10-12 см) их обрабатывают,Затем заражают спорами Peronospora tabaciпа, ответственной за милдью
табака, примерно по 2 - 10 спор на растение.
В этих условиях наблюдают, что минимальные концентрации, вызыванадие 95-100% ингибицию грибка следукяцие: Вес, мг/л Соединение 628,18,23,37
1254,6,7,14,27,34,
39,40,41,42 150 . 22 . 2503,5,13,20,21,
30,31
30016
50015,25,38
Д. Тест в оранжерее на грибке огурца..
Следуют методике Б, только выращивают огуречные растения (Cacumis sativts, разновидности Blanchatft) и обработку водной суспензией действующего начала осуществляют после заряжения (лечебная обработка).Для этого огуречнйе растения в возрасте 3-4 недель (стадия 1 или 2 листьев, высота 6-10 см) заражают спорами 6rysiphe сichoracearum, ответственной за поражение грибком огурцов,примерно по 7,5 10 спор на растение. Спустя 8 дней после заряжения,растения обрабатывают водной суспензиейдействукяцего начала в условиях примера 4. Оценку результатов осуществляют спустя 7 дней после лечебной фунгицидной обработки.
.В этих условиях наблюдают, что минимальные концентрации, вызывающие 95-100% ингибицию грибков, составляют cooTBeTcTBeHHb, Вес, мг/л Соединение 25033,35
3008
4007
745349;
22
50023,27,34,36
7502,24,25,31,37,
41 и 42 100011,14,17,18,29,
30,38,39,40.
Е. Тест в оранжерее на зерновой ржавчине.
Следуют методике Б, только выргицивают зерновые растения (Tritlcum satfгит.разновидность Etoile de cholsy) Наблюдение осуществляют спустя 14 дней после заражения. Растения обрабатывают в возрасте семи дней (стадия одного листа, высота 9-10 см),затем заражают спорами Pucclnia glumarum, ответственной за зерновую ржавчину, примерно по 7.5 10 спор на чашку.
В,этих условиях наблюдают, что минимальные концентрации, вызывающие 95-100% ингибицию грибков, соответственно следующие:
,Вес, мг/л Соединение
629,18,20
1001,23,31
1255,6,14,15,16,17,
..19,22,25,32,33,
37,40
15024,30
20042
25021,26,27,29,34,
35,38 и 39 .
Таким образом, предложенная фунгицидная композиция обладает усиленным фунгицидным действием.
35
Формула изобретения
Фунгицидная композиция, содержащая, действующее начало на основе
производных 1,3,4-оксадиазола и добавку, выбранную из группы носитель, разбавитель и наполнитель-, отличающаяся тем, что, с целью усиления фунгицидного действия,она
содержит в качестве производного 1, 3,4-оксадиазола соединение общей формулы Q
К-СгГ с см
где R - фенил; фенил, замещенный 13 одинаковыми или разными заместителями, выбранными из группы галоген, нитро,циано, метил, алкокси , аллилокси, метилтио, дйметиламино, 3,4-метилендиоксифенил, нафтил, пиримидинил, замещенный двухкратно хлором, метокси, в количестве 5-95 вес.%. Приоритет по признакам.
23- 74534924
сифенил, нафтил, пиримидинил, заме- принятые во внимание при экспертизе щенный двукратно хлором, метокси. 1. Патент Франции 2211008,
кл. С 07 d.85/00, опублик. 16.08.74.
Авторы
Даты
1980-06-30—Публикация
1978-03-03—Подача