(54) СПОСОБ. ПОЛУЧЕНИЯ НИТРИЛОВ КЕ ОКАРВОНОВЫХ Изобретение относится к способу получения нитрилов кеток рбоновых кислот, которые являются Промежуточ ными продуктами в сийтезеоо-кетокар боновых кислот. Известен способ получения нитрилов ароматических кетокислот, в час ности нитрила п-метоксизамещенной кетобензойной кислоты, взаимодействием хлористого п-метоксибензола с цианидом ртути в стехиометрических соотношениях при температуре 125130 С 1. :.Известен способ получения нитрилов алифатических кетокарбоновых кислот, в частности нитрила пировиноградной кислоты взаимодействием хлористого ацетила с цианидом меди в ацетонитриле при кипячении. Однак выход целевого продукта составляет 50% 2 .. Известные способы получения соот ветствующих нитрилов ограничены использованием определенных исходных и таким образом получением соответ.ствующих конечных продуктов. Целью данного изобретения являет ся увеличение выхода и расширение ассортимента конечных д одуктов.
КИСЛОТ Поставленная цель достигается способомполучения нитрилов кетокарбоновых кислот общей формулы: О II R-C-CN, где R - незамещенный или одно-, многократнозамещенный фенилом,атомом фтора, хлора, брома, линейный или разветвленный алкил Cj-Cg, незамещенный или одно- или многократнозамещенный алкилом , атомом хлора, брома, фтора, фенил, нафтил,пятичленный гетероцикл, который может быть прерван атомом кислорода или серы, замещенный атомом хлора, фтора, брома, нитро-, алкил-, алкоксигруппбй с в алкильной части, циклоалкил с. 3-8 атомами углерода, взаимодействием соответствующего галоидангидрида карбоновой кислоты с цианидом меди в присутствии нитрила карбоновой кислоты при повышенной температуре с последующим вьщелением целевого продукта. Отличительная особенность его состоит в том, что процесс ведут в среде инертного органического, растворителя при содержании нитрила карбоновойкислоты и указанного растворителя в реакциоиной массе соответственно равном 1.. --.
10 мол. эквивалентов и 0,5-20 мол. эквивалентов при 50-180 С.
Выход целевого продукта до 93-95% от теории.
Таким образом, удалось осуществить взаимодействие как с ароил-,так и с алкилгалогенидами, как с бромангидридами кислот, так и с хлорангидрйдами кислот. Во всех случаях получают хорошие выхода,
Наряду с простым осуществлением существенное преимущество способа изобретения состоит в том, что он не ограничен получением специальных нитрилбв кйслот, а может применяться унйверйально, и можно получа г1ь неописанные соединения, например (2,2-дихлор-1-метидцйклопропил)-глиоксилонитрил и (2,2-дихлор-1,3-диметилциклопропил)-глиоксчлонитрил.
В преДлбжёйнойспособе в качестве Нитрила карбоновой кислоты пригоден а цетонитрил, пропионитрил, §ензонитрил. Предпочтительно применять 1,0:-5,О эквивалентов нитрила карбоновой кислоты на моль галоидангидрида кислоты. - . , . ,.
В качестве органических растворителей принимают во внимание, например простые циклические эфиры кик диоксан, или этиленгликолевые п бстые эфиры, или слбжные эфйры как бутилацетат. Особенно пригодны ароматические углеводороды как бензол, толуол, ксилол или тетралин, или а:ли-. фатй ёские углёводбродй как цйклогекса:н или лигроин, с пределами кй йёййя примерно от 90 до 140°С, или галргенированные, предпочтительно хлорир1Ованнйе ароматические углеводородй..
Предложенный способ недгранй- ён получением определенных нитЬйлЬв и; является унйверсальйым, Tak .прзволяет получить йитгрйлы; как ёлйфатичёскйх, так и apoMa й чёckйx кётбкйс- лот.
Пример 1. В сна женйой обратным холодильником реакторе сйешйвают 154,5 г (1,0 моль) 4-мётйл6ензоилхлорида с 117 г (1,3 моль) цйй нистой меди (1),150 мл толуола и 61,5 г (1,5 моль) аце они1: рила. СМёсь нагревают при перемешивании до , вьщерживают при этой температуре и течение 3 ч и охлаждают до 20 с. Biaпад&ющйё в ocaдok этом доли дтфйльтровывают и промывают 2 х 50 мл толуола. ФилbiipaT подвергают фракционюрй neperOHke tipit понижением давлёНИ1Г. -Получают 137 гчйстбгб Цйаййй гого 4-метйлбензойла, что соответствует выходу 95% по отношению к испольэбванному хлорангидЕ йду. Цианистый 4-метилбенз6ил имеет т.кип. 100103 С (15,2 мм рт.ст.).
Пример 2. Следует методике примера 1, о днако вместо . применяют 250 мл дихлорэтана и смесь неисрев&ют только до 90с. Вьеделяют
745361
1125 г цианистого 4-метилбензоила,что соответствует выходу 87% по ртношению к использованному хлорангидриду. Цианистый 4-метил6ензоил имеет т.кип.107-110°С (15,2 мм рт.ст.).
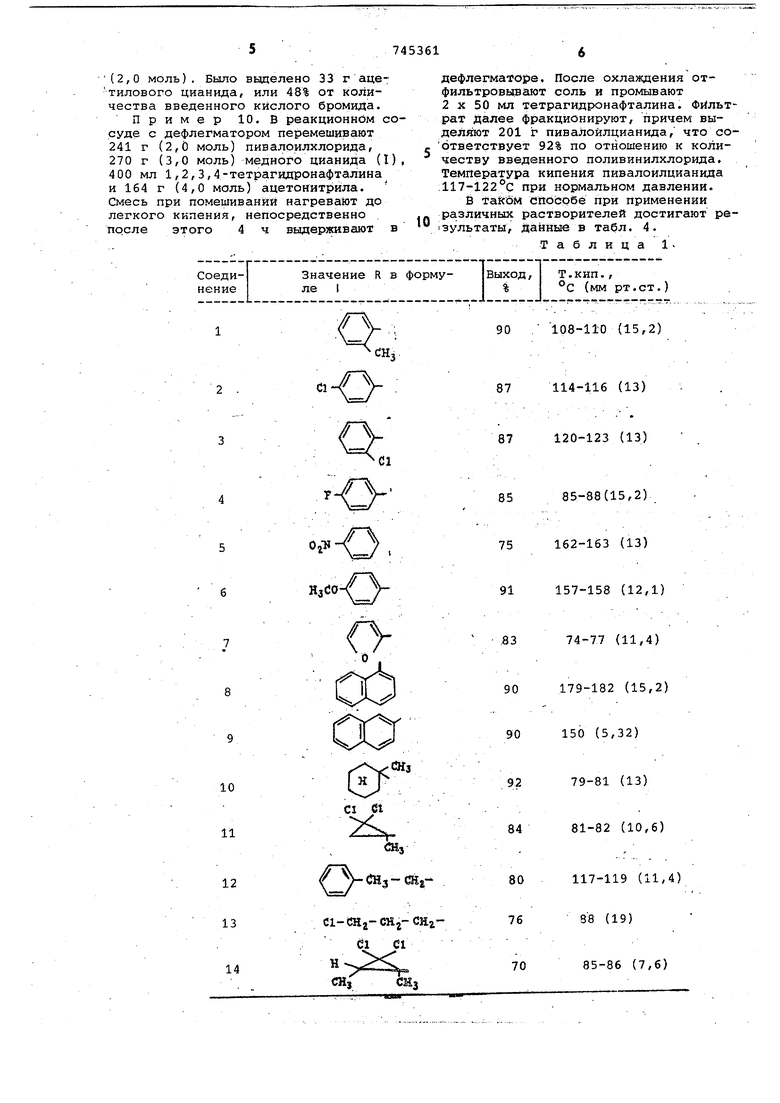
Пример 3. По способу, описанному в примере 1, получают указанные в табл. 1 соединения.
Приме, р, 4. В снабженном обратным холодильником реакторе смешивают 157,0 г (2,0 моль) хлористого ацетила с 270 г (3 моль) цианистой меди(1), 400 мл 1, 2, 3, 4-тетрагидронафталина и 164 г (4 моль) ацетоНитрила. Смесь при перемешивании нагревают до кипения и кипятят с обратйым холодильником в течение 4.ч. Затем охлаждают, соли отфильтрЪвывают и промывают 2 х 50 мл тетрагидронафталина. Фильтрат подвергают фракционной перегонке, при этом первую фракцию вплоть до температуры кипения верха (колонны) 110°С отбирают. Вес этой фракции 291 г, она состоит (по газовой хроматограмме) на 39,5% из нитрила пировиноградной кислоты. Это означает выход 84% нитрила пировиноградной кислоты по отношению к использованному хлористому ацетилу.
П р и ме р 5. Следует методике примера 4, однако вместо хлористого ацетила используют 241 г (2,0 Моль) хлористого триацетилацетила. Фракционная перегонка дает 201 г чистого нитрила триметилпировиноградной кисЯоты, что соотвействует выходу 92%, по отношению к использованному хлористому трймётилацетилу. Нитрилтриметилпировиноградной кислоты имеет т.кип. 117-122°С при нормальном давлений., : . ,
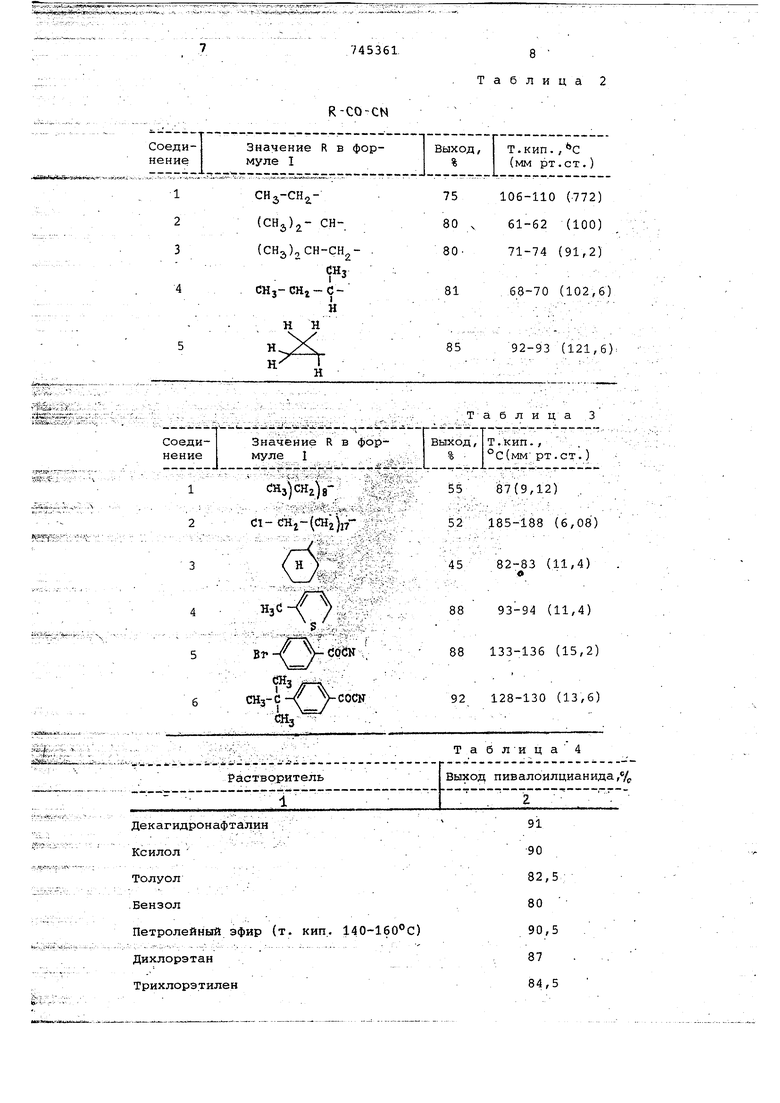
Пример 6. Описанным в примере 5 способом получают соединения формулы I, данные в табл. 2. «. .
Пример 7. Обработку ведут в соответствии с примером 1, гтри этом получают соединения, приведённые в табл. 3.
Пример 8. В реакционном сосуде с дефлегматором производят нагрев смеси при постоянном помешиваний в течение 1 ч. Состав смеси: 113- г (1,0 моль) ацетилбромида, 1030 г (10 моль) бензонитрила, 55 г тётрагидровафталина и 95 г (1,05 моль) медй цйамида (1). Температура нагрева 90с. После этого из колбы отфильтровывают ацетидцианид. Количество йнделанного ацетилцианида составnftet 42 г (61% от количества ввёденйбго кислого ;бромида).
Пример 9. Опыт проводят таким же образом, что и в примере 8, однако вместо 1030 г бензонитрила в опыте участвуют 103 г (1,0 моль), вМертр 55 тетрагидгЗонафталина 2200 г тетрагидронафталина и вместо 95 г меднрго цианида (I) - 180 г
(2,0 моль). Было вьщелено 33 г ацетилового цианида, или 48% от количества введенного кислого бромида.
Пример 10. В реакционном сосуде с дефлегматором перемешивают 241 г (2,0 моль) пивалоилхлорида, 270 г (3,0 моль) медного цианида (I), 400 мл 1,2,3,4-тетрагидронафталина и 164 г (4,0 моль) ацетонитрйла. Смесь при помешиваний нагревают до легкого кипения, непосредственно после этого 4 ч выдерживают в
дефлегматоре. После охлаждения отфильтровьшают соль и промывают 2 X 50 мл тетрагидронафталина. Фильтрат далее Фракционируют, причем выделяоот 201 г пивалойлцианида/ что соответствует 92% по отношению к количеству введенного поливинилхлорида. Температура кипения пивалойлцианида ; 117-122 с при нормальном давлении. В TakoM спосрбе при применении
различных растворителей достигают результаты. Данные в табл. 4.
Таблица 1R-CO-CN
745361
8 Таблица 2


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения нитриловКЕТОКАРбОНОВыХ КиСлОТ | 1977 |
|
SU799653A3 |
| Способ получения -замещенных ами-дОВ -КЕТОКАРбОНОВыХ КиСлОТ | 1978 |
|
SU797573A3 |
| Способ получения амидов -кето-КАРбОНОВыХ КиСлОТ | 1977 |
|
SU799651A3 |
| Способ получения -кетокарбоновой кислоты | 1977 |
|
SU793376A3 |
| Способ получения бензоилцианида | 1977 |
|
SU843734A3 |
| Способ получения пеницилламина | 1971 |
|
SU508207A3 |
| Способ получения производных 1,2,4-триазин-5-она | 1978 |
|
SU791236A3 |
| Способ получения 6-азазн-1,4-бензодиазепинов или их таутомерных или изомерных форм, или их солей | 1973 |
|
SU567406A3 |
| Способ получения 6-аза-3н-1,4-бензодиазепинов | 1972 |
|
SU468423A3 |
| Способ получения бензоилцианида | 1978 |
|
SU1093243A3 |

: т ::;:: -: -;ч:
4582-83 (11,4)
H,C.,
-V- „
Вт
СНз yj СНз-С-/ VcOCN
ctt,- .
iAhib.. A . .J
:-,..
,L
Декагидронафталин Ксилол Толуол .Бензол
Петролейный эфир (т. Дихлорэтан Трихлорэтилен
8893-94 (11,4)
88 133-136 (15,2)
92 128-130 (13,6)
91
90
82,5
80
90,5
87
84,5
Тетрахлорэтан
Хлорбензол
Анизол
Бензойная кислота метилового эфира
. Формула изобретения
Способ получения нитрилов кетокарбоновых кислот общей формулы
R-$-CN,
где R - незамещенный или одно- или многократнозамещенный фенилом, атомом фтора, хлора, брома, линейный или разветвленный алкил Cj-Cg, незамещенный или одно- или многократнозамещенный алкилом Cj-Cg, атомом хлора, брома, фтора, фенил, нафтил, пятичленный гетероцикл, который может быть прерван атомом кислЬрода или серы, замещенный атомом хлора, фтора, брома, нитро, алкилалкоксигруппой с Cj-Cj, в алкильной части, циклоалкил с 3-8 атомами углерода, взаимодействием соответствующего галоидангидрида карбоновой кислоты с
Продолжение табл,4
I -. I . ИГ- I I I -И
2
82
90,5 78,5 81
цианидом меди в присутствии нитрила карбоновой кислоты при повышенной температуре с последующим выделением целевого продукта, отличающийся тем, что, с целью увеличения выхода и расширения ассортимента конечных продуктов процесс ведут в среде инертного органического растворителя при содержании нитрила карбоновой кислоты и указанного растворителя в реакционной массе соответственно равном 1-10 мол. эквивалентов и 0,5-20 мол. эквивалентов при 50180°С.
Источники информации, принятые во внимание при экспертизе
.1. Вег. Chem. Ges., kk, 2465. 2. OAmour Bull. Soc. Chem.
France, 1972, c. 2402-2403 (прототип) .
Авторы
Даты
1980-06-30—Публикация
1977-06-02—Подача