(54) СПОСОБ ПОЛУЧЕНИЯ 6-АЗА-ЗН-1,4-БЕНЗОДИАЗЕПИНОВ








Изобретение относится к способу получения новых проиэво;5ных 6-ааа-ЗН-1,4-бензодиазепиноБ, обладающих neipibiMH фар i макологическими свойствами. Основанный на применении ряда известных реакций (на пример, аиелирование аминов хлорангидриJ дами кислот, конде нс1ашя аминосоединений с кетонами, а илировавйе аминов и т, д.) предлагаемый способ позволяет получать новые производные диазёпнна, обладающие лучшими свойствами, чем структурные аналоги подобного действия. Описывается получение соединений обще формулы где Ц.. - атом галогена ; Ц и Но одинаковые, |различные и означают водород, галоген, трифторме1 ильную, нитро- , нитрильную , окси-. 1ШЗК(эм6леКулэд с ную алкильную или нкзкомолекупярную алкоксигруппу4 водорода, оксигруппа, ацилированная алифатическими моно- или дит-карбоновыми кислотами с 2 -г 6 атомами углерода оксигруппа, низкомодшсупярная алкокси-, низк6моле1Д/лярнаа алкильная, бензильнаяв ннзкомрлекулярная, алифатическая адильная, карбокси- или низкомолекулярная карбалкоксигруппа; 2, - атом азота или группа О; fj - атом водорода, низкомолекулярная, алкильная группа, замещенная циклоалкильным остатком с 3 - 6 атомами углерода, низкомолекулярная алкенильная группа, шклоалкильнея группа с 3 - 6 атомами углерода, низкомопекулярная оксиалкильная, бензильная группа, алифатическая ацильная группа с 2 - 6 атомами углерода или аминоалкильная группа с 2 - 7 атомами углерода, которая может быть замещена по азоту одной или двумя алкильными группами, причем две алкипьные грушты вместе с атомом азота могут также образовывать 5 -7-членное гетероциклическое кольцо, которое может содержать еще один гетероатом азота или кислорода J
А - атом кислорода или серы или груп- . па - NRg , -NORg , NH -,NHRg или два
атома водорода ,
или их солей.
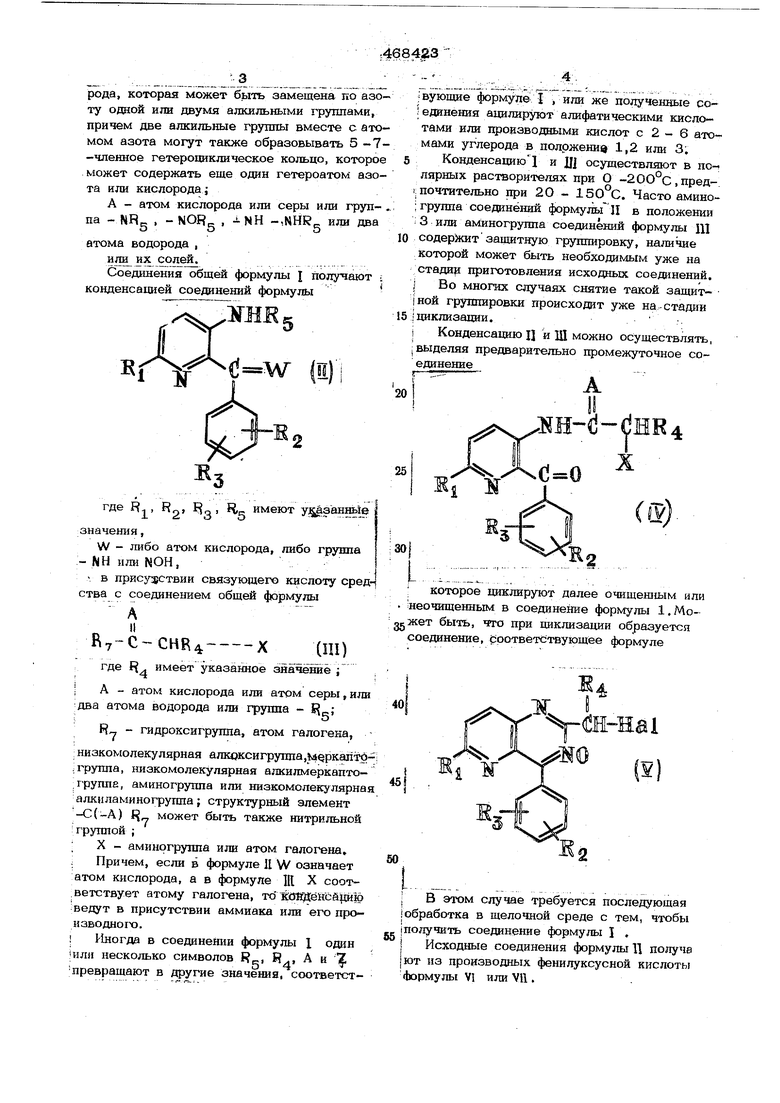
Соединения общей формулы J получают ; конденсацией соединений формулы
.ЖНЕ
IE
В
где R, Rg 3 5 значения,
W - либо атом кислорода, либо группа
NH или NOH,
в присуа;ствии связуюшего кислоту средства с соединением общей формулы
и Ry-C-CHB X(Ш)
где J. имеет указанное значешё ;
А - атом кислорода или атом серы, или два атома водорода или группа -
Я„ - гидроксигруппа, атом галогена,
низкомолекулярная алкоксигруш1а,ц рк алто.группа, низкомолекулярная алкилмеркаптогруппа, аминогруппа или низкомолекулярная алкиламиногруппа; структурный элемент -С(-А) может быть также ннтрильной группой ;
; X - аминогруппа или атом галогена, ; Причем, если в формуле Л W означает атом кислорода, а в формуле Ш X соот.ветствует атому галогена, тоХОВДеНсй рю
ведут в присутствии аммиака или его производного.
Иногда в соединении формулы 1 один :или несколько символов R, R ., А к Ij. превращают в другие значения, соответст;вующие формуле I , или же полученные со;единения ацилнруют алифатическими кислотами или производными кислот с 2 - 6 атомами углерода в полржени) 1,2 или 3.
Конденсацию1 и JJJ осуществляют в по- лярных растворителях при О -20О°С, пред, почтительно при 20 - 150°С. Часто амино; группа соединений формулы П в положении 3 или аминогруппа соединений формулы Ш содерХит защитную группировку, наличие которой может быть необходимым уже на стадии приготовления исходных соединений.
Во многих случаях снятие такой защит- ной группировки происходят уже на-стадии циклизации.
Конденсацию I и Ш можно осуществлять, выделяя предварительно промежуточное соединение
А
; которое циклируют далее очищенным или неочищенным в соединение формулы 1. быть, что при циклизации образуется соединение, соответствующее формуле
40
45|
SO
I В этом случае требуется последующая (обработка в щелочной среде с тем, чтобы (получить соединение формулы I .
S5 I Исходные соединения формулы Ц получе }ют из производных фенилуксусной кислоты формулы VI или VII.
(ш)
CHgtiOgK (Ш)
R
где R - водород или низшая алкильная группа, и 2,3-дихлор-З-нитропиридана в присутствии сильного основания (амид калия, гидрид натрия и т.д.)
Образующееся при этом соединение фор мулы
где С, - С N или СО J ,
превращают далее окислением в соеди:нение формулы
,т
ПГ
Аминирование IX приводит к соответствующему 6-аминопиридин-производному, из которого реакцией Зандмейера получают соединения формулъ
(X)
6где J -фтор.или бром,
нитрогруипу которых восстанавливают ; обычным способом до аминогруппы с обра|зованием соединений формулыЦ , где W |означлот кислород.
I Соединения, соответствующие общей формуле; П . где W является группой - NH или -N ОН, можно получить, например, из соединений, соответствующих формулеП , где
iW является кислородом, 1 , FJ,, R и Ц f ,X t3о
имеют указанные значения, взаимодействи;ем с аммиаком или гидроксиламином. Эта I реакция протекает предпочтительно в поляр;ных растворителях (атшфатические спирты, :диоксан, тетрагидрофуран, пиридин, жидкий аммиак), предпочтительно О - 15О С, а также под давлением 1 - 1ОО атм.
Пример. 5-фенил-6-аза-7-хлор-1,2-.ДИГИДРО-ЗН-1,4-бензодиазепинон -2.
.-бе1азилоксикарбонилглицина суспендирувэтся в 400 мл сухого эфира (диэтилового) и при деремещивании добавляют 21 г пятихлористого фосфора. того, как все перейдет в раствор, при перемещивании добавл5ают 23 г 2-бензоил-З-амино-6-хлорпиридина в 9О мл хлороформа и перемещивают 2 часа при к6мнаа :я ной температуре, причем выпадает 2-бензойл-3- N-r( бензилоксикарбониламиноацетил) -амино-6-хлорпиридин. Его отсасывают и промывают эфиром (выход 30 г, т. пл. ХЗО-С). ipSi г этого промежуточного продукта порщ1ями добавляют к раствору lOOiбромистого водорода в 360 мл ледяной уксусной кислоты. Выделяется СО . Затем
перемещивают еще час и добавляют эфир для полного выделения осадка. Осадок отсасывают, суспендируют в метаноле и добавляют концентрированный водный раствор аммиака, после чего вещество переходит. Б раствор. После кратковременного стояния, смещивают с водой вплоть до помутнения, после чего вещество выкристаллизовывается. Перекристаллизовывают из изопропанола. Выход 50 г , т. пл. 198 С. Приготовление исходных веществ , К охлажденному и перемешиваемому раствору 190 г 2,6-дихлор-З-нитропиридина R: 117 г бензилцианида в 2 л диоксана |8обавшют в атмосфере азота 64 г гидрида натрия (80% в вазелиновом маазе). ;Постепенно начинает выделяться мелкозер1нистый осадок, температура повыщается (при охлаждении- ледяной водой) до 30 С. Через 3 часа добавляют 20 мл спирта, пе|рёмешивают еще20 мин, затем отсасыва; iioT. Натриевую соль растворяют в 1 п , смешивают с разбавленной уксусной i кислотой до изменения окраски. Образующнйся 2-( а -1шанобензил)-3-нитро-6-хло пиридин выкристаллизовывается чистым. Т. пл-. 165 С ; выход 146 г. Смесь 20О г 2-(01 -1щанобензил)-3-ни |тро-6-хлорпириданау 600 мл ацетона и |160 мл ЗО%-ного раствора перекиси водо рода при перемешивании при 35 - 4О С, по каплям смешивают с концентрированным раствором гидроокиси калия ( из 75 г КО и 5О мл воды). Прикапывают так быстро, что не происходит изменение цвета. После изменения цвета, которое указьшает на окончание реакции, реакционную смесь охлаждают и декантируют раствор с кристаллического вещества. Этим веществом, количество которого может колебаться меж,ду 3U и 40 г, является 2-бензоил-З-ни ро-6-хлорпиридин, который очищают кристаллизацией из метанола.Т.пл. iO6 С. Фильтрат подкисляют разбавленной соляной кислотой, после чего вьшадает 2-бензоил-3-нитро-6-оксипиридин в количестве 120 :;i40 г; т. пл. 211 С. Гидроксисоединение путем хлорирования переводят в 2-бензоил-3-нитро-6-хлорпи ридин.Для этого 190 г 2-бензоил-З-нитро-6-оксипиридина перемешивают с 2ОО мл треххлористого фосфора, 50О мл оксихлорида фосфора и 190 г пятихлористого ;фосфора в течение 4 час.-.при 72 С. Затем (галогениды фосфора упаривают в вакууме : на роторном испарителе, остаток забирают :в 1 л хлороформа, промывают ледяной во|дой, 2 раза разбавленным раствором ед: КОГО натра и 2 раза водой. Органический ; раствор высушивают, упаривают в вакууме досуха и остаток перекристаллизовывают из метанола. Выход 145 г, т. пл. 106 С. 110 г 2-бензоил-3-ннтро-6- хлорпиридина каталитически гидрируют в 500 мл диоксана при 6О атм и 20 С над ЗО г никеля Ренея, Отфильтрованный раствор концентрируют в BaKyyivie охлаждают до 5 С, 2-бензоил-3-амино-6-хлорпиридин отсасывают и перекристаллизовывают из :этанола. Выход 78 т. пл. 159 С. ; Прим ер, 2. 5-фепил-6-аза-7. ,2-дигидро-З Н-1,4-бензодиазепи |нон-2. j 15 мл бромацетилхлорида перемешива ют 2 часа при комнатной температуре с 33 г 2-бензоил-3-амино-6-хлорпирид11на в 2 ОО; мл jaHOKcaBa в присутствии 11,5 г ; пиридина. Отсась вают, промывают эфиром, и затем 25г:промеясуточного продукта растворяют в 9ОО мл 12%-ного метаноль. ного раствора а1 1миака и оставляют стоять : в течение ночи. Раствор упаривают в вакууме досуха, остаток растворяют в 200 мл хлороформа, раствор промывают водой. Высушенный раствор подкисляют 6 н. соляной кислотой и смешивают с бензолом до помутнения. Вьпсристаллизовавшуюся HCi I соль через 2 часа отсасывают, растворяi ют в метаноле и с помощью аммиака получают основание, которое выкристаллизовывается при добавлении воды. Выход 10 г; т. пл. 198 - 2ОО°С. Пример 3. 5-фенил-6-аза-7j хлор-1,2-дигидро-ЗН-1,4-бензодиазепиНОН-2-4-ОКСИД. 2-оксиминобензоил-3-амино-6-хлорпи.ридин (сырой продукт), полученный из .46 г 2-бензоил-3-амино-6-хлорпиридина, 7О г гидроксиламингидрохлорида, растворяют в 4ОО мл ледяной уксусной кислоты и добавляют 32 мл хлорацетилхлорида. Смесь оставляют стоять 2 дня, затем про пускают хлористый водород до насыщения и оставляют стоять еще 3 дня. Раствор выпаривают в вакууме, остаток забирают в метиленхлорид и органический раствор промьтают водой и холодным раствором соды. Высушивают, концентрируют до 15О мл и добавляют петролейный; эфир (40 - 70 С) до помутнения. Спустя 2 часа отсасывают выделившиеся кристаллы 5-аза-6-хлор-2-хлорметил-4-фенилхиназолин-3-оксида (выход 23 г, т, пл. 146 С) , 6,5 г этого вещества добавляют к смеси 8 г гидроокиси натрия, 2 О мл воды и 100 мл этанола при комнатной температуре. ; После перемешивания в течение часа раствор разбавляют водой и аодкисляют соляной кислотой. % 1кристалли.зовавшееся соединение отсасьтают и пе рекристаллизовывают из этанола. Выход }4,5 г; т. пл. 215°С, ; I Приготовление исходного соединения, Юмесь 46 г 2-бензоил-3-амино-6-хлор|пиридина, 10О мл пиридина и 40О мл I этанол кипятят в течение 6 час при не|ремешивании. Растворители упаривают в вакуум; продукт реакции выделяется в |виде сиропа. Он непосредственно перера|батывается далее.
.9 i Пример 4. З-Метил-5-фенйп|б-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазепинон-2, Смесь из 26 г 2- ензоип-3-амино- б-хлорпмридина,- 28 г бенйилоксикарбонил-4,1 I -аланина, 28 г пятихлористого фосфора и ОО мл эфира перемешивают 1 час при комнатной температуре. Затем упаривают досуха и сиропообразный остат ;{50 г) обрабатывают раствором 7О г HB в 20 мл лёд$шой уксусной кислоты, как |указано в примере 1, Продукт, выпадающи ИЗ аммиачного раствора, частично циклизо ван и циклизуется до конца путем 3 - 4- час перемешивания в 200 мл кипящего то ;луола в присутствии 3 мл пиридина. Иско мое соединение выкристаллизовьшается из толуольного раствора и перекристаллизовы вается. Выход 26 rj т. пл. 182 С. Пример 5, З-Изопропил-5-фени 6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазепинон-2. Смесь из 26 г 2-бензоил-3-амино-6хлорпиридина, 30 г бензиаоксикарбонилd , t -аланина, 26 г пятихлористого фос фора и 400 мл эфира перемешивают 1 ча при комнатной температуре. Затем упарив ют досуха и сиропообразный остаток (40 г обрабатывают раствором 50 г НВГ в 160 мл ледяной уксусной кислоты аналогично примеру 1. Из аммиачного раствора выпадает си- I ропообразное основание, которое, согласно i данным тех, частично состоит, из нециклизованного соединения. Это основание за тем Ш1клизуется путем 3-час перемешива ния в 2ОО мл кипящего толуола в присут ствии 3 мл пиридина. Искомое соединение выкристаллизовывают из толуольного раствора и перекристаллизовывают из смеси бензол-бензрш. Выход 14 г j т. пл. 225226°С. Пример 6. 5-({ -Хлорфенил)6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазепинон-2. К смеси из 34 г 2-о-хлорбензоил-3- амино-6-хлорпиридина, 27 г бензилоксикарбонилглицина и 300 мл диоксана при перемешивании добавляют порциями 27 г пятихлористого фосфора. Температура повышается от 27 до 37 . Перемешивают далее 1 час и затем постепенно добавляют 800 мл петролейного эфира. После внесения затравки выкристаллизовывается 5О г промежуточного соединения. 20 г этого соединения обрабатывают далее как
:1D в примере 1. Продукт, выпадающий из аммиачного раствора, содержит еще большое количество нециклизованного соединения и циклизуется путем 3-час перемешиВания в 200 мл кипящего толдола с 3 мл пиридина. Чистое соединение выкристаллизовывается из толуольного раствора. Выход 10 ri т. пл. 2О1°С. Пример 7. 5-{о-Хлорфенил)6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензоI диазепинон-2-4-оксид. Примерно 70 Г2- Qrxлopбeнaoилoкcиминo)-3-aминo-6-xлopпиpидинa (сырой продукт) растворяют в 400 мл 99%-ной ледяной уксусной кислоты и добавляют 46 мл хлорацетилхлорида. Затем пропускают ток ;НС , причем постепенно выкристаллизовы вается 2-(о-хлорбензоилоксимино)-3-хлор:ацетиламино-6-хлорпиридин (выход 53 г, т. пл. 134 - 138 С). 36 г этого соединения растворяют в 150 мл 70%-ного эта,нола и при перемешивании и охлаждении с i помощью ледяной бани добавляют 40 г |500%-ного КОН, Оставляют реагировать ;на ЗО мин при 2р°С, Прозрачный раствор подкисляют уксусной кислотой и смешива;ют с 100 мл , Кристаллический осагдок белого цвета Г 6тсась1вают, промыва- ,ют изопропанолом и перекристаллизовыва- ют из смеси диокеан-бензин. Выход 14 г; IT. пл. 241 - 243°с. Исходное соединение получают следую|щим образом. i Смесь из 70 г 2-{о-хлорбензоил)-3I амино-6-хлорпиридина, ЗО г гидроксила мин-гидрохлорида и 2 GO мл пиридина пе ремешивают 20 час при комнатной температуре. Добавляют еще ЗО г гищюксиламин-НС и перемешивают 20 час. Затем пиридин угоняют на роторном испарителе, остаток забирают в 2ОО мл хлороформа и этот раствор промывают несколько раз водой, а затем высушивают. Вещество выкристаллизовывается частично из осушенного раствора. Пример 8. 5-(2,5-Днхлорфенил)j 8-аза-7-хлор-152-дигидро-ЗН-1,4-бензодиазепинон-2. Смесь из 10 г 2-(2,5-дихлорбензоил)З-амино-б-хлорпиридина, 7О мл сухого диоксана, 10 г бензилоксикарбонилглицича и 10 г ляткхлористого фосфора перемешивают 2 час при комнатной температуре. Затем растворитель удаляют в вакууме и остаток (14 г) обрабатывают далее как
il
описано в примере 6, Выход 8 г; т. пл,
:240°С.
П р и м е.р, 8 Д-Метил-б-СО-фторфенил )-6-а Цт-7.,дигидро- ЗН--1,4бензодиазепинон -2.
Смесь из 25 г 2-Огч})торбёнз нл43- - метиламино-6-хлорпиридина,. ЗО г бёнзилоксикарбонилглицина, 100 мл диоксана и. 30 г пятихлористого фосфора перемешивают 2 час при комнатной температуре. Затем растворитель удаляют в вакууме и остаток (б1 г) поршшми добавляют к 500 мл 4О%-ного НВг в ледяной уксусной кислоте и перемешивают далее в течение 1 ча .Затем реакционный раствор смешивают с 1,5 л эфира, аморфный осадок отфильтровывают и нагревают при интенсивном перемешивании до кипения с 500 мл толуола и 1ОО мл пиридина в течение 4 час с водоотделителем. После этого реакционную смесь отфильтровывают, а раствор упаривают на роторном испарителе досуха. Остаток перекристаллизовывают из
этанола. - о Выход 22 г: т. пл. 139°С.
г;
Пример 1О. 5-( О-фторфенил)6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазелинон-2.
Смесь.,из 35 г. 2-о-фторбензоил-3-амино-6-хлорпиридина, ЗЗг бензилоксикарбо-: нилглицина, 500 мл эфира и 33 г пятихлористого фосфора перемешивают 2 час при комнатной температуре. Затем растворитель удаляют в вакууме и остаток (55 г) обрабатывают далее аналогично методу, ; описанному в примере 6. Полученный продукт перекристаллизовывают кз | -пропанола. Выход продукта 28 г; т. пл. 195 lee c.
Пример 11. 3-Бензил-5-4)енил6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензОдиазепинон-2.
I Смесь из 35 rdr t -карбобензоксифенипаланина, 4ОО мл эфира и 26 г пяти; хлористого фосфора перемешивают 20 мин К раствору добавляют 26 г 2-бензоил: 3-амино 6-хлорпиридина и перемешивают i час при комнатной температуре. Промежуточный продукт отсасывают и после высушивания (45 г) аналогично методу, описысанному в примере 6, перемешивают с 280 мл 4О%-ного НВг в ледяной уксусной кислоте и вналог-ично обрабатывают далее. Выход продукта 28,4 г; т, пл, 234 и.
Пример 12. 3-Окси-5-(о г-х лорфенил )-6-аза 7-хлор-1,2-дигидро-ЗН1,4-бензодийзепинон-2.
Д2
ЗОО г КОН добавляют при 15 С к раствору 110 г 1-ацетил-Зааетокси-5-. |1(о-ч и1ррфеваа:л)-.6-аза-7-хлорЗН-1,4-бензодЙазепинона-2 ,,4ОО МЛ этанола. Перемешивают. 30 :м1гщ npja- ком .; температуре ПрР:31ра.чзиЬ1йГраствор .;-прсле; п.с. ;укс|гсjapi кнслоил до рНJ S ;сме1Ч1иваит, .е;, .цл , .Выде m wjt&es iiHO
вают.-фидатрат .смбцшваютс 1,5 л . и экстрагиругот хлороформом. Органическую . фазу высушивают и концентрируют. Остаток дважды перекристаллизовывают из этанола. Выход продукта 23
г ; т, пл. 200 202°С.
Пример 13, 5-Фенил-6-аза-7хлор-1,2-дигидро-ЗН-1,4-бензодиазепи нон-2.
i 3 г 5-фенил-6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазепинон-4-оксида гидрируют в 150 мл метанола при нормальном давлении и комнатной температуре над 5 г никеля Ренея, Теоретический I объем водорода поглошается через ЭОмнд Отфильтрованный раствор выпаривают;в вI кууме досуха, остаток перекристаллизовьт ют из этанола.Выход продукта 2г;т,пл,198 I Пример l4, 1-Ацетил а-ацетокси-5-( 0-хлорфенил)-6-аза-7-хлорJ1,2 дигидро-ЗН-1,4-бензодиазешшон-2, Смесь из 23 г 5-(0 -хлорфенил)-6; аза-7-хлор-1,2-дигидро-ЗН-1,4-бензоди i азепинон-2-оксида и 12О мл ацетангидЧрида кипятят ЗО мин. Затем выливают в 700 мл ледянрй воды. Выкристаллизовав шееся вещество перекристаллизовывают
метанола. Выход продукта 15 г . из |т. пл, 203 - 207°С.
Пример 15, З-Гидрокси-5-фенил16-аза-7-хлор-1,2-дигидро-ЗН-1,4 бензо; I диазепинон-2,.
j Нагреванием г 5-фенил-6-ааа-7;| хлор-1,2-дигйдро-ЗН-1,4-бензодиазепинон , -2,4-оксида с 160 мл ацетангидрида
(ЗО мин на водяной бане) получают смесь из 1-адетил-3-ацетокси-5-фенил-6-аза7-хлор-1,2 дигидро-ЗН-1,4 бензодиазе. пинона-2 и 3-ацетокси-5-феиил-6-аза7-хлор-1,2-дигидро-ЗН-1,4-бензодиазепинона-2. От этих соединений отщепляется ацетильная группа при обработке водно-этанольным раствором КОН при 15 С. После подкисления и разбавления водой экстрагируют хлороформом и остаток после упаривания хлороформа дважды перекристаллизовывают из этанола, Выход продукта 11 г; т. пл. 3 52 - 155 С.
:Щ.,
Пример 1бг,i leтип-5r4eнилi 6-аза-7 -хлор-1,2 -да гия.р9-ЗН -1; 4-беу зоi диазепинон-2., .;--.:;,:;- -; ,:v
I К 20 .г 5-фенил-6-аза-7-:-хп ррп1,2-ди: гидро-ЗН-1,4- ензрдиазепинрна-2 в il20 МП сухого диметилформамида дрбав- 1Пяют порциями в атмосфере азота 2,5 г гидрида натрдя (8О% в вазелиновом мас)Ле). Температур; поддерживают 25 С,
Через час прикапывают 15 г йодистого
метила, затем продолжают перемешивание 1 час при 30 С и 1 час при 40 С. После I стояния в течение ночи растворитель вы|паривают в вакууме, остаток забирают в 1 мётиленхлорид, промывают несколько раз iводой и один раз разбавленной соляной ;кислотой, высушивают над сульфатом и концентрируют. Остаток перекристаллизо шают из смеси бенз -бензин. Выхо
продукта 11 г; т. пл, 154 С,
Пример 17. 1-Aллил-5-фeнил|6-aзa-7-xлop-l ,2-дигидро-ЗН-1 ,4-бензодиазепинон-:-2.
Соединение получают аналогично приме ру 17 при применении 2О г 5-фенил-6- аза-7-хлор-1,2-дигидро-З Н-1,4-бензодиазешшона-2 и 11 г аллилбромида. Выход продукоди7 г; т. пл. 94 С.
Пример 18. 1-Циклопропилметил-5-фенил-6-аза-7-хлор-1,2-дигидроЗН-1,4-бензодиазепинон-2.
Соединение получают аналогично примеру 17 при применении 23 г 5- ёнил-6аза-7-хлор-1,2-дигидро-ЗН-1-,4- ев:зодиазепинона-2 и 1.2 г циклопропилметилхлорида. Реакционный продукт хроматрграфией, на колонке с окисью алюминия (длина 60 см, диаметр 5 с, растворител хлороформ). Чистое соединение затем растворяют примерно в 1ОО мл эфира и добавляют изопропанольную 6 н. НС& , посл чего выкристаллизовывается гидрохлорид. Выход продукта 5 г; т, пл. 180 - 188 С
Пример 19, 1-( -Диэтиламиноэти л)-5-фенил-6-аза-7-хлор-1,2-дигидро-ЗН-1,4-бензодиазопинон-2.
К раствору 20 г 5-фенил-6-аза-7хлор-1,2-дигидро-ЗН-1,4-бензодиазепинона-2 в 50 мл диметилформамида добавляют реремешивании в атмосфере азота при комнатной температуре 2,5 г гидрида натрия (8О% в вазелиновом масле). Температуру в течение ЗО мин повышают до 5О С, затем прикапывают раствор 9 г свежеприготовленного диэтиламиноэтип - , . .,., ,/14,
:хлорида в 20 мл диметилформамида и 0,5 г йодида калия. Смесь перемешивают 1 час.при 7О С, затем концентрируют в вакууме до 20 мл, добавляют 50 мл 5этанола и 60 мл воды. Вещество выкристаллизовывают при трении. Перекристал:лизовывают из смеси бензол-бензин. Вы;х д продукта 15 Г; т. пл. 154 С.
: Пример, 20. i-Meтил-5-(or ;Xлopфeнил)-6-aзa-7-xлop- l.,2-дигидpo: ЗН-1,4-бензод1Шзепинон-2,
,10 г р- (сн : хлорфенил)-6-аза-7-хлор1,2-дигидрО-ЗН,-1,4-бензодиазепино;н 2,, метилируют -аналогично примеру 17. Реакционный раствор упаривают в. вакууме, осi таток смешивают водой и бензолом, бёнг i зольной слой .дважды промывают водой,. :затем высушивают. При добавлении 6 н, изопропаног1ьного раствора соляной кислоты выкристаллизовывается гидрохлорид. Перекристаплизовывают из смеси метанолэфир и из этанола. Выход продукта 4 г; т. пл. 204 - 2О6°С (разложение).
Пример 21. 5-Фенил-6-аза-7хлор-1,2-дигидро-ЗН-1,4-бензодиазешш.
К смеси из 11,5 гЦАШ. в 2ОО мл сухого тетрагидрофурана прикапывают 41 г 5-фенил-6-аза-7-хлор-1,2-дигидро-ЗН1,3-бензодиазепинона-2, растворенного в
-600 Мл тетрагидрофурана, при перемешивйний в течение 45 мин. При этом темпе. -, .о
ратура повышается до 4О С. Нагревают до 60 С и выдерживают при этой температуре 6 мин, затем быстро охлаждают до : О - 10 С и прикапывают смесь из 28 г ; воды, 15 г метанола и 1ОО мл тетрагидрофурана. Все операции осуществляют в
1 атмосфере азота, Реакищонную смесь фильтi, руют, фильтрат высушивают и упаривают в f вакууме. Остаток забирают в бензол. Из ; бензольного раствора при стоянии в тече-i. ние ночи при 5 - 7 С выкристаллизовывается искомое соединение в виде основания.
5 К маточному раствору дoбaвлs ют раствор 10 г малеиновой кислоты в 5О мл ацетона, после чего выкристаллизовывается малеат. Его перекристаллизовывают из эта-f. нола. Т. пл. 186 - 187 С (разложение). Выход в расчете на малеат 15г.
Пример 22, 1-Метил-5-фенил6-аза7-хлор-1,2-дигидро-ЗН--1,4-бензодиазепинтион-2.
25 9.5Ё.5Ё 26 г 5-фенил-6-аза-7-хлор1,2-дигидро-ЗН-1,4-6ензод11азешпюна-2, :32 г пентасульфида фосфата и 150 мл то15j nyona нагревают при перемешивании в течение 2 час. Затем фильтруют, раствор упа ривают в вакууме, остаток объединяют с остатком после фильтрования и обрабатыва ют концентрированным рартвором аммиака После 30 миа дэремешивания: отсасывают. Продукт растворяют в хлороформе, хрома тографируют на колонке с Ькйсью алюминия {д7шна 60 см, диаметр 5 см, раствор Зритель хлороформ.), перекристаплизовывают из .бензола. Выход продукта Юг; т, пл. 158°С, , . П р и м е.р 23. 1-Метил-5-(о-хлорфени л)-6-аза- 7-xjfop-l, 2-дигидро-3 Н-1,4 I бензод 1азепинтион-2. I Получают аналогиро примеру 23 из J40 г 1-метш1-5-(о-5слорфенил)-6-азаj 7 -хлор-1,2 -ди гидро-3 Н-1,4-бензодиазепинона-2 и 29 г пентасульфида фосфора в 12 ОС мл толуола. Выход продукта 12 г ; IT. ял. 188 - 189°С. : I Пример 24. 5-Фенил-6-аза-71 хлор-1,2-дигидро ЗН-бензодиазепцтд9}|-2. Смесь из .54 г 5-фенил-6-аза-Ут-ялор1,2-дигидро-ЗН-1,4-бензодиазепинона-2, 44 г пентасульфида фосфора и 6ОО мл толуола кипятят в течение 2,5 час в атмосфере азота. Зернистый осадок отсасывают, несколько раз перемешивают с хлороформом, обрабатывают водным аммиаком и еще раз экстрагируют хлороформом. Из экстрактов после высушивания выкристалли зовывается тион. Выход продукта 30 rj т. гш. 202°С, 1 Пример 25. 2-Ацетилгидрази; но-5-фенил-6--аза--7-хлор-ЗН-1,4-бензс диазепин. Смесь из 6 г ацетилгидразина, 10 г I 5-фенил-6-аза-7-хлор-1,2-дигидро-З Нi 1,4-бензод 5азепинтиона-2 и 50 г диоксана нагревают 20 мин до 5О - 6О С. При этом выкристаллизовывается искомое соединение. После охлаждения его огсасыва ют и перекристаллизовывают из этанола. Выход продукта 10 г; т. пя. 176 С. Пример26. 2-Мотиламино-5фенил-6-аза-7-хлор-ЗН-1,4-бензо диазепин. Юг 5-фенил-6-аза-7-хлор-1,2-дигид ;ро-ЗН-1,4-бензодиазепинтиона-2 нагрева, ют в 200 мл 10%-ного раствора метилI амина в течение 10 мин на водяной бане. ;При этом выкристаллизовывается искомый продукт. Его отсасывают и:перёкристал лизовывают с активированным углем из
.16 бензола. Выход продукта 5 г; т. пл. 214°C. Предмет изобретения 1. Способ получения 6-аза-ЗН-1, зодиазепинов общей формулы / ariOM галогена; 2 «То одинаковые или различные и означают водород, галоген, трифторметильную группу, нитрогруппу, нитрильную группу, оксигруппу, низкомолекулярную алкильную группу или низкомолекулярную алкоксигруппу;R - водород, оксигруггпа, ацилированйая алифатическими моно- или дикарбоно- выми кислотами с 2 - 6 атомами углерода оксигруппа, низкомояекулярная алкоксигруппа, низкомолекулярная алртьная, бенз альная, низкомолбкулярная Ы1Ифатическая ацильная, карбокси- или низкомояекулярная карбалкоксигрупла; 21-атом азота .или группа 5 водорода, низкомояекулярнй алкильная группа, замещенная циклоалкильг ным остатком с 3 - 6 атомами углерода, низкомолекуяярная алкенильная группа, ииклоалкильная группа с 3 - 6 атомами углерода, низко -юлекулярная оксиалкильная или бензияьнаяа алифатическая ацильная группа с 2 - 6 атомами углерода или аминоалкальная группа с 2 - 7 атомами углерода, которая может быть замещена по азоту одной или двумя аякильными группами, причем 2 аякильные группы вместе с атомом азота могут также образовывать 5 - 7,-членное гетероциклическое кольцо, которое может содержать еще один гетеро атом азота И1Ш кислорода; А г: атом кислорода или серы или групny NRg, -NOFJg ,,.- NH NHP или два 5 атома водррвда..
Авторы
Даты
1975-04-25—Публикация
1972-12-08—Подача