(54) СПОСОБ ПОЛУЧЕНИЯ НИТРИЛОВ КЕТОКАРБОНОВЫХ КИСЛОТ
В среде -рганического инертного растворителя .
Выход г.елевого продукта до 95%. Наряду с довольно простым осуществлением преимущество предлагаемого способа состоит в том, что он не ограничен получением специальных нитрилов кетокислот и может применяться универсально. Согласно предлагаемому способу получены до сих пор неописанные соединения, например (2,2-дихлор-1-метилциклопропил)-гликосилонитрил и 2,2-ДИХЛОР-1,3-диметилциклопропил. При использовании нитрилов карбоновых кислот особенно пригодны нитрилы простых одноосновных карбоновых кислот (пропионитрил, бензонитрил и изобутиронитрил), однако предпочтительно использовать ацетонитрил Из используе(дх для взаимодействи цианидов щелочных металлов предпочтительными являются цианиды натрия и калия. Целесообразно использовать, по крайней мере,стехиометрические количества цианида, В качестве солей меди(1) можно использовать цианистую хлористую или бромистую соль меди(1) и тетраацианокупрат (1)калия.
Количества применяемых нитрилов карбоновых кислот и соли меди f1), зависят от рода нитрила карбоновой кислоты и соли меди(1)и от условий взаимодействия (температура и дазвление),а также от рода и количества дополнительно используемого растворителя .
Целесообразно на 1 моль хлорангидрида кислоты использовать не менее 0,05 моль нитрила карбоновой кислоты Нитрил можно применять в многократном избытке, но предпочтительно брат не более 1 моль нитрила карбоновой кислоты на 1 моль гапоидангидрида ки лоты.
В качестве органических инертных растворителей применяют, например, простые циклические эфиры (диоксан), зтиленгликолевые простые эфиры или сложные эфиры(бутилацетат). Особенно пригодны ароматические углеводороды (бензол, толуол, ксилолы или тетралин) или алифатические углеводороды (циклогексан или лигроин) с пределами кипения от 90 до 140 С, или Гсшогенированные, предпочтительно хлорированные , ароматические или ги фатические углеводороды (трихлорэтилен,и в особенности хлорбензол, дихлорбензолы и тетрахлорэтан). Могут применяться и смеси этих растворителей. Кроме того, органический растворитель должен легко отделяться от образующегося нитрила кетонокислоты.
Температура взаимодействия может меняться в широких пределах и выбирается в зависимости от рода растворителя и компонентов реакции. Принимает во внимание температуры примерно от 50 до 180 С, желательно /(}130 С. Хотя давление можно использовать любое, но предпочтительно нормальное .
Изобретение иллюстрируется примерами .
Пример. В снабженном обр(лгным холодильником реакторе смв:1 иыают 154,5 г (1,0 моль) 4-мети,пбензои.чхлорида с 59 г (1,2 моль) цианистогч натрия, 9 г (0,1 моль) цианистой меди(1), 50 мл ксилола и 12,3 г(0,3моль) ацетонитрила. Смесь нагревают при перемешивании до 130с, выдерживают в течение 3 ч при зтой температуре, а затем охлаждают до 20°с. Полученные при этом соли (главным образом хлористый натрий) отфильтровывают и промывают 25 мл ксилола. Фильтрат подвергают фракционной перегонке при пониженном давлении. Получают 127 г чистого цианистого 4-метилбензоила, что соответствует выходу 88% по отнсшению к использованному хлорангидриду кислоты. Цианистый 4-метилбензоил имеет Т.кип. 100-102°с/ 5 /15 мм рт,ст. Нитрил кетокислоты застывает в приемнике и имеет Т.ГОГ. 50°С,
Пример 2. Следуют методике примера 1, однако вместо 4-метилбензоилхлорида используют 2-метилбен: о.илхлорид, а вместо цианистого натрич78 г(1,2 моль)цианистого калия. Получают 135 г цианистого 2-метилбе;н-зоила, что соответствует выходу 93,5% по отношению к использованмг.му хлорангидриду кислоты. Цианистый 2-метилбензоил имеет Т.кип.107-110°С / /15 мм рт,ст.
П р и м е р 3. Следуют методике примера 1, однако наряду с 154,5 г (1,0 моль) 3-метилбензоилхлорида -цгпользуют 74 г (1,5 гюль) цианистого натрия, 30 г (0,3 моль) хлористом меди (1)50 f,OT хлорбензола и 20,5 г (0,5 моль)ацетонитрила. Получают 1 4 г цианистого 3-метилбензоила, что соответствует выходу 93% по отношению к использованному хлорангидриду кислоты. Цианистый 3-метилбензоил имеет Т,КИПЛОЗ-108°С/15 мм рт.ст,
П р и м е р 4. Следуют методике примера 1, однако вместо 4-метилбензоилхлорида используют 130,5 г (1,0 моль) хлорангидрида фуран-2-карбоновой кислоты. Получюат 102 г фурил-2-глиоксилонитрила, что соответствует выходу 85% по отношению к использованному ораигидриду кислоты. Фурил-2-глиоксилонитрил имеет Т.кип.76°С /12 мм рт.ст.
Пример 5. По описанной в примере 4 методике с использованием соответствующих исходных получают сое.
динения формулы Г,-С
значения
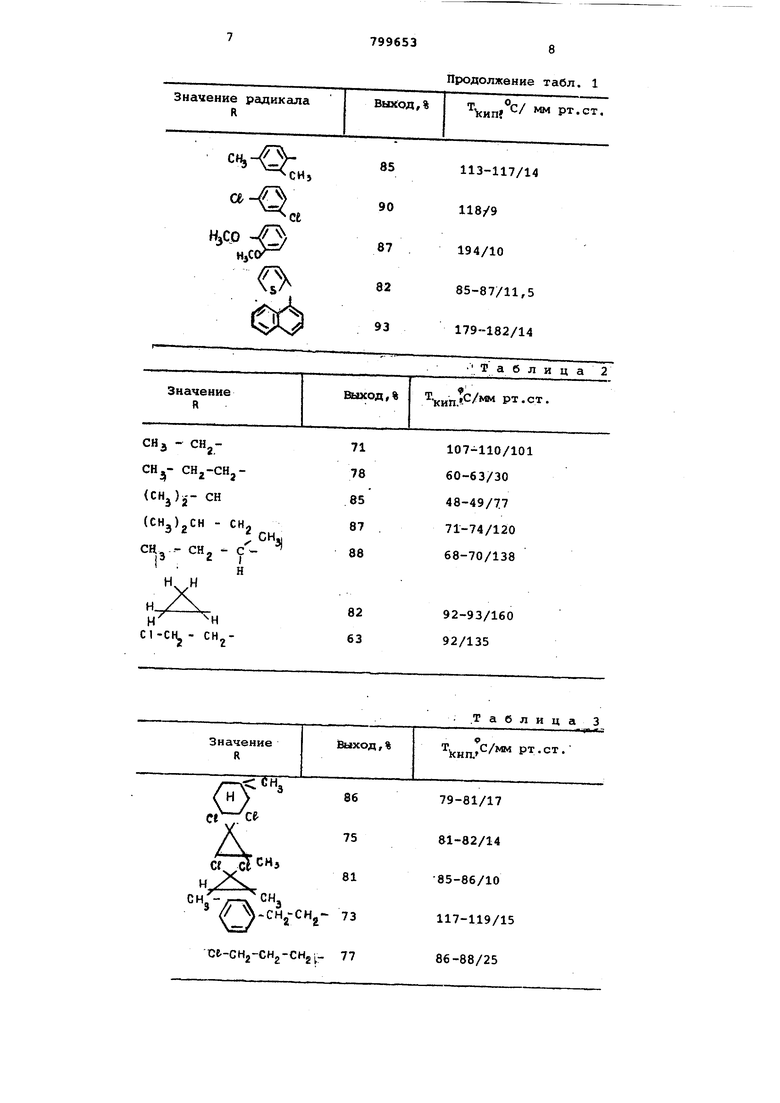
радикалов в которых, выходы и температуры кипения представлены в табл.1. Примере. В снабженном обратным холодильником реакторе смешивают 157,0 г (2,0 моль) хлористог ацетила со 103 г (2,1 моль) цианисТого натрия, 90 rfl,0 моль) цианистой меди (I), 150 мл ортодих-иорбензола и 49 г (1,2 моль) ацетонитрила Смесь при перемешивании медленно на гревают до 90 С, выдерживают 4 ч при этой температуре, а затем охлаждают до 15 С. Выделяквдиеся при этом соли отфильтровывают и промывают 100 мл ортодихлорбензола. Фильтрат подвергают фракционной перетонке при норь.гльном давлении. Выделяют 192 г первой фракции, которая перегоняется до температуры верха колонны 100 С, Эта фракция, со ласно газовой хроматографии, состоит на 58% из нитрила пировиноградной кислоты, что означает выход 82% нитрила пировиноградной кислоты по отношению к использованному хлористому ацетилу. Пример 7. Следуют методике примера 1, однако используют 120,5 г (1,0 моль) хлористого триметилацетила, 64 г (1,3 моль) цианистого натрия, 9 г(0,1 моль)цианистой меди(1) 50 мл 1,2,3,4-тетрагидронафталина и 12,3 г (о,3 моль)ацетонитрила. Смес нагревают при перемешивании в течение 4 ч при 110°С. После охлаждения до 15с отфильтровывают выпавшие в осадок соли и промывают 30 мл тетрагидронафталина. Фильтрат подвергают фракционной перегонке. Получают 101 чистого цианистого триметилацетила (нитрила триметилпировиноградной кис лоты) , что соответствует выходу 92% по отношению к использованному хлори тому триметилацетилу. Цианистый триметилацетил имеет Т.ККП.118-122 С при нормальном давлении. Примере. Следуют методике примера 7 и получают соединения, зна
45
Таблица 1 чения радикалов в которь-х, выходы И температуры кипения представлены в табл. 2. П р и м е р 9. Следуют методике примера 7, однако BMek.ro хлористого триметилацетила используют 146,6 г (1,0 моль) хлорангидрида циклогексанкарбоновой кислоты, а вместо тетрагидронафталина используют тетрахлорэтилен. Получают 105 г циклогексил-глиоксилонитрила, что соответствует выходу 77% по отношению к использованному хлорангидриду кислоты. Циклогексил-глиоксилонитрил имеет Т. 85 87С при 20 мм рт.ст. Пример 10. Следуют методике примера 9 и получают соединения, значения радикалюв в которых, выходы и температуры кипения представлены в табл. 3. П р и м е р 11. Действуют как в примере 9 и получают соединения,значения радикалов в которых выходы и температуры кипения представлены в табл. 4 . Пример 12. В реакторе с обратным холодильником смешивают 199 г (1,0 моль) 4-метилбензоилбромида с 59 г(1,2 моль)цианида натрия, 12,1г (0,1 моль) медь (1) роданида, 50 мл ксилола и 28 г(О,4 моль)изобутиронитрила. Дальше действуют как в примере 1. После дистилляции отделяют 97 г 4-метилбвнзоилцианида, что соответствует выходу 67%, рассчитывая на бромид. Пример 13. Осуществляют аналогично примеру 1, однако вместо ксилола прибавляют дополнительно 50 мд ацетонитрила. После перегонки выделяют 4-метилбензоилнитрил с выодом 82% в расчете на взятый хлорангидрид.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения нитрилов кетокарбоновых кислот | 1977 |
|
SU745361A3 |
| Способ получения бензоилцианида | 1977 |
|
SU843734A3 |
| 5-ГИДРОКСИПИРАЗОЛ-4-ИЛКАРБОНИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ САХАРИНА, ОБЛАДАЮЩИЕ ГЕРБИЦИДНЫМ ДЕЙСТВИЕМ И ГЕРБИЦИДНОЕ СРЕДСТВО | 1995 |
|
RU2159244C2 |
| СПОСОБ ГИДРОЦИАНИРОВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ С НЕНАСЫЩЕННОЙ ЭТИЛЕНОВОЙ СВЯЗЬЮ | 1996 |
|
RU2186058C2 |
| Способ получения бензоилцианида | 1978 |
|
SU1093243A3 |
| Способ получения ацилированных дикетоновых соединений | 1985 |
|
SU1697591A3 |
| ПРОИЗВОДНЫЕ САХАРИНА И ГЕРБИЦИДНЫЙ ПРЕПАРАТ | 1995 |
|
RU2156244C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ОРТО-НИТРОБЕНЗОНИТРИЛА (ВАРИАНТЫ) | 1999 |
|
RU2236399C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ АРОМАТИЧЕСКИХ НИТРИЛОВ | 1991 |
|
RU2037483C1 |
| Способ получения 2-/2',2',2'-тригалогенэтил/-4-галогенциклобутан-1-онов | 1978 |
|
SU917695A3 |

ИзСО- 0
:)ис114-116/18120-125/12 85-87/14
162/13 160/16,5
118-122/15
7996538
Продолжение табл. 1
CHilCHg)72 62
(сн)Формула изобретения
« xcN
где R - незакющенный или одно- или многократнозамещенный фенилом, атомом фтора, хлора, брома линейный ил разветвленный алкил С, - , незамещенный или одно-, или многократнозамещенный алкилом С., атомом хлора, брома, фтора, фенил, нафтил, пятичленный гетероцикл, который может быть прерван атомами кислорода или серы; замещенный йтомом хлора, фтора, брома, нитро-, алкил-, гшкоксигруппой с С.- С,в алкильной частн С,- С.циклоалкил, взаимодействием соответствующего галоидангидрида карбоновой кислоты с цианидом металла при повышенной температуре в присутствии нитрила
Таблица 4
87/7,6 185-188/2,28
карбоновой кислоты с последующим выделением целевого продукта, отличающийся тем, что, с целью увеличения выхода целевого продукта и расширения ассортимента конечного продукта, в качестве цианида металла используют цианид щелочного металла в смеси с солью одновалентной меди, взятые в количестве 0,1-5 и 0,05-2 мольных эквивалентов соответственно, и процесс ведут при 50ISO C.
Источники информации, принятые во внимание при экспертизе 1. Edwards 0. Е. et al. tJ.Amer, Chem. Soc. 1944, , 2014,

Авторы
Даты
1981-01-23—Публикация
1977-06-02—Подача