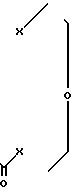
Предлагается новое соединение, а именно новые краун-эфиры 1,7,10,13,16-пентаокса-4-тиадифуро[2,1,5-a, r; 2,1,5-f, g] циклооктадека-9,17-дион или 1,7,13-триокса-4,10,16-тритиадифуро[2,1,5-a,r; 2,1,5-f,g]циклооктадека-9,17-дион или к их комплексам с хлористым никелем или хлористым кобальтом общей формулы
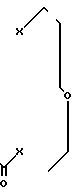

 где Х 0 [I-III] S [IV-VI] Y NiCl2 [II,V] CoCl2 [III, VI] n 0 или 1, проявляющие антимутагенную активность. Эти соединения могут найти применение в различных областях народного хозяйства, в частности при работе с различными химическими промышленными веществами, обладающими мутагенной активностью, при использовании различных цитостатиков (в онкологии), химиотерапевтических и фармакологических средств.
где Х 0 [I-III] S [IV-VI] Y NiCl2 [II,V] CoCl2 [III, VI] n 0 или 1, проявляющие антимутагенную активность. Эти соединения могут найти применение в различных областях народного хозяйства, в частности при работе с различными химическими промышленными веществами, обладающими мутагенной активностью, при использовании различных цитостатиков (в онкологии), химиотерапевтических и фармакологических средств.
Предложенные соединения и их биологическая активность в литературе не описаны. Однако в литературе описаны родственные соединения, антимутагенная активность которых не изучена. В качестве антимутагенов широко известны 2-меркаптоэтиламин (МЭА) L-цистеин, диметилсульфоксид (ДМСО) и тиомочевина. Однако названные соединения сравнительно слабые протекторы, действие их не универсально и ограничено отдельными тест-объектами.
Целью изобретения является изыскание новых высокоактивных, слаботоксичных, устойчивых и удобных для применения антимутагенов, а также расширение арсенала средств, воздействующих на живой организм. Указанные свойства определяются новой химической структурой новых соединений общей формулы I.
Краун-эфиры синтезированы взаимодействием дихлорангидрида дифурфурилсульфид-5,5'-дикарбоновой кислоты с диэтиленгликолем и 3-окса-1,5-пентандитиолом в присутствии гидрида лития в диметилформамиде (ДМФА) по следующей схеме: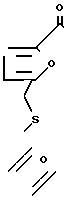



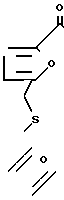
Комплексы краун-эфиров I и IV с хлористым никелем и хлористым кобальтом получены взаимодействием соответствующей соли с краун-эфиром в метаноле.
Индивидуальность полученных кран-эфиров доказана ТСХ (Silufol UN 254, элюант вода метанол 1:10, проявление ультрахемоскопом). В ИК-спектрах синтезированных соединений присутствуют полосы поглощения, характерные для сложноэфирной карбонильной группы в области 1720 см-1. Молекулярные веса определены масс-спектрометрическим методом.
П р и м е р. 1,7,10,13,16-Пентаокса-4-тиадифуро[2,1,5-a,r; 2,1,5-f,g] циклооктадека-9,17-дион [1]
Суспензию 0,16 г (0,02 моль) гидрида лития в 50 мл ДМФА нагревают до 90-95оС и медленно прибавляют раствор 1,06 г (0,01 моль) диэтиленгликоля и 3,2 г (0,01 моль) дихлорангидрида дифурфурилсульфид-5,5'-дикарбоновой кислоты в 50 мл ДМФА. Смесь нагревают в пределах 90-95оС в течение 20 ч. Осадок отфильтровывают и отгоняют растворитель в вакууме водоструйного насоса. К остатку добавляют воду (100 мл). Выпавшие кристаллы отфильтровывают, промывают водой и сушат на воздухе. Перекристаллизовывают из смеси вода-этанол (8:1) и получают 1,6 г (45,4%) соединения I с т.пл. 191-192оС.
Найдено, С 54,26; Н 4,51; S 9,29.
C16H16SO7
Вычислено, C 54,53; Н 4,58; S 9,09.
Аналогично из 0,16 г (0,02 моль) гидрида лития, 1,4 г (0,01 моль) 3-окса-1,5-пентандитиола, 3,2 г (0,01 моль) дихлорангидрида дифурфурилсульфид-5,5'-дикарбоновой кислоты в 100 мл ДМФА получают 2,3 г (60,5%) 1,7,13-триокса-4,10,16-тритиадифуро[2,1,5-a, r, 2,1,5-f,g] циклооктадека-9,17-диона (IV) с т.пл. 206-208оС.
Найдено, С 49,85; Н 4,21; S 24,85
C16H16S3O5
Вычислено, С 49,99; Н 4,19; S 25,01.
П р и м е р 2. 1,7,10,13,16-Пентаокса-4-тиадифуро[2,1,5-a,r; 2,1,5-f,g] циклооктадека-9,17-дион.СоCl (III)
Смесь 0,35 г (0,001 моль) 1, 0,13 г (0,001 моль) хлористого кобальта растворяют в 20 мл метанола и раствор концентрируют. Выпавшие кристаллы отфильтровывают, промывают небольшим количеством охлажденного метанола и сушат на воздухе. Получают 0,47 г (97,9%) соединения III с т.пл. 204-205оС (с разложением).
Найдено, С 39,66; Н 3,51; S 6,52.
C16H16SO7 ˙CoCl2
Вычислено, С 39,85; Н 3,34; S 6,65.
Остальные комплексы (II, V, VI) получены аналогично соединению III. Физико-химические константы и LD50 заявляемых соединений приведены в табл.1 и 2.
Антимутагенное действие краун-эфиров. Антимутагенное действие изучено из биохимических штаммах: Esherichia coli P-678, ауксотрофный по треонину, лейцину и витамину В1, Actinomyces rimosus 222 (исходный штамм BS-21), ауксотрофный по лизину, и на индикаторных штаммах Salmonella typhimurium ТА-1534, несущий мутацию типа сдвига считывания генетического кода, генотип his D 3022, LPS+, Repair Δи vr B; TА-1535, несущий мутацию типа замены основания в молекуле ДНК, генотип his G46 LPS-, rfa, repair Δи vr B и ТА-1950, несущий мутацию типа замены основания в молекуле ДНК, генотип his G 46 LPS+, repair Δи vr B. Эти штаммы являются ауксотрофами по гистидину. На штамме ТА-1950 изучены процессы метаболических превращений исследуемых соединений.
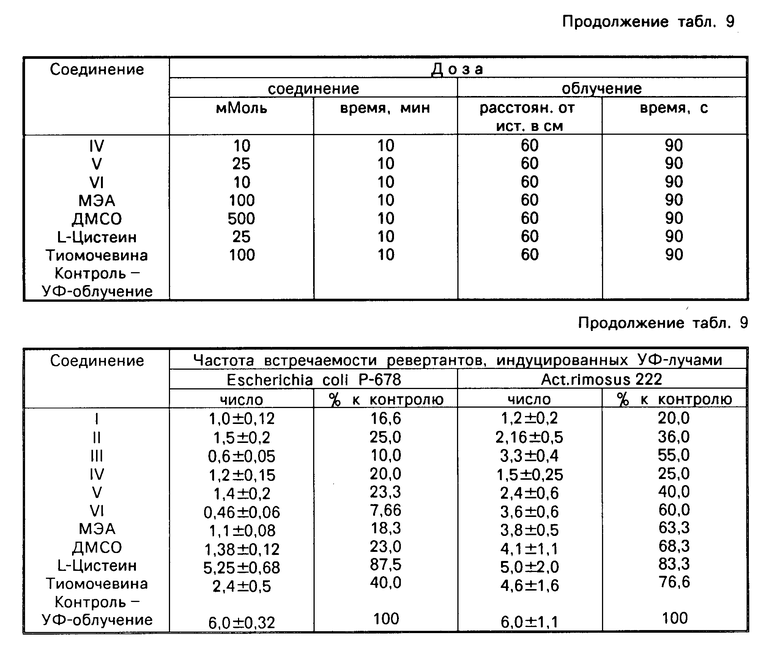
Антимутагенное действие исследуемых соединений изучали различными методами на указанных тест-объектах по разным направлениям. Результаты изучения антимутагенного действия исследуемых соединений и контрольных препаратов в отношении треонинового локуса кишечной палочки приведены в табл.3. Из данных этой таблицы видно что некоторые соединения оказывают антимутагенное действие, заметно уменьшают выход спонтанной мутации. Так, соединение III снижает мутацию на 31,25% соединения IV и VI снижают еще больше, соответственно на 52,5 и 61,25% Они по активности превосходят известные препарат МЭА и ДМСО. L-Цистеин и тиомочевина на названном штамме не оказали антимутагенного действия.
В отношении лизинового локуса актиномицетов (см. табл.4) активными, как и на предыдущем, оказались соединения III и VI, содержащие хлористый кобальт, уменьшили спонтанную мутацию соответственно на 35,4 и 36,16% Из контрольных наиболее сильным действием обладал МЭА. Цистеин и тиомочевина по-прежнему были неактивны.
Результаты изучения исследуемых соединений в отношении гистидинового локуса Salm. typhimurium ТА-1534 с нормальным бактериальным липополисахаридом (LPS), служащим барьером проникновения веществ в клетку, приведены в табл. 5. Как видно из табл.5, соединения III и VI, несмотря на сохранность LPS в клетках, оказали заметное антимутагенное действие. Остальные соединения, как и контрольные, лишены этого действия. Наиболее активное из исследуемых соединение III снизило частоту спонтанных мутаций на 75%
В табл.6 приведены данные изучения заявленных соединений на штамме ТА-1535, у которого LPS разрушен (для увеличения чувствительности клеток к воздействию веществ). Из этих данных видно, что исследуемые и контрольные соединения на этом штамме оказывают антимутагенное действие заметно сильнее, чем на штамме ТА-1534 с нормальным LPS. По-прежнему самыми интересными оказались соединения с хлористым кобальтом (III и VI), они соответственно снизили выход спонтанной мутации на 82,9 и 89,48% и по антимутагенному действию заметно превзошли контрольные препараты.
Изучено влияние краун-эфиров на мутации, индуцированные химическими мутагенами (см. табл.7). Из этой таблицы видно, что соединения III и VI оказывают сильное влияние на мутации, индуцированные новыми химическими мутагенами: N 1070877 бис-( β -хлорэтил)амид n-бутоксибензоил глицином и N 513076 -N-(2-метил-4-изопропоксибензонсульфонил)-N'-бутилтиомоче-виной. Эти мутагены самостоятельно индуцируют обратные мутации по треониновому локусу кишечной палочки соответственно в 2000 и 3500 раз больше контроля (спонтанной мутации). Предварительная обработка этой культуры исследуемыми антимутагенами в дозах, указанных в табл.7, заметно снижает мутагенное действие химических мутагенов. Соединение III уменьшает частоту встречаемости обратных мутаций соответственно в 3,0 и 3,2 раза, а соединение VI в 4,5 и 4,0 раза.
В табл.8 приведены результаты изучения влияния двух отобранных наиболее активных соединений на Salm typhimurium ТА-1950. Как видно из данных этой таблицы, заявленные соединения, изученные методом учета мутагенеза в системе с метаболической активацией, не лишаются антимутагенной активности. Исходные соединения III и VI, подвергаясь метаболическому превращению, сохраняют антимутагенное действие, соответственно снижают частоту спонтанных обратных мутаций максимально на 52,4 и 62%
В табл.9 приведены результаты изучения антимутагенного действия заявленных и контрольных соединений в отношении облученных УФ-лучами штаммов кишечной палочки и актиномицетов. Из данных табл.9 видно, что заявленные соединения оказывают довольно мощное влияние на мутации, индуцированные УФ-лучами. Наиболее сильное действие из них оказывают соединения III и VI, которые снизили выход мутации по треониновому локусу кишечной палочки соответственно на 90,0 и 92,34% сравнительно с контролем.
В этой же таблице приведены данные экспериментов, полученных на актиномицетах. В этом случае наиболее активными оказались соединения I и IV. Они снизили индуцированные радиацией мутации соответственно на 80,0 и 75,0% соединения III и VI соответственно снизили мутаций на 45 и 40% по сравнению с контролем. И в этом случае исследуемые соединения снизили мутации, индуцированные УФ-лучами больше, чем контрольные препараты.
Таким образом, на различных тест-объектах выявлено антимутагенное действие у группы исследуемых краун-эфиров. Наиболее активные среди них соединение III 1,7,10,13,16-пентаокса-4-тиадифуро[2,1,5-a,r; 2,1,5-f,g] циклооктадека-2,17-дион ˙ хлористый кобальт и соединение VI 1,7,13-триокса-4,10,16-тритиадифуро[2,1,5-a, r; 2,1,5-f,g]циклооктадека-9,17-дион.хлористый кобальт соответственно уменьшают выход спонтанной мутации кишечной палочки на 31,25 и 61,25% актиномицетов на 35,4 и 36,16% сальмонелл ТА-1534 на 75 и 40% и ТА-1535 на 82,9 и 89,48% снижают частоту мутаций, индуцированных химическими мутагенами, примерно в 3-4,5 раза и частоту мутаций, индуцированных радиацией, в 10 и 13 раз (E.coli P-678). Эти соединения, подвергаясь метаболическому превращению, не лишаются антимутагенного действия. По антимутагенному действию они намного превосходят известные антимутагены, изученные в идентичных условиях.
Заявленные соединения как сильные антимутагены могут найти применение в различных областях народного хозяйства, в частности при работе с различными химическими промышленными веществами, обладающими мутагенной активностью, при использовании различных цитостатиков (в онкологии), химиотерапевтических и фармакологических средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКС КРАУН-ЭФИРА ПИРИДАЗИНОВОГО РЯДА С ХЛОРИСТЫМ КАЛИЕМ, ПРОЯВЛЯЮЩИЙ АНТИМУТАГЕННУЮ АКТИВНОСТЬ | 1979 |
|
SU784267A1 |
| КОМПЛЕКС КРАУН-ЭФИРА ПИРИДАЗИНОВОГО РЯДА С ХЛОРИСТЫМ КАЛИЕМ, ПРОЯВЛЯЮЩИЙ АНТИМУТАГЕННУЮ АКТИВНОСТЬ | 1979 |
|
SU784268A1 |
| КРАУН-ЭФИРЫ ПИРИДАЗИНОВОГО РЯДА, ПРОЯВЛЯЮЩИЕ АНТИМУТАГЕННУЮ АКТИВНОСТЬ | 1979 |
|
SU784265A1 |
| КРАУН-ЭФИРЫ ПИРИДАЗИНОВОГО РЯДА, ПРОЯВЛЯЮЩИЕ АНТИМУТАГЕННУЮ АКТИВНОСТЬ | 1979 |
|
SU784266A1 |
| ГИДРАЗОН-4-АМИЛОКСИ-3-НИТРОАЦЕТОФЕНОНА, ПРОЯВЛЯЮЩИЙ АНТИМУТАГЕННУЮ АКТИВНОСТЬ | 1989 |
|
SU1626614A1 |
| 1-АМИНО-8,9- ДИГИДРО-5- МОРФОЛИНО-7,7,8- ТРИМЕТИЛ-2-ЭТОКСИКАРБОНИЛ-6Н-ТИЕНО [2,3-C] [2,7] НАФТИРИДИН ИЛИ ЕГО ДИГИДРОХЛОРИД, ОБЛАДАЮЩИЕ МУТАГЕННОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1640984A1 |
| 3-АМИНО-2-КАРБЭТОКСИ- 5,5- ДИМЕТИЛ-8- (N-МОРФОЛИНО)-4,5- ДИГИДРО-7Н-ПИРАНО(4,3-D)ТИЕНО (2,3-B) ПИРИДИН, ОБЛАДАЮЩИЙ АНТИМУТАГЕННОЙ АКТИВНОСТЬЮ | 1984 |
|
SU1184244A1 |
| 8-АМИНО-4,5,5- ТРИМЕТИЛ -7- ЦИАН-5,6- ДИГИДРО-3Н-ТИОПИРАНО [3,4-С] ПИРИДИН-2-ТИОН, ОБЛАДАЮЩИЙ АНТИМУТАГЕННОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1984 |
|
SU1226819A1 |
| Гидрохлориды 3-(3-хлор-4-алкоксифенил)-5,6-дигидроимидазо/2,1- @ /тиазолов,обладающие мутагенной активностью | 1980 |
|
SU910637A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОГО РАСТВОРА МЕДА И СПОСОБ ПРОВЕРКИ ЕГО ПОДЛИННОСТИ | 2012 |
|
RU2506813C2 |




Краун-эфиры или их комплексы общей формулы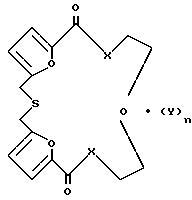
где X=O, S;
Y=NiCl2, CoCl2;
n=0 или 1,
проявляющие антимутагенную активность.
| Бариляк И.Р | |||
| Неумерисицкая Л.В | |||
| и Туркевич А.Н | |||
| Цитология и генетика, т.12, N 1, с.50-56, 1978. |
Авторы
Даты
1995-12-20—Публикация
1979-01-29—Подача