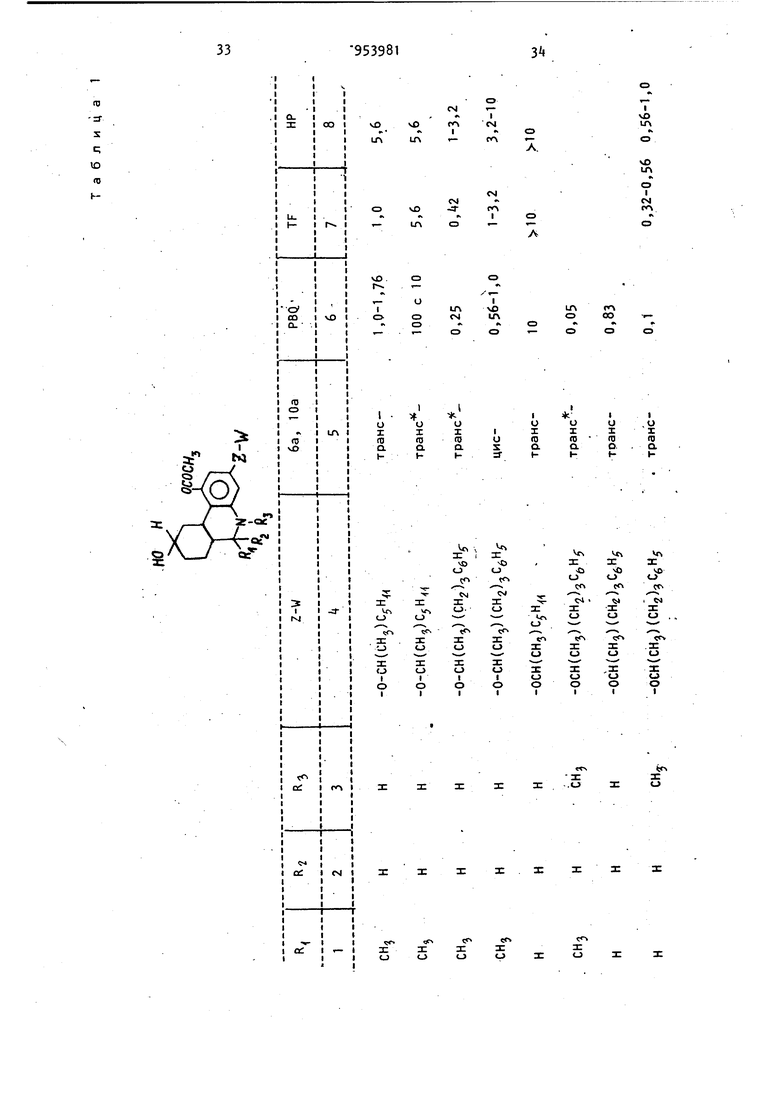
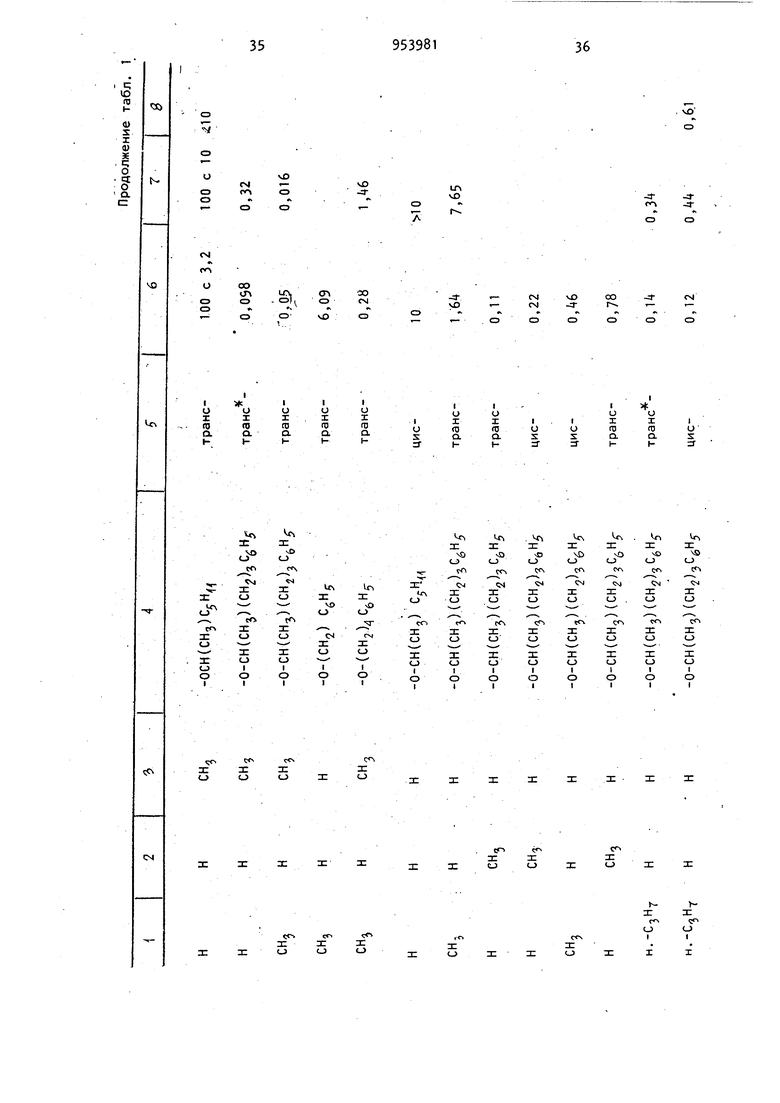
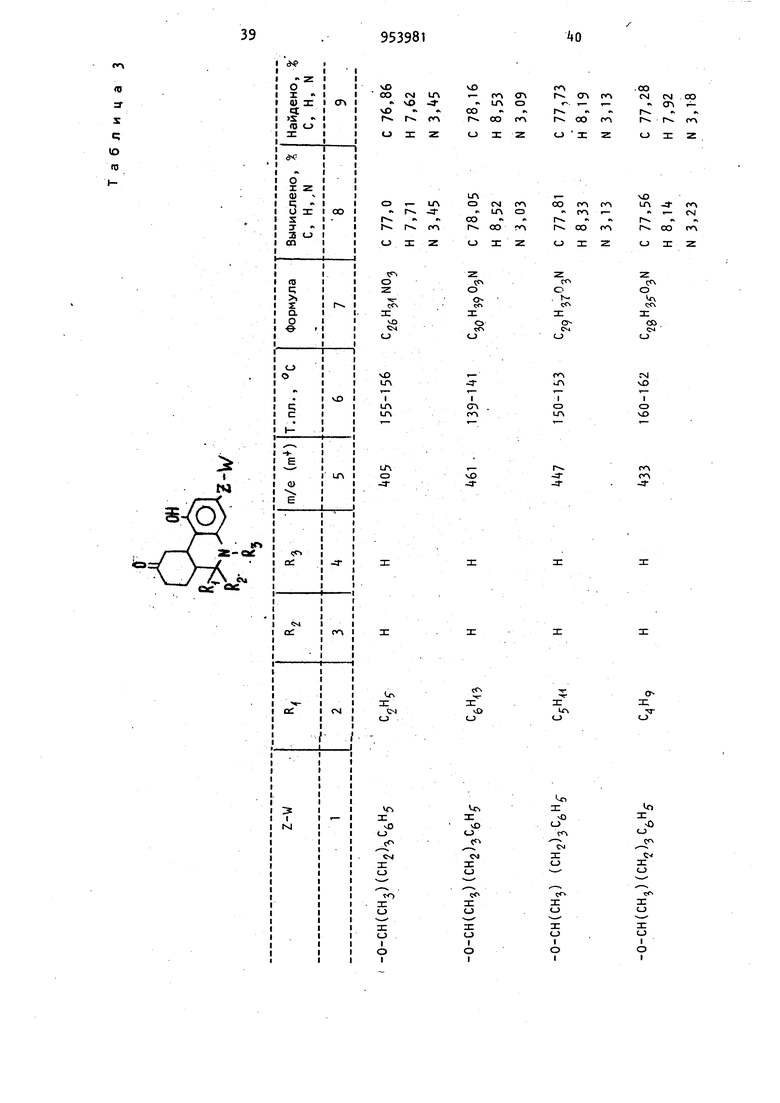
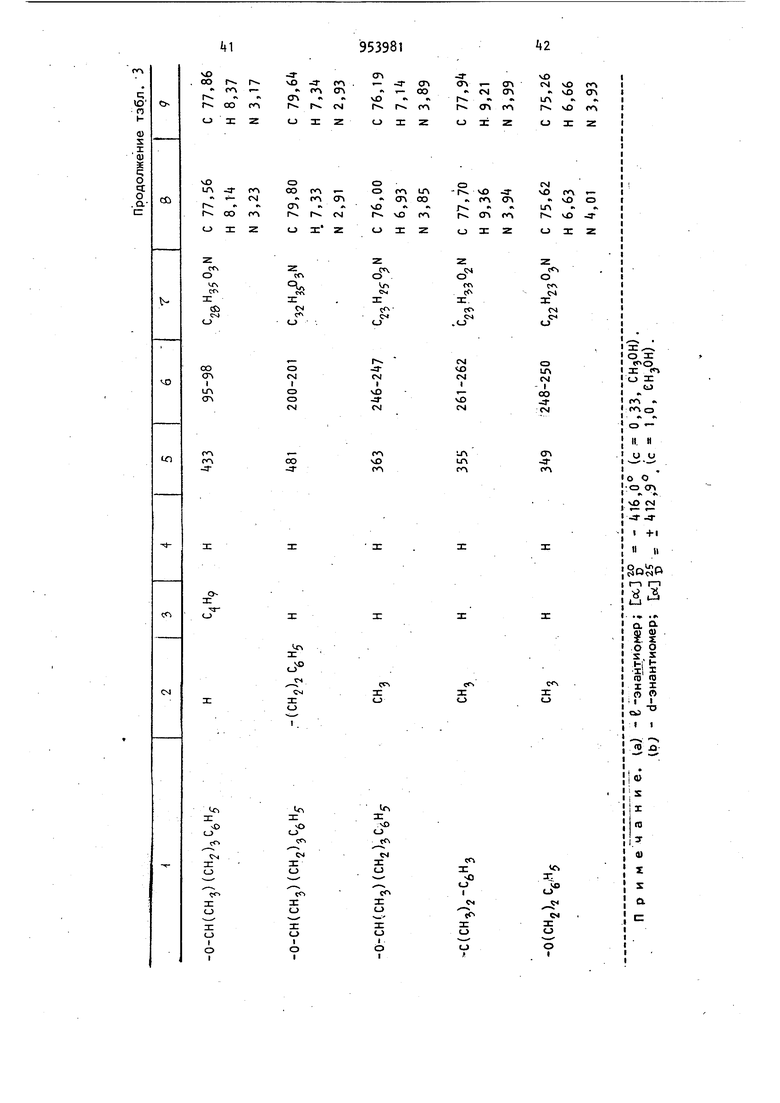
Изобретение относится к получению новых производных бензо(с)-хинолиноб общей формулы где R,- атом водорода или C -Cg-алкил; . R или R.- атом водорода или метил; Z-W - С -С -алкокси, С/|-С -алкилолссифенил или или их фармацевтически приемлемый солей с кислотами, которые обладают ценными фармацевтическими свойствами Известно восстановление ненасыщен ных кетонов до насыщенных литием в жидком аммиаке при 33-7бС l j. Известно восстановление циклических кетонов боргидридами металлов до соответствующих спиртов. Реакцию, как правило, проводят в органическом растворителе, например в тетрагидрофуране, в спирте и других растворитёлях при комнатной температуре или нагревании 2 , а также при охлаждении зЗ Цель изобретения - разработка на основе известного метода способа получения новых производных бензо(с)-хинолинов или их фармацевтически приемлемых солей с кислотами, которые об-, ладают анальгезическими свойствами. Поставленная цель достигается способом получения производных бёнзо(с)-xинoJOИнoв формулы I , заключающимся в том, что соединение общей формулы 395 где R. , Rg, и Z-W имеют приведенные значения, подвергают восстановле нию щелочным металлом в жидком аммиаке и полученное соединение общей формулы О где R, Rg, R и Z-W имеют приведенные значения, подвергают ацилировани а затем восстанавливают боргидридом металла, и целевой продукт выделяют в свободном виде или в виде фармацев тически приемлемой соли с кислотой. Целевые продукты выделяют в виде солей с такими кислотами, как хлористоводородная, бромистоводородная, серная, азотная, фосфорная или в вид цитрата, ацетата, сульфосалицилата, тартрата, гликолата, малоната, малеа та, фумарата, малата, 2-гидрокси-3 -нафтолата, памоата, салицилата, сте арата, фталата, сукцината, глюконата манделата, лактата или метансульфоната.Восстановление соединения общей формулы II осуществляют щелочным металлом, например литием в.жидком аммиаке при 35 80С. Полученное соединение общей форму лы III после а цилирования восстанавливают, предпочтительно боргидридом натрия, в качестве растворителей используют метанол, этанол или воду и реакцию ведут при О-ЗО С, Для повышения селективности реакцию можно проводить при пониженных температурах, вплоть до -70°С. Более высокие температуры способствуют деа тилированию и взаимодействию боргидр да с растворителем. I Анальзические свойства предлагаемых соединений определяют по тестам термического ноцицептивного раздражения, например прижигания хвоста у мышей, или по химическому ноцицептив ному раздражению, например измерению способности соединений подавлять болевой синдром у мышей, индуцированны с помощью фенилбензохинонового ирританта. Методика тестовых испытаний Следующая. Тесты термического ноцицептивного раздражения. а)испытание анальгезического действия на мышей с помощью горячей пластины. К лапкам мышей прикладывают алюминиевую пластину толщиной 3,1 мм, являющуюся регулируемым источником тепла. 250-ваттный инфракрасный рефлектор помещают снизу алюминиевой пластины. Терморегулятор в виде термистера, расположенного на поверхности пластины, регулирует нагрев лампы таким образом, чтобы поддерживать постоянную температуру пластины 57 С. Каждую мышь помещают в стеклянный цилиндр, основанием которого служит алюминиевая пластина, а отсчет времени начинают с момента, когда лапки мыши коснутся пластины. Спустя 0,5 и 2 ч после обработки тестовым соединением наблюдают за первыми конвульсивными движениями одной или обеих задних лапок или до установления 10-секундного интервала между этими движениями. Доза морфина составляет МРЕ 4-,5 мг/кг. МРЕ(МВЭ) - максимальный возможный эффект. б)испытание анальгезического действия на мышей по взмахам их хвостов. Используют регулируемую подачу интенсивного тепла на мышиный хвост. Каждую мышь помещают в металлический цилиндр так, чтобы ее хвост высовы вался из-одного конца цилиндра. Цилиндр этот устанавливают таким образом, чтобы хвост плоско лежал над экранированной лампой, являющейся источником тепла. В начале испытания удаляют алюминиевый экран над лампой, позволяя пучку света проходить через щель и фокусируя его на кончике хвоста. Одновременно включают таймер, определяют время возникновения конвульсивного движения хвоста. Мыши, не подвергавшиеся предварительной обработке, обычно реагируют спустя 3 с после экспозиции света лампы. Максимальный срок для защиты составляет 10 с. Каждую мышь подверагют испытанию спустя 0,5 и 2 ч после обработки морфином и тестовым соединением. Доза морфина составляет 3,2-5,6 мг/кг Тесты химического ноцицептивного раздражения. Подавление болевого синдрома, вызванного фенилбензохиноном. Группы, состоящие из мышей, предварительно обрабатывают путем подкожного или орального введения физиологическим раствором морфина , кодеина или 5.9 тестового соединения. Спустя 20 мин (при подкожном введении) или 50 мин (при оральном введении) каждую группу подвергают внутрибрюшинной инъекции фенилбензохинона, который, как известно, вызывает абдоминальные сокращения. Спустя 5 мин после инъекции возбудителя мышей наблюдают в течение 5 мин на предмет наличия или отсутствия конвульсивных сокращеНИИ. Определяют действие предварительно введенного препарата в дозе МВЭур на подавление конвульсивных сокрещений. Результаты описанных тестов выражают в процентах максимально возможного эффекта (% МВЭ). % МВЭ для каждой группы статистически сопоставляют с % МВЭ контрольного и предварительно обработанного животного. % МВ320 вычисляется следующим образом: о/ UDC, Тестовое время -6 nBJ - Время отсечки контрольное время X 100 . контрольное время С помощью описанных методов определяют анальгезирующуюактивность некоторых предлагаемых и известных соединений. . Анальгезирующая активность, выраженная в единицах МВЭ, т. е. доза, при которой достигается половина воз можного максимального эффекта, приведена в табл. 1. где РВЦ. - фенилбензохинон - возбудитель болевого синдрома; TF - метод конвульсии хвос та; HP - метод горячей пластины (t 9; ос 4DH). Возможность использования этих со единений в качестве препаратов, снижающих давление, определялась у крыс и собак, у которых давление было повышено искусственным способом, до ст тической величины при оральном введе нии препарата в указанных дозах. Их активность в качестве транквилизаторов определяют при оральном вв дении крысам дозами 0,01-50 мг/кг по соответствующему снижению спонтанной моторной активности. Дневная доза для млекопитающих составляет 0,01 100 мг/кг. Использование этих соединений при борьбе с глаукомой, по-видимому, свя зано с их способностью снижать внутр глазное давление. Их действие на 1 внутриглазное давление определяют по тестам на собаках. Испытуемый препарат вводят в глаз собаки в виде раствора систематически или в различные промежутки времени, после чего глаз анестезируют введением хлоргидрата тетрацина (1/2%-ный, 2 капли). Спустя несколько минут после такой местной анестезии, измеряют внутриглазное давление механическим тонометром. Испытываемое соединение обычно ис- пользовали в виде раствора, например следующего: испытуемый препарат 1 мг, этанол 0,05 мл, туин 80 (полиоксиалкиленовое производное сорбитанмонсо-; леата) и физиологический раствор (до 1 мл) или в виде более концентрированного раствора, где ингредиенты присутствуют в количестве 10 мг, 0,010 мл. 100 мг и 1 мл соответственно. Для людей можно использовать концентрации препарата от 0,01 до 10 мг/кг. Активность соединений в качестве диуретиков определялась на крысах. Для использования соединений в качестве анальгезирующих средств применялись те же дозы. При м е р 1.. d,1-5,6,6a,7,10, 10а-Гексагидро-1-гидрокси-6 3-метил-3-(2-гептилокси)бензо(с)-хинолин-9 (8Н)-он. Суспензию d, 1-5,6,6а,7-тетрагидро-1 -гидроксй-6 -метил-3- (2-гептилокси)бснзо(с)-хинолин-9(8Н)-она (1,0 г, 2,91 моль) в тетрагидрофуране (20 мл) по каплям добавляют через дополнительную воронку в интенсивно перемешивае 1Й раствор лития (0,1 г) в жидком аммиаке (75 мл, перегнанный через таблетки гидроокиси калия). Дополнительную воронку прЪмывают тетрагидрофураном (10 мл). Смесь перемешивают в течение 10 мин и затем твердый хлорист тый аммоний добавляют для уничтожения синего цвета. Избыточному количеству аммония дают возможность испариться и остаток выливают в воду (100 мл) и этилацетат (50 мл). Слой этилацетата отделяют и водную фазу экстрагируют этилацетатом (2 х 50 мл). Соединенные экстракты промывают солевым раствором, сушат (N9804) и концентрируют при пониженном давлении до получения коричневого полужидкого продукта (1,35 г). Тщательное растирание маслянистого продукта в смеси пентан и эфир (1:1) приводит к получению свет195ло-коричневого твердого вещества (0,884 г), т. пл. 130-138°С. Указанную процедуру повторяют, ис пользуя 1,84 г (5,36 ммоль) бензо(с -хинолин-9-он-реагента,,0,184 г лития, 140 мл жидкого аммония и 45 мл тетрагидрофурана. Остаток (2,1 г), оставшийся после выпаривания аммония, раст воряют в бензоле и ВВОДЯТ в хроматографическую колонку ( х б1 см) с силикагелем (250 г). Колонку промывают объемом дегазированного бензола равным объему колонки, и затем 1700м дегазированной смеси бензол - эфир (9:1). Продолжение элюирования (1100 мл) приводит к получению яркокрасного элюента , который концентрируют до светло-пурпурного твердого соединения (580 г) при пониженном дав лении и растирании в смеси бензол эфир (1 :1). Получают 370 мг твердого соединения с т. пл. 154-156 С. Его хранят в атмосфере азота в темноте. Выделенное вещество представляет собой смесь цис- и транс-изомеров целевого соединения; rh/e-345 (m) . Пример 2. Изомерные 5,6,6а, 7,10,1Оа-гексагидро-1-ацетокси-6 J-ме тил-3-(2-гептилокси)бензо(-с)-хинолин -9(8Н)-оны. 2,2 мл пиридина добавляют к суспен зии 5,6,6а ,7,1 О,1Оа-гексагидро-1-гидрокси-6 В-метил-3-(2-гептилокси)бензо (с)-хинолин-9(8Н)-она (222 мг, 0,642 ммоль) в уксусном ангидриде (2,2 мл) в атмосфере азота. Смесь перемешивают в течение 1,5 ч при комнатной темпераутре и затем выливают в лед (50 мл). Смолу выделяют и экстрагируют эфиром (З х 50 мл) и соединенные экстракты промывают сначала водой (4 X 50 мл), а затем солевым раствором (1 X 60 мл). Полученный экстракт сушат (MgSO) и выпаривают при пониженном давлении до получения красного масла (250 мг). Масло растворяют в минимальном количестве горячего эфира и вводят в колонку с силикагелем (45 г), уплотненную и промытую смесью пентан эфир (3:1). Колонку промывают смесью пентан - эфир (3 х 1 ,200 мл) . Элюирование продолжают и собирают фракции по 10 мл каждая. Фракции 22-32 соединяют и концентрируют до получения пенообразного соединения (113,5 мг), которое кристаллизуют из петролейного эфира в виде белых кристаллов, т. пл. П2-114°С. Фракции 33-35 также соединяют и концентрируют до пенообразного соединения (89,7 мг), которое перекристаллизовывают из петролейного эфира в виде белых кристаллов, т. пл. 78824. Продукты являются изомерными моноацетилированными соединениями. Пример 3. d,l-5,6,6a,7,10, 1 Оа-Гексагидро-1 -ацетокси-6 3 -метил-3-(2-гептилокси)бензо(с)-хинолин-9 (ан)-он. Повторяют процедуру примера 1, однако используют удвоенное количество реагентов. Полученный продукт 22,2 г затем непосредственно ацетилируют по методике примера 2, в результате чего получают 2,35 г ацетилированного продукта. Этот продукт тщательно перетирают в смесь пентан - эфир (3:1) до получения рыжевато-коричневого твердого вещества (905 мг), которое при дальнейшей перекристаллизации из этанола дает 404 мг светло-коричневых кристаллов с т. пл. 112-113,5°С. Маточные растворы, из которых бы- ли выделены упомянутые соединения, объединяют и концентрируют. Остаток растворяют в минимальном количестве смеси бензол - эфир - хлористый метилен (1:1:1) и вводят в колонку с силикагелем (2б5 г), элюированную смесью петролейный эфир - простой эфир (3:1). Вначале элюирование осуществляют 2-мя л смеси петролейный эфир - простой эфир (3:1), а затем 1,5 л смеси петролейный эфир - эфир (2:1) и 2 л смеси петролейный эфир эфир (1:1). Фракции 2-11 (по 50 мл каждая) элюата из системы растворителя 1:1 собирают и концентрируют при пониженном давлении до получения пенообразного продукта (496 мг). После перекристаллизации из петролейного эфира получают белые кристаллы с т. пл. 100-113°С (410 мл). После перекристаллизации из смеси этанол води (1:1) получают d, 1-транс-5 ,6,,1 0,1 Оа-гексагидро-1 -ацетокси-6 (3 -метил-3-(2-гептилокси)бензо(с)-хинолин-9(8Н)-он с т. пл. П1-П2°С; т/е-387 (т+). Элементный анализ. Вычислено, %: С 71,629; Н 8,58; N3,61. СгзНззНО. 9 Найдено, I: С 70,95; Н 8, N 3,58. Фракции 12-18 и 19-27 по 50 мл .каждая собирают и концентрируют до получения соответственно 273 мл и 208 мл ацетилированного продукта. Кристаллизация остатка фракций 19из петролейного эфира приводит к п лучению белых кристаллов (119 мг) т. пл. 84-88 С.-После перекристалл зации из смеси этилацетат - гексан (1:10) получают d, 1-цис-5,6,6а. ,7, 10 , 1 Оа Р -гексагидро-1 -ацетокси-3- (2-гептилокси) -6 3 -метилбензо(с) -хинолин-9(8Н)-он с т. пл. 8 -86°С Элементный анализ. Вычислено, С 71,29; Н 8,58; 3,61. C23ri-j N04 Найдено, %. С 71,05; Н 8,18; Аналогичным образом получают из соответствующих реагентов следующи соединения: d,l-TpaHc-5,6,6a р,7,10,10с6 -Ге сагидро-1 -ацетокси-бР) -метил-3- (5нил-2-пентилокси)бензо(с)-хинолин(8Н)-он, т. пл. 80-82 0; (т-). Элементный анализ. I: С ,5; Н 7,64; Вычислено, N 3,22. С27НззМ04. С 7t, Н 7,73; Найдено, -И N 3,38. d, 1-цис-5,6,6з 3 ,7,10,10а| -Гек гидро-1 -ацетокси-б -метил-З- (5-фен -2-пентилокси) бензо(с)-хинолин-9(8 -он, т.пл. 172-17б-С в виде хлорги рата, полученного из смеси ацетонэфир. Элементный анализ. Вычислено, С 68,71; Н 7,26; 2,97. Найдено, /;: С 68,86; Н 7,16; 2,97. d,1-транс-5,6,6а р ,7,10,10ао6-Г сагидро-1-ацетокси-3-(5-фенил-2-пе тилокси) -6;3-пропилбензо (с) -хинолин (8Н)-он, т , пл. 79-80°С; т/е - (т). d,l-циc-5,6,6a. ,7,10,10ар -Гек сагидро-1-ацетокси-3-(5-фенил-2-пе тилокси)-6р)-пропилбензо (с)-хинолин (8Н)-он, т. пл. 144-146.°С в виде ли нее,; т/е-463 (т-) . d-циc-5.b,6a/,7,10,10а/ -Гексагид-3 (5 Фенил-г-пентилокси; о-1-ацетокси бр-метилбензо(с)-хинолин-9(5Н)-он, . пл. (с разложением) в виде оли хлористоводородной кислоты; И2р5 +22,8° (с 0,31 СН.ОН); /e-t35 (m). Элементный анализ. Вычислено, %: С 8,71;Н 7,26; 2,96. C27H33N04- нее Найдено, %: С 69, Н 7,30; 3,01. d-TpaHC-5,6,6а(3,7,10,1 Оар-Окси-1 ацетокси-3-(5-фенил-2-пентилокси)бр-метилбензо(с)-хинолин-9(8Н)-он, . пл. 90-95°С (с разложением) в виде оли хлористоводородной кислоты; 12з.. 1-3 о ltd I п 1Э ru ли) . Е- 178,+6 (с 0,13, СН ОН); т/е435 (т-) . Элементный анализ. Выислено, %: С 6S,71; Н 7,26; N 2,97. С27НззМ04-нее Найдено, %: С 70,20; Н 7,23; N 3,07. 1-цис-5,6,6ар,7,10,Юар-Гексагидро-1-ацетокси-3-(5-фенил-2-пентилок-. си)-6р-метилбензо(с)-хинолин-9(8Н)-он, т. п/1. 90-92 С в виде хлоргидрата; 20,5° (с ± 0,19 ). Элементный анализ. Вычислено, 1: С 68,71; Н 7,26; N 2.97. С27Нзс}М04 : е 68,92; Н 1, Найдено, N 3,09. 1-транс-5,6,6ар,7,1 О,Юар-Гексагидро-1 -ацетокси-З- (5-фенил-2-пентилокси)-6й-метилбензо(с)-хинолин-Э(8Н) - -, л« -он, т. пл. 92-96 е в виде хлоргидри25 - да. -79,00 (с 0,10 еН.ОН); т/е - (т-) . т/Р - , fm+l Элементный анализ. I: е 68,71; Н 7,26; Вычислено, 2,97. не 27 : е 68,67; Н 1, Найдено, N 3,02. П р и.м е р k,. d, 1-5,6,бар,7,10, 1Оа-Гексагидро-1-ацетокси-б -метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-он, транс- и цис-изоАммиак (1150 мл) вносят непосредственно в высушенную на пламени трехлитровую трехгорлую колбу (в атмесфере азота) ,снабженную механической мешалкой, 300-миллилитровой капельной воронn953
кой и хладагентом (твердый ацетон ). В нее помещают литиевуй проволоку (2,2 г., нарезанную на кусочки), .Немедленно появляется характерная синяя окраска. К перемешиваемому синему раствору при -78°С добавляют 3,1-5,6,6а, 7-тетрагидро-1 -oкcи-6|5-мeтил-3- Г5-фенил-2-пентилокси)бензо (с) -хинолин-9(8Н)-он (21,5 г), растворенный в тетрагидрофуране (250 мл) по каплям в течение 10 мин. После дополнительного 10-минутного перемешивания при -78 С реакционную смесь резко охлаждают дополнительным количеством хлористого аммония (20 г). Затем охлаждение прекращают и реакционную смесь медленно нагревают на паровой бане до полного испарения аммиака. Затем добавляют этилацетат (2 л), воду (1 л) и смесь перемешивают в течение 10 мин. Затем разделяют слои и водную фазу еще раз экстрагируют этилацетатом (500 мл), Объединенные органические экстракты промывают еще раз водо1/ (1 л), сушат (МдЗОи) и концентрируют до коричневого полутвердого состояния (28 г). Полученный остаток немедленно растворяют в хлористом метилене (200 мл) добавляют -димеТиламинопиридин (7,5 г, 0,0б1 моль) и триэтиламин (6,1 г, 0,061 моль) и перемешивают раствор, охлажденный до 0°С (хладагент лед - вода) в атмосфере азота. Затем при интенсивном перемешивании за 5 мин прикапБшают уксусный ангидРИД (6,1 г, 0,0б1 моль).
После дополнительного перемешивания в течение 30 мин при реакционную смесь разбавляют этилацетатом (2 л), ;водой (1 л) и перемешивают еще 10 мин. Водную смесь еще раз экстрагируют водой и объединенные органические экстракты последовательно промывают водой (4 х 1 л), насыщенным бикарбонатом натрия (1 х 1 л) / солевым раствором (1 х 1 л), сушат (Мд$0;(|).и концентрируют до светлокоричневого масла (27 г). Остаток очищают на хромагографической колонке с 1,8 кг силикагеля, используя в качестве элюирующего растворителя смесь бензол - этилацетат. Собирают фракции (по 1 л). После элюирования менее полярных примесей фракции 16-20 соединяют и выпаривают до остатка, который затем кристаллизуют из смеси эфир - петролейный эфир, в результате чего получают 5,6 г (22,if) транс12
изомера целевого продукта. Фракции 21-27 соединяют и получают 7,6 г (31,8) смеси транс- и цис-изомеров, а фракции 28-32 соединяют и получают 2,5 г (Ю,) цис-изомера целевого соединения.
Хаоактеоистики транс-изомера: т/е - 35 (т-). НЯМР-спектр (60 мгГц)0(осе (ч. на млн.); 7,24 (с. 5Н, ароматика) ; 5,97 (с. 2Н, мета HS); 2,28 Дс. ЗН, ); 1,23 д. ЗН, СН,СН1,20 (д. ЗН, CH -CH-N); 1,3-4,5 (м. 17Н, остальные протоны); т. пл. 8183°С.
Элементный анализ.
Вычислено. I: С 74,45; Н 7,64; N 3,22.
С2 .
Найдено, %: С 74,15; И 7,68; N 3,18.
Характеристики цис-изомера: т/е435 (т-); т. пл. соли НС.е 172-17б°С (с разложением) из смеси ацетон - . простой эфир).
Элементный анализ.
Вычислено, %: С 68,71; Н 7,26; N 2,97.
С2тНз Н04 -.неб.
Найдено, %: С 68,86; Н 7,16; N 2,97.
Пример 5. d,1-3 6,6а,7,10, 1Оа-ГексагидрЬ-1-ацетокси-6Й-метил-3-(4-фенилбутилокси)бензо(с)-хинолин-9(8Н)-он, цис- и транс-изомеры.
В соответствии с процедурой примера 1 d, 1 -5,6,6а,7,10-тетрагидро-1-окси-6(метил- (4-фенилбутокси)бензо(с)-хинолин-9(8н)-он вначале восстнавливают литием в аммиаке, а затем ацетилируют до получения нужного гексагидро-изомера. Выделение на хроматографической колонке с силикагеле с использованием простого эфира в качестве элюента приводит к получению вначале d,1-транс-5,6,ба,7,Ю,lOq-гексагидро-1-ацетокси-6р-метил-3-(4-фенилбутилокси)бензо(с)-хинолин-9(.8Н)-она, т. пл. 155-15бС, после перекристаллизации из смеси этилацетат - пентан (1:5).
Элементный анализ.
Вычислено, I: С 74,Об; Н 7,4Г; N 3,32.
Найдено, %: С 74,00; К 7,47; N 3,22.
т/е - 421 (т). 1395 Дальнейшая очистка последних фракций на хроматографической колонке с силикагелем с использованием.в качестве элюирующего растворителя смеси циклогексан - эфир (1:1) приводит к получению изомерного d,1-циc-5,6,6ap 7, Ю, lOafJ -гексагидро-1-ацетокси-6( -метил-3-(-Фенилбутилокси)бензо(с)-хинолин-9(8Н)-она с т. пл. 95-9б°С после перекристаллизации из смеси . этилацетат - гексан (1:5) ; / - Л21 (т).. Элементный анализ. Вычислено, %. С 7«,08; Н 7,+1; N 3,32. Найдено, %: С 73,95; Н 7,51; N3,31. П р и м е р 6. d,l-5,6,6a,7,10, 1Оа-Гексагидро-1-ацетокси-3-(2-гептилокси)-бензо(с)-хинолин-9{8Н)-он. Раствор d, 1-5,6,6a,7-тeтpaгидpo-1-окси-3-(2-гептилокси)брнзо(с)-хинолин-9(8Н)-она (9,0 г) в тетрагидро фуране (100 мл) прикапывают к быстро перемешиваемому раствору лития (0,1 г) в жидком аммиаке (750 мл). Во время прикапывания добавляют допо нительно 0,1 г лития по частям для сохранения синего цвета. Смесь перемешивают 10мин, затем синий раствор обесцвечивают, добавляя избыток хлористого аммония. Избыточному аммиаку дают возможность испариться, а остаток выливают в смесь воды и этилацетата Органический слой отделяют и водную фазу дважды экстрагируют этил ацетатом. Соединенные экстракты промывают водой солевым раствором, суша (MgSO) и выпаривают до получения 8,5 г сырого продукта в виде коричневого твердого соединения. Неочищенный продукт (8,0 г) суспендируют в хлористом метилене (48 м при 0°С и обрабатывают N,N-диметил- -аминопиридином (3,2 г) и триэтил амином (3,72 мл). Затем добавляют уксусный ангидрид (2,52 мл) и полученную смесь перемешивают в течение 30 мин при 0°С. Ее разбавляют хлорис тым метиленом (300 мл), выделяют слой хлористого метилена,промывают водой (3 X 150 мл), насыщенным бикар бонатом натрия (1 X 100 мл), солевым раствором (1 X 100 мл) и сушат (MgSO После выпаривания хлористого мети/ieна получают 13,7 г темного масла, которое очищают на хроматографичесой колонке с силикагелем (450 г). олонку промывают последовательно месью эфир - гексан (1:1), эфир ексан (2:1) и эфиром. Собирают фрак ии по 18 мл. Фракции 176-22 соедияют и концентрируют до масла, кото ое перекристаллизовывают из гексана получают 3,2 г (32%) транс-изомера елевого соединения в виде кристал- ов светло-желтого цвета; т. пл. 3,5-684; т/е - 373 (т+). ИК-спектр (КВг): 5,82 (кетон ); 5,75 (сложный эфир ); 2,95 (NH)|U. ракции 2 6-290 соединяют и концентируют до получения 0,55 г (5) сырого цис-изомера целевого соединения в виде масла. В дальнейшем его очищат описанным образом на хроматограической колонке и получают чистый цис-изомер в виде масла; т/е - 373 ш-). ИК-спектр (СНСВз): 5,82 (кетон ); 5,67 (сложный эфир );2,92 (NH)y. Элементный анализ. ., Вычислено, %. С 70,75; Н 8,37;, N3,75. . C22H3iN04 Найдено, %: С 70,90; Н 8, N3,69. Фракции 225-245 соединяют и выпаривают до получения 2,69 г (26) смеси цис- и транс-изомеров, которые выделяют по описанной методике. Из d,1-5,6,6а,7-тетрагидро-1-окси-3-(5-фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-она таким же способом получают следующие соединения: d, 1 -транс-5,6,6a{i, 7-10,10аоС-Гексагидро-1--ацетокси-3-(5-фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-он в виде масла mZ.e - 421 (m) . Элементный анализ. Вычислено, % С 74,08; Н 7,41; N З.,32. С2бНз «04 Найдено, % С 74,16; Н 7,59; N 3,20. d, 1-цис-5,6,,10,10ар.-Гексагидро-1-ацетокси-3-(5-фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-он в виде масла, т/е 42Г(). Элементный анализ. Вычислено, % С 74,08; Н 7,41; N 3,32. CgeH -iNOii Найдено, % С 74,04; Н 7,49; N 3,54. d,1-5,6,6а,7-Тетрагидрр-1-окси-бЛ -метил-3.(5 Фенил-2-пентилокси)бензо (с)-хинрлин-9(8Н)-он превращают вd,1-транс-5,6,бар,7,10,1Оэй-гексзгид ро-1 -ацетокси-6с4.-метил-3- (5 фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-он и d, l-циc-5,6,6ap,7,10,10a/ -гeкca гидpo-1-aцeтoкcи-6o;-мeтил-3- (5-фенил -2-пентилокси)-бензо(с)-хинолин-9 (8Н) -QH. Изомерные продукты переводят в их соли хлористоводородной кислоты по способу, описанному в общей методике получения солей; Характеристики полученных солей приведены в табл. 2. Используя методики примеров 1-6, получают соединения, представленные в табл. 3. П р-и м е р 7- d, 1-транс-5,6,6af 7,10,1 ОаоС-Октагидро-1 -ацетокси-9-окси-6р-метил-(2-гептилокси)бензо(с)-хинолин. К перемешиваемой суспензии ,150 мг :(0,39 моль) dJ-TpaHC-5,6,6af,7,10, 10ао6-гексагидро-1-ацетокси-6/3-метил-3- (2-гептилокси)-бензо(с)-хинолин-9 .{8Н)-она в этаноле (10 мл) при 0°С добавляют 40 мг боргидрида натрия. Спустя 0,5 ч реакционную смесь влива ют в смесь ледяной уксусной кислоты (50 мл) и эфира (75 мл). Пос ле выделения эфирного слоя водную .фазу экстрагируют эфиром (2x50 мл) Соединенные эфирные фракции промывают последовательно водой (2 х 50 мл) насыщенным бикарбонатом натрия (1 х мл), солевым раствором (1 х X 65 мл), сушат (MgSO), фильтруют и концентрируют при пониженном давле НИИ до получения 156 мг белого пенообразного соединения, содержащего смесь аксиального (меньшая часть) и экваториального (оснод ная часть) cпиpJoв - транс-5,6,.8,9,1,0,10а -октагидро-1-ацетокси-9-окси-б|з-метил-3-(2-гептилокси)бензол(с)-хинолин; т/& -389 (т ). ИК-спектр () : 5,72р (карбонил сложного эфира). ЯМР-спектр (60 мгГц), дает характеристический синглет на 2,23 .(ч. на млн.) для метильной группы ацетата. Меньший и основной изомеры выделяют следующим образом: 180 мл спиртов а,1-транс-$,6,6а,7,8,9,10,10асзб-октагидро-1 -ацетокси-9-окси-6(-метил-39516 -(2-гептилоксиУ-бензо(с)-хинолина вводят в колонку, содержащую 15 г силикагеля, и промывают растворителем, представляющим собой смесь 3 ч.бензола и 1 ч. эфира. Собирают фракции. Фракции 6-8 соединяют и концентрируют при пониженном давлении до получения 13 мг d,l-TpaHc-5,6,6af3,7,8,9,10,10ao -октагидро-1 -ацетокси-9о6-окси-р-метил -3-(2-гептилокси)бензо(с)-хинолина. Фракции 11-16 соединяют и концентрируют до получения 83 мг d,J-TpaHc-5,6,6ар,7,8,9,10,10а(-октагидро-1-ацетокси-9р-окси-6р-метил-3-(2-гептилокси)бензо(с)-хинолина. Таким же способом из соответствующих реагентов получают следующие соединения:d,1-TpaHc-5,6,6ap,7,8,9,10,10ao(;-OKтагидро-1 -ацетокси-9-окси-6)3-мётил-3- (5-фенил-2-пентилокси)бензо (с)-хинолин; (); ИК-спектр (СНСЮ; 5,70 У (карбонил сложного эфира); превращают в хлоргидрат с выходом твердого продукта, т. пл, 188-190°C; После перекристаллизации из смеси ацетон-метанол - эфир (25:1:100) получают аналитический образец 9р-спирта с т. пл. 193-19 С. Элементный анализ. Вычислено, %: С 68,2; Н 7,66; N 2,96.. с,27Нзь- о. нее Найдено, %: С 68,«8; Н 7,70; N 2,89. После взаимодействия с метансульфонатом (с помощью метансульфокислоты в дихлорметане) получают твердый продукт, который после перекристаллизации из этилацетата дает белые кристаллы с т. пл. ПО-11й°С. ИК-спектр (CHCej): 2,95; 3,70; 3,95; 5,60; 6,06; 6,19; 6,27/li . Элементный анализ. Вычислено, %: С 63,02; Н-7,37; N 2,63. Найдено, %: С 62,90; Н 7,31; N 2,7. d,l-циc-5,6a,6|i,7,8,9,10,10att: -Октагидро-1-ацетокси-9-окси-6р-метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин; 1П/е-437 (т). 1-транс-5,6,,8,9,10,10аоб-Октагидро-1 -ацетокси-9р-окси-6|3-метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин,.т. пл, 120-125°С (с разложением) в виде хлоргидрата. foilj 17953 -98,57 (с 0,351, СН,ОН); m/e-A37 Элементный анализ. - Вычислено, %: С 68,iZ; Н 7,66 N 2,96. С27Нз5МОа нее С 68, Н 7,68; Найдено, %: N 3,00. d-TpaHc-5,6,6ap,7,8,9,10,1U-OKTaгидро-1 -ацетокси-9р-окси-6р-метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин, т. пл. 120-125°С (с разложением) в виде хлоргидрата.М + 99,33° (с 0,30, ) ; .т/е - 437 () . Элементный анализ. Вычислено, %: С 68, Н 7,66-; N 2.96. C27H35N04 С 68,Л1; Н 7, Найдено, % N 2,95. Аналогичным способом из соответствующих реагентов получают соединения, приведенные в табл. 4 и 5При м е р 8. d,1-TpaHc-5,6,6aj 7,8,9,10,1 OaoL-Октагидро-1 -ацетокси-Э -окси-6р-метил-3-(5-фенил-3-пентил окси)бензо(с)-хинолин. К 200 мл метанола в атмосфере азоfa, охлажденного в (5ане ацетон -су-: ,;ой лед до около , добавляютборгидрид натрия (7,57 г, 0,2 моль). Полученную смесь перемешивают около 20 мин до растворения большей части или всего боргидрида натрия. Раствор d -TpaHC-5,6,6ap 7,83JO ,0 -гаксагидро-1-ацетокси-6р-метил-3- 5-фенил-2гпенти локси Ьензо(с) -хинолин-9(8Н)-она (8,71 г, 0,02 моль) в тетрагидро фуране (88 мл) охлаждают до -50°С, а затем прикапывают за 5-10 мин раствор боргидрида натрия. Реакционную смесь перемешивают при температуре около -70°С в течение 30 мин, а затем выливают в смесь воды (1000 мл), содержащей хлористый аммоний (45 г, ;0,80 моль), измельченный лед (250 мл) |и этилацетат (250 мл). Слои разделяют а водную фазу экстрагируют этилацетатом (3 X 200 мл). Соединенные экстракты промывают водой (1 х 100 мл) и сушат (MgSO). Высушенный экстракт охлаждают до около 5°С. Затем по каплям добавляют раствор этилацетата (15 мл), НС1 1,5 и.(0,025 моль) в
течение 15 мин. При перемешивании сме-55 N 2,73,
си при 0-5 С в осадок выпадает хлоргидрат целевого соединения. Затем смесь перемешивают еще в течение
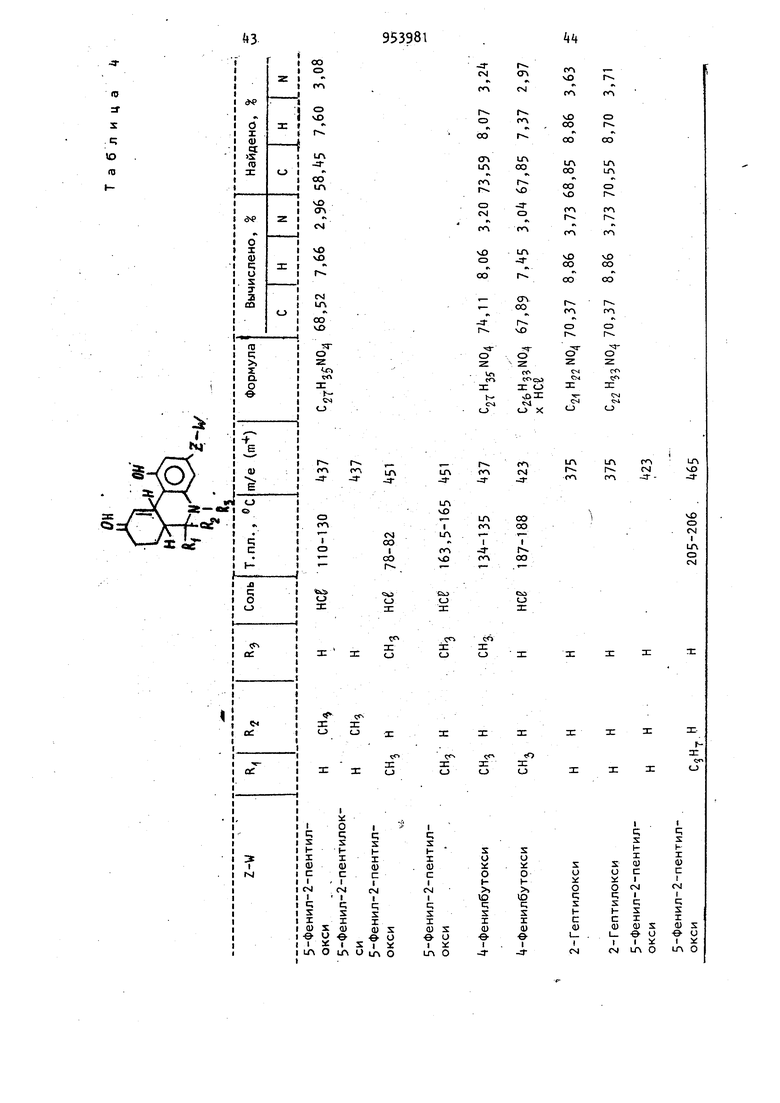
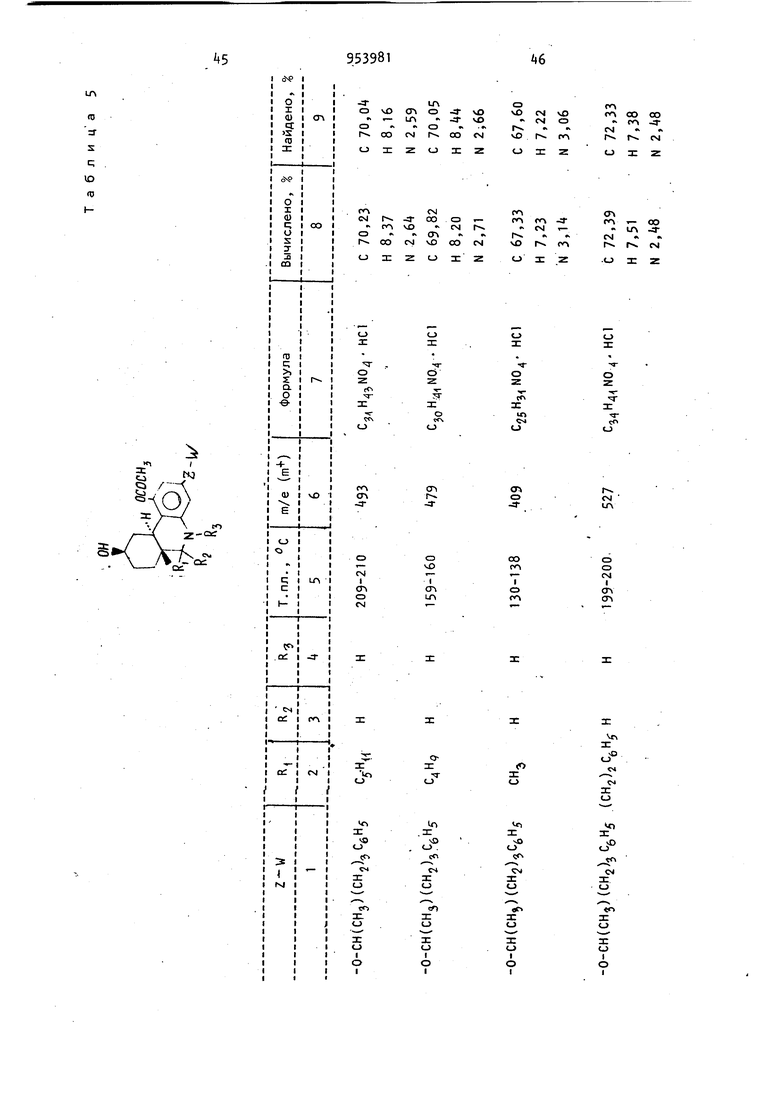
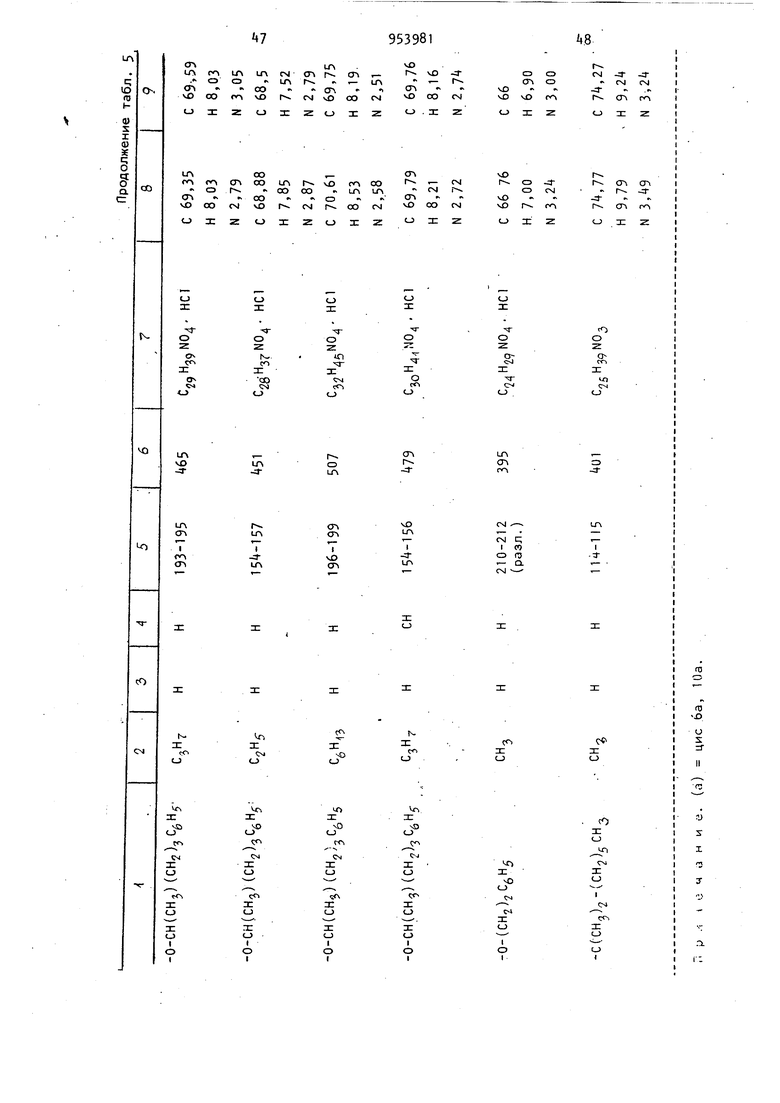
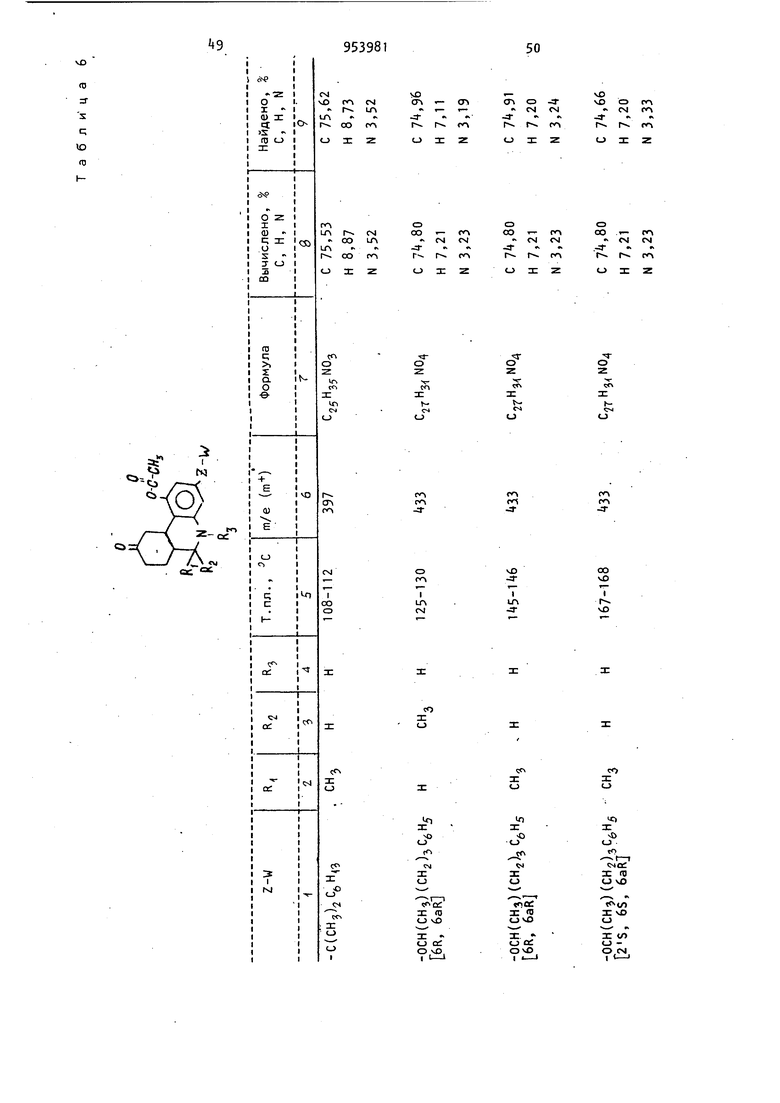
Из соответствующих реагентов аналогичным способом получают соединения, представленные в табл. 7. 18 олучаса, фильтруют и полученную соль ушат при 25 С и 0,055 мм рт.ст. до получения 6,378 г (67,3) продукта с т. пл. 195-198°С (с разложением). Используя методику примера 2, получают соединения, представленные в табл. 6. , . Пример 9. d,l-uHc-5,6-,, 7,8,9,10,1 Оа-Октагидро-1 -ацетокси-9/ -гидрокси-6р-метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин. К раствору d,l-циc-5,6,6a(,7,0, 1 Оар -гексагидро-1 -ацетокси-6| -метил-3-{5-фенил-2-пентилокси)бензо(с)-хинолин-9(8Н)-она (1,0 г, 2,29бммоль) в сухом тетрагидрофуране (100 мл) при добавляют при перемешивании втор.-бутилборгидрид калия (4,6 мл, 0,5 М, 2,29б ммоль) по каплям за 5 мин. Реакционную смесь перемешивают еще 30 мин при -78.°С и затем выливают при перемешивании в раствор уксусной кислоты (250 мл) и эфира (500 мл), предварительно охлажденных до ... Образующиеся слои разделяют и водный слои экстрагируют дополнительным количеством эфира . (250 мл). Соединенные эфирные-экстракты промывают последовательно- водой (2 X 250 мл), насыщенным раствором бикарбоната натрия (1 х 250 мл) и солевым раствором (1 х 250 мл), сушат (MgSO) и концентрируют в вакууме до получения желтого масла (1,4 г). Неочищенное масло хроматографируют на . ; - силикаГеле (100 г), используя в каче, ii . .стве элюирующего растворителя смесь бензол - эфир (3:1). После элюирова,ния менее полярных примесей выделянэт в виде прозрачного .мае-;, ла целевой продукт (700 мг). растворяют в простом эфире (35 мл) и обрабатывают эфиром, насыщенным газоп образным НС8, для получения соли хлористоводородной кислоты целевого.соединения (448 мг), т.пл. 115-124 0 (после перекристаллизации из смеси эфир - хлороформ). Молекулярный ион 43б; ИК-спектр .(КВг): Ш (сложный эфир ). Элементный анализ. Вычислено. %; С 68,41; Н 7,66; N 2,96. С тНзз Оц-НС Найдено, %: С 68,52; Н 7,91; Элементный, анализ. Вычислено, %: С 68,88; Н 7,85; N2,87. . . С2 НзтМ04- НС1 Найдено, %: С 68,2; Н 7,78; N 2,75. П р и. м е р 10. d, 1-транс-5 ,6, 6а|,7,8,9,10,10ай-Октагидро-1 -ацеток си-9-окси-5 метил-3(5 Фенил-2-пентилокси)бензо(с)-хинолин. Формальдегид (1,1 мл) водного раствора добавляют к раствору d, 1 -транс-5,6,6а/3,7, Ю, 10ао -гексагидро-1-ацетокси-З(5 фенил-2-пентилокси)бензо{с)-хинолин-9{8Н)-она в ацетонитриле (15 мл) при комнатной температуре с последующим добавлением цианборгидрида натрия (0,2б2 г). Реакционную смесь перемешивают в течение 1 ч, за это время рН поддерживают нeйtpaльным, добавляя по мере надобности уксусную кислоту. К реакционной смеси добавляют дополнительное количество цианборгид рида натрия (0,2б2 г) и метанол (15 мл), затем ее подкисляют до рН 3 перемешивают в течение 2 ч и концент рируют при пониженном давлении до масла. Масло разбавляют водой 50 мл рН устанавливают с помощью водной гидроокиси натрия и щелочную смесь экстрагируют эфиром (З х 200м Соединенные эфирные экстракты промывают солевым раствором, сушат ( и концентрируют при пониженном давле НИИ до получения прозрачного масла. Масло затем растворякзт в смеси 50 эфир гексан и вводят ,в хроматографическую колонку с силикагелем. Вначале колонку промывают смеСЬЮ эфир - гексан, а затем соответст венно 60-ти, 70-ти и смесью эфир - гексан. Элюат исследуют с пом шью тонкослойной хроматографии (смес эфир 10 ч,- гексан 1 ч.). Первым . выделяют d, 1-транс-5,6,6ар j7,10, Oaa -гeкcaгидpo-1-aцeтoкc.и-5 мeтил-3(5-фeнил-2-пeнтилoкcи),бeнзo(c) -хинолин -9(8Н)-он (0,125 г,);тЬ7е - 435 (т-). Элементный анализ. Вычислено, %: С 7,5; Н 7, N 3,22. C27H33N04 Найдено, I: С 7,06; Н 7,77; N 3,31. Вторым продуктом .выделяют -диастереомер целевого соединения (25 г);т/е - 437 (пт). 9 20 Элементный анализ. Вычислено, I: С 7,11; Н 8,Об; N 3,20. С2гНз5М04 Найдено, %: С 73,96; Н 8,34; N 3,00. Третьим продуктом выделяют 9р-окси-диастереомер целевого соединения (0,7 г); т/е - 437 (fP) . Элементный анализ. Вычислено, %: С 74,11; Н 8,Об; N 3,20. С 7Нз5М04 Найдено, %: С 73,5б; Н 7,86; N 3,21. Аналогично d, 1-транс-5,6,6а/,7, 1 0,1 Оаоб-гексагидро-1 -ацетокси-3- (2-гептилокси)бензо(с)-хинолин-9(8Н)-он обрабатывают цианборгидридом натрия, в результате чего получают: d, 1-транс-5,6, бар, 7,10,1089:-Гексагидро-1-ацетокси-5-метил-З-(2-гептилокси)бензо(с)-хинолин-9(8Н)-он в виде масла; т/е-387 (т ) ; ИК-спектр (CHClj): 5,80 (кетон ); 5,65 (, в сложном рфире)К. Элементный анализ. Вычислено, %: С 71,29; Н 8,58; N 3,61. С2зНззМ04 Найдено, %: С 70,78; Н 8,71; N 3,27. d, -транс-5,6,бар, 7,8,9 ,1 О , 1 Oaot -Октагидро-1 ацетокси-9р-гидрокси-5-метил-3(2-гептилокси)бензо fc)-хинолин в виде масла; т/ё-389 (пТ) ИК-спектр (СНС1):2,80 (О-Н) ; 5,70 ( сложный эфир) , Элементный анализ. Вычислено, : С 70,92; Н 9,Об; N 3,60. С2зНз5 04 Найдено,: С 70,5б; Н 8,95; N 3,56. d, 1 -транс-5,6,бар,7,1 О , IOaoi-Гексагидро-1-ацетокси-6р-метил-3-(5 фенил-2-пентилокси)(с)-хинолин-9 (8Н)-он, который превращают в d,1-транс-5,6,6аВ ,7,1 0,1 Оао(,-гексагидро-1 -ацетокси-5-метил-6| -метил-3- (5-фенил-2-пентилокси)бензо(с)-хинолин-9 (8Н)-он; d,l-TpaHc-5,6,6ap,7,8,9,10, 1 Оаос-октагидро-1 -ацетокси-9р-гидрокси-5.-метил-6| -метил-3(5 фенил-2-пентилокси)бензо(с)-хинолин, который выеляют в виде хлоргидрата, т. пл. 163-165°С; т/е-451 (т-.).. Пример П. d, 1-транс-5,6,6aR, 7,8,9,10,10аоС-Октагидро-1-ацетокси2195-9р)-гидрокси-5-изобутирил-3-(фенил-2-пентилокси)бензо(с)-хинолин. Боргидрид натрия (38 мг, 1,0 ммол медленно добавляют к раствору d,1 -транс-5,6,6а,7, Ю, IOaoi-гексагидро-1-ацетокси-5 изобутирил-3(5 фенил-2-пентилокси)бензо(с)-хинолин-9(8Н) -она (2бО мг, 0,529 ммоль) в абсолют ном этаноле (20 мл) при в атмосфере азота. Реакционную смесь перемешивают в течение 1 ч и затем под кисляют 10%-ной соляной кислотой. Эт нол удаляют отгонкой при пониженном давлении. К оставшемуся раствору добавляют 10 мл воды и проводят экст--ракцию этилацетатом (2 х 50 мл).. Экстракты соединяют, промывают соле вым раствором и затем сушат (MgSOx). После концентрирования в вакууме получают целевое соединение в виде тве дого аморфного вещества (213 мг), которое используют без дальнейшей очистки. Пример 12. d,1-транс-5,6, ,7,10,10ар-Гексагидро-1 -ацетокси-5-aцeтил-6{i-метил-3- (5 Фенил-2-пентилокси)бензо(с)-хинрлин-9(8Н)-он. 3,9 г (0,008 моль) d,l-TpaHc-5,6,6ар,7,8,9,10,10ао(-октагидро-1-ацетокси-6р-метил-3-(5-фенил-2-пентилокси)бензол(с)-хинолин-9(8Н)-она растворяют в 20 мл не содержащего спирт хлороформа, полученный раство охлаждают на водяной бане со льдом, после чего добавляют 1 мл пиридина, высушенного над гранулированной гидр окисью калия, затем добавляют 0,95м (0,013 моль) хлористого ацетилу, который растворяют в 5 мл хлороформа. гомогенный раствор перемешиваю при нормальной температуре в течени 18 ч. Реакционную смесь переливают 50 мл ледяной воды и дважды экстрагируют хлороформом (порциями по 25 мл). Объединенные органические слои промывают 25 мл насыщенного ра створа бикарбоната натрия, 25 мл во (ды, 25 мл рассола, сушат над сульфа том магния, фильтруют и выпаривают досуха при пониженном давлении. Очи стку проводят хроматографией (200 г силикагеля Бринкмана, растворитель циклогексан-эфир 3:1) с образованием- 2, 20 г (выход 83,8)целевого соединения. Элементный анализ. Вычислено, I: С 72,90; Н 7,39, N2,80. Ce9H:i NOf Найдено, %.: С 72,б9; Н 7, N 2,19. Аналогичным образом d,l-циc-5,6,6а(3|7, ЮаВ-гексагидро-1-ацетоки-6-метил-З-(5-фенил-2-пентилокси) бензо(с)-хинолин-9(8Н)-он превраи(ют в d, 1-цис-5,6,6а,7,10а| -гексагидро- 1-ацетокси-5-ацетил-6р-метил-3-(5-фенил-2-пентилокси)бензо(с)-хинолин -9(8Н)-он; т. пл. 12б-128°С, выход 82. Элементный анализ. Вычислено, %: С 72,90; Н 7,39; N 2,80. Найдено, V С 72,80; Н 7,35; N 2,70. Пример 13. d,1-транс-5,6, бай, 7,10а у;-Гексагидро-5 ацетил-2-пентилокси)бензо(с)-хинолин. Шлам, состоящий из 0, г (0,039 моль) гидрида натрия (полученного промыванием 1,87 г 50 -ного раствора гидрида натрия в дисперсии с минеральным маслом сухим пентаном) в 57 мл диметилсульфоксида нагревают при в течение 2,5 ч. После добавления 15,32 г (0, моль)- трифе-. нилметилфосфоний -бромида реакционную смесь нагревают в течение 2 ч при 60°С. Добавляют раствор, состоящий из 1,86 г (0,004 моль) d,l-TpaHC-5,6,6aft,7,10,10асй-гексагидро-Т-ацетокси-5 ацетил-6-метил-3-( 5 Фенил-2-пентилокси)бензо(с)-хинолин-9(8н)-она в 57 мл диметилсульфоксида и реакционную смесь переливают в 200 мл смеси вода - лед, содержащей 20 г бикарбоната натрия. Полученную смесь дважды экстрагируют этилацетатом (порциями по 50 мл), объединенные органические слои промывают 50 мл воды, 50 мл рассола, сушат над сульфатом магния, фильтруют, выпаривают с образованием оранжевого окрашенного масла, которое содержит окись трифенилфосфина (согласно данным тонкослойной хроматографии). Путем хроматографической очистки (силикагель Бринкмана 125 г, растворитель циклогексан-эфир 3:1) получают целевое соединение в количе(выход 75), т, пл. 17 стве 1,252 г 76°С. Элементный анализ. %: С 77,56; Н 8,U; Вычислено, 3,23. C2SH35N03 С 77,29; Н 7,96; Найдено, 3,22. Аналогичным образом из соответств ющего исходного вещества получают d, I -цис-5,6,6ар, 7,10,1 Оа -гексагидро -5 ацетил-1- гидрокси-6р-метил-9 мети лен-3(5Фенил-2-пентилокси)бензо(с) -хинолин; т. пл. 168-169, (выход 8,8). Элементный анализ. С 77,56; Н 8,14; Вычислено, N 3,23. СзеНззМОз с 77,25; Н 8,14; Найдено, ; N 3,12. Пример 14. 2R,6S,6aR,9R, 10аЯ(-)(-)-1-Ацетокси-5,6,6а,7,8,9, 10,10а-октагидро-9 гидрокси-5,6-диме тил-3(5 фенил-2-пентилокси)бензо(с) -хинолин. К перемешиваемому раствору, состо ящему из 1,0 г (0,0021 моль) 2Я,б5,6аЯ,9Я,10аЯ,(-)(-)-1-ацетокси-5,6,6а,7,8,9,10-октагидро-9-гидрокси-6-метил-3(5 фенил-2-пентилокси) бензо(с)-хинолин гидрохлорида в 30 м CHCSj, добавляют 30 мл насыщенного раствора NaHCOg и полученную смесь перемешивают в течение 5 мин при ком натной температуре. Слои разделяли и водный слой повторно экстрагируют (20 мл). Объединенные хлороформные слои сушат () , фильтруют/ и раст воритель удаляют в вакууме с образованием свободного основания в виде бесцветной пены. Эту пену растворяют в 50 мл тетра Гидрофурана ив полученный раствор добавляют 1,0,г 5 Pd/C, 1,05 (0,018 моль 8,7 экв) ледяной уксусной кислоты и 5,18 мл (0,20 моль 100 экв) 37 -ного раствора формальдегида. Эту смесь помещают в аппарат Парра и проводят гидрирование при давлении водорода 50 фут/дюйм в течение 50 мин. Катализаторотфиль ровывают на диатомитовой и про мывают этилацетатом. фильтрат разбав ляют до объема 150 мл этилацетатом и затем последовательно промывают 3 х X 100 мл насыщенного раствора 75 мл , 75 мл рассола, и сушат над MgS04. Растворитель отфильтровывают и Удаляют в вакууме с образованием жел того вязкого масла, которое подверга ют хроматографической очистке на 50 г силикагеля (0,04-0,63 мм) и элюируют смесью толуол - диэтиловый эфир (1:1). Одинаковые фракции объе диняют и выпаривают в вакууме с обра зованием окрашенного масла, которое повторно растворяют в 50 мл диэтилового эфира и через полученный раствор барботируют Hes в атмосфере азота при перемешивании. Полученное твердое вещество отфильтровывают в атмосфере азота и сушат в вакууме (0,1 мм) в течение 24 ч при комнатной температуре с образованием 0,45 г (44) целевого продукта; т. пл. 90-95®С (разл.). Элементный анализ. Вычислено, %: С 68,90; Н 7,85; N 2,87. нее Найдено, %: С 68,60; Н 7,92; N 2,77. Ир - 73 (с, 1,0 метанол); масс-спектр т/е-451 (т) . Следующие соединения получают аналогичным образом: d,1-1-ацетокси-5,6,6а,7,8,9,10,10ас -октагидро-9/ -гидрокси-5,6|3-диметил-3-(1 ,1 -диметилгептил)-бензо(с)-хинолин гидрохлорид, т. пл. 129-UO°C (разл.); m/e-4l5 (m) 100,а также d, l-1-ацетокси-5,6,6а,3,7,8,9,10,10, lOacd-октагидро-9 -гидрокси-5-метил-6|3-н-бутил-3-(5 Фенил-2-пентилокси)бензо(с)-хинолин гидрохлорид; т. пл. 106-108®С; т/е-493 (т). i .Элементный анализ. Вычислено, %: С 70,21; Н 8,37; N 2,6 : C3iH.,NO . НСГ Найдено, %: С 71,02; Н 8,43; N 2,6. Пример 15. d,1-5,6,бар,7,8, 9,1 Оа oi-Октагидро-1-ацетокси-5-бензоил-9-бензоилокси-6|3-метил-3 (1 -метил-4-,фенилбутокси) бензол (с)-хинолин . Перемешиваемую суспензию 47,4 г (0,10 моль) d,l-5,6,6afi,7,8,9a,10, 10а|Х -октагидро-1 -ацетокси-9-гидрокси-6 -кетил-3- (1 -метил-4-фенилбутокси) бензо(с)-хинолингидрохлорида в 500 мл сне и), в. атмосфере азота охлаждают до и обрабатывают 250 мл пиридина , и затем 58 мл (0,50 моль) бензоилхлорида в 500 мл хлороформа. Полученный в результате гомогенный раствор нагревают с обратным холодильником на паровой бане в течение часа. Реакционную смесь переливают в колотый лед и экстрагируют хлороформом. Органические экстракты объединяют, промывают последовательно водой.(2 х 500 мл), 101-ной соляной кислотой, насыщенным раствором бикарбоната натрия (500 мл) и насыщенным раствором рассола (500 мл), сушат над MgSO;, фильтруют и концентрируют с образованием 119 г светло-желтого масла, В результате хроматографирования через 2000 г силикагеля ( этилацетат-циклогексан) получают 50,5 г (78) d,l-5,6,6ар,7,8,9а,10,10ао -октагидро-1-ацетокси-5-бензоилокси-6|3-метил-3-(1-метил- -фенилбутокси)бензо(с)-хинoлин с т. пл. С. Элементный анализ. Вычислено, %: С 76,24; Н 6,72; N 2,17. . С 76,35; Н 6,92; . Найдено, %: N 2,19. Разделение d,1-5,6,бар,7,8,9,Ю, 1 иао -октагидро-1 -ацетокси-5 бензоил-9-бензоилокси-6р1-метил-3(1 а-метил - -фенилбутокси)бензо(с) - хинолина и d, 1-5,6,,7,8,9а, 10, Юаоб-октагидро-1-ацетокси-5-бензоил-9 бензоилокси-1 -метил-3- (Т-метил- -фенилбу токси)бензо(с)-хинолина. Перекристаллизацией 50,5.г d,1-5,6,бар.,7,8,9а, 10 ,10а(у;-октагидро-1.-ацетокси-5-бензоил-9-бензоилокси-6|-метил-3-(1-метил-1-фенилбутокси) бензо(с)хинолина из 2 л 2-пропанола получают 23,8 г твердого белого веще ства, т. пл, 136-138°С, которое дваж ды перекристаллизовывают из 2-пропанола и один раз из ацетонитрила с образованием 5,7 г d,1-5,,7,8, 9а, 10,10аоб-октагидро-1-ацетокси-5-бензоил-9 бензоилокси-6р-метил-3-(1-метил- -фенилбутокси)бензо(с)хинолина, т. пл. l48-1i9°C. Фильтрат начальной перекристаллизации из 2-пропанола d,1-5,6,бар,7, 8,9а, 10,10ас -октагидро-1-ацетокси-5 -бензоил-9 бензоилокси-6 -метил-3 - (1 -метил-4-фенилбутокси)-бензо(с) -хинолина выпаривают до образования белой пены и обрабатывают 500 мл эфи ра с образованием 12,9 г белого . твердого вещества, т. пл. . Полученные твердые соединения дважды снова обрабатывают эфиром с образова нием 3,8 г d,l-5,6,6aA,7,8,9a,10,10a -пктягмлпп-1-д„Ртп,.гми-ррн,о,мп-ч-. октагидро-1-ацетокси-5-бензоил-9 -бёнзоилокси-6р -метил-3- (1 -метилг4-фенилбутокси)бензо(с)-хинолина, т. пл. 139 141°С. Получение, d, 1-5,6,6а/3,7,8,9а ,10, Юаоо-октагидро- -ацетокси-9-гидоокси 95 26 -6 1-метил-3-(1|3-метил-4-фенилбутокси)- -бензо(с)-хинолин гидрохлорида. К перемешиваемому раствору 2,0 г (5,3 ммоль) литийалюминий гидрида в 150 мл тетрагидрофурана в атмосфере азота по каплям добавляют раствор, состоящий из 5,7 г (8,8 моль) d,l-5,6,6а(5,7,8,9а,10,10ао(.-октагидро-1-ацетокси- -бензоил-9-бензоилокси-6р-метил-З(1p-мeтил- фeнилбyтoкcи)-бензо(с)-хинолина с 112 мл тетрагидрофурана в течение 5 мин. Полученную в результате смесь нагревают с обратным холодильником в течение 5 мин , охлаждают и осторожно переливают в охлаждаемую льдом смесь 1125 мл 5 ной уксусной кислоты в воде и 2250 мл эфира. Полученную двухфазную смесь перемешивают в течение 10 мин и разделяют слои, водный слой экстрагируют 500 мл эфира и объединенные эфирные слои последовательно промывают водой (3 X 500 мл), насыщенным раствором бикарбоната натрия (2 х 00 мл) и насыщенным раствором рассола (1 х X 500 мл), сушат над MgSO, фильтруют и выпаривают с образованием 5, г d, 1 -5-бензил-5,6,6а(,7,8,9а, 10, -октагидро-1,9-дигидрокси-6р-метил-3-(1(-метил-4-фенилбутокси)бензо(с)-хинолина в виде светло-фиолетового масла. d,1-5-Бензил-5,6,6ар,7,8,9а,10, 10ас -октагидро-1,9 дигидрокси-6|3-метил-3-(1р-метил-4-фенилбутокси)бензо (cj-хинолйн немедленно переносят в 450 мл метанола и гидрируют при атмосферном давлении над 4,27 г Pd/C в течение 3 ч с образованием d,l-5,6,6а(3,7,8, 9а, 10,10aoi-октагидро 1,9 Дигидрокси-6| -метил-3(1|3 метил-4-фенилбутокси)бензо(с)-хинолина после фильтрации катализатора и выпаривания метанола. d, 1-5,6,6a|i,7,8,9а,10,Юао -Октагидро-1,9 Дигидрокси-6|5 метил-3- (1 ft -метил-4 фенилбутокси)бензо(с)-хинолин немедленно растворяют в 210 мл хлористого метилена, охлаждают до О С в атмосфере азота и последователь ° обрабатывают Ь,35 мл триэтиламина, Г (9,7моль) 4-диметиламинопиридина и 0,834 мл (8,8 моль) уксусного ангидрида. Пясле перемешивания в течение 30 мин реакционную смесь переливают в 250 .мл воды и органические слои разделяют, бодный слой экстрагируют один раз метиленхлоридом и объединенные метиленхлоридные слои последовательно промывают насыщенным раствором бикарбоната натрия (2 х X 150 мл), водой (15 мл) и насыщенным раствором рассола, сушат над MgSO,4, фильтруют, выпаривают и хроматографируют на 300 г силикагеля, используя в качестве элюента смесь ЗЗ -ного эфира в толуоле, с образованием 1, г d, 1 -5,6,6aft,7,8,9a, 10, IOaoi-октагидро -1-ацетокси-9-гидрокси-6 -метил-3-(1р-метил- -фенилбутокси)бензо(с)-хинолина гидрохлорида в виде свободного основания. В результате обработки эфирного раствора d, 1-5,6,6а,7,8,9, 1 ОаоС-октагидро-1 -ацетокси-9-гидрокси-6)-метил-3- (1|3-метил-4-фенилбутокси)бензо{с)-хинолина газообразной нее получают 795 мл d, 1-5,6,6а|3,7,8, 9а,10,10аЫ-октагидро-1-ацетокси-9 -гидрокси-6р-метил.-3 (1р-метил- -фенилбутоксибензо(с)-хинолин гиДрохлорид, т.пл. 213-215 С, после фильтрации и обработки ацетоном; т/е-+37 (т , 100).
Элементный анализ.
Вычислено,: М 68,42; Н 7,66; N 2,96.
нее
Найдено, %: С 68,8; Н 7,63; . N2,05.,
Аналогичным образом из 3,8 г d, 1-5,6,6ар),7,8,9а,Ю,10ао1:,-октагидро-1-ацетокси-5-бензоил-9-бензоилокси-бр-метил-З- (Ш-метил- -фенилбутокси) бензо(с)хинолина получают 1,1 г d,l-5,6,6aft,7.8,9a,10, 10а(х;-октагидро-1 -ацетокси-9 гидрокси-6 -метил-3 ( -метил-+-фенилбутокси)бензо(с)-хинолин гидрохлорид, т. пл; 202-205°С (разл.); т/е-437 (100, т)..
Элемйнтны анализ.
Вычислено, : С 68,42; Н 7,66; N 2,96.
С27Нз5М04 - НС1
Найдено, %: С 68,20; Н 7,5б; N 3,04.
Пример 16. Ди-транс-5 6,6а, 7,8,9,10,10а(Х.-октагидр6-1-ацетокси-3-(1,1-диметилгептил)-1,9-бета-окси-б-бета-метилбензо(с)-хинолин.
I. 1,3-Диокси-5-{1,1-диметилгептилбензол). .
Смесь, состоящую из 1,3-ДиметилокСИ-Б-(1,1-диметилгептил)бензола (93,7 г, 0,355 ммоль) и пиридиний гидрохлорида, подвергают нагреванию при при перемешивании в течение
2 ч. К реакционной смеси добавляют лед и 100 мл 6н. хлористоводородной кислоты. Полученную таким образом реакционную смесь экстрагируют просты эфиром. Полученный эфирный экстракт промывают водой, сушат сульфатом магния и выпаривают. Полученный остаток
, кристаллизуют из гексана. Выход 83,5 от теоретического. Продукт характеризуется т. пл. 85-,87°С.
II. З-Амино-5-(1,1-диметилгептил) фенол.
Смесь, состоящую из 1,3-диокси-5(1,1-диметилгептил)-бензола (1б г
.0,068 моль), хлорида аммония (17,7 г) бисульфита натрия (35 г) и гидроокиси аммония (100 мл), нагревают в стальном автоклаве при 182°С в течение 3 дней. Далее автоклав охлаждают содержимое извлекают и автоклав промывают этилацетатом и водой. Водную фазу отделяют, экстрагируют этилацетатом и соединенные этилацетатные растворы сушат сульфатом магния и подвергают концентрированию при пониженном давлении с получением масла темного цвета (17,8 г). Это масло выливают в толуол и вводят в колонку, заполненную силикагелем (900 г). Содержимое колонки элюируют с помощью смеси толуол - простой эфир в соотношении 3:1. Первые 2 л элюата выгружают и собирают по 500 мл в фракции. Фракции с 8 по 12 смешивают и подвергают отгонке до получения масла светло-коричневого цвета, которое далее кристаллизуют из петролейного эфира с получением белого твердого вещества с т. пл. б5-66°С в количестве
10,6 г (выход 66 от теоретического В результате перекристаллизации из холодного гексана точка плавления повышена до б7-б9°С. Продукт переводят в хлористоводородную соль путем растворения в простом эфире и барботирования сухого газообразного хлористог водорода через раствор. Выпавший осадок фильтруют.
III. Диэтил-3- З-окси-5-(1,1-диметилгептил) анилино бутират.
З-АМИНО-З-(1,1-диметилгептил)фенолгидрохлорид (150,8 мл) превращают в целевое соединение (50,8 г). Выход 96,4% от теоретического. Продукт используют непосредственно без очистки.
IV. Диэтил-3- 3-Диокси-5-(1,1-дидиметилгептил)-М-этоксикарбонилани-
линобутират. Диэтил 3- 3-окси-5-(1,1-димeтил гeптил)-aнилинo -бyтиpaт (50,8 г) . превращают в целевое соединение (б2,8 г), которое используютбез очи стки в процедуре V. V. Ди-3- 3-окси-5-(1,1-диметилгеп тил) -N-этоксикарбониланилино1 масляна кислота. АИЭТИЛ-З- З-окси-5- (1,1 -диметилге тил)-N-этоксикарбонил анилинобутират (б2,8 г) превращают в целевую кислот Выход 51 г, что соответствует 86,5% от теоретического. Полученный таким образом продукт используют без очист ки в процедуре VI. VI. Ди-5-окси-7-(1,1-диметилгепти -2-метил- -оксо-1 ,2,3, тетрагидрохинолин. Смесь, состоящую из ди-3 3 окси 5(1,1-диметилгептил)-N-этоксикарбо нил анилиномасляной кислоты (51 г, 126 ммоль) и метансульфокислоты (510 мл), нагревают в атмосфере азота при 115°С в масляной бане в течение 3,5 ч. Полученную таким образом реакционную смесь охлаждают до 60°С, выливают в 2 л ледяной воды и 500 мл простого эфира. Полученную таким образом смесь перемешивают 15 мин, далее слой простого эфира удаляют и водные слои экстрагируют 200 мл простого эфира. Смешанные слои простых эфиров тщательно промывают водой (3 X 250 мл), один раз насыщенным раствором бикарбоната натрия, 100 мл рассола и сушат с помощью сульфата магния. После отгонки простого эфира получают масло красного цвета.. Его растворяют в 400 мл кипящего гексан и полученный раствор перемешивают 12 ч при комнатной температуре с пол чением кристаллического осадка желто го цвета. Выход Н,8 г. Продукт пере кристаллизовывают из гексана, т.. пл. 79-80°С. Элементный анализ. Вычислено, С 75,20; Н 9,63; N 4,63. С|9Н29 02 Найдено, I: С 75,25; Н 9,5б; N 4,58. Vll. Ди-1-формил-5-окси-7-(1 ,1-диметилгептил)-3 оксиметилен-2-метил- 3 оксимётилен-2 -метил- 4-оксо-1,2,3,4-тетрагидрохинолин. ДИ-5-ОКСИ-7-(1,1-диметилгептил)-2-метил-4-оксо-1,2,3,4-тетрагидрохинолин (16,65 г, 54,9 ммоль) превра Я 30. щают в целевое соединение (выход 19.7 г) в виде масла желтого цвета. VIII. Ди-1-формил-5-окси-7-(1 ,1-диметилгептил)-2-метил 4-оксо-3(3 -оксобутил)-,2,3,-тетрагидрохиноПолучают из ди-1-формил-5 окси-7 -(1,1-диметилгептил)-3(Зоксиметилен)-2-метил-А-оксо-1 ,2,3, -тетрагидрохинолина (19,7 г, 5,Э мм).. Выход полупродукта-сырца 26,7 г. В таком виде продукт используют в процессе, проводимом в соответствии С методи кой IX. IX.Ди-5,6,6а,7-тетрагидро-1-окси 3-(1 ,1-диметилгептил)-6-бета-метилбензо(с)-хинолин-9(8Н)-он. Ди-1-формил-6-оксо-7(1.1 Диметилгептил)-2-метил- -оксо-3-(3-оксобутил)-1,2,3,4-тетрагидрохинолин (33,0 г, 862 ммоль) превращают в целевое соединение. Выход 3,35 г. X.Ди-5,6,6а,7-тетрагидро-1-ацетокси-3-(1,1-диметилгептил)-6-метилбензо(с)-хинолин-9(8н)-он. В результате ацетилирования ди-5,6,6а,7-тетрагидро-1 -окси-3-(1 ,1-диметилгептил)-6-метилбензо(с)-хи- нолин 8(9Н)-она 03,0 г, 8,4 ммоль) получают 3,12 г целевого продукта; т. пл. 108-112°С. Элементный анализ. Вычислено, %: С 75,53; Н 8,87; N 3,52. C25H35N03 Найдено, %: С 75,62; Н 8,73; N 3,52. . XI.Ди-5,6,6а,7,10,10а-гексагидро-1-ацетокси-6-бета-метил-3(1,1 диметилгептил)-бензо(с)-хинолин-9(8Н)-он. Суспензию ди-5,6,6а,7-тетрагидро-1-окси-6-бета-метил-З(1,1-диметилгептил)бензо(с)-хинолин-9(8Н)-она (2,0 г, 5,63 моль) в тетрагидрофуране (25 мл) добавляют по каплям через дозирующую воронку к быстро перемешиваемому раствору лития (0,236 г) в жидком аммиаке (120 мл, дистиллироварнногованного через таблетки гидроокиси калия) при (сухой лед - ацетон). Дозирующую воронку промывают 10 мл тетрагидрофурана. Полученную таким образом смесь перемешивают 10 мин добавляют 4 мг лития и перемешивают еще в течение 2 ч. Твердый .хлорид аммония (24 г) добавляют, чтобы уст31953981
ранить голубую окраску. Избыточное количество аммония выпаривают И; остаток выливают в воду (50 мл) и этилацетат (100 мл). Этилацетатный слой отделяют и водную фазу экстрагируют 5 два раза этилацетатом, каждый раз по 50 мл. Смешанные экстракты промывают рассолом, сушат с помощью безводного сульфата магния и концентрируют при пониженном давлении с получением полу-О твердого продукта коричневого цвета в количестве 1,35 г. Остаток вводят в 25 мл хлористого метилена, охлаждают до (в льдо-водяной бане) и добавляют 0,869 мл триэтиламина, 5 0,7б2 г диметиламинопиридина и 0,588 г уксуснокислого ангидрида в течение 1 мин. Полученную таким образом р1еакционную смесь перемешивают при в течение 30 мин, разбавляют 20 50 мл метиленхлорида и 25 мл воды. Полученную органическую фазу отделяют и водную фазу экстрагируют с помощью 50 мл метиленхлорида. Смешанные органические экстракты тщательно промы-25 вают 4 X 50 мл насыщенным раствором бикарбоната натрия, 1 х 50 мл рассола и сушат с помощью сульфата магния. Выпаривание растворителя при пониженном давлении позволяет получить остаток зо темно-коричневого цвета.
Полученный остаток растворяют в толуоле и загружают а хроматографичес«ую колонку (размером 3,8 х 61 см), содержащую 200 г силикагеля. Содёр- j5 жимое колонки элюируют смесью, состоящей из 3 ч, толуола и 1 ч. простого эфира, в количестве, равном объему колонки, и далее - с помощью дегазированной смеси толуол - простой эфир 40 (3:1). Продолжая элюирование и применяя хроматографирование на тонких пленках, получают элюат красного цве32
та, который концентрируют и обрабатывают с помощью безводной хлористоводородной кислоты с получением целевой соли гидрохлорида продукта в виде твердого вещества (0,40 г). Выход 17,8 от теоретического; т. пл. 135-137°С; масс-спектр т/е 399 (), Зб7, 273.
Элементный анализ.
Вычислено, I: С 68,87; Н 8,78; N 3,21.
С2 НзтМОз
Найдено,- : С 68,85; Н 8,92; N 3,18.
XII. Ди-транс-5,6,6а,7,8,Э,10, 1 Оа-а-октагидро-1 -.ацетокси-3- (1 ,1 -диметилгептил)-1,9-бета-окси-6-бета-метил-бензо(с)-хинолин.
Смесь, состоящую из ди-5,6,6а,7-тетрагидро-1-ацетокси-6-бёта-метил 3-(1,1-диметилгептил)бензо(с)-хинолин-9-(8Н)-она (kk6 мг, 1,12 ммоль) в метаноле (10 мл) и палладия на углероде (46 мг, 5) гидрогенизируют в аппарате Парра при комнатной температуре в течение 1,25 ч. Реакционную .смесь фильтруют, катализатор промываю хлористым метиленом и смешанные фильтрат и промывочный раствор выпаривают с получением 460 мг масла. Затирание масла в 10 мл смеси, состоящей из простого и петролейного эфиров (1:3) позволяет получить целевой продукт в виде кристаллической массы. Выход 235 мг (52/0 от теоретического) .
Элементный анализ.
Вычислено, %: С 1,11; Н 9,79; N 3,9. - C25H39N03
Найдено, %: С 7, Н 9,68; N 3,2.
Соединения общей формулы I могут быть применены в медицине в качестве анальгетиков.
03
s с;
ю ш
кю лз
х
сз
-
u з:
s/
I
0)
о
о
о
чО
§
сч
ч- О
с
еэ О а
ч
«ч
r
о
о
СМ
го о
00
ю.сг
СП
о
, «ч
о-чО
т-о
0
сэ
Lr чО
-:}
-3f«-v
-:Г
Г-смVD
оо
СМ
чО -СМ-3-- . о
CD
о


















I
I о
О Z 0}
о
о
I та о.
го о.
та о.
а.
ь
к IVr
«ч
5° зс
чО
{
г
J
«ч
X
и
о
о
X
4
о
t
to
л: I о
о
«N
-X
X о
о
о
I
I о
I о
о I
I
W
«
X
X X )
о
о
см
сс-
X
о
II-I :
ОUо(J
XX1.1XX1
о оо о та та о
Q.Q.SSО.О.S
H-brrJH(-3Ws
i-r,
tr,
Vf
X
XX X
X X чО
о
VO
-О
чО
о
оо
о с
о tJ
f
Cf
м
«N
«ч
«N
X
X О
X
X
X
«л
о
О
о
о .
о
О
со
г
t
сч
го
с
t X О X О
X X
X О X О
X
о
о
о
X
X
X
X
X
X
о
О I
о I о
о I
о
о
(J I о
t
I
I
о I
о
о I
о
о
I
I
I
I
4
сг
X
о
h-hXX
Оо
II
X
J
с
so СМ
о .эЧ)
U
I
го
а
Vft
д:
0°
с
«NI X о
7
X
о
X
(}
I о
I
CS
ОС«Л
гоФ
оо
.«ОСс/)
I-«Ti Г (О
о.-ctо:о
SИ)ш
UvOчО
QАк
XvOvO
I :
т
a
s
с;
o
(0
го
aX
.с;
ю га
га у
s q Ю 01
(О
J s
с; Ю
та
oo
urxcr r
-exj
-3-r r ГО
оIz
d 5
Q.
С
о
oo.-(V
CMCsJ
оз:z
ГЛ
T: tСЧCJ
J5
CO
rr
-3CM
I
C5 CVJ
о
cs
з: о
ю
vO
t)
-ST
з: то
vO
t(/
X vO
о
ЗГ Ю
о о cvj I
(
r voг
-3oo
LA
o
ГО
2 953981 Таблиц ococw.
Соль HCg СИз Н СН 159-
172 (В)
Формула изобретения
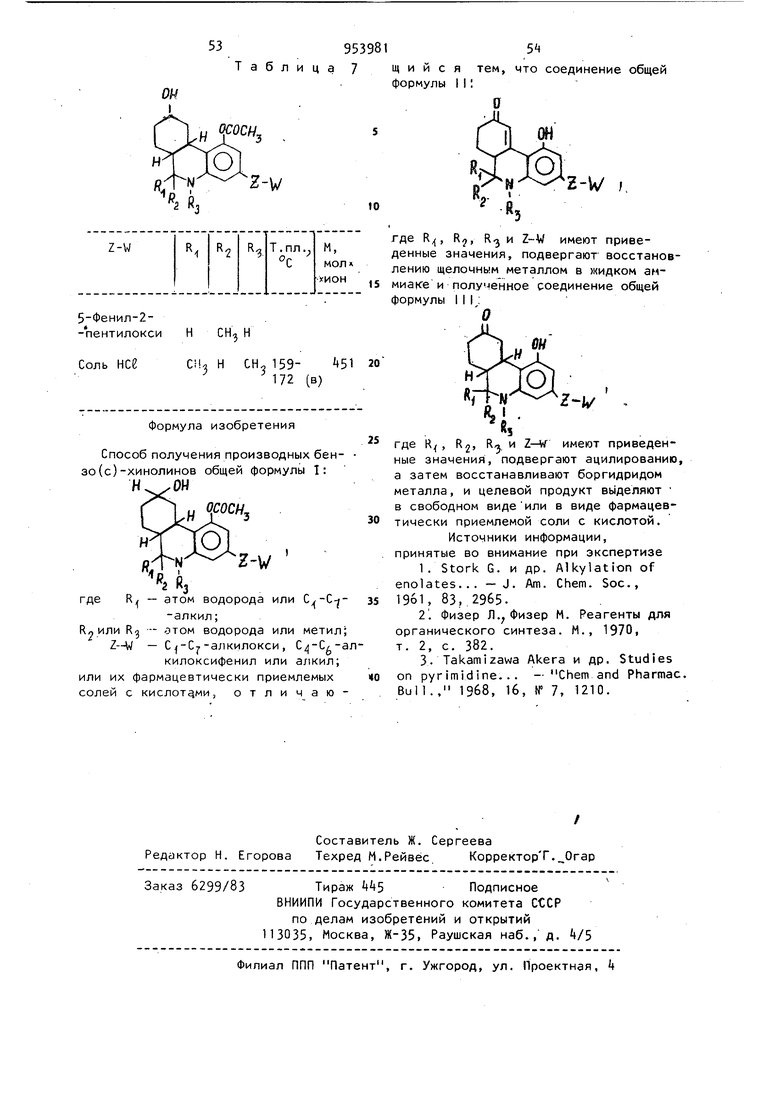
Способ получения производных бензо(с)-хинолинов общей формулы I:
н он
ососн.
нл Ю .f, из
- атом водорода или С/-С- где
-алкил;
R2или R - ЭТОМ водорода или метил; Z-W - С -С -алкилокси , С |-С/-акилоксифенил или алкил; или их фармацевтически приемлемых солей с кислотами, отличаюЩ И И С Я тем, что формулы II
где R, Rj, R и Z-W имеют приведенные значения, подвергают восстановлению щелочным металлом в жидком анмиаке и полученное соединение общей формулы III: О
он
z-i
где R , R2, R-. и имеют приведенные значения, подвергают ацилированию а затем восстанавливают боргидридом металла, и целевой продукт выделяют в свободном видеили в виде фармацевтически приемлемой соли с кислотой.
Источники информации, принятые во внимание при экспертизе

Авторы
Даты
1982-08-23—Публикация
1978-08-31—Подача