1 элюента, который концентрируют досветло-пурпурного соединения (580 мг) при пониженном давлении и растирании в смеси бензол/эфир (1:1) , получают 370 мг твердого соединения; т,пл.154 . Его хранят в атмосфере азота и в темноте. Выделенное вещество представляет собой смесь цис- и транс-изомеров указанного соединения rVe- 345 К 1Н,ЯМР (100 MHZ) ,lyle , ч./млн: 6,85 и 7,49 (1Н, перем. 5,67, 5,71; 5,85; 5,93 ( д.,1 2Н2, 2Н поли., ароматич, водороды в смеси аис/транс) , 0,90 (т., ЗН, концевые СН), 1,12-4,43, (ме остальные Н). П м е р 2. Изомерные 5,6,с(,7 10,10о(-гвксагидро-1-ацетокси-6/з-метил-3-(2-гептш10кс д бензо(с) хинолин9(8Ш-оны. 2,2 мл пиридина добавляют к суспензии 5,6,6о,7,10,Юа-гексагидро1 -гидрокси-6 метил-3- (2-гептш1окси) бензо(с) хинолин-9 (8Ю она (222 мг, 0,642 ммоль) в уксусном ангидриде (2,2 мл в атмосфере азота. Смесь перемешивают в течение 1,5ч при комнатной температуре и затем выливают в лед (50 мл . Смолу выделяют и экстрагируют эфиром (3x50 мл) и соединен иле экстракты промывают сначала водой (4x50 мд), а затем соленым раствором (1x60 MJ . Полученный экстракт сушат (MgSOv) и вьтаривают при пониженном давлении до красного масла (250 мг). Масло растворяют в минимальном количестве горячего эфира и вводят 0 колонку с силикагелем (45 г) , уплотненную и промытую смесью пентан/эфир (3:1) . Колонку промывают смесью пентан/эфир (3:1, 200 мл), Элюирование продолжают и собирают. фракции по 10 мл каждая. Фракции 2232 соединяют и концентрируют до полу чения пенообразного соединения (113,5 мг), которое кристаллизуют из петролейного эфира в виде белых крис таллов; т. пл, 112-114 0, Фракции 33-35 соединяют и концентрируют до пенообразного соединения (89,7 мг), которое перекристаллизовывают из петролейного эфира в виде белых . кристаллов; т, пл, 78-82 С, Продукты являются изомерными моно-ацетилированными соединениями, П р и м е р 3,d, f-5,6, 6а7,10J1 Qet-Гек сагидро-1-ацетокси-6 -метил-3-(2-геп тилокси) бенз о ( с) хинолин-9- ( 8Н J -она Г 74 22,2 г а,-5,6-,й,7,10,10й гексагидро-1-гидрокси-6/4-метил-3-(2гептилокси)бензо(с)хинолин-9-(8Н)она непосредственно ацетилируют, в реоу-льтате получают 2,35 г ацетилированного продукта. Продукт тщательно перетирают в смеси пентан/эфир (3:1) до получения рыжевато-коричневого твердого вещества (905 мг), которое при дальнейшей перекристаллизации из этанола дает светло-коричневых кристаллов; т,пл. 112113,5С, Маточные растворы, из которых выделяют соединения, соединяют и концентрируют. Остаток растворяют в минимальном количестве смеси бен зол/эфир/хлористый метилен (1:1:1) и вводят в колонку с силикагелем (275 г), элюированную смесью петролейный эфир/простой эфир (3:1), Вначале элюирование осуществляют 2 л смеси петролейный эфир/простой эфир (3:1), ja затем; 1,5 л смеси петролейный эфир/эфир (2:1) и 2 л смеси петролейный эфир/эфир (1:1). Фракции 2-11 (по 50 мл каждая) элюата из системы растворителя 1:1 собирают и концентрируют при пониженном давлении до получения пенообразного продукта(496 мг),Посде кристаллизации из петролейного эфира получают белые кристагтлы; т,пл, 100-113 С (410мг) После перекристаллизации из смеси этанол/вода (1:1) получают d,iтранс-5,6,6р-7,10,10о(-/з-гексагидро1-ацетокси-6 -метил-3-(2-гептилокси)бензо(с)-хинолин-9(8Н)-он; т.пл. 11112°С, т/е-387 (т-). Рассчитано %: С 71,29, Н 8,58, N 3,61: Найдено, % С 70,95; Н 8,64; IN 3,58. .фракции 12-18 и 19-27 по 50 мл каждая собирают и концентрируют до получения 273 мл и 208 мг соответственно ацетилированного продукта. После кристаллизации остатка фракций 19-27 из петролейного эфира получают белые кристаллы (119 мг), т,пл, 84-88 С. После перекристаллизации из смеси этилацетат/гексан (1:10) получают д,-цис-5,6,6е1сД,7, 10,10а/5-гексагидро-1-ацетокси-3-(2гептш1окси)-6 з-метилбензо(с)хинолин9(8Н)-он; т.пл, 84-86 С. Рассчитано, %: С 71,29; Н 8,58; N 3,61
Чз
11ай,цчно, %; С 7 i ,05 ; И Я, iB; N3.56
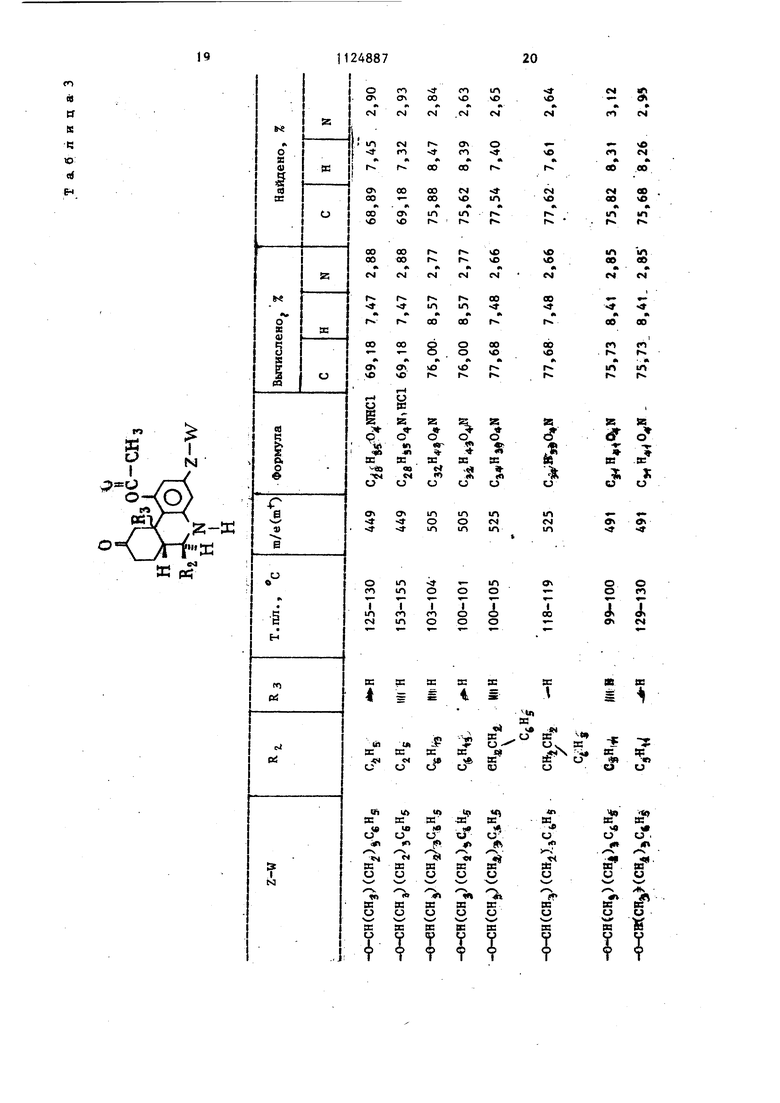
Аналоги:;иым образом nfijivsiaioi и-, соответстзуюпп-тк р;5ят-ь н-) ; ледуэд-иг;,;-; сЪединения,
d l-rpaTIc-Sjfe,, 7, 10, 10rtf/ if4;
сагидрс 1 -ацьтогсси-6/:)-ч.те (iLn 3- (6- фени.п--2--1те1-5тилоксн)бен:к;(с)хи1Г;;,;;;гн-9(8и)-оп т. vTji, , I ofSS (тЧ ,
Psrcчи ано %; С 7 4 .,i; Г 7 )-t; N 3,22
ч п -зз-- -П аил а ко %: С 7i,,43; li .-5;
:- 5.ГИДDO- --arteroKCK-6fi- мй 3-- ( i -itOнил 2 ni iiTt:riOKc;i) банзп(с ) xnitDjnii . У (rjiO O: , т , П.Т , i72--17hf ji .;i;
XjrOprH;i;j;LTa , П Oj i iUiO U ,: Г:л:(;-ГИ
аце to ;/;-nb-,jp,
Ряссш-г-ано, ;: С 6R/7(. il 7,20,
iinftnCHO., A; С f;H. S) ; { 7, i . ;,
N 2,97,
fU --.:-Ji,C-5,G,6e(,u7, iO, Kb-.:...:,;.,;.
сагп).фо-- -,чцетпкси--3-(5- diei-ii-jT-vneKTiij7OK-i 2 6/ Г1по;п чбг:-г;,з(c) хиг,смли 9(8li)-oHj ,,iu:., 79 - -ft3 Гт-.) u ДД/:;;с-- 2., u-ip . lis |0ай .;ч - 1 .{;;: .-Ч- ( j --ibetO-ijr-,:- Tii i; т и,п;кг.) in..jrn-;j(6eK3;:i ( с ) У
(SH) -ОИ; т-,г.г . ;Д. .; :.6-Г; я :;ид,- гп
пи lie ; - 4- : (пГ) ,
d-цис- ,,;., 7„ ;0. ; -С/:1гйд
сизй -11 ети.: пкij: о с;; хиподи -
он, г j..f , 90 (с: ;1РЧ.-;о::д ЛИДР ;Ч:. п : ХДСЧД/С -он; ; м :Г,
лоты.
N . 9 7
;., ,|.; . ,, 0,.
айд:сно, %- С 64,2ч; И 7,:0 N3,01.
Н Г1;а гг:-- , 6 . 6ciff., / , К;. I Оир--iKCH1 -aueTCiOCH --З- ( 5--фрти1 г 2 ч ii i.:n;:K;;t2
6/J MCTKJ-t6SHSo( с) ХИПОДИИ Т (Bfij /h J
т П.Л „ 90-95( (; раз ifwcciniev.:; ь .одде С0.у- ХДОрДД: .ПОрОП;10Й к ,Д
Loil
П.И--3 „ j. Ьягз; 7, К), 1 Ойй-Гексагид1 --.iuOToKCvi--3-v5- фени. --пснтилок; --h/a мртш1пеизс(г-)хипо.гши-9(8Н)-он J- /;7i-92 C в ч1-:де кдоргидрата, i-r; -20,2С (г - о, 19, CHjOH) . -if i--яно, %; С 68Л1; И 7,26;
С,, дТ„0,1-тС
Иайдеио,:Ь С 6Я.-2; Н 7,23: ;Д-д,
--1J--HC-T.Djoa/i., 7; 0j (Оч/ч-ТексаuM)- - л до7(жси- -З-С 5фекид-2-пен : i iU .nfJeif3o (с) хииолин-9 i.-f-, 1Д1Ш, 92--37 2 в пиде хлорНС
, 6,Sw-,iOj :к-бР:-метил
аде 7где
с)хи
дзс
:---VO)i ; -о;, , vд.:- и ДИС-ИЗС. i 1 :7;) .д) i-)-.(;T ке.io-.cv)::4{uo п i-,. :я п.памеД.:;.-1.гтрОл1уЮ ч РСХГ(Д.ДУК- К0. (в
-xibcpc ,-;Ji схабжеиг ую njexa.t:x;.;-v :-;.:1:мт7кой, SCO м.д капепьной
, А ;iee помещают :; -Одок: 2.2 г) нареук : )у1Д)дк V; недедденно появ-:-;- дд:хд;т ория ( окраска, К л -1О;и :;л7К::х;у ип.--1у pricTBOpy пои , .д.о г d 5,1-J J 6; 5--тетра-Г -1- 1:гси-о; --;Етил--3(5--феннл-2- и ;;..д:и;0сч::дис ) хи} ;дтид-9(8Н)-он ;/ :-К11ду - 1Д1С -с;орен ый в 2- .1Д:Д.Фута;Г;:; i 250 ч:д) по кагг.пям -SiiiiTp in ./;.;, Посде дс17дгнитель:; доромсии-кд1ия (1П мин) при -78° 1:ко дгугс f-Me..b резке охлаждают до:(r:t.;-;::Hb M ;д),ддгрством хлористого -iT 7-Hi -,; Затем ох,паждение :;;Д1 П1 л релк(1)-го {ну1о смесь медfo ::.ч ред;;:эт да паровой 5а;ге для рехпд 1Д1:Д Ия. Кпгда ок почти . дс.ифится дооа11; шт зтилацеи -:f;v ( 1 л) и :MtJCb пе/р;;-г;:г ;:дл г т, т;- чп11не П мин, Затем дод;.;-7 С.Л01Д norjiiyk; фяпу еще рээ трягируют гидад:Тгго|А ( ЗПО мл) , 5.(; .;,.: .;.ид:дд де экстрагггы 7 промывают еще раз водой (1 л), суша (MgSO) и концентрируют до коричневого полутвердого состояния ( г) Полученный остаток немедленно растворяют в хлористом метилене (200 мл добавляют 4-диметиламинопиридин (.7,5 г, 0,061 моль) и триэтиламин (6,1 г, 0,061 моль) перемешивают раствор, охлажденный до (хладагент лед/вода) в атмосфере азота. Затем при интенсивном перемешивании за 5 мин прикапывают уксусный ангид рид (6,1 г, 0,061 моль). После дополнительного перемешива ния в течение 30 мин при реакционную смесь разбавляют этилацетатом (2 л) и водой (1 л) и перемешивают в течение 10 мин. Водную смесь еще раз экстрагируют водой и объединенные оргзническ1;е экстракты последовательно промывают водой (4x1 л насьпценным бикарбонатом натрия (1x1 л), солевым раствором (1x1 л), сушат (МпО) и концентрируют до све ло-коричневого масла (27 г). Остато очищают на хроматографической колон ке с IjS кг силикагеля, используя в качестве элюирующего растворителя смесь бензол 15/этилацетат. Собираю фракции по 1 л. После элюирования менее полярных примесей фракции 16- 20 соединяют и выпаривают до остатка, который затем кристаллизуют из смеси эфир/петролейный эфир, в результате получают 5,6 г (22,4%) транс-изомера указанного продукта. Фракции 21-27 соединяют и получают 7,6 г (31,8%) смеси транс- и цис- изомеров, а фракции 28-32 соединяют и получают 7,6 г (31,8%) смеси тран и цис-изомеров, фракции 28-32 соеди няют и получают 2,5 г (10,4%) цисизомера указанного соединения. Характеристики транс-изомера: т/е 435 (т). , Н 5ШР (60 MГц),(cDMэ ч/млн.: 7,24 (с. 5Н, ароматика); 5,97 (с.,2 мета KS); 2,28 (с., ЗН, СНз-СОО); 1,23 (д., ЗН, СН,СН-0-), 1,20 (д.,З GHj-Cff-N)-, 1,3-4.5 (м.. 17Н, осталь ные протоны), т. ил. 81-83С. Рассчитано, %: С 74,45, Н 7,64, N 3,22. Найдено, %: С 74,15; Н 7,68; N 3,18. Характеристики цис-изомера: We - 435 (m). 78 Т.пл. соли НС1 172-176С-(с разложением) (из смеси ацетон/простой эфир). Рассчитано, %t С 68,71; Н 7,26; N7 07 - С.7Н5эО,ШС1 Найдено, %: С 68,86; Н 7,16; N 2,97. П р и м е р 5. d,J-5,6,6ei-7,10, 10«-Гексагидро-1 -ацетокси-6/ -метил3-(4-фенилбутилокси)бензо(с)хинолин9(8Н)-он, цис- и транс-изомеры. В соответствии с примерам 3 d,t5,6,6а|7-тетрагидро-1 -окси-б метил(4-фенилбутокси)беизо(с)хинолин-9 (8Н)-он вначале восстанавливают литием и аммонием, а затем ацетилируют до получения нужного гексагидроизомера. Выделение на хроматографической колонке с силикагелем с использованием простого эфира в качестве элюента приводит к получению вначале d,К-транс-5,6,6а,7,10 10Aгeкcaгидpo-1-aцeтoкcи-6/ -мeтил-3(4-фенилбутокси)бензо(с)хинолин-9 (8В)-она; т.пл. 155-15б С, после перекристаллизации из смеси этилацетат/пентан (1:5). Рассчитано, %: С 74,08, Н 7,41, N 3,32. CjtHg Q N Найдено, %: С 74,00, Н 7,47; М 3,22. т/е - 421 (т). Дальнейшая очистка последних фракций на хроматографической колонке с силикагелем с использованием в качестве элюирующего растворителя смеси циклогексан/эфир (1:1) приводит к получению изомерного d,f-uHC5,6,6c(/s,7,10,10а-гексагидро-1-ацетокси-6 р-метил-3(4-фенилбутилокси) бензо(с)хинолин-9(8Н)-она,т.пл.9596°С после перекристаллизации из смеси этилацетат/гексзн (1:5), га/е 421 (т). Рассчитано, %: С 74,08; Н 7,41; N 3,32. С.Нэ. Найдено, %: С 73,95; Н 7,51; N 3,31. Аналогично примеру 5 получают соединение, представленное в табл.2, П р и м е р 6, d,f-5,6,6a,7,10, 10й-Гексагидро-1-ацетокси-3-(2-гептилокси)-бензо(с)хинолин-9(81).--он. Раствор d,f-5,6,6n,7-тетрагидро- 1-окси-3-(2-гептилоксй) бензо (г.) хинолин-9 (8Н)-она (9,0 г) в тетрагидп иЬуп,ч ::- ( (Ю ч:О :1ИКЧ iib:i-iкп; к бЬГСгг;О rTl::,KMO;rn-fFi 1 V IJHC IfJU i ;. ,4;;тня (о, 1 ;) ojiiv- M ;)ммк:;ко (. Во нрсм; ;|;я Сс : ;VHi-iя д(1бя.ьпо- до- ПХГ НИГе.ПЬНО Ojl V jnri-ln ll;;i 4.aCTHr-i для сокрапег йя CiiHor;-; , С--.е;;|, nsyj-Mv;C; i HBa;o-r P (.c. 10 --.iHii,, -nтем рг;с i Liop jnecuHc i-iBf-mT ,до-:;ал;-г/: . избыток х...Г)С|1С;о:о :;м;--юн1(я, (v; ночу пмммЯСу дают зочмо;к;;;:: М; Р.сплpT-TThfia ) л ocTajOi; :; :р;л-госяг- смс;ч, волы ;Г 3i4-r:U.nvaT;iTa , О |Л,ЧКИЧСС.К1..Л слой стдсляюл Бо, Л3м;;;л,: ЭК.СГП;ЛГ трУ 0 :)ГИ.ГагГРЛУГГ1М, (J jO Hнел;Ь,ч, т; 1-р:Ч л л т пщ-п- лпот водой., B-.ni:iT ,:от ло полуп лигг В, ; 5 : : ро:-л -.po.v;-T.i ;; -л, л)рк:;л1й:;;л тлС|::д: :л ;:.олд;лг|С(. М ;:ол1ЛГ:м(1оЩ Ггкчд ук: ,(. Г ;:icueiy,;;:v;:r л ) гУЛШГСИС .|л чЛ.} ГЛЭЛ Обрал;-ЛГЬ В;Л; Л Я : jTHf-fe i rf-i -г.ьллч ллтл/ л-лм (и..; ) л .,1Л:МГЛ-0,т л.;,72 МЛ ) , :v-TL:; -.Л d . - . 22::,.Д5 сое::иияют и ; .ч.апяв;;; : ,c, nc.riy чо-пгя 2,69 г (26%) li си иис- vi 1ь..:с;о;, чоторь-. зьп:1.:;-;й::т ;(о (uii4., методике, И- J ; г-),:,. 6-, / -г;.: };о;идр---1 л; ги./д:;,:- -i-.tT Oicrii-Л-- л:л,с i-лолг;, ri/s - и/i (-л). Л: с: f ;л ;-,) ю , :;й Г 7 :д18; 1 7,41 ; : - л-. (и, :,,t)j;-л: y-i . С 1:i; if , 5 S; i J .. О .. л.-мь.- )Лл.6а, 7, Ил И}-.:/;--1окса -,. О 1Л л-/л 1,Р ; i к - ( 7 Ы Л f j; . ,,(;; Т ТОТ






Способ получения производных бензо(с)хинолинов общей формулы О OR 1 Z-W где R - ацетил или 4-Н-пиперидйлбутирил; RJ - Ci-Cj-алкил шга(СН),,, где Z - 1, 2; Z-W-С -Cj-алкилокси- или С -С алкоксигруппа; RJ - атом водорода, метил, изобутирил, бензоил, или их солей с фармацевтически приемлемыми кислотами, отличающийся тем, что соединения формулы II ОН О) г-w 1C где Rj,R и Z-W имеют указанные зна4 00 00 чения, подвергают восстановлению литием в аммиаке с последующим ацилированием полученного соединения и целевой продукт вцделяют в свободном виде или в виде соли с фармацевтически приемлемыми кислотами.
ллл:лт :;л :д.:.м;лглл, -Л: г; j ;й. ,,.,. .,.,л: д ;. „ ,.,,.; , ,j
:.. ; ,ллллп..:У:ОЛ-- ..,::л.-.:лrдл:),л.лп,c-мeДlл-лл;л.l:(; -О Л --::-;,,:..;.. (Ч .,,,,;,:-;-- j Г f Л i Л1,. , f ,С С И ) Л 3 Н 3 О Фрдь.:;. л- лл : ..,, I Л): дм: ;/-- -л;. соел,д:{Я10г л ;::о:: ш- i рд-уьл дл лп;.Л;Л, КОЛ(ЛЛ::(- 11 Л,,;-. .: и д9, ,- ( 5д;дс Li лIJлv- :л,-ллJ: 1.л: -J- : (МП) Фрг1лмл :л-лг-;;90 --ЕДПГТЯЮЛ :, 5со цечтр: рллог ло лолу-г/одт 0 д S г.:;о О-О огярого 1 л -1:чо;-гд,:.; -лгзг лногО соедипония в нтгд глл;-л;л ч длДjЛIaл-шек его )к-- 1Л| хромдт;.-гро.филоо,-коп колои-д, -лу;: ук,длдд; и л(.Л1уд;лгачистый лlOi:l ;(л л ллдо У5аслдл m/i - 5:) (rn) , ИКСсПС ьд-д: .Г:алго, с-0) -- - -5 дксаглг рл- 1 1J.O. О Л - : , -л л-л-л ь--ф:лл;д--2- пен1:-л;(:л ел) У-;::л.п.д .-:н- 9 (оН он, . Д-. .|0д-.л,.: у;П()ДУКТЫ ГИДПЧЛ-.ЛЯТ в ,,, ,.,,. ; |лр-глго-Длаоро.;лд.;.; кчслотк 7лда1-лге лдллки :10луч:Л1ЯЬ|Х сэлей л 1 ЗЛОГЛ-:Л. ЧЛЛУ ДЮТ Л Л Л.;: НСчИЯ , V: р к .; о л 7. :1; Л-грагс-5. 6, У;-;/ , ., IО/i С,..,д лел ;агидрс-Ь-г ютоксиД- (--Лллг/ л, 5--О.гои.ч-л, ;/.-мртйлДллооС л) ;л1 1оллн-9 (Ы:)-он . К перлл:л:гл1-лл-лд,у тп;лтукту лри-н ддра 3 ci , л-чОУ нс--5 , 9 . , : . i ( гдкся i -ацс то;хси-б;;гл д -{л-}-(2-|-(:ЛЛлг,;токуд) псдз(Псд г.лчоллч-дх&гОоку (819 .лг) ;. /,5 ьл1 лирил,;л;а лобан.пягзл д91 мл i
11 1
в 5 мл хлороформа. Спустя 2 ч реакционную смесь выливают на лед и дважды экстрагируют эфиром. Соединенные эфирные экстракты промьлвают водой, бикарбонатом натрия, сушат (MgSO;) и фильтруют до получения после кониентритэования и кристаллизации из смеси эфир/петролейный эфир d,-TpaHC-5,6,6a/J,7, to, ЮасСгексагидро- -ацетокси-З-СЗ-гептилокси) 5-бензоил-6/}-метил-бензо(с) хинолин-9(8Н)-он т.пл. 108-11(f С, т/е 491 (т).
В результате повторения этой процедуры, используя эквивалентные количества хлористого ацетилена вместо хлористого бензоила исоответствующий бензо(с)хинолин, получают следующее соединение: d,Pтранс-5,6,6сч,7,10,10о« -гексагидро1-ацетокси-З-(2-гептилокси)-5-ацетил-6 -метилбензо(с).хинолин-9(8Н)-о ш/е - 433 ().
Примере, d, 8-транс-5,6,60/а7,10,10аЫ-Гексагидро-1-ацетокси-6изобутирил-З-( 5-фенш1-2-пентш1окси) бензо(с)хинолин-9(8И)-он.
Раствор хлористого изобугирила (И5 мг, 1,07 ноль) в хлороформе (20 мл) постепенно добавляют при перемешивании к раствору d,t-TpaHc5,6,601/4,7,10,10с Ы-гексагидро-1ацетокси-3-(5-фенил-2-пентш1окси) бензо(с)хинолин-9(8Н)-она (450 мг, 1,07 моль) в сухом пиридине (1,5 мл) при и в атмосфере азота. Реакционную смесь перемё.ши- вают в течение 5 ч и затем вьтивают в смесь лед/вода (50 мл), Слой хлороформа выделяют и водную фазу экстрагируют хлороформом (2x20 мл). Экстракты Хлороформа соединяют и промывают 10% соляной кислоты (2х х10 мл), затем солев1Ф1 раствором (1x10 мл) и сушат (MgSO), После концентрирований хлороформовога раствора в вакууме получают желтое масло, которое при стоянии отверждаетс Растирание твердого продукта с гек- саном дает белое кристаллическое . вещество, которое выделяют фильтрованием и сушат (400 мг), т,rot, 128129°С, Концентрирование фильтрата гексана дает 121 мг масла.
П р и м е р 9, d,-TpaHc-5,6,6eip 7,8,9,10,1 OaoL-Октагидрб-1 - (4-Н-пиперидилбутирилокси)-9-окси-6,| гметил3(5-фенил-2-пёнтилокси)бензо(с)хийолина хлоргидрат.
488712
К раствору при 25 С d,B-TpaHc5,6,6«/э 7,8,9,10,1 Овюб-октагидро-1,9диокси-6/ -метш1-3-(5-фенил-2-пвнтилокси)бензо(с)хинолина (1,0 г, 2,53 ммоль) в хлористом метилене (20 мл) добавляют хлоргидрат 4-Nпиперидилмасляной кислоты (0,524 г, 2,53 ммоль) и дициКлогексилкарбодиимид (0,573 г, 2,78 ммоль), РеакЦИОНН5ГЮ смесь перемешивают при 25 С в течение 6ч, затем охлаждают в течение 12 ч и фильтруют. Выпари-, вание фильтрата и растирание остатка с простым эфиром дает 1,3 г тверJ дои соли - монохлорпадрата,
ИК(КВг): 2,95; 3.60; 5,65 (сложный эфир, с «о), 6,13 н 6,27ja.
Препаративная тонкослойная хроматография части твердого соединеQ ния на силикагеле толциной 0,5 мм и.10% метанол/метилендяхлорцда в качестве элюента дает свободное основание d,t-TpaHC-5,6,6ef/3,7,8,9,10, 10ot-октагидро-1 - ( А-Н-пиперидилбу-ч тирилокси)-9-окси--6 э-метил-3-(5-фенил-2-пентилокси)бензоле)хинолнн.
Н ЯМР (60 Гц),J, , ч/мпа: 1,12 (д,, , С-3 ме-йш боковой цепи); 1,25 (д., J- 6HZ, С-6 метил); 5,84 (с., два АчН) и 7,16 (с,, 5Н),
После обработки свободного основания избытком хпорнстбхх) водорода в простом эфире получают дюслоргцдрат в виде гигроскопического порояка.
П р и м е р 10, d,f-5,6,,75 Тетрагидро-1-(4-пиперид1Шбутнр«локси)-6р-метил-3-(5-фен1Ш-2-пентипокси) бензо(с) хинолин-9(8Н)-он,
К 23°С раствору d,t-5,6,6isi,7тетрагидро-1 -гидрокси-6/4-метш1-3(5-фенил-2-пентилокси)бензо(с)хинолин-9(8Н)-она (550 мп, 1,41 ммоль) в хлористом метилене (26 мп) добавляют хлоргидрат 4-М-пипер1Вдшшасляную кислоту (291 мг, 1,41 ммоль) и 5 дициклогекснлкарбодинмид (3,19 мг, . 1,55 моль). Реакционную смесь перемешивают в течение 18 ч, затем охлаждают до. и отфильтровывают. После выпаривания 4и1льтрата и тца0 тельного растирания остатка с эфиром получают 800 мг d,f-5,6,6«(,7тетрагидро-1-(4-Н-пиперидип&ут1филокси) -6/ -метил-гЗ-(5-фенил-2-пентил окси)бензо(с)хииолин-9(8Н)-она хлор5 гидрат в виде гигроскопического желтого продукта,ф,
ЙК(СНС1э): 2,92, 4,14 ( 5,69 (ел.эфир); 6,00; 6,20 и 6,40.
Аиалогичн)1м образом хлоргкдрат d, -транс 5 5 6 , беяр, 7; 8 5 9., i С, 1 Оад 6октагидро--1 - (А-Н-морфолинбутири.Гокси) 9 окси-6р-мети.( 5 фенр1л-2-пентипокси)бензо(с)хиколина получают из 4--Н-морфолиномасля1- ой ккспоты и d S f Транс--5 5 6 , бн/j, 7 , 8, 9.10,1 Cadоктагидро-1 ,, 9--дигидрокси-6р-меткл-3- (5-фет1ил 2--пентйлокси) бензо (с) хинолика,,
ИК(КБг) 3,00, 3,75; 5,67 (сл„ эфр1р, 6; 15 и 6., 30
12488714
/И, мети;гь-; ; .лУ (с 3li, аиетат Me); /Л)2 и (Ус,, ЗИ, амид Me);
(2л., 31Г С.Ме); К12
Uou.oOif,iM o6pa3(jM df --ЦИС-5 5 6 5 6а(3, 7 1 Осг-гексагидро--1 -алетокси-6/5MeTT;ji----(5- 11)ени.п-2-гчеггти1гокси) бенго ( с)хииоли :--9( превращают в t-цис-Ь,. 6 J oa/Oj 7, гОсш-гексагидро1 --адстокси- 5-aцeтил-6fi-мётил-3-(5Ф е ч-тл - 2 - л е н тил о к с: н) о е н я о ( с) х к н о л и н 7; 10, 10ас/--Тексагидро-1 -апетилркси5-ацет-11Л-6,|}--мет-и.п-3- ( кил 2-пегг тилокси)бензо(с)хинолин-9(8Н)-он.
Гастворяют 3,49 г (0,008 моль) d,e -транс-5 , 6 . бея/5 5758.9, 10, 1 Ойс -октагидро-- (-апйтоксп-6(3--метил 3-(5фен1-ш-2-иентоксг) -бензо (с) 9(8П)--опа в 20 мл освобож;1снкого от спирта хлороформа, раствор охлаждают нэ бане вода со льдом, затем добапляют --Ш пиридина (высупгенного над таблетками с гт-тдроокисью кал1-1я) „ 0,95 ип (0,013 моль) aij.eTHjхлор1-1да, который растворен Б 5 мл хлороформа. Затем перек€чшивают Омогекяый раствор прн комнатнсж температуре в течение ;8 ч. Реакционную смесь вылЕииают ;; 50 мл додь со н дважд;- экстрагируют хлоро-формом. каждый раз ло 25 мл, Обьединенньи оргапнлсскгк с.ггои niiOMbmatOT 25 мл насыпгенчого раствора 6t- sp6oиата -натрия, 25 мл поды, 25 мл рассола., сугяат над сульфатом натниНр фильтрзпот и выпаривают д()суха при понг-жеьгиом давлении. Очистка доаткгается с noMfirabW хроматографии (200 г сигккагедтя Бринкмана, растворитель гциклогексан 3„ эфир 1) ло
лучают 2,20 г (выход 83,8% целевого с.оеди.нет)ия „
Вычислено, %: С 72,90, Н 7,39; N 2,80.
Найдено, %t С 72.,69; И 7д8; N 2,49
ИК-спект (КВн),м: 2,90 (м); (с); 3,48 (с); 5,62 (с); 5,78 (с); 6,00 (с); 6,15 (с); 6,30 (с), М/е - Л77 (МО.
-Н ЯМР (60 МГц),. 7.20 (м., ЭН, apof-fj; 6.53 ( с-2) ; и,39 (д. , 1И, с-4); 7,41--),08 (м,.
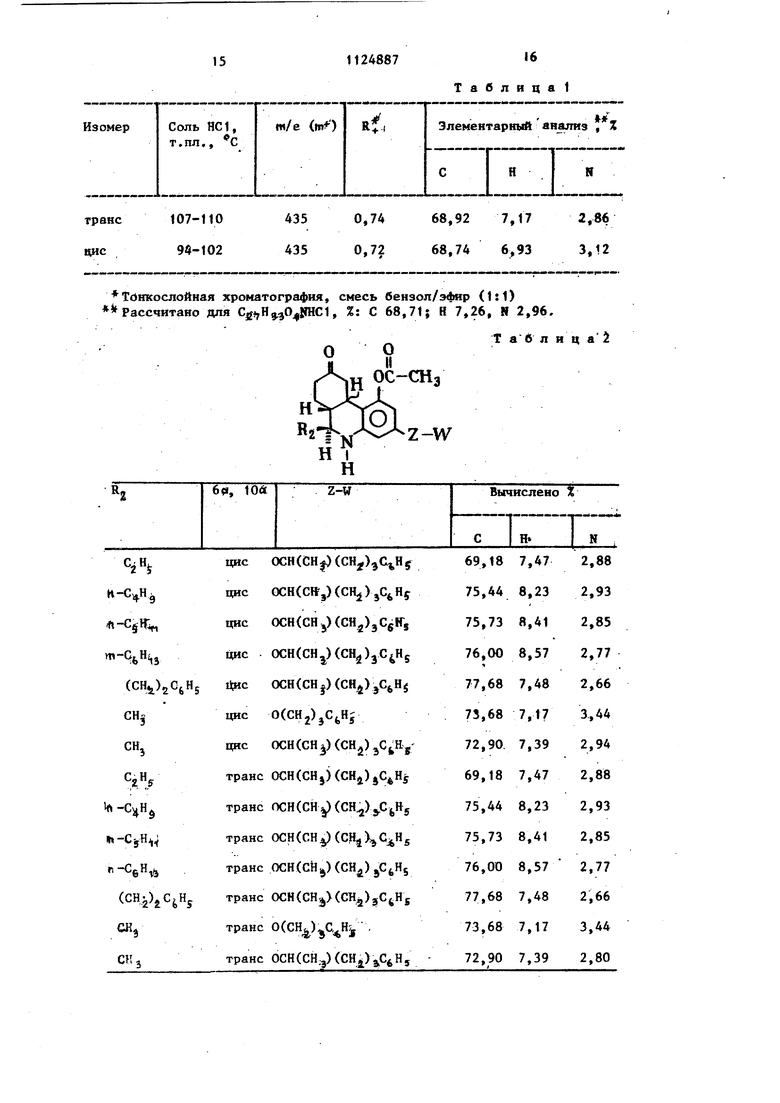
15
Тднкослойная хроматография, смесь бензол/эЛяф (1:1) Рассчитано для %,Н зО |1гаС1, %: С 68,71; R 7,26, Н 2,96,
1124887«6
Т а б л и ц а 1
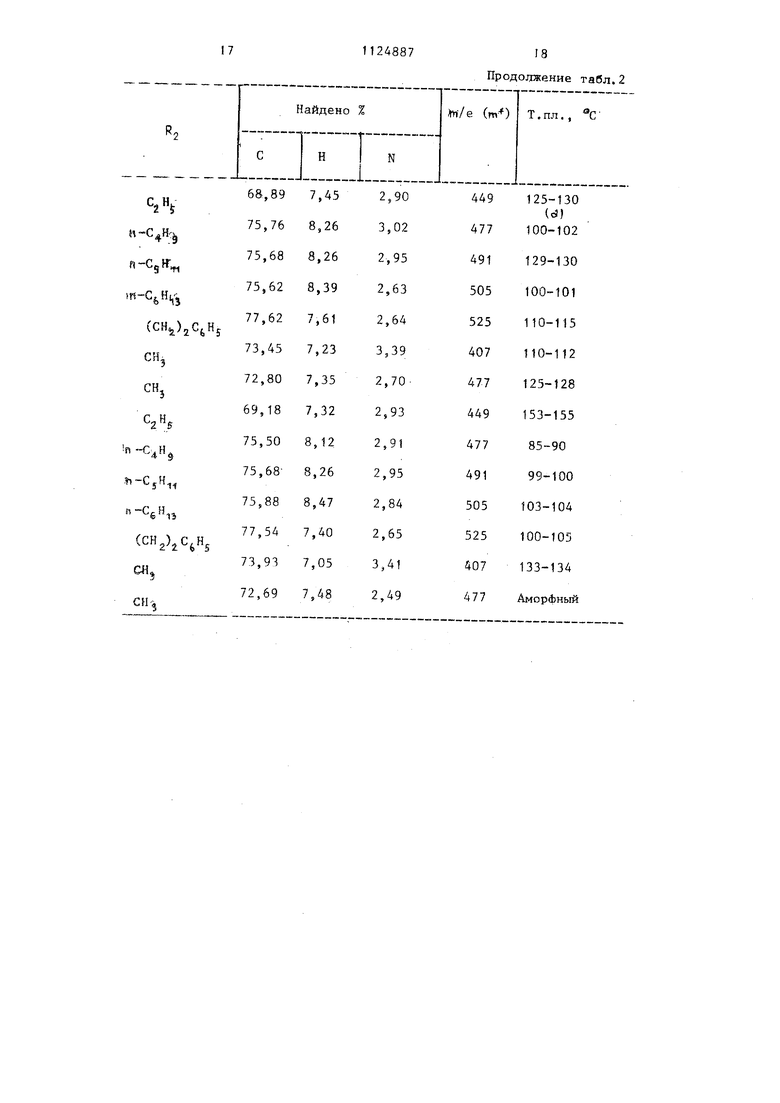
Продолжение табл.2
n nt
a
к
R Ю d еч
i.,....,,,.,
«rj t: c:;
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Физер Л., Физер М | |||
| Реагенты для органического синтеза | |||
| М | |||
| Кинематографический аппарат | 1923 |
|
SU1970A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для останова мюля Dobson аnd Barlow при отработке съема | 1919 |
|
SU108A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Общий практикум по органической химии | |||
| Под ред | |||
| А.Н | |||
| Коста | |||
| М., 1965, с | |||
| Гидравлический подъемник | 1922 |
|
SU389A1 |
Авторы
Даты
1984-11-15—Публикация
1978-09-18—Подача